原发性输尿管非尿路上皮癌的临床诊治分析
刘 良,魏 东,李守宾,刘俊江
(1.保定市第一中心医院泌尿外科,河北保定 071000;2.河北省人民医院泌尿外科,河北石家庄 050051)
输尿管被覆尿路上皮,原发于输尿管的非尿路上皮癌临床上罕见,常与泌尿系结石、泌尿系感染等有关[1-5]。早期难以确诊,误诊率高,预后极差,治疗首选根治性肾输尿管切除术+膀胱袖口状切除术,但化疗、放疗对预后的影响还有争议。本研究回顾性分析2018年1月-2020年10月就诊于河北省人民医院泌尿外科的5例原发性输尿管非尿路上皮癌患者的临床资料,探讨其临床病理特征及预后,报告如下。
1 病例资料
1.1 病例1患者男性,83岁,因“左侧腰部胀痛10 d”入院,无明显诱因,可耐受,阵发性发作。输尿管计算机断层扫描(computed tomography,CT):左侧输尿管远端可见结节状软组织密度影,约16 mm×15 mm×24 mm,增强扫描呈较明显强化。术前诊断为左侧输尿管癌。全身麻醉下行左侧输尿管镜检查+活检+输尿管支架置入术,术中见输尿管下段肿物,约20 mm,宽基底,挤压管腔变窄。活检组织免疫组化染色:CKpan(小灶状+)、LCA(-)、CD3(-)、CD20(-)、CK7(-)、P63(-)、Syn(+)、CgA(+)、CD56(+)、Vimentin(-)、PAX-5(-),CD99(-)、Bcl-6(-)、CD34(血管+)、Ki-67(阳性率80%)。诊断为原发性左侧输尿管小细胞癌。患者拒绝手术治疗。4个月后再次入院,查糖类抗原(carbohydrate antigen,CA)125:40.800 U/mL。腹部CT:左侧输尿管近端及左侧肾窦区可见不规则软组织肿块影,呈轻度不均匀强化,左肾周围可见多发软组织结节影,融合成团。左侧输尿管下段可见软组织团块影,边界清,约37 mm×27 mm×51 mm。腹膜后区可见多发肿大淋巴结,均匀强化。考虑腹膜后转移,予以放疗,单次剂量为200 cGy,每周5次,共25次,总剂量为5 000 cGy。放疗结束时复查腹部CT提示左侧肾窦、肾门区及左侧输尿管下段占位较前稍小;左肾周多发转移,左侧肾盂及输尿管扩张,腹膜后及双侧髂血管旁多发肿大淋巴结。考虑放疗有效,于放疗疗程结束当日出院。自确诊后随访3个月,出现腹膜后转移;随访6个月,出现纵隔转移。
1.2 病例2患者男性,75岁,因“间断右侧腰部憋胀不适2月余,伴全程肉眼血尿40 d”入院。CA199:51.460 U/mL,CA153:29.950 U/mL。腹盆部CT:右侧输尿管上段扩张,腔内可见较长节段软组织密度影,增强扫描呈明显不均匀强化,其以上右侧肾盂扩张积水,右肾实质各期强化程度均低于左肾实质,排泄期右侧肾盂内未见造影剂进入。腹膜后区及盆腔未见异常肿大淋巴结影。肾动态显像提示右肾滤过功能中度受损。全身骨显像未见骨转移。输尿管肿物活检:退变坏死组织中散在异型上皮细胞,不除外癌。免疫组化染色:CK7(+)、CKpan(+)、CK20(散在+)、LCA(-)、GATA-3(尿路上皮+)、Ki-67(约30%+),提示右侧输尿管癌。术前诊断为原发性右侧输尿管癌。静吸复合全身麻醉下行右侧根治性肾输尿管切除术+膀胱袖口状切除术,术后剖开标本,见右肾中下极肾盂内有一菜花样肿物,约20 mm×15 mm×10 mm,右侧输尿管管腔内一肿物,约55 mm×30 mm×10 mm。镜下观察见:右输尿管小细胞恶性肿瘤伴大量坏死。免疫组化染色结果不典型:CKpan(-)、LCA(-)、Vimentin(+)、CgA(-)、CD56(部分+)、Syn(+)、CK7(-)、CK20(-)、CK5/6(-)、P63(散在+)、GATA-3(局灶+)、CD99(-)、CD117(±)、S100(-)、Desmin(-)、NSE(NS)、SMA(局灶+)、Ki-67(约80%+)(图1A)。肾盂小细胞恶性肿瘤,伴大量坏死,浸润肾窦脂肪组织。诊断为原发性右侧肾盂、输尿管小细胞癌。术后予以注射用盐酸吡柔比星膀胱灌注化疗,术后10 d出院。4个月后因肿瘤进展死亡。

A:病例2为小细胞癌,肿瘤细胞呈梭形,核仁不明显(HE,×200);B:病例3为输尿管淋巴上皮样癌,肿瘤细胞弥漫性分布,呈巢状,核大,核仁明显,可见大量淋巴细胞浸润(HE,×200);C:病例4为输尿管鳞癌,可见嗜酸性胞质的角化鳞癌细胞(HE,×100);D:病例5为腺癌,肿瘤呈管腔样结构(HE,×200)。
1.3 病例3患者女性,79岁,因“右侧腰痛伴全程肉眼血尿1周”入院。CA199:38.980 U/mL。输尿管CT:右侧输尿管远端管腔内可见软组织密度影,向膀胱腔内突出,邻近膀胱壁增厚,增强扫描病变边缘呈明显强化,中心呈稍低密度影。肾动态显像:右肾滤过功能重度受损。术前诊断为右侧输尿管癌。局部麻醉下行膀胱镜检查+活检术,术中见右侧输尿管口明显隆起,呈球形。活检组织免疫组化染色:GATA-3(-)、CK7(-)、CK20(-)、P40(+)、P63(+)、CK5/6(+)、Ki-67(活跃区约70%)。诊断为原发性右侧输尿管低分化鳞状细胞癌(图1B)。患者拒绝手术治疗。电话随访,患者于外院行右侧根治性肾输尿管切除术+膀胱袖口状切除术,术后予以免疫治疗。随访14个月,肿瘤无复发及转移。
1.4 病例4患者女性,69岁,因“间断无痛性肉眼血尿2 d”入院。CA199:73.010 U/mL。输尿管CT:右侧输尿管中段局限性增粗并呈软组织密度影,长约58 mm,最粗处直径约14 mm,相应输尿管管腔变窄,局部截断,增强后病变区明显强化。肾动态显像:右肾滤过功能极重度受损。正电子发射断层-X线计算机断层组合系统(positron emission tomography-computed tomography x-ray system,PET-CT) 未见远处转移。术前诊断为右侧输尿管癌。静吸复合全身麻醉下行后腹腔镜下右侧根治性肾输尿管切除术+膀胱袖口状切除术,术后病理检查距输尿管断端10 cm局部可见一肿物,大小25 mm×20 mm×10 mm,镜下观察肿瘤组织分化差,伴多量淋巴细胞浸润(图1C)。免疫组化染色:CKpan(+)、Vimentin(-)、CK7(+)、CK20(部分+)、P63(部分+)、GATA-3(部分+)、CK5/6(散在+)、P40(个别细胞+)、P16(+)、E-cadherin(+++)、CgA(-)、CD56(-)、Syn(-)、P53(+++)、Ki-67(约70%+)。诊断为原发性右侧输尿管淋巴上皮样癌。术后于外院规律化疗(具体方案不详)。随访8个月,肿瘤无复发及转移。
1.5 病例5患者女性,64岁,因“左侧腰部疼痛7 d,加重2 d”入院。血甲胎蛋白 (α-fetoprotein,AFP)>1 210.00 ng/mL,癌胚抗原(carcinoembryonic antigen,CEA) 34.200 ng/mL。腹盆部CT:左侧肾盂及输尿管内可见片状稍高密度影,边界不清;膀胱内左侧输尿管入口区可见类圆形软组织密度影,其以上输尿管及肾盏肾盂扩张积水伴周围脂肪间隙模糊。腹膜后区及盆腔未见异常肿大淋巴结影(图2)。肾动态显像:左肾血流灌注重度减低,无滤过功能。局部麻醉下行膀胱镜检查+活检+经皮左肾穿刺造瘘术,术中见左侧输尿管区域有一巨大菜花样肿物,约35 mm×30 mm×25 mm,有蒂,较宽,表面覆盖脓胎样物质,触之易出血。活检病理免疫组化染色:PAX-8(-)、CK7(-)、CK20(-)、Villin(+)、P63(-)、GATA-3(-)、P53(-)、P16(+)、Ki-67(活跃区约70%+)。特殊染色:PAS(+)。诊断为原发性左侧输尿管中分化腺癌。全身麻醉下行左侧根治性肾输尿管切除术+膀胱袖口状切除术,术后沿肾门对侧剖开,于肾中极见一肿物,约40 mm×30 mm×10 mm,质中,肾盂肾盏扩张,可见淡黄色液体及糟脆物充满管腔。输尿管膀胱壁段局部见一菜花样肿物,约30 mm×20 mm×20 mm,质中。免疫组化染色:CK7(部分+)、CK20(-)、MUC5AC(部分+)、P63(少量+)、GATA-3(-)、Villin(+)、CDX-2(+)、P53(-)、Ki-67(活跃区约60%+)(图1D)。诊断为左输尿管及左肾盂中分化腺癌。术后复查腹盆部CT:左肾及输尿管呈术后改变,膀胱左侧壁稍厚,未见异常密度影。腹膜后区及盆腔未见异常肿大淋巴结影。自诉于外院予以注射用紫杉醇(白蛋白结合型)化疗3个周期。并在我院予以注射用紫杉醇(白蛋白结合型)完成4个周期化疗。术后6个月复查CT:肿瘤无复发及转移。
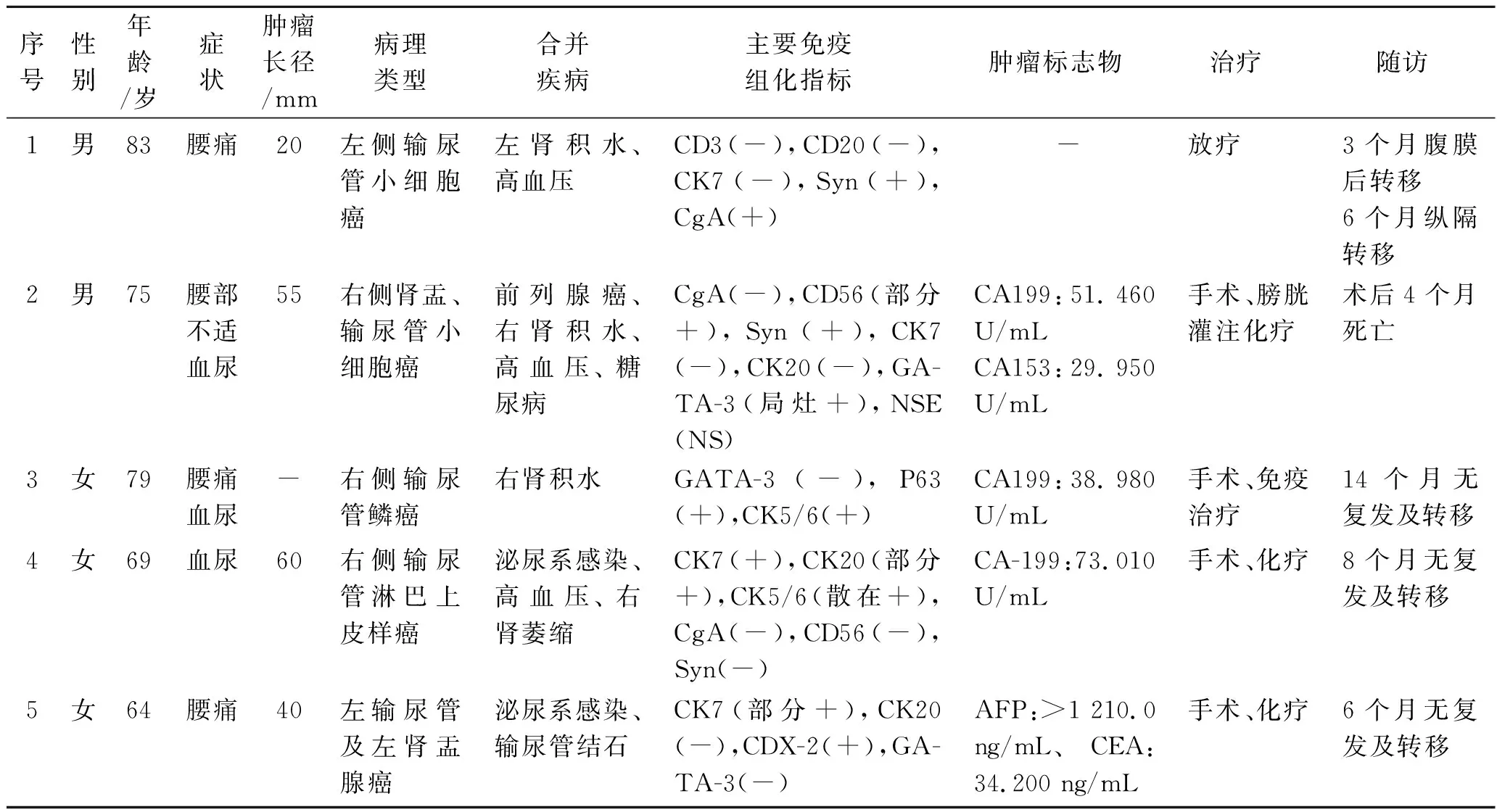
表1 5例原发性输尿管非尿路上皮癌患者的临床特点
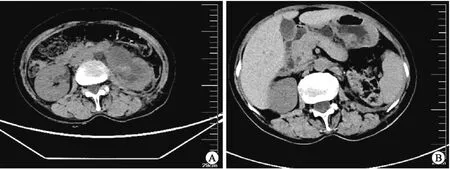
A:术前左侧肾盂及输尿管内可见片状稍高密度影,边界不清;B:术后。
2 讨 论
上尿路尿路上皮癌临床少见,仅占尿路上皮癌的5%~10%,其中输尿管癌发生率约为肾盂癌的50%[6]。原发于输尿管的非尿路上皮癌临床罕见,临床表现无特异性,最常见的症状是肉眼血尿、腰部疼痛不适,也可表现为全身症状如体重减轻、发烧、盗汗、贫血等。本组5例患者,输尿管小细胞癌2例,鳞癌、淋巴上皮样癌、腺癌各1例,其中合并肾盂小细胞癌、肾盂腺癌各1例。本组患者以局部症状为主,合并泌尿系感染2例,输尿管结石1例,肾积水3例,影像学检查或病理学检查本组患者肿瘤均处于中晚期,属于高危分期,与既往文献报道输尿管非尿路上皮癌早期诊断困难,发现时多已是中晚期或进展期一致[7]。因此,以腰痛、肉眼血尿合并泌尿系结石或感染的患者,应考虑上尿路非尿路上皮癌如鳞癌、腺癌、小细胞癌等特殊病理类型。
本组患者肿瘤标志物CA125、CA153、CA199、AFP和CEA水平不同程度的升高,其中一半患者CA199升高,与KATO[8]、HOSOMI[9]等学者研究结果一致,但是此类肿瘤标志物特异性低,无法同其他部位的肿瘤鉴别。内镜下活检对于该病的确诊具有重要意义。本研究中4例患者进行了活检术,且提示输尿管癌,活检诊断率达到100%。但内镜下活检阴性并不能完全排除输尿管肿瘤,仍需结合临床症状和影像学检查,在诊断的同时还可初步判断肿瘤分期与分级[10]。活检可提高输尿管非尿路上皮癌确诊率,术后病理是确诊的金标准,也是各型输尿管肿瘤鉴别的重要依据。输尿管小细胞癌的病理特征与小细胞肺癌相似,免疫组化表现为CK7阴性,NSE、AE1/AE3、CD56、Syn、CgA阳性[11]。有研究报道NSE是小细胞肺癌最敏感、最特异的肿瘤标志物[12-13]。免疫组化对输尿管淋巴上皮样癌的诊断具有特异性,表现为CK7、AE1/AE3、淋巴细胞标志物(CD3和CD20)阳性[14]。镜下可见角化癌细胞则是鳞癌的典型特征,免疫组化CK5、34βE12和P63阳性有助于其诊断[15-16]。CDX2、CK20阳性和CK7、GATA-3阴性则有助于上尿路腺癌的诊断[17]。
上尿路小细胞癌预后差,多数在术后1年左右死亡。鳞癌为高度恶性肿瘤,5年生存率仅为7.7%[18]。腺癌预后则与病理亚型密切相关,乳头状型预后最好,5年生存率可达到100%;黏液型次之,为60%~70%;管状型最差,小于30%[7]。上尿路尿路上皮癌,根治性肾输尿管切除术+膀胱袖口状切除术是治疗的金标准,非尿路上皮癌各类型均呈恶性,且多呈浸润性,常合并积水,处于高危分期,预后差,尚无统一的治疗标准,仍以手术治疗为主,首选根治性肾输尿管切除术+膀胱袖口状切除术[19-20]。但患者是否需要进行新辅助化疗、术后化疗或放化疗尚无定论[18,21]。杨蕴一等[22]检索了输尿管小细胞癌的既往英文文献,共计29例,单纯小细胞癌仅12例。整组患者中根治性肾输尿管切除术27例,含新辅助化疗1例,术后化疗5例,术后放化疗10例,生存期4个月至5年不等。他们总结认为手术联合化疗或放化疗可适当延长生存期,但手术、放疗、化疗的最佳联合方式及方案有待证实。
一项关于上尿路鳞癌的最大研究结果显示,接受辅助化疗患者的中位生存期更长(24个月vs.12个月;P=0.56),但结果未显示出差异具有统计学意义[23]。倪志富等[24]认为药物腔内化疗(如卡介苗、丝裂霉素等)和局部放疗均可降低上尿路鳞癌的复发率,二者结合或可延长患者的总体生存率和无病生存期。蔡兴韫等[21]报道了2例输尿管腺癌,1例采取手术联合术后辅助放疗,随访7个月时发现盆腔复发,另1例仅行手术治疗,于术后8个月出现肺转移,术后12个月死亡,表明放疗在输尿管腺癌中的治疗有限。本组研究病例1患者拒绝手术治疗,给与了姑息放射治疗,观察到肿块缩小,生存期达到6个月,优于既往文献报道的部分病例,可见放疗对输尿管小细胞癌的治疗具有积极的意义。本研究还观察到手术联合化疗疗效明显优于单纯手术者,长期疗效及预后仍需进一步随访。尽管该研究发现患者生存时间长于既往文献,但总体生存时间均较短,同时结合既往文献报道,我们认为输尿管非尿路上皮癌短期内复发和转移可能与肿瘤或结石造成梗阻加速淋巴回流,进而促进肿瘤侵犯淋巴结、肾周脂肪以及肾实质有关。
近年来,免疫治疗逐渐应用于晚期和转移性尿路上皮癌,免疫治疗是否适用于上尿路非尿路上皮癌的治疗仍有待研究。病例3病理诊断为鳞癌,出院后于外院行手术+免疫治疗,随访14个月无复发及转移,生存时间优于本组其他患者,还需继续随访,评估长期疗效及预后。总体而言,本研究为回顾性分析,随访时间短,样本含量少,仍需长期观察便于评估疗效及预后。
综上所述,输尿管非尿路上皮癌临床罕见,恶性程度高,预后较差,早期诊断极为困难,发现或就诊时常合并肾积水,属于高危分期者预后更差,确诊有赖于术后病理检查,免疫组化有利于亚型的鉴别。根治性肾输尿管切除术+膀胱袖口状切除术是首选治疗手段,放化疗及免疫治疗或可改善患者的预后。

