艾灸调节溃疡性结肠炎小鼠E3泛素连接酶TRIM31的肠黏膜屏障保护机制
吴璐一 钟蕊 林亚莹 郑寒丹 刘世敏 黄艳 马喆 刘雅楠



摘要 目的:觀察艾灸对野生型和TRIM31基因敲除(TRIM31-/-)溃疡性结肠炎(UC)模型小鼠紧密连接蛋白以及血清炎症介质的影响,探讨TRIM31能否通过保护UC肠黏膜屏障而降低UC肠道炎症反应以及艾灸对其调节作用。方法:分别采用野生型和TRIM31基因敲除小鼠构建UC模型,免疫组织化学检测结肠组织中TRIM31、闭合蛋白、密封蛋白、ZO-1的蛋白表达;实时荧光定量PCR(RT-qPCR)检测法检测结肠组织中TRIM31的mRNA表达;ELISA检测血清白细胞介素-1β(IL-1β)、IL-13、IL-25、IL-33蛋白的浓度。结果:艾灸可改善野生型UC小鼠的结肠炎症,升高结肠TRIM31蛋白及mRNA的表达以及肠黏膜屏障相关闭合蛋白、密封蛋白、ZO-1的表达,降低血清炎症介质IL-1β、IL-13、IL-25、IL-33的浓度;TRIM31-/-小鼠较野生型小鼠相比,结肠炎症加重,肠黏膜屏障相关闭合蛋白、密封蛋白、ZO-1表达降低,血清炎症介质IL-1β、IL-13浓度升高;艾灸还可改善TRIM31-/-UC小鼠的结肠炎症,升高结肠组织肠黏膜屏障相关闭合蛋白、密封蛋白、ZO-1的表达,降低血清炎症介质IL-1β、IL-13、IL-25、IL-33的浓度。结论:TRIM31蛋白可能是艾灸参与调节UC肠黏膜屏障保护的关键靶点;艾灸对TRIM31-/-小鼠肠黏膜屏障相关闭合蛋白、密封蛋白、ZO-1及血清炎症介质IL-1β、IL-13、IL-25、IL-33仍有调节作用,表明艾灸还可能通过发挥其多靶点调节作用参与UC肠黏膜屏障保护。
关键词 溃疡性结肠炎;艾灸;TRIM31;肠黏膜屏障;炎症介质;基因敲除
Protective Mechanism of Moxibustion on Intestinal Mucosal Barrier by Regulating E3 Ubiquitin Ligase TRIM31 in Mice with Ulcerative Colitis
WU Luyi1,2,ZHONG Rui3,LIN Yaying2,ZHENG Handan2,LIU Shimin2,HUANG Yan2,MA Zhe2,LIU Yanan2
(1 Yueyang Hospital of Integrated Traditional Chinese and Western Medicine,Shanghai University of Traditional Chinese Medicine,Shanghai 200437,China; 2 Shanghai Research Institute of Acupuncture and Meridian,Shanghai 200030,China; 3 Shanghai Qigong Research Institute,Shanghai University of Traditional Chinese Medicine,Shanghai 200030,China)
Abstract Objective:To observe the effects of moxibustion on tight junction proteins and serum inflammatory factors in wild-type and TRIM31 knockout (TRIM31-/-) ulcerative colitis (UC) model mice and explore the possibility of TRIM31 in reducing intestinal inflammation in UC by protecting the intestinal mucosal barrier,as well as the regulatory role of moxibustion.Methods:The UC model was induced in the wild-type and TRIM31-/-mice.Immunohistochemistry was used to detect the protein expression of TRIM31,Occludin,Claudin-1,and ZO-1 in colon tissues.RT-qPCR was used to detect the mRNA expression of TRIM31 in colon tissues.The serum levels of IL-1β,IL-13,IL-25,and IL-33 were detected by ELISA.Results:Moxibustion could resist colonic inflammation in wild-type UC mice,increase the protein and mRNA expression of TRIM31 and the expression of Occludin,Claudin-1,and ZO-1 in the colon,and reduce the concentrations of inflammatory factors IL-1β,IL-13,IL-25,and IL-33 in the serum.Compared with the wild-type mice,the TRIM31-/-mice showed aggravated colitis,decreased expression of Occludin,Claudin-1,and ZO-1,and increased serum concentrations of IL-1β and IL-13.Additionally,moxibustion could improve the colitis of TRIM31-/-UC mice,increase the expression of Occludin,Claudin-1,and ZO-1 in the colon,and reduce the serum concentrations of IL-1β,IL-13,IL-25,and IL-33.Conclusion:TRIM31 protein might serve as a key target of moxibustion in regulating the intestinal mucosal barrier in UC.The regulatory role of moxibustion on Occludin,Claudin-1,ZO-1,IL-1β,IL-13,IL-25,and IL-33 in TRIM31-/-mice was verified,which suggested that moxibustion presumedly participated in the protection of intestinal mucosal barrier in UC by virtue of its multi-target regulatory role.
Keywords Ulcerative colitis; Moxibustion; TRIM31; Intestinal mucosal barrier; Inflammatory factors; Gene knockout
中圖分类号:R256.3文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.03.007
溃疡性结肠炎(Ulcerative Colitis,UC)是一种病因未明的慢性复发性结直肠疾病,与克罗恩病(Crohn Disease,CD)同属于炎症性肠病的范畴。UC的临床症状主要包括腹泻、腹痛、黏液脓血便、体质量减轻、里急后重等,另外还可表现为皮肤、眼睛、关节和肝胆等肠外症状。UC的诊断目前主要结合患者病史、内窥镜检查、组织病理学、实验室检查以及影像学研究等综合手段[1]。UC在全世界的影响范围较广,其发病率呈逐年上升的趋势[2-3]。长期反复发作的溃疡性结肠炎降低了患者的生命质量,且增加了患结直肠癌的风险[4]。UC的病理机制较为复杂,目前尚未完全阐明,主要与遗传、免疫、环境等因素相关[5]。研究表明,三结构域蛋白家族(Tripartite Motif,TRIM)可通过泛素-蛋白酶体途径促进各自底物的降解,在先天免疫应答中具有重要的调节作用[6]。其中,TRIM31蛋白作为该家族中重要的一员,与肠道炎症和肠道稳态密切相关[7-8]。TRIM31蛋白还可通过泛素蛋白酶途径介导炎症小体核苷酸结合寡聚化结构域样受体蛋白3(Nucleotide-binding Oligomerization Domain-like Receptor Protein 3,NLRP3)的蛋白降解,参与葡聚糖硫酸钠(Dextran Sulfate Sodium Salt,DSS)诱导的小鼠结肠炎的炎症反应[9]。UC是一种最初由上皮细胞或结构性肠上皮功能障碍引起的肠道屏障疾病,而肠道屏障障碍也可能被固有层中的强炎症介质和细胞破坏引起,继而引发的炎症级联反应可导致疾病呈慢性发展[1]。在UC的整个病理过程中,肠黏膜屏障作为肠道的重要防线之一,其损伤引起的肠黏膜通透性的增加可能是UC发病的始动因素[10-13]。目前TRIM31与UC肠黏膜屏障的相关研究较少,TRIM31能否通过保护UC肠黏膜屏障而降低UC肠道炎症反应,可能是探讨UC发病机制的一个突破点。
UC的治疗主要体现在最大限度地缓解症状、消除炎症、愈合溃疡,常用药物主要有5-氨基水杨酸类、皮质类固醇、免疫抑制剂、抗生素以及一些新兴的生物制剂等,但个体间疗效具有较大差异,且部分药物具有一定的不良反应、停药易复发的缺点[14]。研究表明艾灸治疗UC有着良好的临床疗效,可从多环节、多靶点调节机体免疫平衡,且具有安全、复发率低及远期疗效好等优势[15-16]。实验研究表明艾灸还可对UC免疫细胞因子、炎症信号通路及肠黏膜屏障等有调节作用[17-19]。因此,本研究采用TRIM31基因敲除小鼠深入探讨艾灸干预UC的肠黏膜屏障保护机制。
1 材料与方法
1.1 材料
1.1.1 动物 本研究选用6周龄的无特定病原体(SPF)级雄性C57BL/6野生型(Wild Type,WT)小鼠和C57BL/6背景的TRIM31基因敲除(TRIM31-/-)小鼠为实验对象,均由江苏集萃药康生物科技有限公司提供,所有实验动物均饲养于上海中医药大学动物实验中心[实验动物使用许可证号:SYXK(沪)2014-0008]。饲养环境:12 h昼夜节律交替、室内温度控制在(20±2)℃,室内湿度控制在50%~70%。实验动物适应性饲养1周后开始正式实验,所有实验操作均在上海中医药大学动物伦理委员会指导下进行,动物福利伦理委员会批准通过(伦理审批号:PZSHUTCM211227010)
1.1.2 药物 DSS(MP Biomedicals,美国,批号:00081551),艾绒(南阳汉医艾绒有限责任公司,批号:20190716),桂附一号方(上海华济药业有限公司),黄酒(上海庆丰酿造调味品有限公司,批号:20190519)。
1.1.3 试剂与仪器 TRIM31(Thermo Fisher,美国,货号:PA5-40961),闭合蛋白(abcam,美国,货号:ab222691),密封蛋白(SANTA CRUS,美国,货号:sc-166338),ZO-1(abcam,美国,货号:ab190085),小鼠白细胞介素-1β(IL-1β)ELISA试剂盒(上海司鼎生物科技有限公司,货号:SDM0002),小鼠白细胞介素-13(IL-13)ELISA试剂盒(上海司鼎生物科技有限公司,货号:SDM0012),小鼠白细胞介素-25(IL-25)ELISA试剂盒(上海司鼎生物科技有限公司,货号:SDM0130),小鼠白细胞介素-33(IL-33)ELISA试剂盒(上海司鼎生物科技有限公司,货号:SDM0019),光学显微镜(OLYMPUS,日本,型号:CX33),酶标仪(Tecan,瑞士,型号:F50),组织研磨仪(上海净信科技有限公司,型号:Tissuelyser-48),qPCR仪(Roche,瑞士,型号:LightCycler 480Ⅱ)。
1.2 方法
1.2.1 分组与模型制备 1)实验一:艾灸干预WT小鼠UC模型的效应及机制研究:将WT小鼠随机分成正常组(n=8)和造模组(n=20),造模组采用3% DSS水溶液连续饮用7 d制备UC模型[20]。造模结束后随机抽取正常组和造模组各2只进行模型鉴定;HE染色的组织病理学观察见到溃疡面确定造模成功后将造模组小鼠随机分为模型组、隔药饼灸组、西药组,每组6只。2)实验二:TRIM31-/-对UC小鼠肠黏膜屏障相关蛋白及血清炎症介质的影响研究:WT小鼠和TRIM31-/-小鼠各6只,造模方法同实验一。3)实验三:艾灸干预TRIM31-/-小鼠UC模型的效应及机制研究:将TRIM31-/-小鼠随机分成正常组、模型组、隔药饼灸组、西药组,每组6只,造模方法同实验一。
1.2.2 干预方法 1)实验一:隔药饼灸、西药组小鼠分别进行隔药饼灸、西药连续干预7 d后与正常组、模型组一起取材处理。2)实验二:不进行干預,取材时间节点同实验一。3)实验三:干预方法及取材时间节点均同实验一。
隔药饼灸穴位选取天枢(双)、气海穴,穴位定位参照余曙光主编《实验针灸学》[21]。操作方法:将制附子、肉桂、木香等药研末,用黄酒调制,药饼用定制模具做成药饼(直径0.5 cm,厚度0.3 cm);将药饼置于穴区,上置艾炷施灸,每壮艾炷大小约30 mg,1次/d,每次每穴灸2壮,连续灸7 d。西药组采用柳氮磺胺吡啶(SASP)溶液灌胃,每日投药量参照《药理实验方法学》[22]配制:按成人(70 kg体质量)与小鼠(20 g体质量)1∶0.002 6比例,1次/d,共灌胃7 d,并做与隔药饼灸组同样的抓取固定。
1.2.3 标本采集与制备
干预结束后,所有小鼠禁食、不禁水24 h。小鼠腹腔注射1%的戊巴比妥钠(35~40 mg/kg)进行麻醉后,剪去胸部被毛,于心尖搏动最明显处穿刺抽血,室温静置2 h离心(4 ℃,3 000 r/min,15 min,离心半径10 cm)后取上清,并置于-80 ℃冰箱中保存备用。沿小鼠腹中线剪开小鼠腹部,充分暴露直肠、结肠,从耻骨联合处上行剪至盲肠部,并量取结肠长度;每段结肠分成两部分,一部分将其浆膜层贴于滤纸上,放入4%多聚甲醛中固定,另一部分放入冻存管中置于-80 ℃冰箱中保存备用。
1.2.4 检测指标与方法
1.2.4.1 观察小鼠结肠组织病理学改变 将多聚甲醛中固定的结肠组织脱水、包埋后进行石蜡切片,切片厚度为4 μm。石蜡切片经二甲苯、梯度乙醇脱蜡水化后,再经流水冲洗、苏木素染色、1%盐酸乙醇分化、伊红侵染、乙醇和二甲苯脱水透明后封片,于光学显微镜下观察小鼠结肠黏膜组织形态学变化。
1.2.4.2 检测小鼠结肠组织肠黏膜屏障相关蛋白的表达 取小鼠结肠组织石蜡切片,经脱蜡、水化、抗原修复、封闭后于37 ℃条件下滴加一抗(TRIM31浓度:1∶200;闭合蛋白浓度:1∶200;密封蛋白浓度:1∶200;ZO-1浓度:1∶200),4 ℃冰箱过夜并于第2天滴加二抗孵育。磷酸盐缓冲液(PBS)冲洗后用DAB显色液进行显色。之后用苏木精对细胞核进行染色1 min,脱水,封片。每张切片在固定光亮度下,随机选取3个视野进行拍照,采用Image-Plus Pro 6.0软件分析每张照片积分光密度(IOD),最后取平均值即为该切片的阳性目标积分光密度值。
1.2.4.3 检测小鼠结肠组织TRIM31mRNA的表达 采用实时荧光定量PCR(RT-qPCR)检测法检测小鼠结肠组织TRIM31的mRNA表达。主要的步骤如下:1)总RNA抽提;2)逆转录;3)荧光定量PCR扩增,小鼠的基因序列参照Gene Bank数据库中各目的基因的序列,引物由上海生工生物工程股份有限公司合成。Mouse TRIM31 F-primer:AATACGTTCAGGCCCAATAAGC;Mouse TRIM31 R-primer:GTCCTTGGAGTCACGACACAC;Mouse GAPDH F-primer:AGGTCGGTGTGAACGGATTTG;Mouse GAPDH R-primer:TGTAGACCATGTAGTTGAGGTCA。反应条件:95 ℃,2 min;94 ℃,10 s;60 ℃,10 s;72 ℃,40 s,共40个循环,采用 2-△△Ct法对所得数据进行分析。
1.2.4.4 检测小鼠血清炎症介质IL-1β、IL-13、IL-25、IL-33的浓度 采用ELISA试剂盒检测小鼠血清IL-1β、IL-13、IL-25、IL-33蛋白的浓度,实验方法严格按照试剂盒操作说明书进行,步骤如下:配置标准品液,每孔各加入标准品或待测样品100 μL,将反应板充分混匀后置37 ℃ 40 min;洗涤液充分洗涤4~6次,向滤纸上印干;每孔加入蒸馏水和第一抗体工作液各50 μL(空白孔除外),充分混匀后置37 ℃ 20 min;洗板同前;每孔加酶标抗体工作液100 μL,37 ℃反应10 min;洗板同前;每孔加入底物工作液100 μL,置37 ℃暗处反应15 min;每孔加入100 μL终止液混匀;30 min内用酶标仪在450 nm波长处测吸光值。
1.3 统计学方法 采用SPSS 21.0统计软件进行数据分析。计量资料先作正态性检验,符合正态分布用均数±标准差(±s)表示,多组间比较采用单因素方差分析(One-way ANOVA)法,2组间比较采用t检验法,方差分析法中若方差齐性采用LSD法,方差不齐性采用Dunnett法;不符合正态分布者以M(P25,P75)表示,组间比较采用非参数检验法。所有检验采用双侧检验,以α=0.05为检验水准,以P<0.05为差异有统计学意义。
2 结果
2.1 艾灸干预WT小鼠UC模型的效应及机制研究
2.1.1 艾灸干预WT小鼠UC结肠炎症的效应 结肠长度比较结果提示,与正常组比较,模型组结肠长度明显缩短(P<0.05);与模型组比较,隔药饼灸组与西药组结肠长度均变长(P<0.05)。HE染色结果显示,正常组可见结肠上皮层完整,腺体排列良好,杯状细胞清晰可见;模型组可见溃疡形成,腺体数量减少,伴有大量炎症细胞浸润;隔药饼灸组与西药组溃疡愈合,有新生上皮细胞覆盖,杯状细胞增多,炎症细胞浸润程度减轻。见图1。
2.1.2 艾灸对WT小鼠UC结肠组织TRIM31蛋白及mRNA表达的影响
与正常组比较,模型组结肠组织中TRIM31的蛋白及mRNA表达显著降低(P<0.05)。与模型组比较,隔药饼灸组和西药组TRIM31的蛋白及mRNA表达均显著升高(均P<0.05)。见图2。
2.1.3 艾灸对WT小鼠UC结肠肠黏膜屏障相关蛋白表达的影响
与正常组比较,模型组小鼠结肠组织闭合蛋白、密封蛋白、ZO-1蛋白表达降低(P<0.05);与模型组比较,隔药饼灸组与西药组小鼠结肠组织闭合蛋白、密封蛋白、ZO-1蛋白表达升高(P<0.05)。见图3。
2.1.4 艾灸对WT小鼠UC血清炎症介质的影响
与正常组比较,模型组小鼠血清IL-1β、IL-13、IL-25、IL-33浓度升高(P<0.05);与模型组比较,隔药饼灸组与西药组小鼠血清IL-1β、IL-13、IL-25、IL-33浓度降低(P<0.05)。见图4。
2.2 TRIM31-/-对UC小鼠肠黏膜屏障相关蛋白及血清炎症介质的影响
2.2.1 TRIM31-/-对UC小鼠结肠长度及组织病理学的影响
结肠长度比较结果提示,与WT比较,TRIM31-/-结肠长度明显缩短(P<0.05);HE染色结果显示,与WT比较,TRIM31-/-结肠组织溃疡面积较大,腺体消失,炎症细胞浸润程度较严重。见图5。
2.2.2 TRIM31-/-对UC小鼠结肠肠黏膜屏障相关蛋白的影响
与WT比较,TRIM31-/-小鼠肠黏膜屏障相关闭合蛋白、密封蛋白、ZO-1蛋白表达均降低(P<0.05)。见图6。
2.2.3 TRIM31-/-对UC小鼠血清炎症介质的影响
与WT比较,TRIM31-/-血清炎症介质IL-1β、IL-13浓度升高(P<0.05),而IL-25、IL-33的浓度无明显变化(P>0.05)。见图7。
2.3 艾灸干预TRIM31-/-小鼠UC模型的效应及机制研究
2.3.1 艾灸干预TRIM31-/-小鼠UC结肠炎症的效应
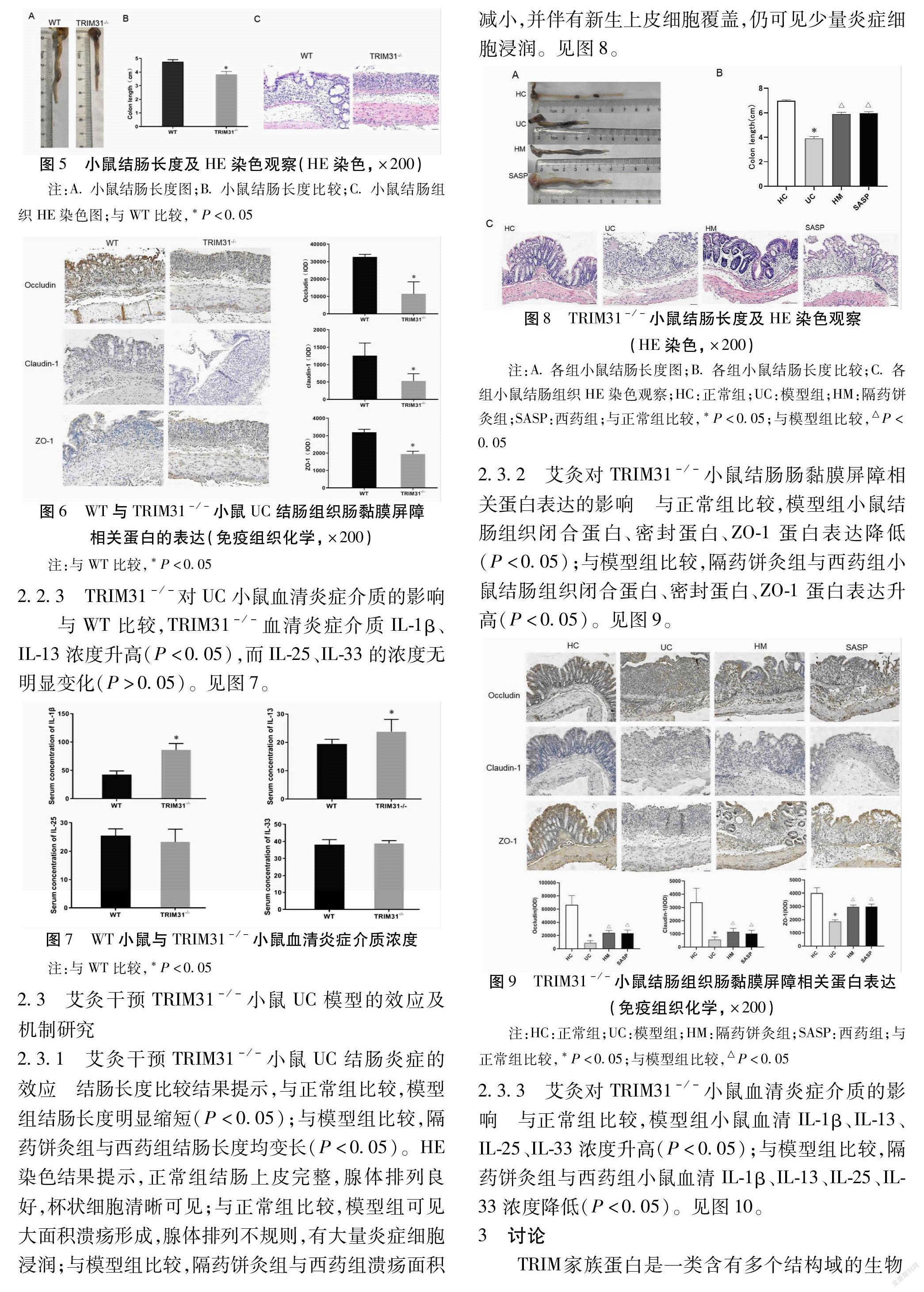
结肠长度比较结果提示,与正常组比较,模型组结肠长度明显缩短(P<0.05);与模型组比较,隔药饼灸组与西药组结肠长度均变长(P<0.05)。HE染色结果提示,正常组结肠上皮完整,腺体排列良好,杯状细胞清晰可见;与正常组比较,模型组可见大面积溃疡形成,腺体排列不规则,有大量炎症细胞浸润;与模型组比较,隔药饼灸组与西药组溃疡面积减小,并伴有新生上皮细胞覆盖,仍可见少量炎症细胞浸润。见图8。
2.3.2 艾灸对TRIM31-/-小鼠结肠肠黏膜屏障相关蛋白表达的影响
与正常组比较,模型组小鼠结肠组织闭合蛋白、密封蛋白、ZO-1蛋白表达降低(P<0.05);与模型组比较,隔药饼灸组与西药组小鼠结肠组织闭合蛋白、密封蛋白、ZO-1蛋白表达升高(P<0.05)。见图9。
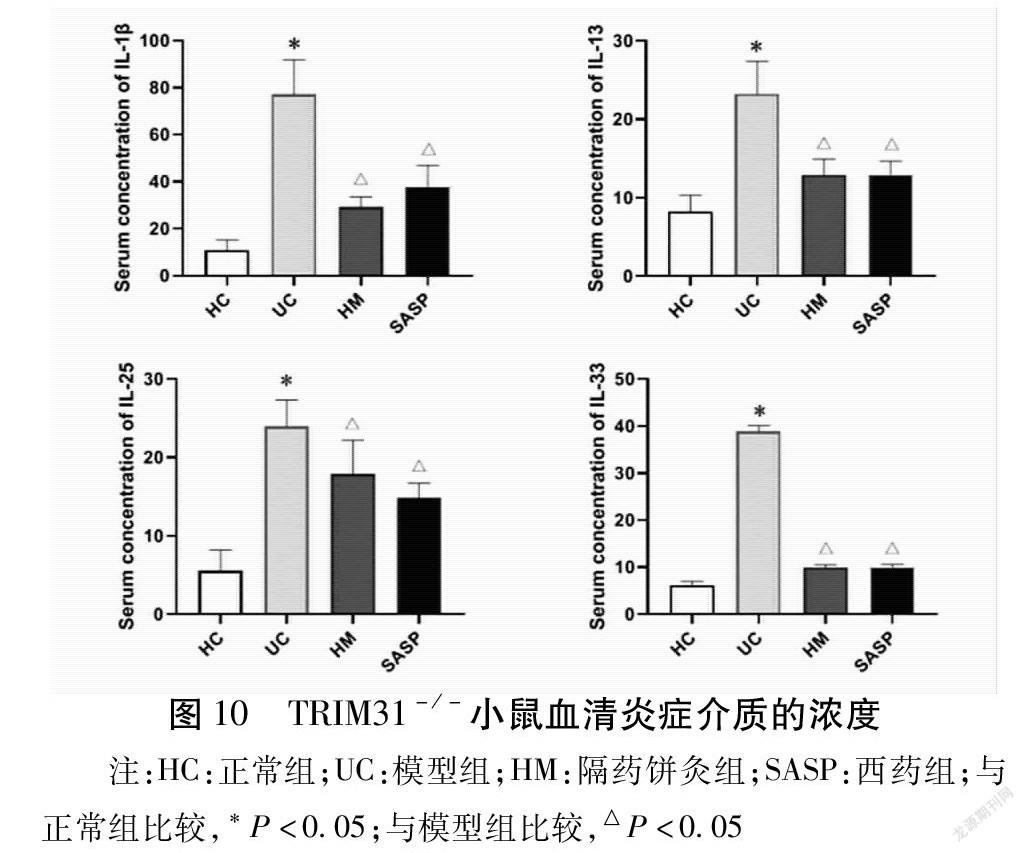
2.3.3 艾灸对TRIM31-/-小鼠血清炎症介质的影响
与正常组比较,模型组小鼠血清IL-1β、IL-13、IL-25、IL-33浓度升高(P<0.05);与模型组比较,隔药饼灸组与西药组小鼠血清IL-1β、IL-13、IL-25、IL-33浓度降低(P<0.05)。见图10。
3 讨论
TRIM家族蛋白是一类含有多个结构域的生物大分子,因其含有RING结构域,有作为泛素连接酶的潜能故而通常有E3泛素连接酶的活性,在抗病毒的天然免疫反应过程中也常常通过其泛素连接酶活性调控信号通路中的分子活性[23]。TRIM家族蛋白中一种命名为TRIM31的分子被确定为具有E3泛素连接酶活性,研究表明TRIM31蛋白参与了肺癌、胃癌、肝癌等的发生发展[24-26],TRIM31蛋白还可通过核因子κB途径介导慢性炎症促进结直肠癌的侵袭和转移[27]。TRIM31在肠道炎症和肠道稳态中也扮演着重要的角色,研究发现,在TRIM31缺陷小鼠中,TRIM31-/-小鼠较WT小鼠可出现葡萄糖不耐受与胰岛素抵抗的现象,并伴有肠道微生物群的显著差异,表明TRIM31缺陷与小鼠糖代谢受损和肠道微生物群破坏有关[7]。另有研究表明,内源性TRIM31的损耗可显著增加肠上皮细胞入侵细菌的数量[8]。TRIM31蛋白還可通过泛素蛋白酶途径介导炎症小体NLRP3的蛋白降解,参与DSS诱导的小鼠结肠炎的炎症反应[9],可能是UC的关键治疗靶点之一。
艾灸治疗UC具有安全、复发率低及远期疗效好等优势[15-16],其中腧穴配伍对临床疗效起了关键作用[28]。气海穴属任脉之经穴,可补益元气,对脾肾之元气亏损所致的UC有较好的临床疗效[29]。天枢属大肠之募穴,是人体气机升降之枢纽,对肠腑疾病具有双向良性调节作用,本穴也是动物实验研究中针灸干预UC的常用腧穴[30-31]。本研究采用DSS诱导的UC小鼠模型,并观察艾灸天枢、气海穴对UC小鼠结肠组织TRIM31的调节作用,研究结果表明,DSS诱导的UC小鼠结肠TRIM31蛋白和mRNA表达均明显降低,这与既往研究中TRIM31在DSS诱导的结肠炎小鼠中表达下调一致[8-9]。艾灸干预后,UC小鼠结肠长度升高、炎症缓解,结肠TRIM31蛋白和mRNA表达均明显升高,提示艾灸可能通过调节TRIM31的表达参与改善UC炎症。
炎症反应始终贯穿UC的整个病理过程,而由肠黏膜屏障损伤引起的肠黏膜通透性的增加可能是UC发病的关键因素。肠黏膜屏障主要由机械屏障、免疫屏障、生物屏障及化学屏障组成[32],而构成机械屏障的紧密连接对于维持肠黏膜屏障完整性和肠上皮屏障通透性具有重要意义[33]。其中,紧密连接蛋白如闭合蛋白、密封蛋白、ZO-1等的减少或破坏会导致肠黏膜通透性增加,引起肠腔抗原摄入的增加,激活机体天然免疫反应,产生大量的炎症介质,进一步加重肠道炎症反应[34-35]。本研究发现,WT小鼠UC模型中肠黏膜屏障相关闭合蛋白、密封蛋白、ZO-1明显降低,血清炎症介质IL-1β、IL-13、IL-25、IL-33浓度明显升高;而经过艾灸干预后,上述肠黏膜屏障相关蛋白的表达均明显升高,血清炎症介质浓度均明显降低,提示艾灸对肠黏膜屏障相关闭合蛋白、密封蛋白、ZO-1蛋白和血清炎症介质IL-1β、IL-13、IL-25、IL-33浓度具有调节作用。
為了进一步观察TRIM31在UC肠黏膜屏障中的作用,我们采用野生型小鼠和TRIM31-/-小鼠,从正反2个方面观察UC小鼠的炎症程度、肠黏膜屏障相关蛋白及血清炎症介质的变化。研究发现,TRIM31-/-小鼠较WT小鼠结肠炎症程度加重,肠黏膜屏障相关闭合蛋白、密封蛋白、ZO-1的表达降低,血清炎症介质IL-1β、IL-13浓度升高,表明TRIM31可能是参与UC肠黏膜屏障保护、降低炎症反应的关键靶点。但既往有研究发现,在DSS诱导的小鼠结肠炎中,TRIM31-/-较野生型小鼠的结肠炎症程度减轻[9],与本研究结果存在一定的差异。既往研究的实验周期为6 d,而本研究为了与艾灸、西药组保持相同的研究周期,在7 d造模结束后设置了7 d的等待期,实验周期的不同可能是造成两项研究结果差异的重要因素。TRIM31在UC不同阶段是否发挥了不同的作用值得关注。
艾灸可从多环节、多靶点调节机体生理平衡。本研究同时也观察了艾灸对TRIM31-/-小鼠UC模型的效应、肠黏膜屏障相关蛋白及血清炎症介质的影响。研究结果表明,艾灸可改善TRIM31-/-小鼠的UC结肠炎症程度,升高TRIM31-/-小鼠UC结肠组织肠黏膜屏障相关闭合蛋白、密封蛋白、ZO-1的表达,降低TRIM31-/-小鼠血清炎症介质IL-1β、IL-13、IL-25、IL-33的浓度,提示TRIM31基因敲除后,艾灸仍能改善UC小鼠的肠道炎症,保护肠黏膜屏障,这也进一步证实了艾灸的多靶点调节作用。
参考文献
[1]Kobayashi T,Siegmund B,Le Berre C,et al.Ulcerative colitis[J].Nat Rev Dis Primers,2020,6(1):74.
[2]Kaplan GG.The global burden of IBD:from 2015 to 2025[J].Nat Rev Gastroenterol Hepatol,2015,12(12):720-727.
[3]Danese S,Fiocchi C.Ulcerative colitis[J].N Engl J Med,2011,365(18):1713-1725.
[4]Eaden JA,Abrams KR,Mayberry JF.The risk of colorectal cancer in ulcerative colitis:a meta-analysis[J].Gut,2001,48(4):526-535.
[5]Ananthakrishnan AN.Epidemiology and risk factors for IBD[J].Nat Rev Gastroenterol Hepatol,2015,12(4):205-217.
[6]Ozato K,Shin DM,Chang TH,et al.TRIM family proteins and their emerging roles in innate immunity[J].Nat Rev Immunol,2008,8(11):849-860.
[7]Cheng J,Xue F,Zhang M,et al.TRIM31 Deficiency Is Associated with Impaired Glucose Metabolism and Disrupted Gut Microbiota in Mice[J].Front Physiol,2018,9:24.
[8]Ra EA,Lee TA,Won Kim S,et al.TRIM31 promotes Atg5/Atg7-independent autophagy in intestinal cells[J].Nat Commun,2016,7:11726.
[9]Song H,Liu B,Huai W,et al.The E3 ubiquitin ligase TRIM31 attenuates NLRP3 inflammasome activation by promoting proteasomal degradation of NLRP3[J].Nat Commun,2016,7:13727.
[10]Merga Y,Campbell BJ,Rhodes JM.Mucosal barrier,bacteria and inflammatory bowel disease:possibilities for therapy[J].Dig Dis,2014,32(4):475-483.
[11]Fonseca-Camarillo G,Yamamoto-Furusho JK.Immunoregulatory Pathways Involved in Inflammatory Bowel Disease[J].Inflamm Bowel Dis,2015,21(9):2188-2193.
[12]Camilleri M,Madsen K,Spiller R,et al.Intestinal barrier function in health and gastrointestinal disease[J].Neurogastroenterol Motil,2012,24(6):503-512.
[13]Sánchez de Medina F,Romero-Calvo I,Mascaraque C,et al.Intestinal inflammation and mucosal barrier function[J].Inflamm Bowel Dis,2014,20(12):2394-2404.
[14]Harbord M,Eliakim R,Bettenworth D,et al.Third European Evidence-based Consensus on Diagnosis and Management of Ulcerative Colitis.Part 2:Current Management[J].J Crohns Colitis,2017,11(7):769-784.
[15]Zhou EH,Liu HR,Wu HG,et al.Down-regulation of protein and mRNA expression of IL-8 and ICAM-1 in colon tissue of ulcerative colitis patients by partition-herb moxibustion[J].Dig Dis Sci,2009,54(10):2198-2206.
[16]Xu YL,Du YH,Xu XM,et al.Observation on therapeutic effect of herb-partitioned spread moxibustion for treatment of chronic nonspecific ulcerative colitis[J].Zhongguo Zhen Jiu,2010,30(4):289-291.
[17]Wang X,Liu Y,Dong H,et al.Herb-Partitioned Moxibustion Regulates the TLR2/NF-κB Signaling Pathway in a Rat Model of Ulcerative Colitis[J].Evid Based Complement Alternat Med,2015,2015:949065.
[18]Zhang D,Ren YB,Wei K,et al.Herb-partitioned moxibustion alleviates colon injuries in ulcerative colitis rats[J].World J Gastroenterol,2018,24(30):3384-3397.
[19]Ma TM,Xu N,Ma XD,et al.Moxibustion regulates inflammatory mediators and colonic mucosal barrier in ulcerative colitis rats[J].World J Gastroenterol,2016,22(8):2566-2575.
[20]Okayasu I,Hatakeyama S,Yamada M,et al.A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice[J].Gastroenterology,1990,98(3):694-702.
[21]余曙光,郭义.实验针灸学[M].2版.上海:上海科学技术出版社,2014:145-146.
[22]徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2002:1859-1861.
[23]Versteeg GA,Benke S,García-Sastre A,et al.InTRIMsic immunity:Positive and negative regulation of immune signaling by tripartite motif proteins[J].Cytokine Growth Factor Rev,2014,25(5):563-576.
[24]Li H,Zhang Y,Zhang Y,et al.TRIM31 is downregulated in non-small cell lung cancer and serves as a potential tumor suppressor[J].Tumour Biol,2014,35(6):5747-5752.
[25]Sugiura T,Miyamoto K.Characterization of TRIM31,upregulated in gastric adenocarcinoma,as a novel RBCC protein[J].J Cell Biochem,2008,105(4):1081-1091.
[26]Guo P,Ma X,Zhao W,et al.TRIM31 is upregulated in hepatocellular carcinoma and promotes disease progression by inducing ubiquitination of TSC1-TSC2 complex[J].Oncogene,2018,37(4):478-488.
[27]Wang H,Yao L,Gong Y,et al.TRIM31 regulates chronic inflammation via NF-κB signal pathway to promote invasion and metastasis in colorectal cancer[J].Am J Transl Res,2018,10(4):1247-1259.
[28]王華,梁凤霞.腧穴配伍研究思路和展望[J].中国针灸,2012,32(4):359-362.
[29]陈静子,李岩琪,李晓梅,等.杨兆钢教授气海穴芒针深刺临床应用举隅[J].针灸临床杂志,2013,29(11):49-51.
[30]杨玲,黄艳,黄任佳,等.艾灸预处理天枢穴对溃疡性结肠炎大鼠结肠TLR4/TRIF信号通路调节作用的研究[J].上海针灸杂志,2019,38(8):819-826.
[31]吴丹,梁浩.电针天枢穴对溃疡性结肠炎大鼠NF-κB信号通路的影响[J].针灸临床杂志,2018,34(2):56-59.
[32]Wang K,Wu LY,Dou CZ,et al.Research Advance in Intestinal Mucosal Barrier and Pathogenesis of Crohn′s Disease[J].Gastroenterol Res Pract,2016,2016:9686238.
[33]Turner JR,Buschmann MM,Romero-Calvo I,et al.The role of molecular remodeling in differential regulation of tight junction permeability[J].Semin Cell Dev Biol,2014,36:204-212.
[34]Lee SH.Intestinal permeability regulation by tight junction:implication on inflammatory bowel diseases[J].Intest Res,2015,13(1):11-18.
[35]Martini E,Krug SM,Siegmund B,et al.Mend Your Fences:The Epithelial Barrier and its Relationship With Mucosal Immunity in Inflammatory Bowel Disease[J].Cell Mol Gastroenterol Hepatol,2017,4(1):33-46.
(2022-01-06收稿 本文编辑:吴珊)

