农作物中Cry1A(c)和CP4-EPSPS转基因成分双重实时荧光PCR检测方法的建立
罗建兴 刘国强 其勒木格 郭梁


摘要:采用羧基荧光素(FAM)和六氯荧光素(HEX)荧光基团标记探针,建立针对农作物中常见抗虫和抗除草剂基因的双重实时荧光PCR检测方法,通过特异性、检出限以及模拟掺假试验验证此方法在转基因检测中的适用性。特异性检测试验中仅转基因作物(转基因棉花、转基因水稻、转基因大豆)和阳性质粒检测出相应转基因成分,其余样品均未出现明显PCR扩增曲线;检出限结果表明,双重实时荧光PCR方法对Cry1A(c)、CP4-EPSPS基因的检出限分别为1、0.1 ng,所建立的标准曲线r2值均大于0.98,具有对农作物中的转基因成分进行定量检测的能力;模拟掺假检测显示此方法可检测到1%的Cry1A(c)和5%的CP4-EPSPS转基因成分。综上所述,本试验建立的双重实时荧光PCR法适用于对Cry1A(c)和CP4-EPSPS转基因成分的快速检测和定量分析。
关键词:转基因;Cry1A(c)基因;CP4-EPSPS基因;双重实时荧光PCR;特异性;检出限;模拟掺假
中图分类号:TS207.3 文献标志码: A
文章编号:1002-1302(2022)05-0023-05
收稿日期:2021-04-16
基金项目:锡林郭勒职业学院重点科研项目(编号:ZD-2020-04、ZD-2019-01)。
作者简介:罗建兴(1993—),男,陕西榆林人,主要从事食品安全检测和风险评估及转基因成分检测研究。E-mail:ljxylyh@126.com。
通信作者:郭 梁,博士,主要从事转基因成分检测和动物源性成分检测以及微生物资源开发研究。E-mail:herdman86@163.com。
转基因是指利用现代生物技术,将一些有利于人类生产生活的外源基因导入动物、植物或微生物中,通过对生物体内DNA分子修饰改造达到改变原物种遗传性状的目的,从而使原物种获得本不具备的优良品质和特性[1-2]。1996年转基因烟草的商业化种植,标志着全球转基因商业化时代正式到来[3]。由于转基因具有提高产量、改善产品品质、抗虫、抗氧化剂、抗逆、性状优良等特性,全球都加大了对转基因作物的种植[4-6]。有研究表明,截至2018年年底,全球转基因作物种植面积已达到1917亿hm2[7]。据有关机构预计,2020年转基因食品带来的生物经济将直接达15万亿美元,从而成为保持经济可持续发展的中坚力量[8]。
转基因技术在农作物上的广泛应用不仅带动了全球经济发展,同时也产生了巨大社会效益,但任何技术的发展和进步都离不开风险管理。目前,一些人认为转基因农产品在营养成分、毒理性、潜在致敏性等多方面存在食品安全风险,会对环境及人类健康产生巨大影响[9-11]。20世纪90年代有研究表明,斑蝶幼虫在食用转基因马利筋草后,产生了40%以上的死亡率[12]。同时代的英国研究者给大鼠投食转基因马铃薯,最终导致大鼠免疫系统受损,身体发育出现异常[11]。此类事件的发生间接推动了转基因检测技术的发展,目前针对转基因的检测技术主要分为3个方面,即基于核酸、蛋白[13]及小分子代谢物[14]的检测。由于核酸本身的稳定性相比蛋白和小分子代谢物较强,在各种产品加工过程中稳定、不易降解,同时制备过程简单、成本低[15-16]。因此,目前的检测技术尤以基于核酸检测居多,核酸检测应用较为广泛的主要是PCR技术。传统PCR只能对单一基因进行检测,在一定程度上具有检测通量低的缺陷,而多重PCR虽具有扩增多重靶标的特点,但在后续电泳检测试验中却很难对一些大小相近的DNA片段进行区分[17]。而荧光定量PCR由于特异性强、灵敏度高、无交叉污染且高通量的特点成为目前转基因检测的有效主流技术[3]。
Cry1A(c)和CP4-EPSPS分別是转基因植物中常见的抗虫和抗除草剂基因[18],在现代农业生产生活中对农作物的优良品质和高产等起着非常重要的作用。其中,Cry1A(c)是苏云金芽孢杆菌的一种杀虫晶体蛋白,自然界的一些敏感幼虫在吞食附带有该蛋白的农作物后会形成活性毒素,最终导致昆虫因渗透压失衡死亡,该转基因技术目前已广泛应用于现代农林卫生害虫防治[19]。CP4-EPSPS是一种抗除草剂草甘膦基因,能够消除田间杂草,降低人工成本[20],目前没有Cry1A(c)和CP4-EPSPS同步检测的研究和应用。因此,本试验通过建立双重实时荧光PCR检测方法对植物中Cry1A(c)和CP4-EPSPS转基因成分进行检测,以期为转基因食品安全检测提供高效的检测手段和方法,从而保证食品的安全性和民众知情权。
1 材料与方法
1.1 材料与仪器
3种转基因试验样品(转基因棉花、转基因大豆、转基因水稻)由从事转基因基础研究的实验室提供;8种普通非转基因作物(棉花、水稻、大豆、玉米、小麦、苜蓿、白菜及烟草)于锡林浩特市本地农贸市场及超市采购。
TransStart Probe qPCR SuperMix购自北京全式金生物技术有限公司;qPCR引物和探针委托北京睿博兴科生物技术有限公司进行合成;DNA提取试剂盒购自宝生物工程(大连)有限公司。
高速台式离心机(型号为5418R),德国艾本德股份公司(Eppendorf AG公司);核酸蛋白测定仪(型号为Nanodrop 2000c),美国Thermo Fisher Scientific;实时荧光PCR仪(型号为7300Plus),美国ABI公司。
1.2 试验方法
1.2.1 引物和探针的设计与合成 参考GB/T 19495.4—2018[21]用荧光基团FAM和HEX分别标记Cry1A(c)和CP4-EPSPS探针并委托北京睿博兴科公司合成引物和探针,2种基因引物与探针序列见表1。
1.2.2 试验样品基因组DNA的提取与纯化 采用溴化十六烷三甲基铵(cetyltrimethylammonium bromide,CTAB)法提取DNA,并加适量的灭菌双蒸水溶解样品DNA。经核酸蛋白分析仪测定浓度后,将试验样品DNA终浓度稀释至约100 ng/μL,且使D260 nm/D280 nm为1.8~2.0,保存于-20 ℃冰箱备用。
1.2.3 阳性质粒DNA的提取 本实验室具有事先经过验证且特异性及可靠性检测结果均良好的阳性质粒pCry1A(c)和pCP4-EPSPS,能够在试验中起到阳性对照的作用,按DNA提取试剂盒所述步骤提取质粒DNA,经核酸蛋白分析仪测定浓度后,将其终浓度稀释为0.5 ng/μL,于-80 ℃保存备用。
1.2.4 实时荧光PCR反应体系及条件 反应体系(总体系20 μL):上下游引物各1 μL,探针1 μL,模板DNA1 μL,TransStart Probe qPCR SuperMix 10 μL,补水至20 μL。反应条件:94 ℃预变性30 s;94 ℃变性5 s,60 ℃退火34 s,40个循环,在每次循环退火时采集荧光信号。
1.2.5 特异性检测试验 以“1.1”节所示试验样品的DNA及“1.2.3”节提取的2种转基因阳性质粒DNA为模板,按照上述PCR反应体系加样,对设计和合成引物及探针进行特异性检测试验。根据典型扩增曲线和各反应体系循环阈值的差异验证Cry1A(c)和CP4-EPSPS这2种基因引物和探针对于不同样品DNA模板的特异性。
1.2.6 检出限检测试验及定量分析 将质量浓度同为10 ng/μL的转基因棉花和转基因大豆等体积混合,加灭菌双蒸水对混合DNA原液进行10倍梯度稀释,使各梯度DNA模板质量浓度分别为10、1、0.1、0.01、0.001、0.000 1、0.000 01 ng/μL,然后按照反应体系加样进行荧光定量PCR扩增反应,通过反应测定试验的检出限。根据检出限分析结果制作标准曲线,对DNA样品中的转基因成分作定量分析。
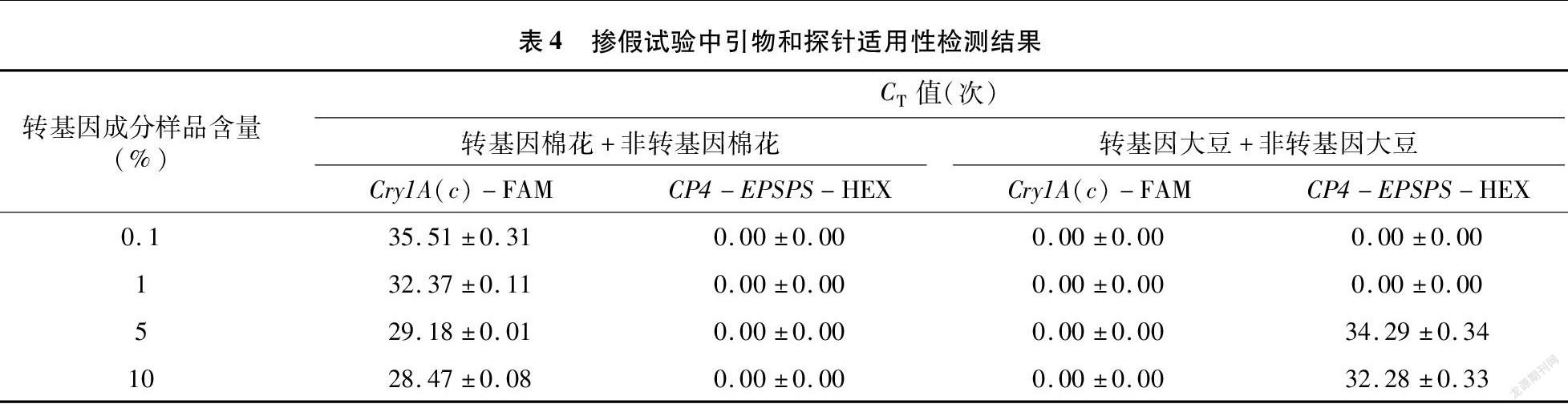
1.2.7 模拟掺假检测试验 将同浓度转基因作物DNA与其非转基因作物DNA(转基因棉花+普通非转基因棉花、转基因大豆+普通非转基因大豆)按不同体积进行混合,使转基因作物成分百分含量分别为0.1%、1%、5%、10%,然后按照实时荧光PCR反应体系及程序进行模拟掺假试验检测,以检验引物和探针在转基因作物掺假检测试验中的适用性。
1.3 数据处理
通过试验仪器自带软件处理和分析检测结果,数据均以“平均值±标准差”表示。
2 结果与分析
2.1 特异性检测
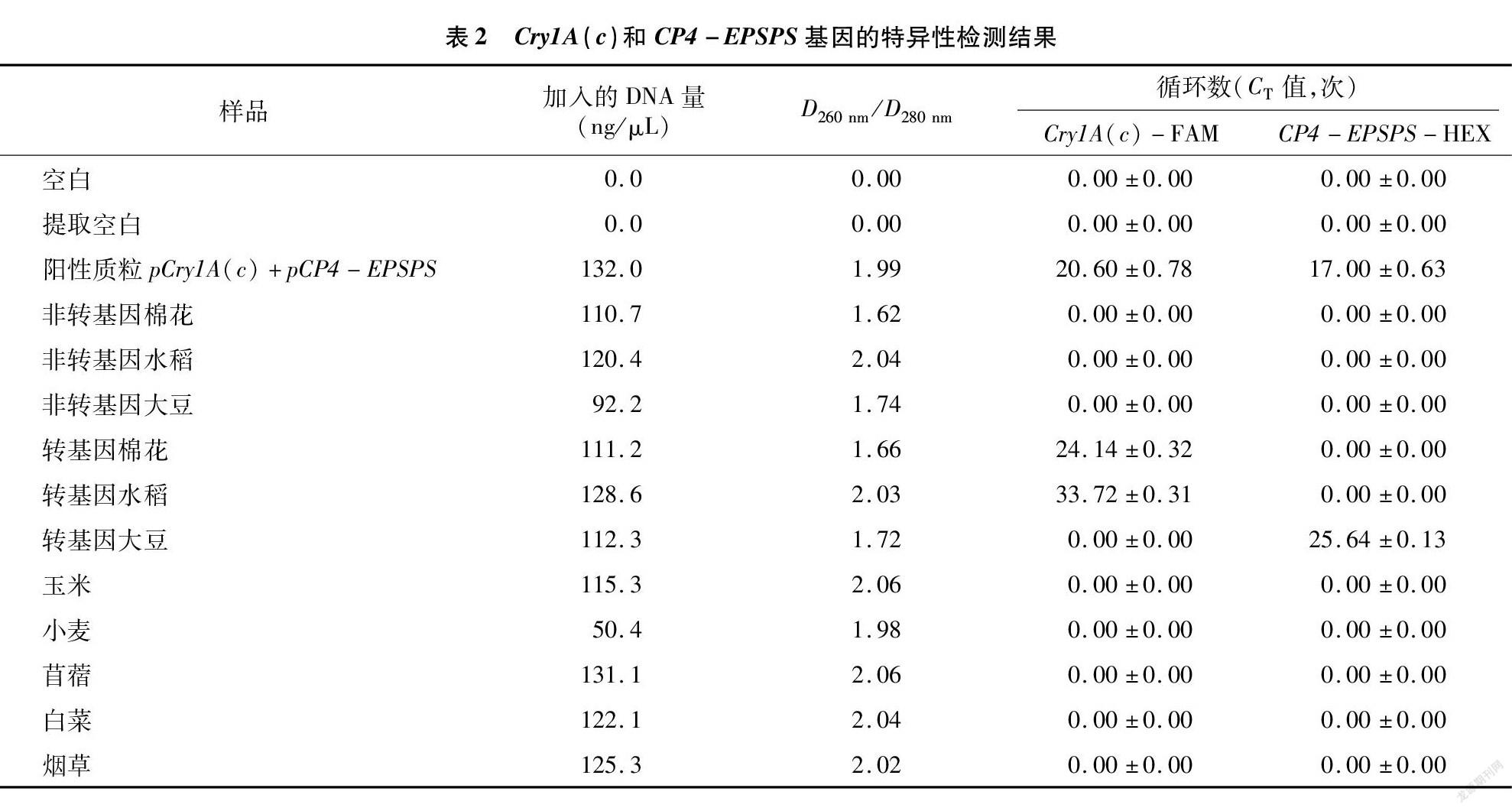
利用双重实时荧光PCR技术对Cry1A(c)和CP4-EPSPS基因引物和探针进行特异性检测,检测结果如表2和图1所示。可以看出,转基因棉花和转基因水稻中均检测出Cry1A(c)基因,转基因大豆中检测出CP4-EPSPS基因,在混合阳性质粒中2种基因均有检出,以上试验结果循环数(CT值)的标准差均在0.1~1之间,且扩增曲线具有很好的平行度(每个样品3个平行反应),说明试验检测结果较好,而对于其他样品的检测无明显特异性扩增曲线,进一步说明设计引物及探针对于不同检测样品的特异性。
2.2 检出限检测与定量分析
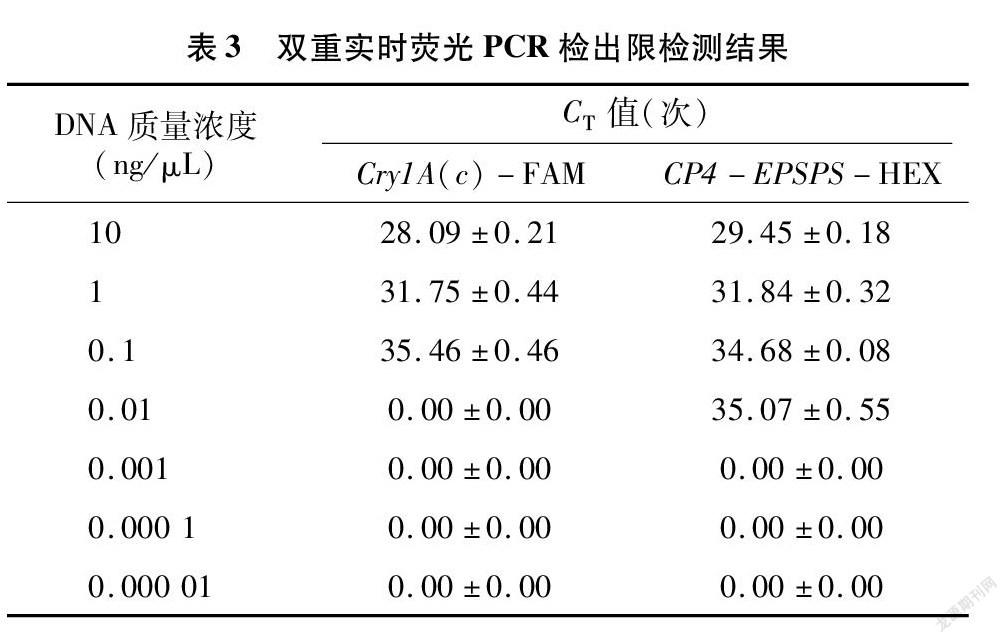
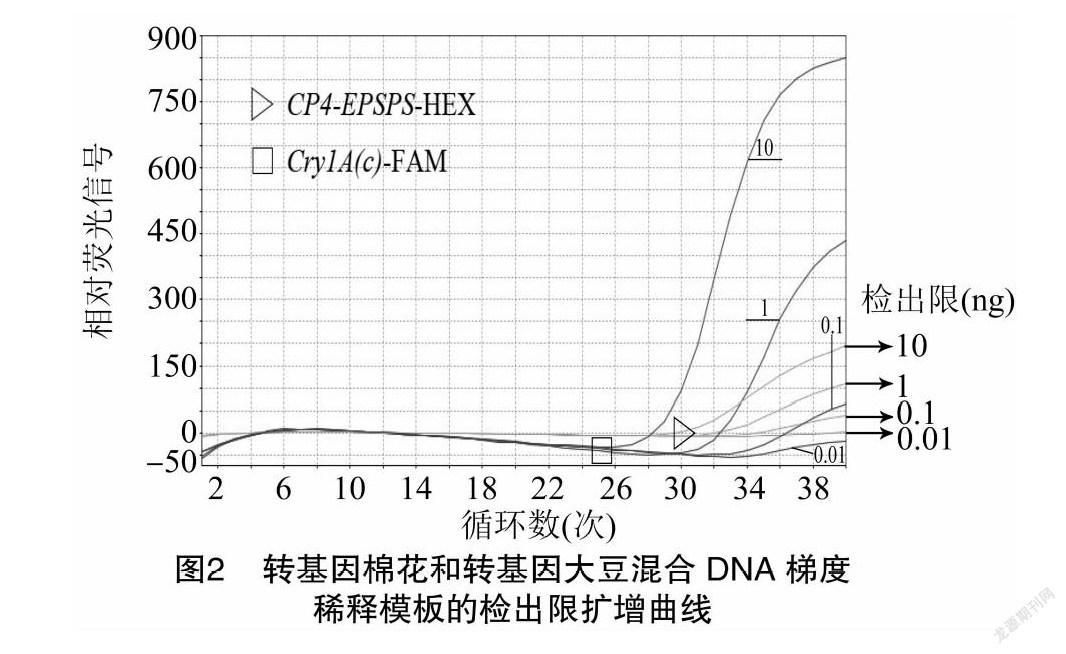
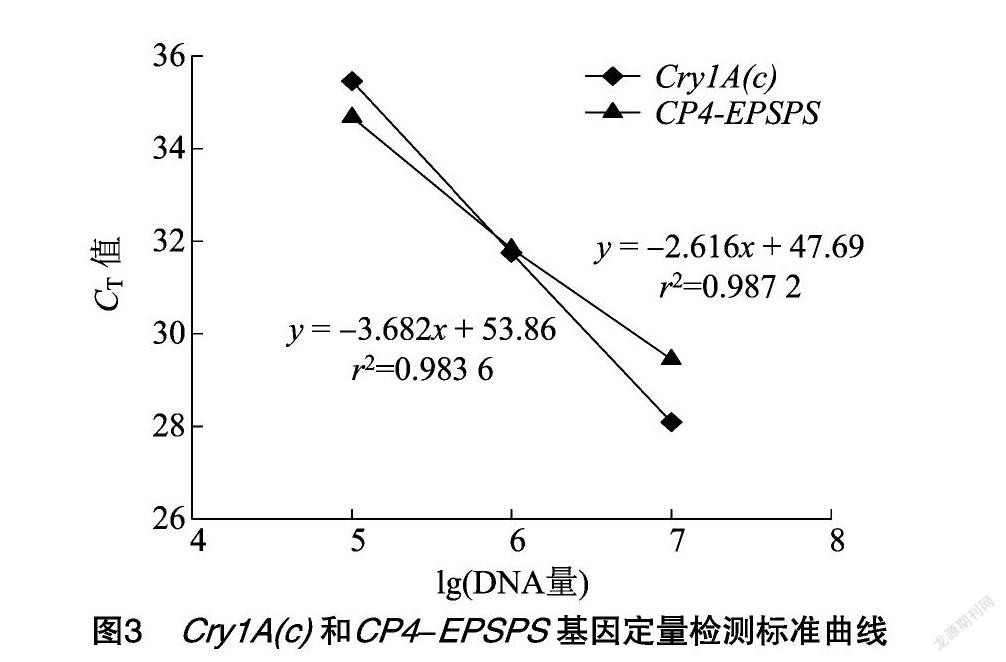
特异性检测试验表明,转基因棉花和转基因大豆中分别含有Cry1A(c)和CP4-EPSPS基因,将上述2种样品DNA进行同浓度等体积混合,并进行梯度稀释,得到质量浓度分别为10、1、0.1、0.01、0001、0.000 1、0.000 01 ng/μL的样品,以不同浓度样品DNA为模板(每个浓度样品6个平行反应),通过双重实时荧光PCR检测以测定引物和探针的检出限,相应的CT检测结果如表3所示,擴增曲线见图2,以扩增结果CT≤35次时判定为确认检出。可以看出,Cry1A(c)、CP4-EPSPS基因在混合DNA中的检出限分别为1、0.1 ng,试验使用△CT法进行相对定量,检出限试验结果显示DNA浓度的对数值与其对应的CT值呈线性关系,然后以模板DNA浓度的对数值为横轴、CT值为纵轴得到回归方程,结果见图3。既得2种基因的标准曲线方程如下:Cry1A(c),y=-3.682x+53.86,r2=0983 6;CP4-EPSPS,y=-2.616x+47.69,r2=0.987 2。由于双重扩增2个基因的r2显示标准曲线呈明显线性相关,说明该方法可适用于转基因作物中Cry1A(c)和CP4-EPSPS这2种基因的双重检测。
2.3 模拟掺假检测
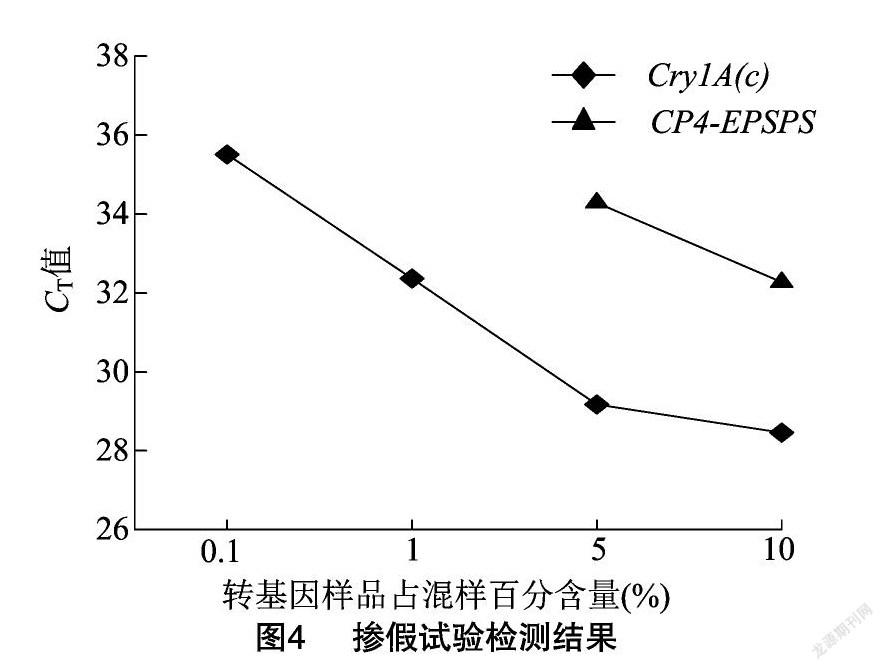
试验将同浓度转基因作物DNA与非转基因作物DNA按一定比例混合来模拟掺假检测,掺假组合为转基因棉花+非转基因棉花(组合1)、转基因大豆+非转基因大豆(组合2),按比例混合使混DNA中转基因成分含量为0.1%、1%、5%、10%,利用双重实时荧光PCR技术进行检测,检测结果见表4。以扩增结果CT≤35次时判定为确认检出,由此可知,组合1中针对Cry1A(c)基因的检测在掺假试验中能够检测到1%的转基因棉花成分,针对CP4-EPSPS基因的检测因组合1样品中不含有该转基因成分,因此未检测到(图4)。综上所述,本试验建立的双重实时荧光PCR方法适用于对掺假样品中的转基因成分检测。同理,组合2中针对CP4-EPSPS基因的检测在试验中能够检测到5%的转基因大豆成分,相较组合1,其检测结果较差。
3 结论与讨论
本试验在特异性检测过程中以水作为空白对照,并且增加了提取空白的特异性检测,进一步加强了试验检测的完整性,在对试验材料的检测中,仅在阳性质粒及转基因作物检出转基因成分,其他普通非转基因样品中并未检出转基因外源基因,说明试验引物和探针具有较好的特异性,能够满足对转基因定性检测。对样品原液梯度稀释进行检出限检测,结果表明,Cry1A(c)、CP4-EPSPS基因在混合DNA中的检出限分别为1、0.1 ng,以CT值为纵轴、模板DNA浓度的对数值为横轴制作标准曲线,线性回归方程r2均大于0.98,说明检测结果能够较好地对外源转基因进行定量分析。模拟掺假在一定程度能够对检测方法或技术的适用性进行评估和检验,本试验显示,双重实时荧光PCR法对转基因成分的检测分别为1%[Cry1A(c)]和5%(CP4-EPSPS),一定程度上能满足实际检测需求。
2017年的国际农业生物技术应用服务组织(ISAAA)数据显示,1996—2016年20年间转基因共使农作物增产6.576亿t[22],全球转基因种植面积的逐年增加使得转基因产品在市场上的份额也越来越大,这都给转基因检测带来了巨大的挑战。同时,由于基因元件的复杂性和转基因作物的多样性加大了转基因检测的难度和需求。2009年,吴珊等对大豆产品外源基因做了普通PCR、荧光定量PCR及微流控芯片等3种方法的灵敏度检测比较,结果显示,普通PCR对于个别基因存在无法检测到或凝胶条带较弱的情况,根据普通PCR和凝胶检测结果容易造成假阴性。荧光PCR和微流体芯片技术检测则不存在此类问题,且检测结果更好,灵敏度和检测效率也更高[23]。王颖等也对普通PCR和荧光PCR检测转基因成分进行了比较[24],得出了相同的结论。尹全等利用多重PCR对进口转基因玉米进行筛查检测,通过构建的基因元件信息矩阵表得出,必须检测2个或2个以上基因才能够对同一物种不同品系的转基因作物达到检测的目的[25]。相比常规PCR技术,多重PCR可以对多个靶基因片段进行检测,不仅打破常规PCR因引物受限只能检测1个目的片段的局限,还大幅提高了检测的效率,能够较好地满足对多个转基因品种的检测需求。本试验双重实时荧光PCR技术对农作物中Cry1A(c)和CP4-EPSPS转基因成分检测方法,相比于多重PCR不仅检测准确性、灵敏度更高且能够根据标准曲线进行相对定量。
参考文献:
[1]顾爱国,王 伟,张晓强,等. 转基因食品检测技术的研究进展[J]. 江苏农业科学,2006,34(3):180-183.
[2]励建荣.转基因食品的优点和安全性[J]. 食品工业科技,2002,23(4):71-73.
[3]趙雨佳,范培蕾,梁 亮,等. 转基因作物的发展与检测分析[J]. 计量技术,2019(10):54-57.
[4]Luthy J. Detection strategies for food authenticity and genetically modified foods[J]. Food Control,1999,10(6):359-361.
[5]樊振江,孟 楠.转基因食品的安全性及优点[J]. 食品安全导刊,2017(3):35-36.
[6]沈 泓,李 超,李 珏.分子生物学技术在转基因食品检测领域中的研究进展[J]. 中国农业信息,2017(15):57-59,61.
[7]国际农业生物技术应用服务组织. 2018年全球生物技术/转基因作物商业化发展态势[J]中国生物工程杂志,2019,39(8):1-6.
[8]张振铎.转基因食品质量安全检测技术的发展研究[J]. 现代食品,2019(24):135-137,148.
[9]宋 欢,王坤立,许文涛,等. 转基因食品安全性评价研究进展[J]. 食品科学,2014,35(15):295-303.
[10]王立平,王 东,龚熠欣,等. 国内外转基因农产品食用安全性研究进展与生产现状[J]. 中国农业科技导报,2018,20(3):94-103.
[11]贾士荣,金芜军.国际转基因作物的安全性争论:几个事件的剖析[J]. 农业生物技术学报,2003,11(1):1-5.
[12]Losey J E,Rayor L S,Carter M E.Transgenic pollen harms monarch larvae[J]. Nature,1999,399(6733):214.
[13]李夏莹,高鸿飞,刘鹏程,等. 转基因作物快速检测技术的研究进展[J]. 江苏农业科学,2018,46(3):5-9.
[14]梁晋刚,徐俊锋,焦 悦,等. 转基因作物快速检测技术进展与展望[J]. 江苏农业科学,2019,47(21):71-74.
[15]罗建兴,海 小,刘国强,等. 利用实时荧光定量PCR法检测食品中鹌鹑源性成分[J]. 食品研究与开发,2019,40(3):177-183.
[16]杨镇州,刘 刚,梁 文. 转基因大豆MON89788芯片式数字PCR定量方法的建立[J]. 生物技术通报,2020,36(5):68-73.
[17]李永进,熊 涛,吴华伟,等. 利用可视化膜芯片检测9种转基因玉米[J]. 湖北农业科学,2016,55(11):2926-2929.
[18]刘国强,海 小,罗建兴,等. 基于TaqMan实时荧光PCR检测植物中转基因成分[J]. 农业与技术,2020,40(10):4-9.
[19]吴洪福,郭淑元,李海涛,等. 苏云金芽孢杆菌杀虫晶体蛋白结构和功能研究进展[J]. 东北农业大学学报,2009,40(2):118-122.
[20]郭文芳,王 楠,李刚强,等. CP4-EPSPS转基因棉花植株鉴定方法比较分析[J]. 生物技术通报,2017,33(4):114-118.
[21]转基因产品检测 实时荧光定量聚合酶链式反应(PCR)检测方法:GB/T 19495.4—2018[S].
[22]James C. Global status of commercialized Biotech/GM crops in 2017[J]. ISAAA Briefs,2017(35):53.
[23]吴 姗,吴志毅,张晓峰,等. 普通PCR法、荧光定量PCR法及微流控芯片法检测大豆产品中外源基因灵敏度的比较[J]. 中国食品学报,2009,9(2):176-186.
[24]王 颖,任志莹,陈芳芳.应用普通PCR与实时荧光标记PCR技术检测玉米子粒中转基因成分的比较[J]. 玉米科学,2016,24(5):43-48.
[25]尹 全,李 忆,宋 君,等. 多重PCR筛查检测进口转基因玉米[J]. 核农学报,2016,30(6):1045-1053.

