艾滋病合并真菌感染患者使用伏立康唑的治疗药物监测及影响因素分析Δ
张晓颖,叶珍洁,俞晓玲,吴灵洁,郑 玲
(福建医科大学孟超肝胆医院Ⅰ期临床试验研究室,福州 350002)
艾滋病患者因机体免疫功能缺陷,极易并发各种机会性感染,其中真菌感染是AIDS患者常见的死亡原因[1]。伏立康唑作为第2代三唑类广谱抗真菌药,在侵袭性真菌感染的预防与治疗方面效果显著,是治疗侵袭性曲霉菌感染的一线用药[2]。伏立康唑在体内主要经肝药酶CYP2C19代谢,基于CYP2C19基因遗传多态性、药物相互作用及特殊的病理生理因素等,伏立康唑体内药动学呈非线性特征,导致其血药浓度存在很大的个体内和个体间差异[3-4]。因此,相关指南和文献均明确指出需对临床上使用伏立康唑的患者开展治疗药物监测[5-7]。维持伏立康唑谷浓度在有效浓度范围内,对提高抗真菌治疗效果、降低死亡率具有重要的临床意义[8]。艾滋病合并真菌感染患者需同时进行抗反转录病毒治疗和抗真菌治疗,伏立康唑易与抗反转录病毒治疗药物(尤其是依非韦伦和蛋白酶抑制剂)发生药物相互作用[9]。因此,在临床治疗时应密切监测该类患者的伏立康唑和抗病毒药的血药浓度。但目前尚无文献报道艾滋病合并真菌感染患者使用伏立康唑的治疗药物监测数据。鉴于此,本研究通过超高效液相色谱串联质谱法监测我院艾滋病合并真菌感染患者的伏立康唑稳态血药谷浓度,对影响伏立康唑谷浓度的相关因素及不良事件进行分析,旨在提高伏立康唑临床使用的有效性与安全性,为伏立康唑的个体化治疗提供参考依据。
1 资料与方法
1.1 资料来源
资料来源于2019年7月至2021年4月我院收治的使用伏立康唑的艾滋病合并真菌感染患者,收集患者性别、年龄、体重、白蛋白(ALB)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TBIL)、直接胆红素(DBIL)、碱性磷酸酶(ALP)、γ-谷氨酰转肽酶(γ-GT)、血清肌酐(CREA)、肌酐清除率(CCR)、联合用药及不良事件发生情况等临床资料。纳入标准:年龄≥18岁;根据《艾滋病合并侵袭性真菌病诊治专家共识》(2019年版)确诊为艾滋病合并真菌感染;参照伏立康唑的药品说明书制定给药剂量;稳态谷浓度采样点:连续使用伏立康唑≥5 d(无负荷剂量)或≥3 d(给予负荷剂量),再次给药前0.5 h内采样。排除标准:年龄<18岁者;妊娠期妇女;临床资料不完整者;采样点非稳态谷浓度点。本研究得到我院伦理委员会批准(伦理号:科审2020_083_01)。
1.2 伏立康唑的治疗药物监测
1.2.1 临床样本采集:患者规律使用伏立康唑治疗≥5 d(无负荷剂量)或≥3 d(给予负荷剂量)后,于下一剂给药前0.5 h内采集静脉血1~2 mL于EDTA-K2真空采血管中。
1.2.2 伏立康唑血药浓度测定:我院已建立快速、准确、灵敏的人血浆中伏立康唑药物浓度的检测方法,色谱柱为Shim-pack XR-ODS Ⅲ(2.0 mm×50 mm,1.6 μm),流动相为乙腈和纯水,定量范围为0.125~16 μg/mL,符合临床需求。
1.2.3 伏立康唑有效浓度范围及剂量调整:参照我国《伏立康唑个体化用药指南》[10]标准,推荐伏立康唑稳态谷浓度范围为0.5~5.0 μg/mL。当首次测定的伏立康唑稳态谷浓度<0.5 μg/mL时,建议伏立康唑维持剂量加量50%;若伏立康唑稳态谷浓度为在5.0~10.0 μg/mL范围内,建议伏立康唑维持剂量减量20%;若伏立康唑稳态谷浓度>10.0 μg/mL,则建议伏立康唑停止给药1次,之后维持剂量减量50%,见表1。

表1 伏立康唑剂量调整方案
1.3 统计学方法

2 结果
2.1 临床资料
本研究共纳入艾滋病合并真菌感染患者112例,共测定152次伏立康唑稳态谷浓度。其中,男性患者95例(占84.8%),女性患者17例(占15.2%);年龄为21~77岁,中位年龄为47岁(33~55岁);体重为34~76 kg,中位体重为54 kg(50~60 kg)。
2.2 伏立康唑稳态谷浓度分布特征
112例患者初次测定的伏立康唑中位谷浓度为3.4 μg/mL(1.8~5.8 μg/mL);其中,伏立康唑谷浓度未达到有效剂量(<0.5 μg/mL)的患者有9例(占8.0%),超过有效剂量(>5.0 μg/mL)的患者有34例(30.4%);对40例伏立康唑谷浓度未在治疗窗内的患者(另外3例患者停药)调整用药剂量并进行二次测定,结果显示,剂量调整后有35例患者的伏立康唑谷浓度达到治疗窗,仍有5例患者的稳态谷浓度未在治疗窗内,见表2。
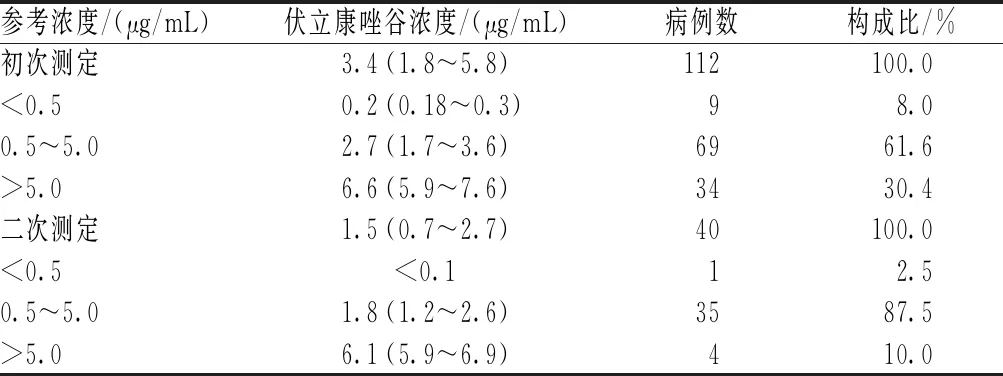
表2 伏立康唑稳态谷浓度分布
2.3 伏立康唑稳态谷浓度影响因素分析
对112例艾滋病合并真菌感染患者的年龄、性别、体重、肝功能各项指标(ALB、ALT、AST、TBIL、DBIL、ALP和γ-GT)、CCR及联合用药进行单因素分析,结果显示,三组伏立康唑谷浓度(<0.5、0.5~5.0和>5.0 μg/mL)患者的AST、AST/ALT及ALB水平比较,差异有统计学意义(P<0.05),见表3。由于糖皮质激素(甲泼尼龙、地塞米松)为肝药酶诱导剂,而奥美拉唑、艾司奥美拉唑等质子泵抑制剂(PPI)为肝药酶抑制剂,二者同时联合应用可能抵消彼此对伏立康唑谷浓度的影响。因此,在分析糖皮质激素或PPI对伏立康唑谷浓度的影响时,排除同时使用上述2类药物的患者17例,对单纯合用糖皮质激素或PPI的患者进行联合用药分析,结果显示,联合应用PPI(奥美拉唑、艾司奥美拉唑)与未联合应用PPI患者的伏立康唑谷浓度比较,差异有统计学意义(P<0.05),见表4。将单因素分析中差异有统计学意义的资料进行多因素线性回归分析,结果显示,ALT/AST、ALB是影响伏立康唑谷浓度的独立危险因素;AST/ALT水平与伏立康唑谷浓度呈正相关(R2=0.039,P<0.05);ALB水平与伏立康唑谷浓度呈负相关(R2=0.115,P<0.05),见表5。上述危险因素与伏立康唑谷浓度的线性回归方程为:Y=7.730+0.45×AST/ALT-0.147×ALB;其中,Y为伏立康唑稳态谷浓度,线性回归方程具有统计学意义(P<0.01)。当危险因素变化时,可通过该方程估算伏立康唑谷浓度,为临床用药提供参考。
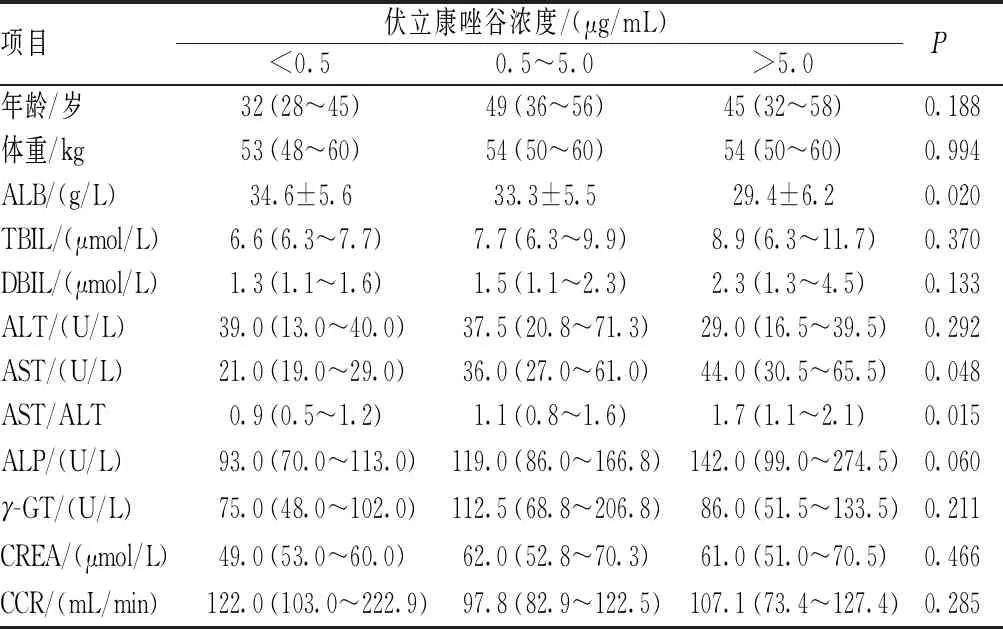
表3 临床指标对伏立康唑谷浓度的影响
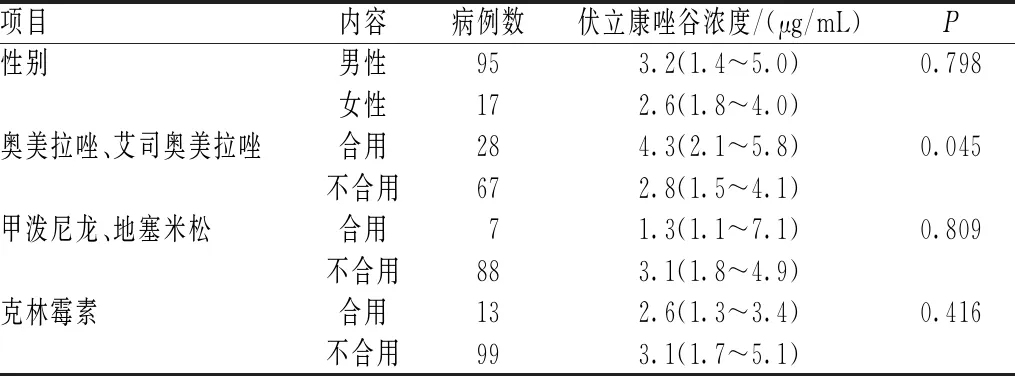
表4 性别和联合用药对伏立康唑谷浓度的影响

表5 伏立康唑谷浓度的多因素线性回归分析
2.4 伏立康唑的不良事件发生情况
112例使用伏立康唑的患者中,共7例患者(占6.2%)发生不良事件,包括明显幻觉3例,妄语2例,睡眠障碍1例,视觉障碍1例。7例发生不良事件的患者中,4例患者(占57.1%)的伏立康唑谷浓度>5.0 μg/mL。发生不良事件患者的伏立康唑中位谷浓度为6.6 μg/mL(3.9~6.8 μg/mL),未发生不良事件患者的伏立康唑中位谷浓度为3.2 μg/mL(1.7~5.6 μg/mL),两者的差异有统计学意义(P=0.027<0.05),见图1。
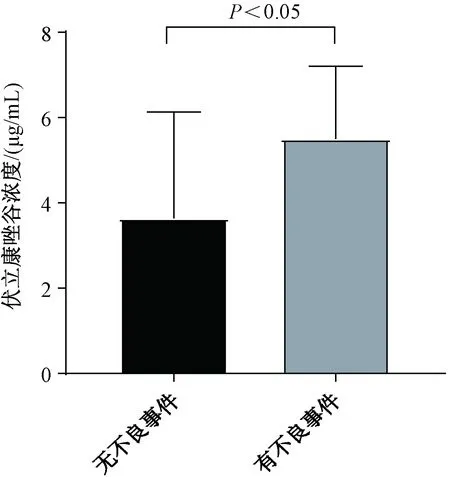
图1 伏立康唑谷浓度与不良事件的相关性
3 讨论
3.1 伏立康唑稳态谷浓度范围
本研究结果显示,伏立康唑谷浓度初次测定中,有30.4%的患者伏立康唑谷浓度高于治疗窗(0.5~5.0 μg/mL),最高达13 μg/mL,而最低甚至低于仪器检测的定量下限,证实了伏立康唑谷浓度存在高度变异性,与Yousefian等[11]的研究结果基本一致。根据检测结果调整伏立康唑剂量后,伏立康唑谷浓度在治疗窗内的患者所占比例从61.6%(69/112)提高至87.5%(35/40)。因此,有必要在临床治疗中对艾滋病合并真菌感染患者加强伏立康唑治疗药物监测,以提高临床疗效。
3.2 肝功能对伏立康唑稳态谷浓度的影响
AST和ALT是反应肝功能的指标。有文献报道,患者AST水平显著影响伏立康唑谷浓度,二者呈正相关(P=0.004)[12-13]。这与本研究结果一致,本研究中,伏立康唑谷浓度>0.5 μg/mL患者的AST水平明显高于正常值(15~40 U/L),伏立康唑谷浓度超过治疗窗与未达治疗窗患者AST水平的差异有统计学意义(P<0.05),且AST/ALT与伏立康唑谷浓度呈正相关(P=0.041)。艾滋病合并真菌感染患者通常因病情较重,病理生理情况复杂,联合用药较多(尤其是长期使用抗病毒药),易出现肝功能指标(AST、ALT)异常或肝功能不全,导致肝药酶含量、活性降低,肝脏代谢能力不足,影响药物在体内的清除[14-15]。因此,建议对AST或AST/ALT水平较高的艾滋病合并真菌感染患者进行伏立康唑治疗药物监测,以避免肝功能进一步恶化。
3.3 ALB水平对伏立康唑稳态谷浓度的影响
本研究中发现,ALB水平与伏立康唑谷浓度呈负相关(P<0.05),当ALB水平降低,伏立康唑谷浓度明显升高。其机制可能与伏立康唑具有非线性药动学特性有关,在特殊病理生理条件下,当艾滋病患者肝脏代谢达到饱和后,低蛋白血症引起的游离型伏立康唑浓度升高无法立即被肝脏代谢和消除,导致药物在体内蓄积,引发不良事件[16-17]。因此,建议对ALB水平较低的艾滋病合并真菌感染患者同时监测伏立康唑总浓度和游离浓度,并根据治疗药物监测结果制定个体化给药方案。
3.4 联合用药对伏立康唑稳态谷浓度的影响
艾滋病患者因出现恶心、呕吐等胃肠道症状,常联合应用奥美拉唑或艾司奥美拉唑等PPI,以减少胃肠道不适。PPI和伏立康唑在体内均经过肝药酶CYP2C19代谢,二者合用时,PPI不仅竞争代谢酶CYP2C19,还抑制CYP450酶的代谢活性,使伏立康唑体内消除减慢、血药浓度升高[18-19]。本研究结果显示,合用PPI患者的伏立康唑中位谷浓度明显偏高,与未合用PPI患者的伏立康唑中位谷浓度比较,差异有统计学意义(P<0.05)。因此,对于艾滋病合并真菌感染患者,在联合应用PPI期间应积极监测伏立康唑稳态谷浓度。由于我院患者在使用伏立康唑治疗期间规避了联合应用依非韦伦、利托那韦和利福平等禁忌用药,故本研究未对上述药物进行联合用药分析。
3.5 不良事件与伏立康唑稳态谷浓度的关系
多项研究结果表明,伏立康唑的谷浓度与临床疗效,神经毒性、视觉障碍和肝毒性等不良事件的发生密切相关[20-22]。发生不良事件患者的伏立康唑谷浓度明显高于未发生不良事件的患者,尤其是伏立康唑谷浓度>5.0 μg/mL与神经系统不良事件之间存在显著相关性[23-24]。本研究结果显示,发生不良事件与未发生不良事件患者的伏立康唑谷浓度比较,差异具有统计学意义(P<0.05),与既往研究结果一致。7例不良事件中,有6例属于神经系统不良事件,可能与伏立康唑容易透过血脑屏障,在脑脊液和脑组织中的浓度较高有关[25-26]。因此,临床使用伏立康唑抗真菌治疗时,应动态监测血药谷浓度,适时调整剂量,保障患者用药安全。
综上所述,艾滋病合并真菌感染患者使用伏立康唑期间,应考虑肝功能(AST、AST/ALT)、ALB水平以及联合应用PPI对伏立康唑稳态谷浓度的影响;在进行伏立康唑治疗药物监测的同时,也有必要密切监测其他伏立康唑相关的视觉、精神异常等不良事件,以保证伏立康唑临床使用的有效性和安全性。考虑到CYP2C19基因多态性决定了其酶活性存在显著的个体间差异,导致伏立康唑在体内的代谢和血药浓度存在差异,而本研究中大部分患者并未测定肝药酶CYP2C19基因型,因此,未来仍需进一步研究CYP2C19基因多态性对艾滋病合并真菌感染患者伏立康唑血药浓度的影响。

