降糖肽的制备、生物学效应及其构效关系研究进展
张廷新,李富强,张 楠,朱丽萍,颜世敢
(齐鲁工业大学(山东省科学院)生物工程学院,山东省微生物工程重点实验室,山东济南 250353)
糖尿病是因胰岛素分泌不足引起的以高血糖为特征的慢性代谢病[1]。持续性高血糖会引发多种并发症,如糖尿病性肾病、糖尿病性眼病、糖尿病性心血管病、糖尿病性脑血管病、糖尿病性神经系统病变和糖尿病足等,严重者危及生命。随着肥胖人群增加,糖尿病的发病率逐年上升。2019 年全球糖尿病患者达4.63 亿。预计到2030 年全球糖尿病患将达5.78 亿。糖尿病已造成严重的社会和经济负担[2]。
糖尿病患者需长期服用降糖药物。目前市场上的降糖药包括胰岛素类注射制剂和口服降糖药物。口服降糖药物以化学药为主,该类药物主要通过增加胰岛素敏感性、延缓碳水化合物在小肠的代谢来修复改善胰岛β细胞功能及促进其分泌胰岛素,但多数具有一定的副作用(表1)[3]。因此,研发安全、有效的降糖药物成为热点。

表1 常用降糖药物的类型及其作用机制和副作用Table 1 Types of commonly used hypoglycemic drugs and their mechanisms of action and side effects
降糖肽具有活性好、结构简单、稳定性高、吸收好、免疫原性低、副作用少等优点。降糖肽分为内源性降糖肽和外源性降糖肽两类。内源性降糖肽存在于细胞内,主要通过促进糖原、脂肪、蛋白质合成,促进胰岛素分泌和抑制胰高血糖素分泌等途径来降低血糖,如胰岛素、GLP-1、GIP 等;外源性降糖肽主要来自于豆类、海藻、坚果等外部食物蛋白质。外源性降糖肽一般含有2~15 个氨基酸残基,常以无活性的前体形式存在于蛋白中,需要通过酶解、模拟胃肠消化、微生物发酵等方法将多肽从前体蛋白中释放出来。制备降糖肽的常用方法包括酶水解、微生物发酵和化学合成等。目前多数研究,是从天然蛋白中分离、鉴定多肽,然后对多肽进行化学合成,得到纯度更高的肽组分,以便进行后续的表征。用于酶水解的常见酶包括酸性蛋白酶、碱性蛋白酶、胃蛋白酶和胰蛋白酶等。微生物发酵作为降糖肽的一种制备方法,枯草芽孢杆菌、米曲霉和植物乳杆菌是常用的微生物。水解处理后进行肽的分离、结构鉴定和表征。常用的分离技术包括超滤、凝胶过滤、反相高效液相色(RP-HPLC)等。对于降糖肽的活性表征,通常使用IC50或抑制率来衡量其降糖活性。
降糖肽的活性主要取决于其氨基酸序列。降糖肽通常含有疏水性氨基酸(如亮氨酸、脯氨酸)及碱性氨基酸(如精氨酸)等。本文结合降血糖活性评价方法综述了近年来降糖肽的制备纯化、结构鉴定及降血糖活性的体外和体内证据,探讨了降糖肽结构与其降血糖活性之间的关系,以期为抗糖尿病相关功能性食品、保健品及药物的开发应用提供参考。
1 降糖肽的制备
酶解是将降糖肽从前体蛋白中释放出来的常用方法。目前已通过酶解动植物蛋白制备多种降糖肽,其中从豆类中鉴定的降糖肽最多。
酶解法制备降糖肽时,需首先提取蛋白质。蛋白质的种类繁多,性质差别大,提取方法不同。食品工业中广泛采用pH-Shift 法分离蛋白质[4]。Chen 等[5]使用pH-Shift 法从田纳西大豆中提取大豆蛋白。Hatanaka 等[6]在使用Umamizyme G 和Bioprase SP 酶解脱脂米糠前,采用pH-Shift 法提取米糠蛋白。
紧密的细胞结构会阻碍酶与蛋白的结合,导致酶的敏感性降低。蛋白能与细胞中的某些成分(如脂类)结合,从而阻碍蛋白质的提取。另外,降糖肽的高度疏水性,使其不易溶于水,不利于后续的分离纯化。采用微波[7]、超声[8]等辅助技术能克服这些问题。Wen 等[8]发现,超声处理能增强慈菇蛋白对胃蛋白酶、胰蛋白酶和碱性蛋白酶的敏感度。超声处理还能改变蛋白质的二级结构,影响其生物活性。Rivero-Pino 等[9]在酶解黄粉虫制备降糖肽时发现,超声处理降低了蛋白中α螺旋和β折叠的含量,增强了蛋白对α-葡萄糖苷酶的抑制活性。原因可能是超声处理促进蛋白质暴露其疏水性氨基酸残基。
另外,在酶解过程中蛋白酶的选择也极为重要。不同蛋白酶具有不同的限制性切割位点,通过切割不同部位的肽键可以产生不同氨基酸组成的活性肽。常用的酶包括碱性蛋白酶、酸性蛋白酶、胃蛋白酶、胰蛋白酶、中性蛋白酶、菠萝蛋白酶、风味蛋白酶等。有时采用多种蛋白酶联合使用的方法,例如按照胃蛋白酶-胰蛋白酶的顺序来模拟胃肠道消化制备降糖肽。选用不同蛋白酶制备的降糖肽其降糖活性存在较大差异。Hatanaka 等[6]使用Umamizyme G和Bioprase SP 分别酶解米糠蛋白制备的二肽基肽酶IV(DPP-IV)抑制肽对DPP-IV 的IC50分别为2.3、26.4 mg/mL,二者功效相差11 倍以上。Admassu 等[10]使用胃蛋白酶、胰蛋白酶、碱性蛋白酶、中性蛋白酶水解紫菜蛋白,其中胃蛋白酶水解物对α-淀粉酶的抑制率最高,抑制率为50%,中性蛋白酶水解物的抑制率最低,仅为18.27%。
酶解法制备的降糖肽的生物活性不仅取决于酶的类型,还取决于水解度(DH)[11]。Ren 等[12]使用碱性蛋白酶酶解大麻种子蛋白制备的降糖肽,对α-葡萄糖苷酶的抑制活性在一定范围内随着水解度的增加而增加,在水解度为27.24%±0.88%时,抑制率最大,为58.26%±3.26%;然而当水解度达33.25%±2.05%时,其抑制活性降低。表明过度水解不利于降糖肽的制备。这可能是由于过度水解导致水解产物中具有降糖活性多肽含量的下降。DH 为20%~40%,对DPP-IV有较大的抑制活性[13]。Li-Chan 等[14]在酶解大西洋鲑鱼皮明胶制备DPP-IV 抑制剂时发现,酶底比(E/S)对水解物的抑制活性也有密切关系,同时水解度与酶底比也存在一定的相关性。使用风味蛋白酶酶解鲑鱼皮明胶,在E/S 为6%时对DPP-IV 抑制率最大(45.2%)。而且三种酶(碱性蛋白酶、菠萝蛋白酶、风味蛋白酶)的水解度与E/S 成正相关。
酶的种类、水解度以及酶底比,都直接或间接地通过改变降糖肽的氨基酸序列和结构来影响其生物活性[12,14]。
2 降糖肽的分离纯化与结构鉴定
降糖肽的传统分离方法主要采用盐析和萃取,但这两种方法制备的降糖肽的纯度较低,而且复杂的成分会与多肽相互作用,从而影响多肽的生物活性。因此目前多采用膜过滤法和色谱法进行降糖肽的分离纯化。尽管近些年在色谱技术上取得了进展,但低选择性可能仍然是分离大小或性质相似生物分子的技术难题。因此,在一些研究中采用色谱技术和非色谱方法相结合的方法。例如,Yuan 等[15]从苦瓜水解物中分离纯化降糖肽,先使用截留分子量10 kDa 的滤膜超滤,然后采用Sephadex G-25 过滤和高效液相色谱法分离纯化。还有研究利用等电点和分子量的差异,采用电渗析和超滤相结合的方式分离降糖肽[16]。
从外源性蛋白水解物中分离纯化降糖肽通常是以活性测定为导向,辅以色谱和非色谱分离技术,最后通过质谱或Edaman 降解法对纯化的肽进行鉴定。鉴定出的肽序列,可采用化学合成多肽,验证其降血糖活性。除了确定肽的分子量外,还可使用高效液相色谱串联质谱法来鉴定降糖肽的氨基酸序列[17]。也可利用生物信息学来预测多肽,如利用BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)来比对新肽序列是否存在于前体蛋白的氨基酸序列中,使用 BIOPEP(http://www.uwm.edu.pl/ biochemia)来预测肽序列是否为新肽以及多肽的生物活性,利用PepDraw(https://www.tulane.edu/~biochem/WW/PepDraw/)来预测多肽的理化性质[17]。
另外,在某些肽序列上发现的各种翻译后修饰的氨基酸残基可能会给肽鉴定带来额外挑战。目前,文献中鉴定和报道的降糖肽大都是含有未修饰的氨基酸残基。鉴定由修饰残基组成的降糖肽可能会是未来的研究热点。
3 降糖肽的活性评价
3.1 降糖肽的体外活性评价
降糖肽的体外效应通常是通过测定其对二肽基肽酶(DPP-IV 酶)、α-葡萄糖苷酶、α-淀粉酶等参与血糖调节的酶的抑制效应来评估的。
DPP-IV 是一种丝氨酸蛋白酶,通过特异性切割氨基末端2 个氨基酸残基(Xaa-Pro 和Xaa-Ala)来调节肠促胰岛素的生物活性,从而调节体内的葡萄糖代谢[18]。肠促胰岛素包括GLP-1(胰高血糖素样肽1)和GIP(葡萄糖依赖性促胰岛素多肽,也称胃抑肽),是摄取食物后由肠分泌的肽类激素,其主要作用是调节血糖水平,抑制胰腺分泌胰高血糖素[19]。GIP 能够促进葡萄糖诱导的胰岛素分泌,此外还能增强脂肪组织的餐后脂质代谢[20]。GLP-1 除了可以增强葡萄糖诱导的胰岛素分泌,还可以抑制胰腺胰高血糖素的分泌,延缓胃排空,抑制食欲和食物摄入[21]。因此,在糖尿病的控制中,可选择抑制DPP-IV 的生物活性,提高体内GLP-1 和GIP 的含量,从而达到降血糖的目的。目前,已有文献报道了多种降糖肽在体外均对DPP-IV 有抑制作用(见表2)。Mune 等[22]用碱性蛋白酶和热裂解酶酶解Bambara 豆蛋白的水解物具有相似的DPP-IV 抑制活性(IC50=1.73 mg/mL),并且具有明显的DPPH 自由基清除活性和亚铁螯合活性,对氧化应激具有保护作用。Nongonierma 等[23]从骆驼乳清蛋白水解物中分离出对DPP-IV 具有较强抑制作用的降糖肽VPV、VPI、VPF。其中VPV被认为是目前发现的仅次于IPI 的DPP-IV 抑制肽。

表2 降糖肽的体外生物学效应Table 2 In vitro biological effects of hypoglycemic peptides
α-葡萄糖苷酶是一种糖苷水解酶(EC3.2.1.20),位于肠刷边缘,具有水解低聚糖中存在的α-1,4-糖苷键,然后将其转化为可从肠道吸收进入血液中单糖的功能。通过抑制α-葡萄糖苷酶的作用,可以延缓食物摄取后碳水化合物的消化,从而减少血液中葡萄糖的整体吸收,防止高血糖[24]。Zhang 等[25]利用定量构效关系(QSAR)筛选法和家蚕多肽数据库筛选α-葡萄糖苷酶的抑制肽,得到了4 种对α-葡萄糖苷酶有较强抑制作用的多肽:QPGR、SQSPA、QPT、NSPR,其IC50分别为65.8、20、560、205 mol/L。Ren 等[12]从大麻子蛋白中发现2 个新的α-葡萄糖苷酶抑制肽LR 和PLMLP。多肽中的疏水性氨基酸,特别是脯氨酸和亮氨酸对α-葡萄糖苷酶的抑制活性具有重要贡献。Kang 等[26]从米曲霉发酵物中分离出α-葡萄糖苷酶抑制肽CL 和PFP。
α-淀粉酶(EC3.2.1.1)是一种消化酶,属于糖基水解酶家族,其基本功能是催化糖原、淀粉(α-1,4-糖苷键)等多糖水解成麦芽糖、葡萄糖、麦芽三糖等较低分子量的产物。作为体内消化碳水化合物的主要酶之一,抑制它将促进血糖水平的整体下降[27]。Yu 等[28]从白蛋白中分离出α-淀粉酶抑制肽KLPGF,其IC50为(120±4.0)μmol/L,KLPGF 还具有较强的α-葡萄糖苷酶抑制活性。Siow 等[29]从孜然种子中分离到肽FFRSKLLSDGAAAAKGALLPQYW,具有抑制α-淀粉酶的作用,抑制率为24.54%。通过构效关系研究发现肽的抑制作用可能是由于肽的存在阻碍了碳水化合物底物(如淀粉)与α-淀粉酶的结合,从而抑制了酶的催化作用。
细胞系或细胞模型也常用来进行降糖活性的评估,例如肝癌(HepG2)细胞[30]、肠(Caco-2)细胞[31]、INS-1E(大鼠胰岛素瘤细胞模型)[32]、AR42J(大鼠胰腺外分泌细胞)[33]等来研究葡萄糖摄取、模拟胃肠消化和胰岛素敏感性等。
体外研究通常采用消化酶的生化分析来评价多肽和水解物的降血糖活性,例如,还有少数采用细胞模型来探究降糖肽对不同类型细胞的影响。但这些都不能很好的反映出多肽或水解物在人体内所发挥的生物学效应。因此,未来研究应注重在体外研究的基础上进行体内研究。
3.2 降糖肽的体内活性评价
降糖肽的体内效应研究相对较少,大多数研究还停留在蛋白水解物的体内效应而没有鉴定具体的肽序列(表3)。已报道有来自奶酪的LPQNIPPL 能降低健康大鼠的餐后血糖[39]和从鱼皮明胶中分离的GPVGPAGNPGANGLN 能够增强STZ 糖尿病小鼠的胰岛素分泌[40]。体内研究使得对降糖肽和水解物的生物学效应研究成为可能。但有研究者认为,动物试验结果可能不能直接预测人类对降糖肽的反应[41]。但这些研究提高了我们对降糖肽和蛋白水解物生物学效应的认识。有些效应不容易通过体外研究来探索,例如降糖肽对动物糖耐量[42]和胰腺β细胞的影响[43]等。
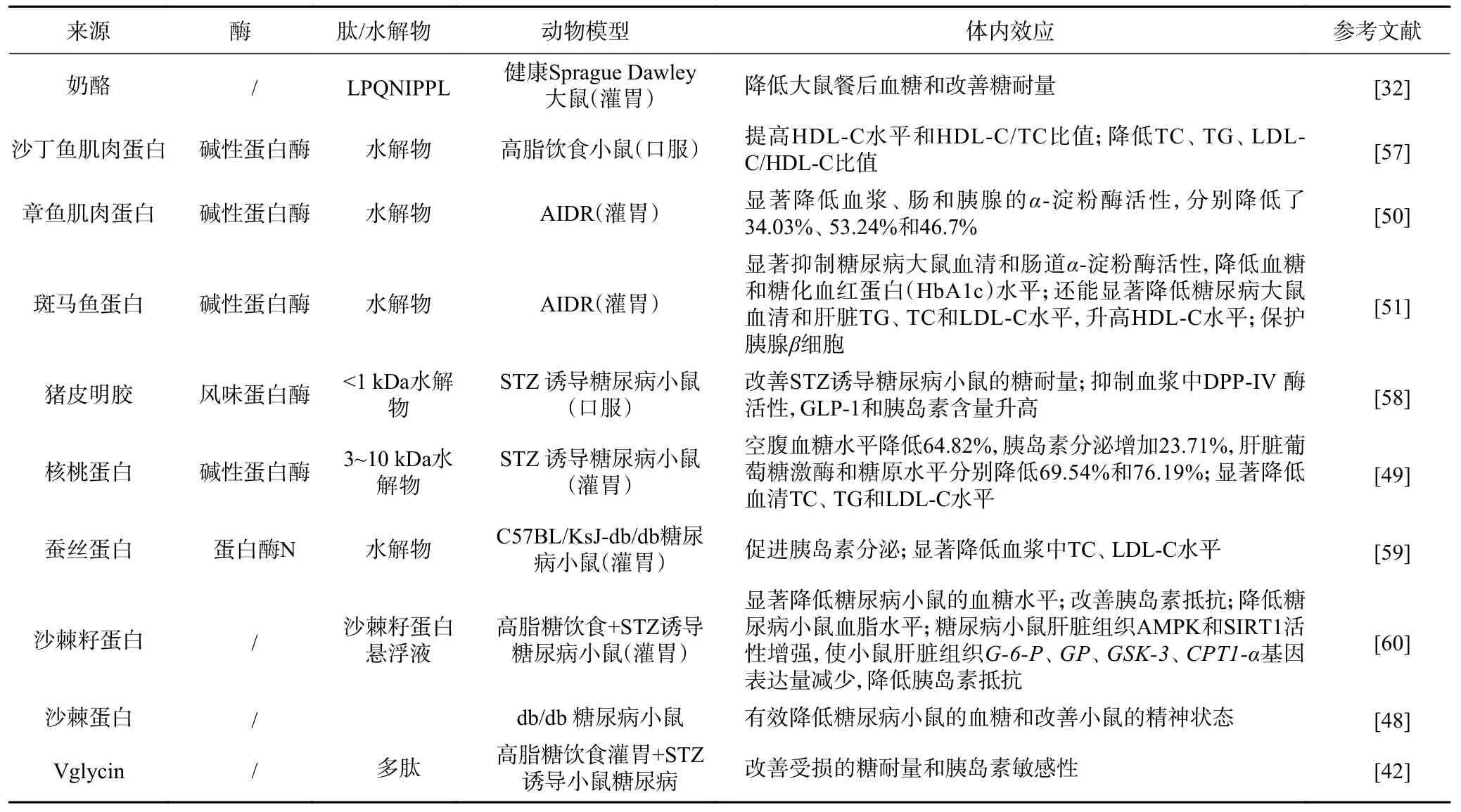
表3 降糖肽或水解物在小鼠模型中的效应Table 3 Effects of hypoglycemic peptides or hydrolysates in rats model
降糖肽的体内效应常在糖尿病小鼠模型上进行研究,例如链脲佐菌素(STZ)诱导的糖尿病模型、四氧嘧啶(ALX)诱导的糖尿病模型和db/db 小鼠(自发性基因突变小鼠)等。诱发性动物模型中高脂高糖饮食联合STZ 诱导的动物模型是目前常用的Ⅱ型糖尿病模型[44]。ALX 诱导的糖尿病模型应用相对较少[45]。关于糖尿病动物的造模方法及其优缺点,可参考裴天仙[46]、唐艺丹[47]等的报道。
刘洪霞等[48]研究发现,用沙棘蛋白灌胃处理db/db 糖尿病小鼠,沙棘蛋白可明显提高糖尿病小鼠的葡萄糖敏感性,减少葡萄糖的吸收,有效降低糖尿病小鼠的血糖。另外,沙棘蛋白还能改善小鼠的精神状态,减轻糖尿病对小鼠的损伤。有些蛋白水解物不但具有降血糖活性,还能改善血脂谱。Wang 等[49]发现,核桃蛋白水解物(3~10 kDa)不仅能够使链脲佐菌素(STZ)诱导的Ⅱ型糖尿病小鼠的空腹血糖降低64.82%,胰岛素分泌增加23.71%,肝脏葡萄糖激酶和糖原水平分别降低69.54%和76.19%,而且还能显著降低血清中总胆固醇(TC)、甘油三酯(TG)和低密度脂蛋白胆固醇(LDL-C)水平。
通过降低四氧嘧啶诱导的糖尿病小鼠(AIDR)的血糖水平,证明章鱼蛋白和其蛋白水解物均具有降血糖作用[50]。章鱼蛋白水解物比章鱼蛋白在降血糖作用上更有效,而且水解物比阿卡波糖降低血浆、肠和胰腺中的α-淀粉酶的活性更高。
通过糖尿病小鼠体内血清、肠道中α-淀粉酶的活性[51]和胰腺细胞中胰岛素的表达水平[43]可以证明斑马鱼蛋白水解物和Vglycin 在体内的降血糖作用。α-淀粉酶活性和胰岛素水平在降低血糖水平上发挥着重要作用。斑马鱼蛋白的氨基酸组成分析结果表明,亮氨酸含量最丰富,其次是精氨酸和谷氨酸。许多研究报道不同游离氨基酸对2 型糖尿病患者胰岛素分泌的影响。亮氨酸是一种促胰岛素分泌剂,通过氧化脱羧和变构激活谷氨酸脱氢酶来诱导和增强胰腺β细胞胰岛素的分泌[52-53]。精氨酸[53]和苯丙氨酸衍生物[54]均具有调节胰岛素分泌的作用。但口服斑马鱼蛋白中亮氨酸和精氨酸的丰度与胰岛素水平之间的关系还有待进一步的研究。
某些蛋白水解物在体内不仅具有降血糖作用,还具有其他活性。例如,Kilari 等[55]证实骆驼奶蛋白水解物在STZ 糖尿病小鼠体内不仅具有显著的降血糖作用,还可明显增强超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性,降低丙二醛(MDA)含量。使用斑马鱼蛋白水解物处理的AIDR 糖尿病小鼠,体内的SOD、GPX、CAT 等酶的活性增强,斑马鱼蛋白水解物还具有调节ACE 酶的作用[56]。高血压是糖尿病的主要并发症,而ACE 酶是体内参与血压水平调节的重要酶。因此,蛋白水解物的多活性作用对糖尿病管理具有重要意义。但这些蛋白水解物是否真的具有多种生物活性,还是这些活性是由不同的肽发挥的,需要深入研究来证实。
4 降糖肽的构效关系
定量构效关系(quantitative structure-activity relationship,QSAR)可以评估某种蛋白是否为降糖肽的潜在来源,还可以预测新肽的潜在降糖活性。分子质量、氨基酸组成和疏水性被认为是影响降糖肽活性的关键结构特征。
降糖肽的降糖作用取决于其结构。降糖肽通常由2~15 个氨基酸残基组成,分子量为228~1656 Da(表4)。降糖肽的降血糖活性受链长影响。降糖肽的氨基酸残基数<7(分子量<700~800 Da)时活性最强,氨基酸残基数为7~25(分子量800~3000 Da)时次之,链长更长的活性最低[61]。Valencia 等[62]发现在易煮菜豆、难煮菜豆水解物中,分子量小于3 kDa的超滤组分对α-淀粉酶和α-葡萄糖苷酶的抑制率最高,其次是分子量为3~10 kDa 的组分,分子量大于10 kDa 的组分抑制率最低。
通常小肽更容易被人体吸收,具有更强的降糖活性[63]。Lacroix 等[64]利用Caco-2 细胞来研究乳蛋白肽的生物利用度,在WR、IPI、IPIQY、LPYPY、LKPTPEGDL 等五个肽中,WR 显示出最高的转运率。而Ding 等[65]研究发现YFCLT 和GLLLPH 均能进入Caco-2 单层细胞。因此,大于3 个氨基酸残基的多肽是否会被小肠吸收并不容易预测。
除分子量外,一些特殊氨基酸在降血糖中也发挥着重要作用。报道的许多食品衍生肽的DPPIV 抑制剂N 端多数含有Xaa-Pro(Xaa 表示氨基酸残基)。Pro 残基对DPP-IV 的抑制作用具有重要贡献[66]。如来自蜡样芽孢杆菌培养物的DPP-IV 抑制肽Diprotin A(Ile-Pro-Ile)and B(Val-Pro-Leu)均具有该结构[67]。Hikida 等[68]发现Trp-Pro 的抑制作用最强。然而,Uenishi 等[39]发现多肽FPGPIPN、VPPFIQPE、YPFPGPIPN 虽然具有Xaa-Pro 结构,但却无明显的DPP-IV 抑制作用。尽管Pro 残基在降血糖方面上具有潜在作用,但显然还存在其他作用机制,使不含Pro 残基的降糖肽在体内外也具有降糖作用。从核桃中分离的多肽LVRL 和 LRYL 可显著提高 IR HepG2 细胞的葡萄糖消耗能力及 GSH-Px和CAT 的活性,且能有效清除细胞内 ROS 含量[30]。肽FEELN、LSVL、LSVSVL 能抑制Caco-2 细胞对葡萄糖的摄取,具有降血糖作用[31]。值得注意的是,LVRL、LRYL、FEELN、LSVL 和LSVSVL 都至少含有一个亮氨酸,亮氨酸和其他疏水氨基酸残基的存在可能有助于多肽与膜脂双层的相互作用,促进其进入细胞,从而提高其降血糖活性。表4 中列出了已经得到验证的降糖肽的疏水性氨基酸残基在其序列中所占的比例。显然,疏水性氨基酸残基的存在并不是多肽降血糖活性的必要条件。

表4 降糖肽的构效关系Table 4 Structure-activity relationship of hypoglycemic peptides
近年来,基于计算机的QSAR 方法已广泛应用于诸多领域,例如,药物设计、材料科学、化学等,但在食品科学中应用较少。在降糖肽的筛选中,利用传统方法需进行大量的实验。与传统方法相比,QSAR 方法利用数学建模、分子对接和模拟、化学计量学等在生物活性肽的筛选中显示出显著优势[69]。Wang 等[70]基于空间电场、静电场、疏水场等构建了三维定量构效关系(3D-QSAR)模型,从60 种多肽中筛选出6 种DPP-IV 抑制肽,分别为VSM、ISW、VSW、ICY、ISD 和ISE。通过体外研究发现均具有明显DPP-IV 酶抑制活性,其中肽ICY 抑制活性最高,IC50为0.73 mmol/L。
在QSAR 建模中还存在一些问题有待解决。例如,QSAR 方法没有考虑到数据的异质性。此外,化学结构的构象柔性仍然是一个有待进一步研究的问题。但是,QSAR 方法对生物活性肽领域的研究人员仍然有很大的帮助。近年来,虽然QSAR 已应用于生物活性肽的食品科学研究中,但如何将QSAR 应用于降糖肽中仍需深入研究。
5 结论与展望
根据体内外研究,降糖肽被认为是一种非常具有前景的抗糖尿病类药物,本文通过对国内外降糖肽的制备、分离纯化、结构表征、生物学评价以及构效关系的综述,揭示了降糖肽的研究空白领域。虽然一些降糖肽的生物学效应已经确定,但还未证明这些肽在食品、保健品、药品生产中的应用。此外,降糖肽的大规模开发与应用应考虑食品和药品的加工条件对降糖肽的降血糖活性和生物利用度的影响,以及这类多肽产品的高生产成本、质量、生物活性、有效性和安全性需要进一步的研究。
另外,胃肠道消化对降糖肽的有效性、稳定性和生物利用度的影响还需通过体内实验进一步确定。未来的研究还应注重降糖肽的肠道吸收机制,以及它们的潜在多功能性。更多的体内研究可以通过口服含有纯肽的复杂食药系统来研究多肽的降血糖活性,而不是口服纯多肽。
虽然降糖肽已经显示出作为药品的潜力,但到目前为止,只有少数商业化的降糖肽产品。除了体内研究和临床试验外,迫切需要研究在食品、药品加工过程中添加到目标基质中的降糖肽的活性和结构稳定性。此外,多肽结构对降糖肽降血糖机制的影响还缺乏深入的研究,如脉冲电场和圆二色谱,可以帮助推断肽的二级结构与其降血糖活性之间的潜在联系。因此,进一步研究降糖肽的构效关系对于降糖肽作用机制具有重要意义,也将拓宽其潜在的应用前景。
综上所述,在过去的十年里,越来越多的研究表明,降糖肽可以在体外、细胞和动物模型中发挥降血糖作用,在食品、保健品和药品等方面具有潜在的应用前景,但要为这些应用奠定基础,未来还需要进行更多深入的研究。

