小鼠IL-1β原核表达及其与在布鲁氏杆菌侵染巨噬细胞中差异表达的初步研究
杨 馨,邹德颖,张 凯,常 江,常恒祯,战俊澎,郭 珣,刘益辛,程梦妍,韩 成,胡 盼,卢士英,李岩松,柳增善,任洪林
(吉林大学人兽共患病研究教育部重点实验室/人兽共患病研究所/动物医学学院,长春 130062)
IL-1β是机体抵御病原微生物入侵,对抗炎症反应和组织损伤、激活和加强免疫应答的强细胞炎性因子,还可在机体内外诱导二级细胞因子(如IL-6、趋化因子)的产生,在宿主防御感染中发挥关键作用[1]。IL-1β释放的信号传导通路分为两步:首先,第一信号由Toll样受体通过与其配体结合将信号传至细胞内,诱导IL-1β前体合成;其次,第二信号外源ATP与P2X7受体结合,激活NLRP3炎性小体,将pro-IL-1β剪切为有生物活性的IL-1β并分泌到细胞外[2]。胞质中IL-1β与白细胞介素-1受体(IL-1R)结合,通过MyD88/IRAK/TRAF6信号转导模式,激活NF-kB信号转导通路,进而导致参与炎症、宿主防御、凋亡抑制和组织修复蛋白质的产生[3]。
布鲁氏杆菌(Brucella)感染引起的人兽共患病,至今仍然在世界范围内流行,特别是在发展中国家[4]。布鲁氏杆菌作为一种兼性胞内寄生菌,通过在宿主细胞内形成含布鲁氏杆菌的布氏小体(BCV),与溶酶体结合,在内质网中形成一个安全的细胞内生态位并进行高效复制,从而避免被宿主免疫系统清除,不产生对细菌生存有害的强烈炎症,最终导致慢性持续性感染,是布鲁氏杆菌病治疗和预防的难点[5]。利用不同毒力布鲁氏杆菌菌株感染绵羊,发现IL-1β和IL-1Ra出现差异性表达,进而推测IL-1β在布鲁氏杆菌胞内寄生感染中发挥一定的作用[6]。因此,为研究IL-1β是否为布鲁氏杆菌在宿主细胞内维持存活提供条件,本试验利用猪种布鲁氏杆菌S2侵染RAW264.7细胞建立感染模型,检测IL-1β在转录和翻译水平上表达量变化,结合胞内细菌计数结果,初步探讨IL-1β与布鲁氏杆菌胞内寄生的关系。
1 材料与方法
1.1 材料
1.1.1 实验动物 3月龄雌性新西兰兔购于辽宁长生生物技术股份有限公司。
1.1.2 菌种与试剂 猪种布鲁氏杆菌弱毒疫苗S2株(Brucellasuis S2)、小鼠巨噬细胞RAW264.7细胞株、大肠杆菌DH5α、BL21(DE3)和表达载体pET-28a(+)由吉林大学人兽共患病研究教育部重点实验室保存。克隆载体pMD18-T、连接酶SolutionⅠ、限制性内切酶XbaⅠ和XhoⅠ购自宝生物工程(大连)有限公司。DNA Marker、质粒小提试剂盒、DNA回收试剂盒均购自天根生化科技(北京)有限公司。2×M5 HiPer plus Taq HiFi PCR mix和2×M5 HiPer Realtime PCR Super mix with Low Rox购自北京聚合酶生物科技有限公司。HRP标记的山羊抗兔IgG均购于Immunoway Biotechnology公司。重组Anti-GAPDH抗体购自Abcam公司。
1.2 方法
1.2.1IL-1β基因扩增 取小鼠肺组织0.2 g迅速磨碎,按照100 mg/mL加入Trizol试剂,提取总RNA;再反转录操作得到cDNA,-80℃保存。根据NCBI发布的小鼠IL-1β基因序列(NM_008361.4),利用Primer 6.0设 计 引 物,上 游 引 物 为F:5′-TGC TCTAGAAATAATTTTGTTTAACTTTAAGAAGGAGA TATAATGGCAACTGTTCCTGAACTCAACT-3′(下 划线部分为XbaⅠ酶切位点),下游引物为R:5′-CCGCTCGAGTTAGGAAGACACGGATTCCATGGTG-3′(下划线部分为XhoI酶切位点),引物由吉林省库美生物科技有限公司合成。PCR扩增产物回收并连接克隆载体pMD18-T,同时将测序鉴定的阳性克隆保种备用。
1.2.2 构建表达载体及目的蛋白的分离纯化 将验证正确的pMD18-T-IL-1β质粒与原核表达载体pET-28a(+)分别用XbaⅠ和XhoⅠ进行酶切,10%的琼脂糖凝胶电泳分离并回收目的片段,用SolutionⅠ于16℃连接过夜;再转化至DH5α感受态细胞中,涂布于含有氨苄青霉素的固体LB平板上,挑取单克隆,培养过夜,经菌液PCR后,选取阳性克隆子测序,测序鉴定正确后命名为pET-28a-IL-1β。
1.2.3 诱导重组蛋白表达及纯化 将重组质粒pET-28a-IL-1β转化BL21(DE3)感受态细胞中,挑取阳性单克隆菌株,接种于含有氨苄青霉素的LB液体培养基,37℃振荡培养至OD600nm为0.5~0.6,1∶1 000的比例加入1 mol/L的IPTG(异丙基-β-D-硫代吡喃半乳糖苷),16℃下140 r/min诱导24 h。收集的菌体在冰浴条件下进行超声破碎至澄清透亮,收集超声后的上清液和沉淀制样进行SDSPAGE分析。再利用His标签镍离子蛋白纯化柱对重组蛋白进行纯化,洗脱杂蛋白,收集目的蛋白并透析浓缩,最后利用BCA蛋白定量检测试剂分析蛋白浓度。
1.2.4 兔源多克隆抗体的制备及效价测定 选择3月龄3 kg的新西兰兔,适应性饲养3 d后,耳缘静脉采集血,收集阴性血清。首免(0 d)按1.0 mg/只将重组蛋白与等体积的弗氏完全佐剂充分混合乳化,进行背部皮下多点注射。每7 d以0.5 mg/只将重组蛋白配伍等体积的弗氏不完全佐剂,加强免疫。42 d时进行心脏采血,收集血清-80℃保存。
将重组蛋白按每孔5μg/mL包被于ELISA板中,4℃过夜后加入5%脱脂乳37℃封闭1 h。PBST洗涤3次,将制备的多克隆抗体血清从1∶1 000倍比稀释至1∶512 000依次加入,免疫前血清作为阴性对照,PBS溶液作为空白对照,孵育1 h。二抗为HRP标记的山羊抗兔IgG按1∶5 000稀释,最后加入100 μL四甲基联苯胺(TMB)反应8 min后加入50μL终止液,利用酶标仪测定OD450nm。
1.2.5 多克隆抗体特异性分析 利用LPS刺激RAW264.7细胞8 h,加入裂解液收集细胞总蛋白,与重组蛋白进行SDS-PAGE和Western blot试验。一抗多克隆血清按1∶1 000稀释,二抗是HRP标记的山羊抗兔IgG按1∶5 000稀释。
1.2.6 布鲁氏杆菌侵染小鼠巨噬细胞RAW264.7模型建立 将对数生长期的RAW264.7细胞以每孔106个铺于6孔板,培养过夜。用猪种布鲁氏杆菌弱毒株S2以MOI=1∶100(细菌∶细胞)对细胞进行侵染,4 h后弃去培养基,利用PBS洗涤细胞3次并加入含有1%双抗的基础培养基作用1 h后,此时计为0 h。收集0、4、8、12、24 h细胞,用含0.5%TrizonX-100裂解细胞,梯度稀释,涂板,每组试验重复3次,计算不同时间段的CFU。
1.2.7 荧光定量PCR检测 在布鲁氏杆菌侵染RAW264.7细胞过程中,分别在0、4、8、12、24 h弃去培养基,加入1 mL Trizol试剂提取细胞总RNA,再反转录得到cDNA。利用Premier 6.0设计IL-1β和MyD88定量引物(表1),β-action作为内参基因,通过实时荧光定量PCR检测各基因的mRNA表达水平。PCR反应体系:2×M5 HiPer Realtime PCR Super 10μL、cDNA 1μL、引物各0.5μL、ddH2O 8μL。利用2-△△Ct方法计算目的基因在不同时间段的相对表达量。
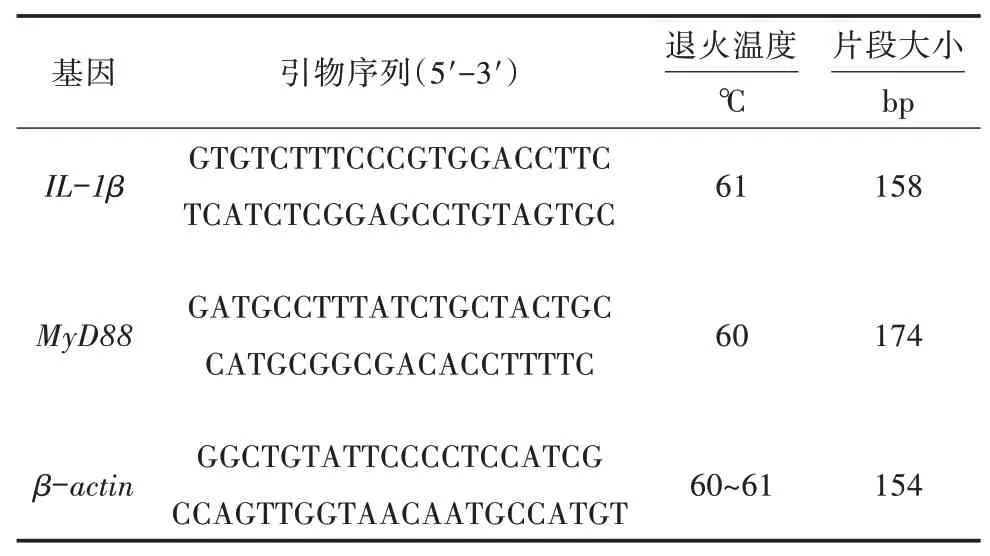
表1 荧光定量PCR引物
1.2.8 Western blot检测 在侵染0、4、8、12和24 h后,弃去细胞培养基,每孔加入200μL裂解液,冰上裂解30 min,于4℃下1 200 r/min离心15 min,取上清液,用BCA蛋白试剂盒检测浓度。取等量的蛋白进行SDS-PAGE电泳并转移至PVDF膜,进行Western blot检测,以GAPDH为参照蛋白,并用Image J软件统计灰度值计算蛋白质相对表达量。
2 结果与分析
2.1 重组载体p ET-28a-IL-1β的构建
10%琼脂糖凝胶电泳结果显示,在810 bp处出现扩增条带(图1)。将测序正确的重组质粒pET-28a-IL-1β,进行XbaⅠ和XhoⅠ酶切鉴定,在810 bp处得到目的条带(图2),表明重组质粒构建成功。

图1 IL-1βPCR扩增结果

图2 重组质粒p ET-28a-IL-1β酶切鉴定
2.2 重组蛋白IL-1β表达纯化
将菌液超声破碎后,离心收集上清液和沉淀并进行SDS-PAGE电泳。结果表明,上清液和沉淀均能观察到大小约31 ku的目的条带,与预期大小相符,且重组蛋白主要在上清液中表达。通过镍柱对重组蛋白进行纯化,纯化后的蛋白进行SDS-PAGE鉴定,在约31 ku处可见目的蛋白条带(图3)。

图3 重组IL-1β的SDS-PAGE分析
2.3 兔源多克隆抗体血清效价和特异性检测
利用纯化的重组蛋白免疫小鼠5次后,采用ELISA方法检测血清中多克隆抗体效价。以未免疫前兔血清为阴性对照,当稀释至1∶25 600时,OD450nm为0.678,大于阴性对照的2.1倍,表明制备的多克隆抗体效价较高。
以收集的LPS刺激RAW264.7细胞的蛋白作为天然蛋白,与重组蛋白分别作为抗原,制备的多抗血清为一抗(1∶1 000稀释)进行Western blot检测。结果表明,两组在31 ku处均出现明显的特异性条带(图4)。

图4 重组蛋白的多克隆抗体Western blot鉴定
2.4 布鲁氏杆菌侵染RAW264.7细胞IL-1β和MyD88 mRNA转录差异分析
将生长状态良好的RAW264.7细胞利用猪种布鲁氏杆菌S2进行侵染,通过荧光定量PCR检测IL-1β和MyD88的相对表达量。与正常组相比,S2组的IL-1β、MyD88均呈上调表达,IL-1βmRNA随着侵染时间延长,先降低,至24 h快速升高;MyD88mRNA随着侵染时间延长,先降低,至24 h再升高(图5)。

图5 IL-1β和MyD88在不同时间的mRNA表达量
2.5 布鲁氏杆菌侵染RAW264.7细胞IL-1β蛋白表达差异分析
Western blot分析发现,在感染0至4 h IL-1β表达量无明显变化,8~12 h IL-1β表达量显著上升(图6),提示布鲁氏杆菌作为胞内寄生菌,可能通过削弱侵染前期IL-1β上调表达为其在胞内寄生创造适宜的环境,待布鲁氏杆菌在细胞稳定存在后,仍会刺激IL-1β上调表达。
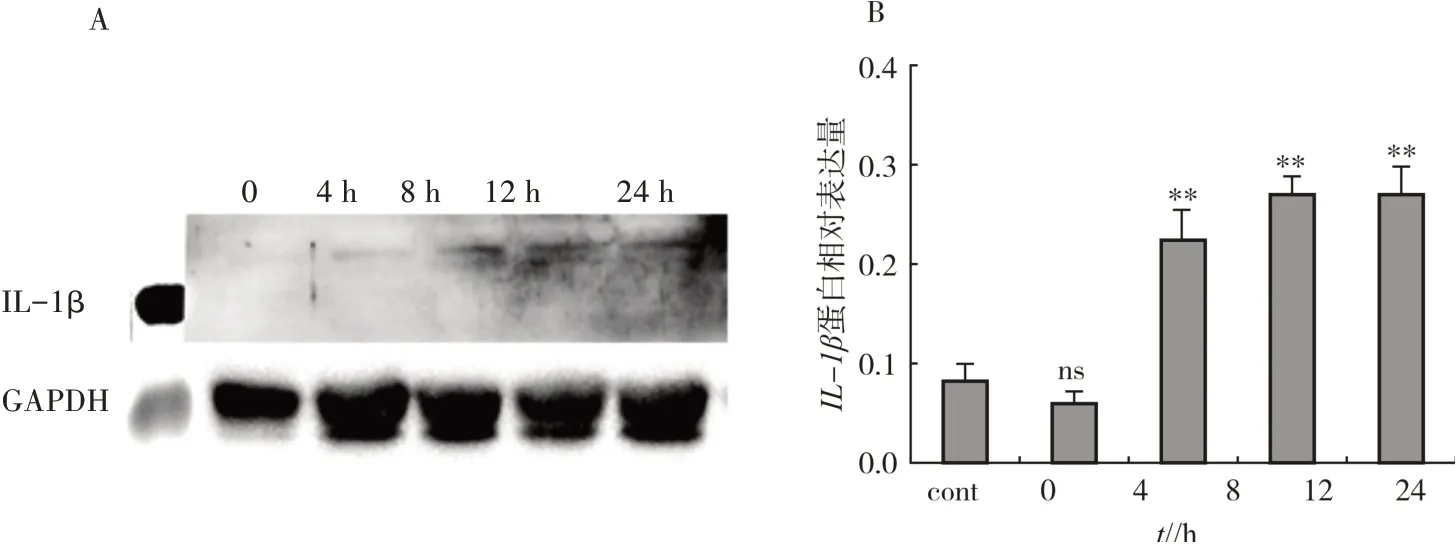
图6 Western blot检测IL-1β蛋白表达量
2.6 布鲁氏杆菌胞内CFU计数
猪种布鲁氏杆菌S2株侵染巨噬细胞RAW264.7后,其细胞内细菌数变化如图7所示。布鲁氏杆菌在胞内的存活能力持续下降,数量呈下调趋势,但变化强度与感染时间有关。侵染0~4 h时,巨噬细胞发挥强劲的杀伤力,绝大部分布鲁氏杆菌死亡,胞内细菌快速减少。待侵染8~12 h后,内体布氏小体(eBCVs)逐渐向有利于布鲁氏杆菌在宿主细胞内复制布氏小体(rBCVs)转换[7],同时IL-1β蛋白表达量仍在增加,炎症反应持续,因此胞内布鲁氏杆菌数量减少的趋势变缓。侵染到达12~24 h,细胞内MyD88和IL-1β明显上调,炎症反应加剧,细胞对布鲁氏杆菌的清除力度加大,胞内细菌数再次快速下降。

图7 布鲁氏杆菌S2株在RAW264.7细胞内的增殖
3 小结与讨论
截至2021年5月,中国共报告布病26 919例,且病例数呈现波动上升趋势[8]。人类感染布病主要是通过直接接触感染动物及含菌的分泌物,或摄入感染动物制品,如未经消毒的牛奶、未煮熟的牛羊肉等。布鲁氏杆菌感染会引起人出现以发热、疲劳、虚弱和体重减轻为特征的炎症性疾病;雌性动物流产或产死胎、弱胎;雄性动物睾丸炎或附睾炎,丧失种用价值[9]。目前,动物布病的主要预防手段是接种疫苗,但无法准确区别布病感染与免疫,造成大量免疫动物因血清阳性反应而怀疑感染,对全球的畜牧业经济造成巨大损失,影响社会公共卫生安全[10]。因此,探讨影响布鲁氏杆菌在宿主细胞内寄生的因素,对进一步防控和治疗布病起到重要的作用。
IL-1β是一种强促炎细胞因子,可由多种细胞合成与分泌,具有广泛的生物学作用,不仅能够刺激参与免疫反应的细胞增殖、分化并提高其功能,还能促进其他炎症因子的释放,维持和放大炎症反应[11]。研究表明,布鲁氏杆菌感染RAW 264.7能诱导IL-1β的显著表达[12,13]。IL-1β是布鲁氏杆菌急性感染期敏感指标[14]。因此,本研究选取小鼠IL-1β的CDS区进行原核表达,利用pET-28a构建表达载体,16℃下利用IPTG诱导培养24 h后,可在上清液中诱导出大量重组蛋白。经镍柱纯化后,可得到无杂带且纯度较高的重组蛋白。通过免疫新西兰兔制备的多克隆抗体制能与重组蛋白IL-1β以及小鼠天然IL-1β结合,特异性好,可用于后续试验。
MyD88作为胞内重要的信号转导分子,通过募集IL-1R相关蛋白激酶(IRAK)等具有死亡结构域的信号分子,参与IL-1R和TLR诱导NF-kB途径[15]。研究表明,MyD88的破坏和结构改变会降低对IL-1β应答,缓解炎症反应[16,17]。MyD88在机体清除绵羊布鲁氏杆菌、山羊布鲁氏杆菌和牛种布鲁氏杆菌过程中发挥不可或缺的作用[18-20]。因此,在探讨布鲁氏杆菌侵染过程中IL-1β差异表达的同时,关注MyD88变化趋势,为后续研究IL-1β和MyD88基因的干扰或过表达对布鲁氏杆菌胞内寄生的影响提供思路。
在布鲁氏杆菌感染初期,巨噬细胞可发挥其杀伤功能,杀灭绝大部分侵入的细菌,少量存活的细菌仍会刺激细胞激活炎症反应,提高IL-1β表达量,促进细胞对细菌的清除,但MyD88的作用有待进一步验证。

