化学能与电能知识检测题
■雷范军
(考试时间:60分钟,试卷满分:100分)
可能用到的相对原子质量:H1 C12 N14 O16 Na23 Mg24 Al27 S32 Cl35.5 K39 Ca40 Cr52 Fe56 Cu64
一、选择题(本题共7小题,每小题6分,共42分,在每小题给出的四个选项中,只有一项最符合题目要求)
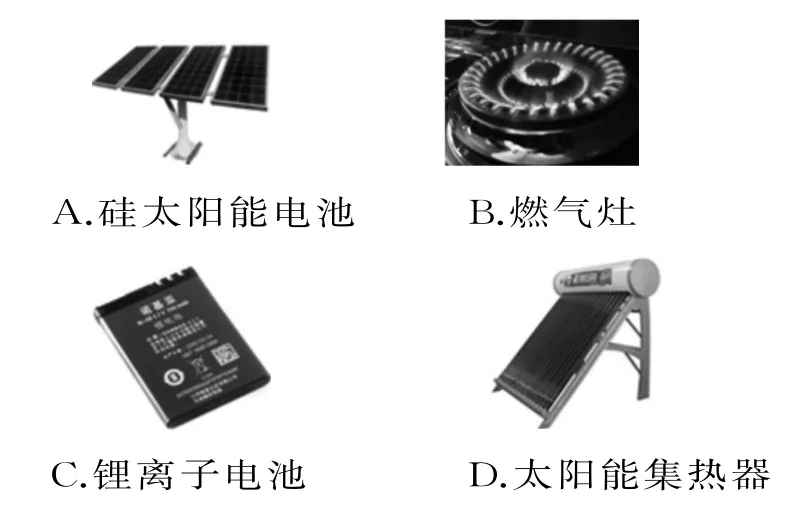
1.下列设备工作时,把化学能转化为电能的是( )。
2.下列装置可以构成原电池的是( )。

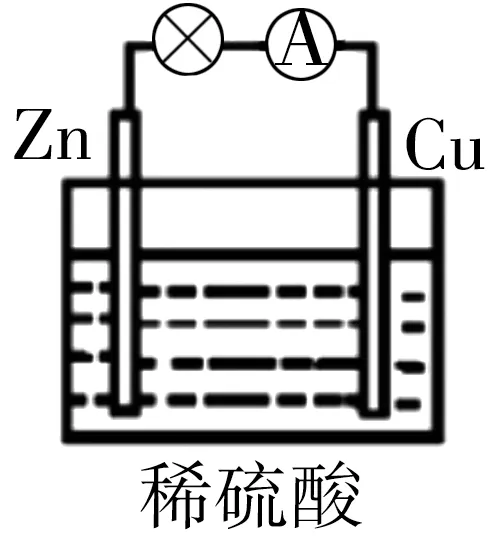
图1
3.原电池原理的发现和各式各样电池装置的发明是化学对人类的一项重大贡献。关于如图1 所示原电池的说法正确的是( )。
A.将电能转化为化学能的装置
B.电子由铜片经导线流向锌片
C.锌片为负极,发生氧化反应
D.铜片上发生的反应为Cu2++2e-Cu
4.有a、b、c、d 四种金属,用导线两两相连插入稀硫酸中,可以组成原电池。a、b 相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,a极发生氧化反应;b、d 相连时,b极有大量气泡生成。则四种金属的活动性按由强到弱顺序排列的是( )。
A.a>b>c>d B.a>c>d>b
C.c>a>b>dD.b>d>c>a
5.已知空气-锌电池的电极反应为:
锌片:Zn+2OH--2e-ZnO+H2O
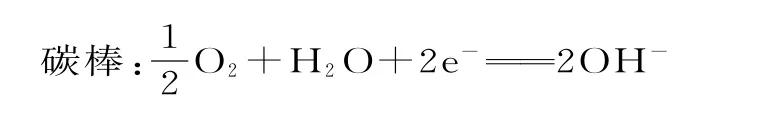
据此判断,锌片是( )。
A.负极,被氧化B.正极,被氧化
C.负极,被还原D.正极,被还原
6.图2 为发光二极管连接柠檬电池装置,下列说法正确的是( )。
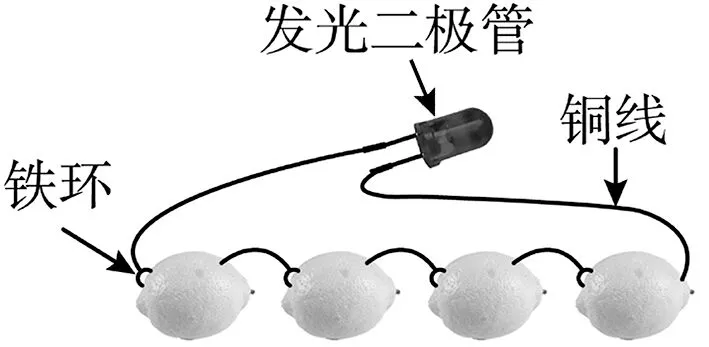
图2
A.铁环作为柠檬电池的正极
B.电子由发光二极管经导线流向铁环
C.可将柠檬替换成盛装乙醇溶液的装置
D.负极的电极反应为Fe-2e-Fe2+
7.某种氢氧燃料电池已经成功应用在城市公交汽车上,其电池构造如图3 所示。下列说法正确的是( )。
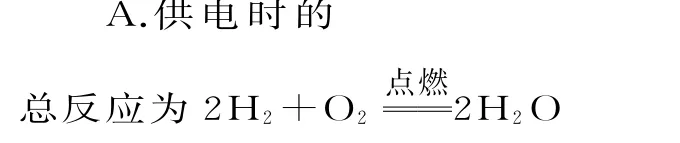
图3
B.多孔金属a作负极,是电子流入的极
C.电池工作时,电解质溶液中OH-移向a极
D.正极的电极反应式为O2+4e-+4H+2H2O
二、非选择题(本题包括4小题,共58分)
8.(14分)化学电源的发明是化学对人类的一项重大贡献。
(1)将锌片、铜片按照如图4所示装置连接,铜片做____极(填“正”或“负”),外电路电子的流向为____(填“Cu→导线→Zn”或“Zn→导线→Cu”)。
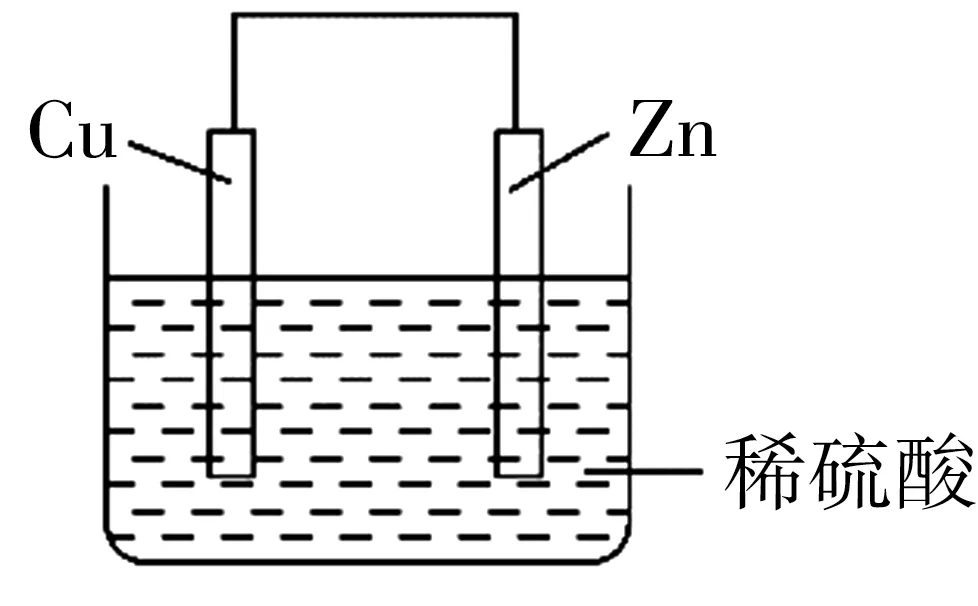
图4
(2)某兴趣小组做完实验后,在读书卡片上记下结论。其中正确的一组是____。
①H+向负极移动
②Cu极上有H2产生
③若有1mol电子流过导线,则产生的H2为0.5mol
④正极的电极反应式为Zn-2e-Zn2+
(3)若将装置中的稀硫酸用CuSO4溶液替代,则相应原电池的总反应的化学方程式为_____。
(4)下列化学反应通过原电池装置,可实现化学能直接转化为电能的是_____(填序号)。

④4Li+O2+2H2O4LiOH
⑤Pb+PbO2+2H2SO42PbSO4+2H2O
9.(14分)如图5,a、b、c三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
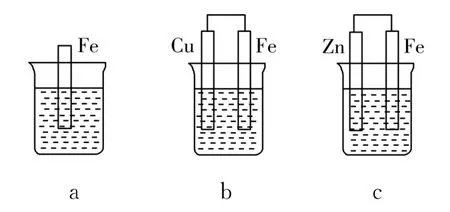
图5
(1)a中反应的离子方程式为____。
(2)b中作正极的金属是____,该电极上看到的现象为_____。
(3)c中作负极的金属是_____,该电极反应方程式为____。
(4)现有未知金属A,将A 与Fe用导线相连后放入稀硫酸中,观察到A 上有气泡,在A 上发生_____反应(填“氧化”或“还原”)。A 与Fe的金属活动性大小顺序为A____Fe(填“>”或“<”或“=”)。
10.(15 分)化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列方程式正确且能设计成原电池的是____。

(2)为了探究化学反应中的能量变化,某同学设计了如图6所示两个实验装置。下列有关实验现象的说法正确的是。
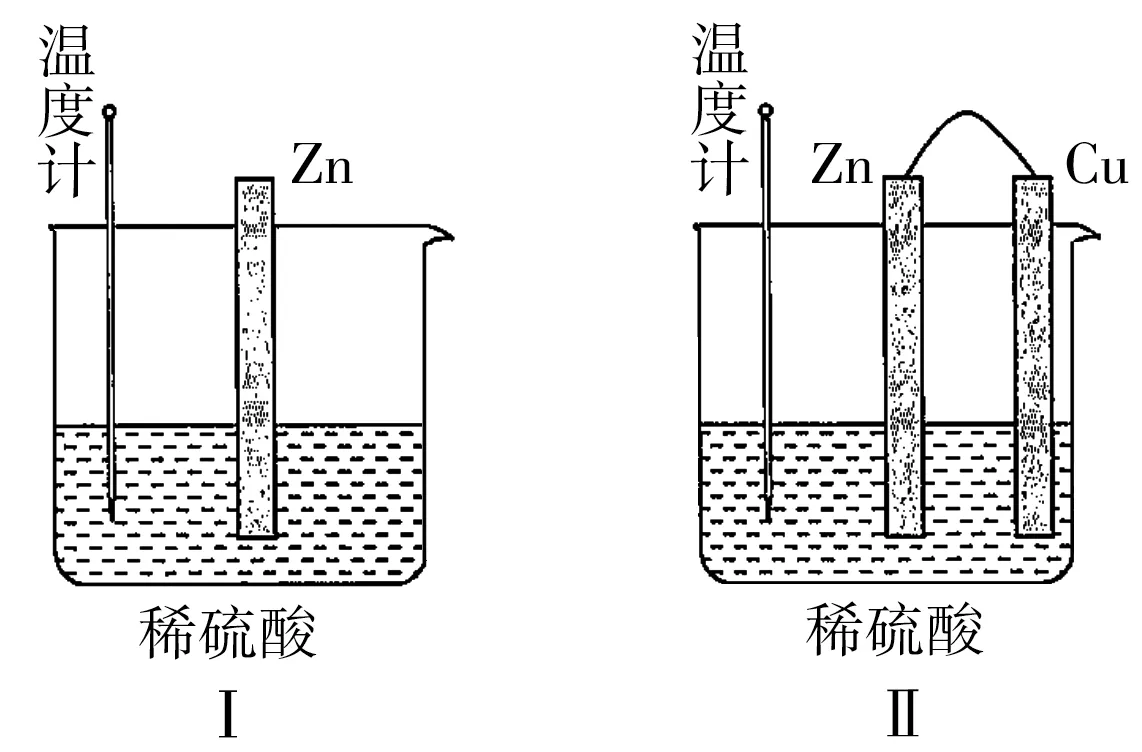
图6
A.装置Ⅰ中温度计的示数高于装置Ⅱ中温度计的示数
B.装置Ⅰ和装置Ⅱ中温度计的示数相等,且均高于室温
C.装置Ⅰ和装置Ⅱ中的气泡均产生于锌棒表面
D.装置Ⅱ中产生气体的速度比装置Ⅰ中的快
(3)对于锌-铜-稀硫酸组成的原电池装置,当导线中有0.1mol电子通过时,理论上的两极变化是_____。
①锌片溶解了3.25g
②锌片增重3.25g
③铜片上析出0.1gH2
④铜片上析出0.1molH2
(4)将锌片和银片浸入稀硫酸中组成原电

Ⅱ.将纯锌片和纯铜片按照图7 所示方式插入100mL 相同浓度的稀硫酸中一段时间,回答下列问题:
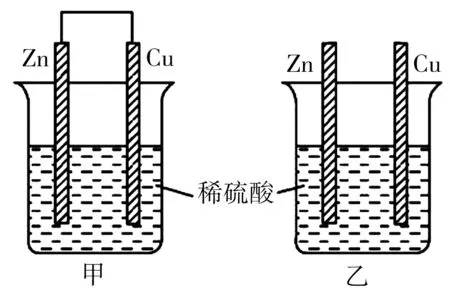
图7
(4)在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”“<”或“=”)。
(5)该原电池的负极反应式为_____。电池工作时,溶液中SO24-向____极(填“正”或“负”)移动,电池工作完成后,溶液中SO24-浓度_____(填“增大”或“减小”或“不变”)。
附加题:(15 分)图8 是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(1)若电极a 为Zn,电极b 为石墨,当电解质溶液为稀硫酸时,该电池的负极的电极反应式为____;当反应中收集到标准状况下672mL气体时,电池中所转移的电子数目为____。
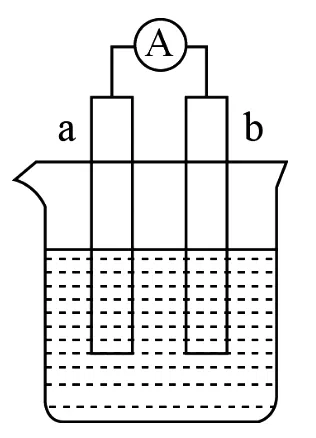
图8
(2)现设计一燃料电池,以电极a 为正极,电极b 为负极,甲烷(CH4)为燃料,采用氢氧化钠溶液为电解质溶液,则氧气应通入____极(填“a”或“b”),另一电极的电极反应式为_____。
(3)某种燃料电池的工作原理如图9所示,a、b 均为惰性电极。使用时,空气从____口通入(填“A”或“B”)。
(4)某同学设计如图10 所示的原电池,则正极的电极反应式为____,当导线中有3.01×1023个电子流过时,溶液质量变化为g。
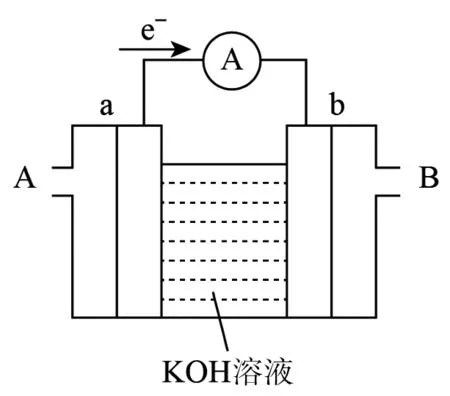
图9

图10
1.C 提示:硅太阳能电池是太阳能转化为电能,A 项错误。燃气灶工作时将化学能转化为热能,B 项错误。锂离子电池是把化学能转化为电能,C 项正确。太阳能集热器是把太阳能转化为热能,D 项错误。
2.D 提示:A 项中蔗糖是非电解质,不能形成闭合回路,错误。B 项没有形成闭合回路,不能构成原电池,错误。C 项没有活动性不同的电极,不能构成原电池,错误。D 项具备原电池构成的四个条件,正确。
3.C 提示:该装置为原电池,是将化学能转化为电能的装置,A 项错误。原电池中,电子从负极流向正极,即由锌片经导线流向铜片,B项错误。活泼性强金属作负极,负极上Zn失电子,发生氧化反应,C 项正确。铜片上发生的反应为2H++2e-H2↑,D 项错误。
4.B 提示:在原电池中,作原电池负极的金属较活泼、作正极的金属较不活泼,电流从正极沿导线流向负极,正极上得电子发生还原反应,负极上失电子发生氧化反应。a、b相连时,a为负极,则金属活动性a>b;c、d相连时,电流方向为d→c,则金属活动性c>d;a、c相连时,a极发生氧化反应,则金属活动性a>c;b、d 相连时,b 极有大量气泡生成,则金属活动性d>b。通过以上分析知,金属活动性强弱顺序是a>c>d>b。
5.A 提示:锌片发生反应Zn+2OH--2e-ZnO+H2O,电极反应中,锌元素的化合价升高,被氧化,原电池中较活泼的金属作负极,发生氧化反应,则锌为原电池的负极,被氧化。
6.D 提示:铜线、铁环插入柠檬,制成柠檬电池,由于活泼性Fe>Cu,所以铜线是柠檬电池的正极,铁环是柠檬电池的负极,A 项错误。电子由负极铁环经导线流向发光二极管,再由发光二极管流向铜线,B 项错误。乙醇溶液为非电解质溶液,不能将柠檬替换成盛装乙醇溶液的装置,C 项错误。负极发生氧化反应,电极反应为Fe-2e-Fe2+,D项正确。
7.C 提示:燃料电池中,通入燃料的一极为负极,还原剂失去电子发生氧化反应,电子沿着导线流向正极;通入助燃物的一极为正极,正极上发生还原反应,内电路中阴离子移向负极,阳离子移向正极,燃料电池中化学能转化为电能,能量转化效率高。供电时的总反应为2H2+O22H2O,不需要点燃,燃料电池中化学能转化为电能,A 项错误。多孔金属a通入氢气,作负极,是电子流出的极,B项错误。按分析,电池工作时,电解质溶液中OH-移向a极,C 项正确。碱性条件下,正极的电极反应式为O2+4e-+2H2O4OH-,D 项错误。
8.(1)正(2分) Zn→导线→Cu(2分)
(2)②③(4分)
(3)Zn+CuSO4ZnSO4+Cu(2分)
(4)②③④⑤(4分)
提示:(1)锌片、铜片插入稀硫酸中,由于锌比铜活泼,所以锌做负极,铜做正极,外电路中电子由负极流向正极,即由锌流向铜。
(2)Zn和Cu形成的原电池中,Zn比Cu活泼,因此Zn作负极,失去电子,发生氧化反应,Cu作正极,电解质溶液中的H+移向正极,并在正极得到电子发生还原反应,原电池装置中电子由Zn经外电路流向Cu。正极的电极反应为2H++2e-H2↑,因此有1mol电子流过导线时,生成的H2为0.5mol。
(3)将装置中的稀硫酸用CuSO4溶液替代,则锌和硫酸铜反应生成硫酸锌和铜,反应方程式为Zn+CuSO4ZnSO4+Cu。

9.(1)Fe+2H+Fe2++H2↑(2分)
(2)Cu(2分) 有气泡产生(2分)
(3)Zn(2分) Zn-2e-Zn2+(2分)
(4)还原(2分) <(2分)
提示:(1)如图5a,未构成原电池装置,仅为Fe与稀硫酸的置换反应,故离子方程式为Fe+2H+Fe2++H2↑。
(2)图5b构成原电池装置,其中Fe的活动性比Cu强,故Cu为正极,Fe为负极,正极上电解质溶液中的H+得电子生成H2,现象为有气泡生成。
(3)图5c构成原电池装置,其中Zn的活动性比Fe强,故Zn为负极,Fe为正极,负极的电极方程式为Zn-2e-Zn2+。
(4)某未知金属A,将A 与Fe用导线相连后放入稀硫酸溶液中,观察到A 上有气泡,说明A 的活动性比Fe弱,故A 为正极,发生还原反应。
10.(1)C(1分)
(2)AD(4分)
(3)①③(4分)
(4)8.96(3分)
(5)Al-3e-+4OH-AlO-2+2H2O(3分)

(2)装置Ⅰ中发生的是锌的化学腐蚀,装置Ⅱ形成铜锌原电池;装置Ⅰ主要是将化学能转化为热能,装置Ⅱ主要是将化学能转化为电能,则装置Ⅰ中温度计的示数高于装置Ⅱ中的示数,A 项符合题意。两个装置温度计中示数不相等,但均高于室温,B 项错误。装置Ⅱ为原电池,Cu 为正极,铜的表面有气泡产生,C 项错误。利用原电池反应可以加快反应速率,装置Ⅱ中产生气体的速率比装置Ⅰ中的快,D 项正确。

(5)虽然镁比铝活泼,但铝单质能与氢氧化钠溶液发生氧化还原反应,镁不与氢氧化钠溶液反应,因此Al为负极,Mg为正极,电极反应式为Al-3e-+4OH-AlO-2+2H2O。
11.(1)碳棒或者Pt(2 分) 铜(Cu)(1分) AgNO3溶液(2分)
(2)Ag++e-Ag(或者2Ag++2e-Ag)(2分)
(3)216(3分)
(4)>(1分)


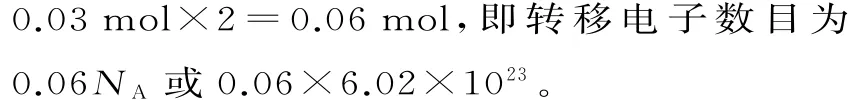
(2)通入燃料甲醇的电极为负极,通入氧气的电极为正极。由于该燃料电池以电极a为正极,电极b为负极,是a电极通入氧气,b电极通入甲烷。b 电极为负极,负极上甲烷被氧化产生的CO2与溶液中OH-结合形成CO2-3,所以负极的电极反应式为CH4-8e-+10OH-CO2-3+7H2O。
(3)根据图中电子流向可判断a为负极,b为正极,燃料电池中正极需通入O2,故空气从B口通入。
(4)由图可知,Fe为负极,石墨为正极,电解质为CuSO4,正极是Cu2+发生反应Cu2++2e-Cu,当导线中有3.01×1023个电子流过,即转移0.5mol电子,溶液中Cu2+转化为Cu,析出64g·mol-1×0.25mol=16gCu,Fe 转化为Fe2+进入溶液,质量为56g·mol-1×0.25mol=14g,故溶液质量减少16g-14g=2g。

