PHA生物制造及加工过程进展
刘凯旋,沈宏伟,谢鑫颖,杨 昊,吕金艳,叶健文
(1.华南理工大学 生物科学与工程学院,广东 广州 510006;2.广东荷风生物技术有限公司,广东 湛江 524300;3.珠海麦得发生物科技股份有限公司,广东 珠海 519031)
聚羟基脂肪酸酯(PHA)是由微生物合成的具有良好生物相容性和生物可降解性的高分子聚酯材料。当前随着限塑令升级、碳中和及碳达峰目标的提出,特别是在民众对生态环境保护意识增强的大背景下,以基因工程改造的微生物为细胞工厂合成PHA的工业生物技术已获得越来越多的产业验证及市场关注。得益于合成生物学技术的快速发展,研究者构建微生物细胞工厂,优化底盘菌株的工作效率,PHA的高效合成得以实现。同时,针对PHA下游提纯瓶颈问题进行工艺及生产菌株优化,也将有利于生物制造成本的进一步降低。
其中,传统工业生物技术(CIB)与下一代工业生物技术(NGIB)分别以不同生长特性的微生物为底盘,构建不同PHA的合成途径,并利用基因工程手段对PHA产量、产率及底物转化率的优化展开了系列深入的研究。其中,由清华大学陈国强教授提出的NGIB以其开放无灭菌、高生产强度等特性,在PHA生产成本上实现了里程碑的突破。然而,不论是CIB或NGIB技术体系,PHA的提纯、改性加工、产品制备等工艺的开发将是进行PHA规模化生产与市场应用的关键。
本文总结近年来基于基因工程改造的微生物合成PHA、菌株优化、生物发酵生产体系、PHA提纯与改性加工等方面的研究进展,提出了未来PHA生物合成仍需解决的潜在问题,并展望了其未来发展的必然性与重要性。
1 PHA工业生产现状
1.1 基于CIB的PHA生物合成进展
随着合成生物学的快速发展,高效的基因编辑方法及工具得以开发,这加快了微生物的工程改造效率,进一步推动生物技术与生物制造工业的发展与进步[1]。因此,工业生物技术可通过大规模的微生物发酵培养来合成多元化的目标产品[2],而PHA作为生物基聚酯材料是最为典型且重要的产物之一。在PHA传统工业生产中,应用较广的微生物底盘有大肠杆菌、真氧产碱杆菌和假单胞菌等,这些菌株的基因组信息、基因改造方法、发酵过程控制等均被较深入地研究,取得了一系列的研究成果,并在国内外有一定的产业建设基础。如TianAn Biopolymer公司以真氧产碱杆菌为底盘生产聚(3-羟基丁酸-co-3-羟基戊酸)(PHBV)可达到2 000 t/a[3],GreenBio公司以大肠杆菌为底盘生产聚(3-羟基丁酸-co-4-羟基丁酸)(P34HB)可达10 000 t/a[3]。
截至目前,针对PHA合成的底盘微生物研究颇多,且已在多方面实现重要的成果突破[4-16](表1)。由于假单胞菌(Pseudomonassp.)含有第Ⅱ类PHA聚合酶(PhaC-Ⅱ),对中长碳链(M/LCL)的单体有天然的聚合特异性,同时假单胞菌可利用的碳源种类多(如不同的脂肪酸等),因此可合成种类繁多的PHA。如Koller等以水解乳清渗透液和戊酸盐为原料培养Pseudomonashydrogenovora合成PHBV,其产量及对3-羟基戊酸(3HV)的摩尔收率分别达1.44 g/L和21%;Li等[5]通过弱化Pseudomonasentomophila的β-氧化途径,以葡萄糖和脂肪酸(碳链长度可从C9~C18)为原料,合成出P(3HB-co-MCL/LCL 3HAs),并且细胞生物量(以干质量计)和PHA的质量分数可达到9 g/L和60%,Vo等[6]通过在PseudomonasputidaKCTC1639中过表达phaJ基因,以辛酸为原料,可使MCL-PHA的产量从0.38 g/L提高至0.51 g/L。Salvachúa等[7]通过基因改造构建PseudomonasputidaAG2162菌株,以木质素为原料可实现65.4 g/L细胞生物量的积累,且MCL-PHA达17.7%(摩尔百分数)。Hokamura等[8]以Pseudomonassp.61-3为出发菌,利用大豆废水提取的粉末(SWP)作为碳氮源,最终得到5.5 g/L的细胞生物量,PHA含量达32%(质量分数)。
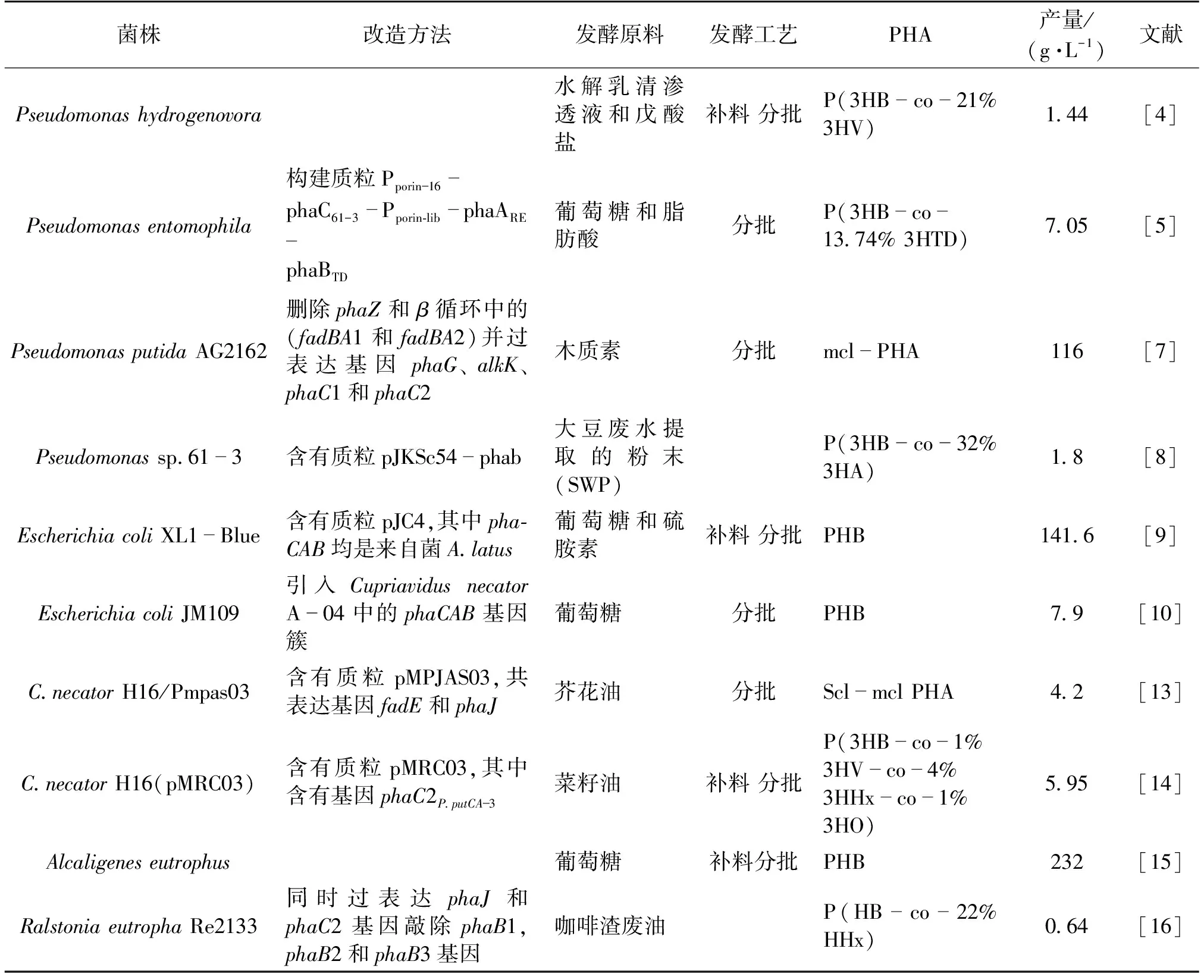
表1 基于CIB的PHA生物合成概览
大肠杆菌具有生长速度快、细胞培养密度较高、基因改造便捷以及胞内没有降解PHA聚合物的解聚酶等优点,因此作为工程底盘被广泛用于PHA发酵生产。Choi等[9]通过基因改造,以葡萄糖和硫胺素为原料,最终细胞生物量和PHB产量分别达到194.1和141.6 g/L。Boontip等[10]引入CupriavidusnecatorA-04中的phaCAB基因簇,在5 L发酵罐中培养实现质量分数89.8%的PHB积累,且生产强度高达0.43 g/(L·h)。
真氧产碱杆菌Ralstoniaeutropha(别名为C.necator)是一株能天然合成PHA的菌株[11],底物利用相对较广,除常规的碳源(如葡萄糖、脂肪酸等)外,它还能利用CO2、废油、植物油及动物脂肪等[12]。C.necatorH16/Pmpas03菌株以芥花油为原料,可产生生物量为6.32 g/L的细胞,PHA共聚物的质量分数达到66.1%[13];C.necatorH16(pMRC03)菌株以菜籽油为碳源,可积累细胞生物量6.2 g/L,PHA共聚物质量分数最高达96%[14];以葡萄糖为原料,基于Alcaligeneseutrophus菌株的分批补料发酵可生产232 g/L的PHB,产率高达3.14 g/(L·h)[15]。此外,以咖啡渣废油为原料培养RalstoniaeutrophaRe2133[16],同时过表达phaJ和phaC2基因,敲除phaB1、phaB2和phaB3基因,最终实现质量分数69%的PHA积累,其中3-羟基己酸(3HHx)的摩尔比例高达22%。Mizuno等[17]将PhaC1-Ps聚合酶引入RalstoniaeutrophaPHB-4中,实现含有特殊官能团结构(苯环)单体的PHA合成,如P(3HB-co-8.9% 3H3PhP)。
然而,传统工业底盘的PHA生产过程仍面临诸多挑战。首先,为保证无菌的菌种生长环境,需投入大量的能耗产生蒸汽,用于灭菌、复杂的防染菌措施等,使得生产的能耗成本、过程控制成本居高不下。其次,生产过程不能连续、碳源转化率及产物产率低等因素也一定程度上增加了PHA的生产成本[18]。最后,下游分离提纯产品收率低、工艺过程复杂等增加了PHA生产过程的能耗与产品损耗[19]。因此,开发更简便、节能、经济的工业生物技术体系是解决以上工业瓶颈问题的关键策略之一。
1.2 NGIB的优缺点
由于传统工业生物技术所使用的底盘微生物只能在中性pH、无菌及低渗透压的条件下生长[20],因此极易出现染菌现象。为降低发酵生产过程中水电气的消耗并实现连续化生产,已开发基于嗜盐微生物的NGIB平台(图1)[19]。目前,NGIB平台主要是基于极性微生物实现连续、开放、节能的高效生产。其中,在高碱、高盐环境下生长的嗜盐单胞菌属(Halomonasspp.)作为NGIB实例,已实现工业应用。因为该类菌株不仅可以在高盐、高碱且非灭菌条件下快速生长[20],而且还是天然的PHB合成菌株[21]。野生型H.bluephagenesisTD01可利用葡萄糖在连续、开放过程中积累细胞生物量达80 g/L,PHB的质量分数高达80%,且过程中葡萄糖转化率最高接近50%[21]。在南海冰里发现的Halomonassp.363菌株携带着3种PHA聚合酶,并且它具有3种不同的PHA合成途径,因此可以同时合成SCL-PHA和MCL-PHA[22]。在埃及的Mariout 盐水湖分离出2株能合成PHBV的盐单胞菌(HalomonaspacificaASL10 和HalomonassalifodianeASL11),其摇瓶发酵培养的PHBV产量分别达到5.5和6.2 g/L[23]。此外,Kawata等[24]筛选的Halomonassp.KM-1菌株可利用含有葡萄糖的硝酸盐作为原料,其批次发酵培养可分泌(R)-3-羟基丁酸(BHB)达40.3 g/L,产率达0.48 g/(L·h)。
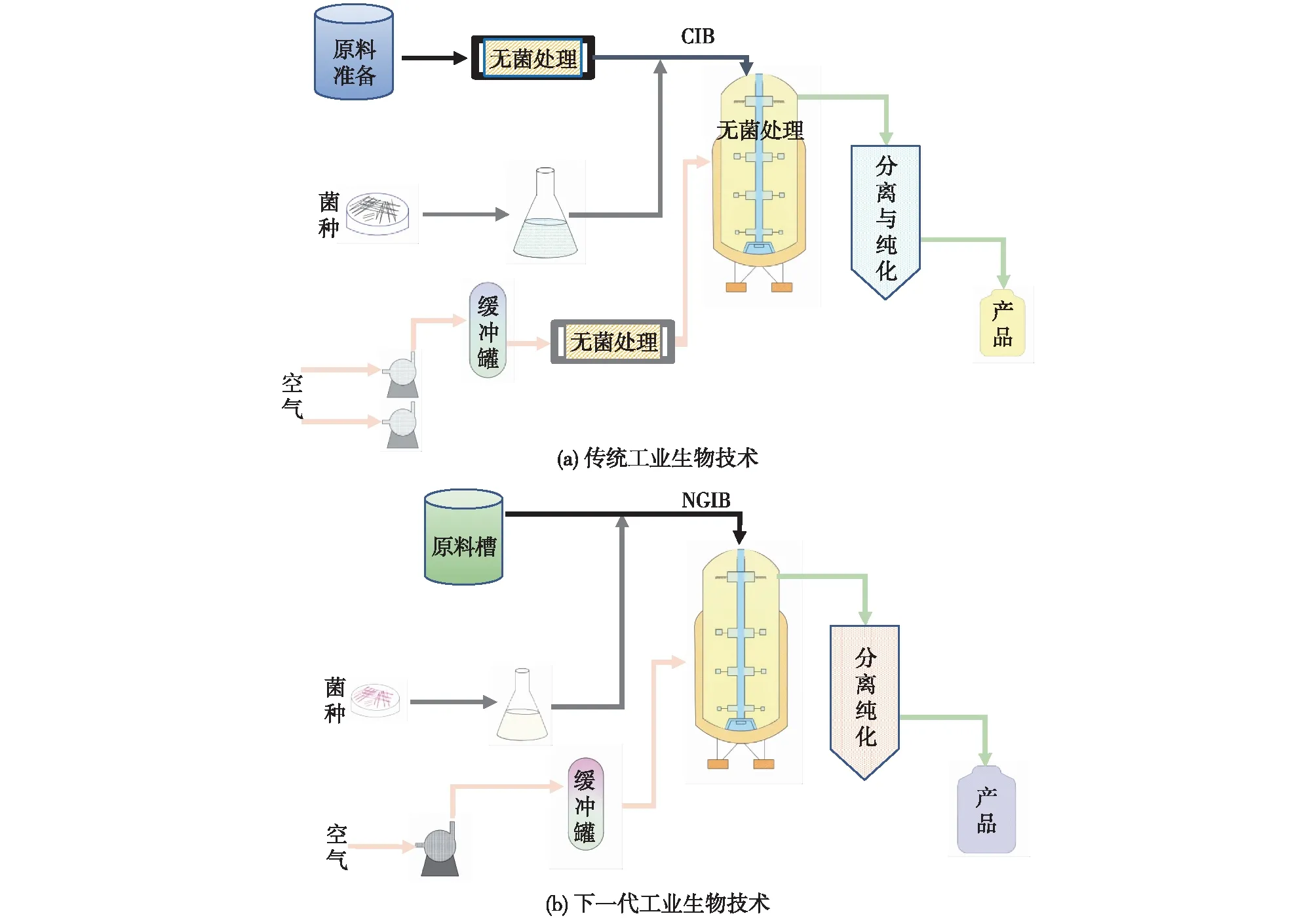
图1 传统工业生物技术与下一代工业生物技术对比
为了进一步强化NGIB技术平台生产PHA及其单体种类,针对H.bluephagenesisTD01的基因改造方法已被逐步开发、建立,其中包括CRISPR基因编辑技术、表达元件及系统等,已在PHA合成中得以应用。如,Zhao等[25]开发了新型类T7的表达系统用于细胞形态控制与PHB合成途径的调控,实现超过100倍的细胞长度增加和高达92%(质量分数)的PHB积累。Fu等[26]通过敲除prpC基因构建菌株HalomonasTD04,利用丙酸和葡萄糖合成HBV共聚物,积累量达70%(质量分数)以上。Chen等[27]通过在H.bluephagenesisTD01的基因组上整合引入orfZ基因,在1 000 L发酵罐中分批补料发酵,细胞生物量83 g/L,并积累近50 g/L的P34HB共聚物。Ren等[28]过表达phaCAB基因簇构建的H.bluephagenesisTDHCD-R3-8-3菌株,可在摇瓶培养中实现15 g/L细胞干生物量的积累,其中PHA的质量分数高达94%,而在7 L发酵罐中培养的细胞生物量和PHA质量分数分别达到90 g/L和79%。Yu等[29]在盐单胞菌种中引入PhaCJ4AK4,利用葡萄糖和5-己烯酸、己酸等为原料,合成短链和中长链PHA的共聚物(S/MCL-PHA),且5-己烯酸转化率可达到91%。Ling等[30]通过调整盐单胞菌胞内NADH/NAD+比例,使得PHB的积累量增加了6%。以上基因工程改造实例从不同角度对盐单胞菌的PHA合成进行优化,对后续的PHA工业生产有着重要的推进作用。
一般来讲,PHA的生产成本[31]主要来源于原料与能耗,而发酵过程的动力消耗是最主要部分,包括搅拌、灭菌及空气供给等,此外下游的分离纯化也是主要的耗能单元[20]。然而,由于盐单胞菌特有的高盐碱生长特性,可以利用海水进行开放发酵,大幅降低了PHA的发酵能耗。而且,经过一系列的基因工程改造,该菌株目前可实现含有3HB、4HB、3HV、3HHx和3HP等多种聚合单体的PHA均聚及共聚物合成,使得热力学性能更优的聚酯材料制备[2,26-27,29]的人力成本进一步降低,目前已建成年产千吨级的PHA生产线(MedPHA Co.Ltd.)[19]。然而,NGIB也同样面临着若干困难,如盐单胞菌底盘细胞的基因组信息研究不够深入、基因改造方法的效率相对不高,还需对能利用廉价原料的菌株进一步改造筛选等。同时,提高开放发酵体系的提取纯化效率、减少废水排放等策略仍待完善。此外,在代谢动态控制[32]、低成本诱导[2]、高通量细胞改造设计[28]等领域均需要进一步探索挖掘。现将CIB和NGIB技术的典型菌种生产优势对比总结于表2中。

表2 重组盐单胞菌合成PHA的工业优势
2 PHA合成强化策略
PHA合成强化策略主要有细胞摄氧能力强化、细胞形态工程、人工固定CO2途径和废弃生物质利用这四方面,具体过程见图2。
2.1 细胞摄氧能力强化
由于PHA的发酵生产过程是强耗氧过程,O2参与了ATP合成与许多细胞活动所必需的生化反应,因此O2供给控制是影响胞内代谢的重要因素。研究表明,在不同的曝氧和搅拌条件下,溶氧对PHBV发酵生产的提高是显著的[35]。然而,纯氧及富氧空气的供给不仅昂贵,增加了生产成本,而且还易引起爆炸[36]。Ouyang等[37]在盐单胞菌中将血红蛋白定位至细胞周质空间以强化微生物的O2摄取能力,从而使得细胞生物量增加1倍(图2(a))。
2.2 细胞形态工程
在微生物胞内产物的发酵生产过程中,细胞体积的大小将一定程度上限制目标产物积累能力的发挥[38]。PHA作为细胞内积累的包涵体[39],通过改变细胞形态大小可进一步提高PHA的积累。Jiang等[40]研究发现,联合抑制编码细菌分裂环和细胞骨架肌动蛋白的基因(ftsZ和mreB)表达[40],可获得更长和更大的细胞空间,使得PHB的质量分数从40%提升至80%(图2(b))[41]。此外,在盐单胞菌H.bluephagenesisTD01中,包涵体包裹蛋白PhaP的敲除,可以获得单一的胞内PHA颗粒[42];同时,通过过表达minC和minD(编码分裂Z环定位蛋白)基因,使得PHA颗粒大小增大至10 μm[43]。该研究的成功对于PHA的下游分离纯化有着重要的应用价值。
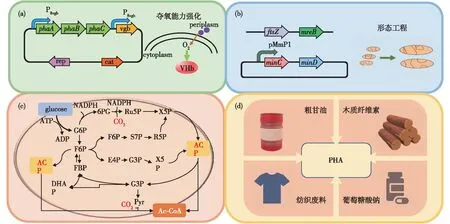
图2 PHA生物合成过程强化
2.3 人工固定CO2途径
在微生物有氧生长的碳代谢过程中,碳源进入细胞代谢后转化为丙酮酸并获得ATP和NADPH,丙酮酸进一步代谢则得到乙酰辅酶A。而在这个代谢过程中,每生成1个乙酰辅酶A将会产生2个CO2,造成严重的碳原子流失,从而难以实现更高的底物转化率[44]。Bogorad等[45]设计了1个从己糖、戊糖和丙糖磷酸盐出发的非氧化糖酵解途径(NOG),使糖分解为乙酰辅酶A的碳完全保留,达到100%碳产率。Li等[46]和Wang等[47]通过结合糖酵解途径、磷酸戊糖途径,在大肠杆菌中构建了1个名为EP-bifido途径的碳保护系统,在提高葡萄糖到乙酰辅酶A转化率的同时,也提供细胞所需的NADPH,从而获得更高的PHB转化率,且PHA的质量分数高达85.1%(图2(c))。
2.4 废弃生物质利用
利用废弃生物质作为底物生产PHA也是目前的研究热点之一,包括纺织废弃物、木质纤维素、粗甘油、玉米深加工副产物等(图2(d))。如,Tamboli等[48]以纺织染料Direcr Red 5B 降解后产生的生物质为碳源合成了聚-3-羟基十六烷酸酯(PHD)。Munir等[49]使用挥发性脂肪酸(VFA)和葡萄糖作为混合碳源培养假单胞菌,获得了更高的PHA产量。Bengtsson等[50]利用活性污泥处理废水中富含的挥发性脂肪酸(主要由羟基丁酸盐和羟基戊酸盐组成)为碳源合成PHA,且PHA的质量分数最高可达污泥干质量的48%。Ye等[51]使用废葡萄糖酸盐母液作为H.bluephagenesis的底物,在7 L发酵罐中培养,实现PHA高产,细胞生物量达70 g/L以上。此外,木质纤维素(LF)也是近年来生物质利用研究的热点。木质纤维素主要由多糖组成,可以经物理化学及生物转化成为发酵用糖,从而合成PHA。因此,使用LF作为底物不仅可以降低PHA原料成本,而且也可促进木质纤维素的生物转化利用[52]。
3 PHA分离纯化
有机/非有机(水相提取)溶剂法是目前常用的PHA提取纯化方法。一般而言,实验室规模的材料提取制备及医疗级的PHA制备多采用有机溶剂法,而工业级的PHA提纯则采用非有机相提取方法。有机相提取方法有提取纯度高、材料分子量损失小等优势,但过程不环保,也难以实现大宗材料的规模化制备。而水相提纯方法过程相对简单、提取成本较低,可以很好地实现规模化生产,但存在提取纯度不高、杂质含量可控性差且会有一定的分子量损失等缺点。在PHA工业化生产过程中,PHA的提纯工艺开发对于PHA材料稳定性、生产成本等有着举足轻重的影响。因此,以提取纯化过程问题为导向的菌株反向设计,同时结合下游工艺及设备改进,可有效改良生产中的PHA提纯工艺,实现高品质、低成本的PHA生产。
PHA的非有机提取流程主要包括两步:第一步为细胞分离及破碎,第二步为PHA纯化。目前,细胞破碎主要有化学法、物理法和酶法3种。刘永东等[53]基于KOH的2次消化提取法获得的PHA纯度达98.3%,其特性黏度为1.02 mL/mg,收率达到75%。可见,二次消化提取有利于提高PHA的纯度和降低KOH对PHA大分子的降解。潘贵全等[54]利用次氯酸钠与氯仿(体积比1∶1)混合液从重组大肠杆菌中提取PHA时发现,次氯酸钠可快速实现细胞破壁,同时PHA分子可及时溶解于氯仿中以防止分子量损失,最终PHA的纯度可达90%。但在碱性条件下,次氯酸钠将导致严重的PHA降解(下降约50%)[55]。此外,使用温和极性溶剂及搅拌辅助对细胞进行预处理可削弱细胞包膜,也可改善PHA后续的溶剂提取效率[56-57]。非离子表面活性剂(如Tween20、BrijL4 和 TritonTMX-114等)预处理含PHA的菌体,提纯的PHA 纯度超90%,分子量损失低于24%[58]。近年来,超临界流体萃取也越来越多地用于天然高值物质的高效萃取[57],而且超临界 CO2(sCO2)由于对许多疏水化合物具有较高溶解度,被认为是一种非常便捷且安全的溶剂,具有提取后可立即完全挥发、无任何残留物的优点。因此,sCO2也被作为溶剂用于PHA的提取纯化[59-60]。高压均质破碎和十六烷基磺酸钠(SDS)破壁是目前主要的物理和化学细胞破碎方法,其中,PHA最大回收率可达 98%,纯度最高可达95%[61]。此外,利用超声和渗透压也可促进细胞破碎,能提高PHA的回收效率[61-62]。
仲丁醇作为溶剂来预处理细胞,PHA分子质量损失小(达83万),提取收率达78%,产品纯度达99%以上[63]。利用正丁醇也可进一步将PHA纯度从 91.2% 提高到98.0%[64]。在有机溶剂提取过程中,通过聚合物在溶剂中重复溶解和析出沉淀的方式,也可极大地提高最终PHA的纯度[65]。典型的卤化物萃取溶剂如氯仿、二氯甲烷等在PHA提取和纯度方面表现良好[57]。在提取PHA后,添加“PHA反溶剂”(通常是低分子醇)降低PHA的溶解度,从而获得高纯度的PHA[66],但该方法需要添加近10~20倍体积的反溶剂,大规模制备难度较大,可行性不高[67]。
此外,伽马辐射也可实现细胞破裂并促进 PHA与非PHA的细胞生物量的分离,同时诱导PHA分子交联以增加摩尔质量,利于细胞内PHA的提取[68]。而通过蛋白酶水解,添加核酸酶、磷脂酶及溶菌酶等可提高PHA的提取效率、收率及纯度;或结合酶混合、表面活性剂和加热的方法,即提取过程中通过热处理(约150 ℃)可使核酸变性并启动细胞裂解,通过胃蛋白酶、胰蛋白酶和木瓜蛋白酶等催化作用对细胞生物质进行酶解,再使用阴离子表面活性剂溶解去除残留生物质,可大幅提高PHA的提纯效率,最终提取的PHA纯度超95%[69]。
4 PHA改性加工
由于前期缺乏稳定、大批量的PHA材料供给,因此PHA的下游改性加工工艺及设备开发仍处于萌芽期。而且,PHA材料种类繁多、聚合单体的比例及种类多样,造就了PHA材料丰富的热力学性能特性的同时,也为其改性加工带来了一定的前期研发成本。目前,物理共混、化学改性等是研究较多的PHA改性加工方式。
例如,微螺杆挤出机可制备木粉和PHA复合材料,其过程的设备和工艺参数评价是决定工艺可靠性的关键,微螺杆类型、制备速度、层厚和喷嘴直径等对新材料性能有显著的影响。因此,印刷产品的性能可以通过挤出流量与螺杆速度相关的比率来控制[70]。Marmol等[71]研究发现,添加微纤维素(MF)可使PHA强度增加23%,紫外线阻隔效果更佳,但同时也增加了材料表面的粗糙度。此外,添加γ-缩水甘油醚氧丙基三甲氧基硅烷(KH560)改性粉煤灰可改善PHA与粉煤灰间的相容性,使得PHA的韧性明显增强,而且粉煤灰的添加也改善了PHA材料的热学性能[72]。而高强度硼酸铝纳米晶须对PHA复合材料的力学性能也具有明显的增强作用,在添加量为0.4%时PHA抗拉强度达到最大(38.5 MPa,增加109%),同时,抗屈服强度提高近3倍(达到26.2 MPa),断裂伸长率提高24.5%,杨氏模量提高4倍以上(达到7.6 MPa)。另外,断裂面分析表明纳米晶须和PHA结合力较好[73]。
由于聚乙烯吡咯烷酮(PVP)与PHA具有较好的相容性,张永霞等[74]研究利用熔融共混技术制备PHA/PVP复合材料,结果发现,随着PVP用量的增加,断裂功和结晶度在PVP用量为4%时出现最大值,复合材料的力学性能和结晶性能得到显著改善。曹伟娜等[75]在PHA中添加聚己内酯(PCL)制备成共混复合材料,以提高PHA的结晶度,但发现对PHA熔点没有影响,而随着体系中PCL含量的增加,PHA结晶度呈现先增大而后降低的趋势,在PHA与PCL的质量比为60∶40时共混材料性能表现最佳。
王淑芳等[76]研究发现,熔融共混聚乳酸(PLA)和PHBHHx时,随着PHBHHx比例的增加,共混材料的拉伸强度和杨氏模量降低,而生物降解速率显著提高。当共混材料PLA/PHBHHx质量比为2∶8时,力学性能和生物降解性能达到最优的均衡值。将甲基丙烯酸缩水甘油酯(GMA)接枝的PHBV(PHBV-GMA)与聚碳酸亚丙酯(MA-PPC)进行反应性共混,通过反应接枝MA-PPC,使得PHBV部分扩散进入MA-PPC相区,降低PHBV结晶度,当PHBV球晶的尺寸降低,可改善PHBV和MA-PPC共混组分的相容性[77-78]。陶剑等[79]将聚乳酸(PLA)、聚碳酸酯(PPC)及PHBV共混制备各种不同比例的三元共混膜,可实现三者的优势互补:PLA对材料强度有增强作用,PPC有助于材料断裂伸长,PHBV则可提高材料在环境中的生物降解速率。Lin等[80]通过PHB和聚(己二酸丁二醇对苯二甲酸酯)(PHB/PBAT)共混,结合制备静电纺丝技术可制备生物降解的纳米纤维膜,并通过接枝1-烯丙基乙内酰脲和全氟丙烯酸辛酯到纤维膜上,结果发现,该纳米纤维膜对大肠杆菌(ATCC 43895)和金黄色葡萄球菌(ATCC 6538)表现出优异的抗菌活性,且对UV-A光照具有良好的稳定性和耐久性。
5 总结与展望
PHA作为全生物合成、全生物降解的高分子材料,近年来受到了产业和市场的广泛关注。而且,PHA上游发酵生产与下游应用加工的相关研究及工业化探索也不断取得突破性进展。本文从生物制造体系比较分析、PHA细胞合成优化、下游分离纯化与改性加工3个方面对PHA的产学研进行了介绍。相比于传统工业技术,下一代工业生物技术在PHA的生物合成中体现出良好的平台化特性,且利于下游分离纯化的节能减排,该技术体系的规模化工业应用对于PHA放大生产与市场化应用有着重要的价值。而PHA下游分离纯化和改性加工在工艺优化和设备改造方面仍有着一定的优化空间,也将是衔接目前产线扩量和终端产品应用的关键节点,其体系的建立更是未来PHA进入规模化市场应用的有力保障。与此同时,基于下一代工业生物技术,不断优化PHA合成效率,加强其以工业生产问题导向的反向工程菌设计、开发,是进一步降低成本的有效策略之一。

