水稻化感抗(耐)稗草相关转录因子OsMYB57的靶蛋白筛选
张翠 马继琼 杨奕 许明辉 孙一丁 郭怡卿

摘要:【目的】揭示水稻化感抗(耐)稗草的转录调控机制,为遗传修饰改良水稻化感性状做铺垫,也为杂草的防控提供新途径。【方法】利用SMART技术,通过同源重组方式,在Y2H菌株中构建水稻受稗草胁迫的酵母cDNA文库;利用限制性内切酶BamHⅠ和NdeⅠ构建OsMYB57 C端缺失的pGBK-OsMYB57誘饵载体,按照YeastmakerTM Yeast Transformation System 2操作检测诱饵自激活活性;用酵母双杂交技术筛选OsMYB57互作蛋白,将所得互作蛋白的编码序列构建至pGAD载体,并与诱饵载体共转化Y2HGold菌株验证蛋白互作,再以BiFC技术进一步验证蛋白间的互作。【结果】酵母cDNA文库库容量为1.36×107 CFU/mL,插入片段在250~2000 bp,平均长度大于1000 bp,重组率为100%,库容量大且质量良好;筛选出4个有注释的互作蛋白,分别是16号RZFP34、50号4HTR、51号BM1PD和74号GTP1;回转验证及BiFC结果显示RZFP34、4HTR、BMIPD、GTP1与OsMYB57在植物细胞中相互作用,其中RZFP34是一个E3亚型泛素连接酶,在植物中响应非生物逆境胁迫应答,且水稻OsRZFP34基因启动子区含有与水稻化感调控有关的水杨酸和茉莉酸等激素响应及MYB转录因子结合域相关元件。【结论】RZFP34通过与OsMYB57互作参与水稻化感转录调控而发挥作用。
关键词: 水稻;稗草;互作;化感抗(耐)性;OsMYB57;酵母双杂交
中图分类号: S511;Q756 文献标志码: A 文章编号:2095-1191(2022)01-0029-09
Screening of target protein of rice allelopathy resistance to barnyard grass related transcription factor OsMYB57
ZHANG Cui1, MA Ji-qiong2, YANG Yi2, XU Ming-hui2, SUN Yi-ding2*, GUO Yi-qing1*
(1College of Plant Protection,Yunnan Agricul tural University, Kunming 650201, China; 2Institute of Biotechnology and Genetic Resources, Yunnan Academy of Agricultural Sciences, Kunming 650205, China)
Abstract:【Objective】To explore the transcriptional regulation mechanism on rice allelopathy resistant weeds, and provide theoretical basis for breeding rice of resistant weeds.It provided basis for the genetic modification and improvement of rice allelopathy traits, and also provided a new way for the prevention and control of weeds. 【Method】Using SMART technology, cDNA library of rice under barnyard grass stress was constructed in Y2H by homologous recombination. The decoy vector pGBK-OsMYB57 with C-terminal deletion of OsMYB57 was constructed using restriction endonuclease BamHⅠ and NdeⅠ, and its self-activation activity was detected according to YeastmakerTM Yeast Transformation System 2. The interaction protein of OsMYB57 was screened by yeast two-hybrid technology, and pGAD vector was constructed with the interaction protein coding sequence, and the interaction protein of Y2HGold strain was co-transformed with bait vector. The interaction between proteins was further verified by BiFC technology. 【Result】The size of yeast cDNA library was 1.36×107 CFU/mL, the inserted fragment was 250-2000 bp, the average length was more than 1000 bp, and the recombinant rate was 100%, showed that the library was large and of good quality. Four annotated interacting proteins, RZFP34 16, 4HTR 50, BM1PD 51 and GTP1 74, were screened out. RZFP34, 4HTR, BMIPD and GTP1 interacted with OsMYB57 in plant cells. The RZFP34 was an E3 subtype ubiquitin ligase that responded to abiotic stress in plants, and the promoter region of rice OsRZFP34 contained elements related to hormone response such as salicylic acid, jasmonic acid and MYB transcription factor binding domain related to allelopathy regulation of rice. 【Conclusion】RZFP34 interacts with OsMYB57 and participates in allelopathy transcriptional regulation of rice.
Key words: rice; barnyard grass; interaction; allelopathic resistance; OsMYB57; yeast two-hybrid
Foundation items: National Natural Science Foundation of China(31760523);Yunnan Science and Technology Plan Project(2018FB146,2018FB063)
0 引言
【研究意义】水稻是重要的粮食作物,杂草是稻田的重要有害生物,全球每年因草害导致的水稻产量损失可高达11%。稗草是田间最难防除的恶性伴生杂草(孔垂华,2018;佟瑶等,2021)。以化学除草剂为主要手段的稻田杂草防除带来了杂草抗药性、药剂残留和后茬作物药害、生产成本增加及环境污染等诸多问题(郭玉峰和邓之亮,2018)。植物化感作用是指一种植物向周围环境释放特定的化感物质而影响邻近植物生长的现象,是植物对环境的一种适应机制和对逆境的防御机制(张小云等,2018;赵新梅等,2019)。因此,利用化感作用选育水稻抗(耐)稗草品种,是稻田稗草防除的重要途径(李家玉等,2021)。【前人研究進展】杨小燕(2017)利用田间抑草圈法从135个水稻品种中筛选出42个对稗草具有化感潜力的水稻品种,丰富了水稻化感研究的种质资源,同时证明利用水稻化感作用防控田间稗草的可行性。化感水稻通过释放化感物质抑制杂草生长,当前研究表明酚酸类和萜类等化合物是水稻的主要化感物质(郭怡卿,2017),分别由苯丙酸代谢和类异戊二烯生物合成途径所产生。其中酚酸类化合物是目前研究最多的一类化感物质,酚酸类物质的代谢途径包括莽草酸途径、苯丙烷代谢途径及类黄酮代谢途径,其中苯丙烷代谢途径在酚酸类物质代谢中发挥着关键作用,而苯丙氨酸解氨酶(PAL)和肉桂酸-4-羟化酶(C4H)是苯丙烷途径中的关键酶(陈志杰等,2018;高媛等,2018)。PAL酶对植物生长发育及响应逆境胁迫具有重要意义。曾嘉丽等(2018)通过生物信息学方法对水稻PAL基因功能进行分析,结果表明PAL酶活性是衡量植物抗逆能力的生理指标。真核生物基因的转录起始需要转录因子的参与,如在杨树转录因子中发现20个与响应盐胁迫相关的基因,在植物生长发育调控和逆境胁迫响应中发挥着重要作用。一些转录因子可通过结合相关顺式作用元件,调控苯丙烷途径相关基因的表达,进而增强植物抵御环境胁迫的能力(王玉等;2019)。MYB是植物中最大的一类转录因子,包括1R、3R、4R和R2R3等4种类型,其中R2R3-MYB型转录因子参与对植物次生代谢基因的调控。有研究在丹参中发现一种新的内源性R2R3-MYB转录因子SmMYB36,能促进毛状根中丹参酮的积累,抑制酚酸和黄酮的生物合成,因此,代谢途径相关基因的表达调控能导致代谢物含量改变(Ding et al.,2017)。随后,赵英(2019)通过酵母双杂交、转录组和代谢组分析等方法证明丹参SmMYB36基因与SmMYC2结合形成复合物,从而参与丹参次生代谢的调控。此外,中药材金银花中的LmMYB15具有转录激活功能,可通过结合并激活4CL、MYB3和MYB4启动子调控苯丙烷代谢途径,促进3-咖啡奎宁酸(CGA)的生物合成和苯丙素代谢(Tang et al.,2021),增强R2R3-MYB类转录因子在植物次生代谢尤其是苯丙烷代谢途径中的重要地位。在植物逆境生理研究领域,Fang等(2020)通过染色质免疫共沉淀技术发现OsMAPK11通过与OsPAL2;3相互作用调节水稻对稗草的抑制作用,而OsMAPK11的表达又受到OsMYB57(R2R3-MYB型转录因子)的正调控,表明OsMYB57在水稻响应杂草胁迫中发挥着积极作用。然而,水稻抗(耐)稗草机制是一个多基因共同作用、涉及多个信号转导途径的复杂过程。【本研究切入点】目前,OsMYB57在水稻化感抗(耐)稗草作用中的表达调控机制仍有待探索。【拟解决的关键问题】基于OsMYB57结构域分析基础,采用SMART技术构建受稗草胁迫0~20 d的水稻cDNA文库;通过酵母双杂交筛选出与OsMYB57互作的蛋白,并结合双分子荧光互补技术对互作蛋白进行验证,以期挖掘更多与OsMYB57互作的蛋白,揭示水稻化感抗(耐)稗草的转录调控机制,为遗传修饰改良水稻化感性状做铺垫,也为杂草的防控提供新途径。
1 材料与方法
1. 1 试验材料
1. 1. 1 植物材料 水稻材料是与稗草共培养不同时间段的化感水稻PI312777。水稻种子利用20%次氯酸钠消毒液浸泡10 min,然后用灭菌ddH2O漂洗4~5次,将种子置于垫有湿润滤纸的培养皿内,将培养皿置于28 ℃、相对湿度80%左右的环境中,待种子萌发后将发芽种子移栽至装有水稻土的育苗盘中(40 cm×30 cm×15 cm)培育,期间注意施加适量的氮肥。当水稻苗长至3叶1心期时移入经过同样消毒处理后萌芽的稗草(稗草∶水稻=1∶1)共培20 d,取共培养0、1、7和20 d 4个时间段水稻材料的叶片,经液氮冷冻后置于-80 ℃冰箱保存备用。本氏烟在14 h光照∶10 h黑暗、25 ℃、相对湿度70%条件下培养5周左右。
1. 1. 2 主要试剂、菌株和载体 RNA提取试剂盒购自上海普洛麦格生物产品有限公司;Taq DNA聚合酶、琼脂糖凝胶DNA回收试剂盒、酵母质粒提取试剂盒、乙酰丁香酮、MES、氯化镁(MgCl2)和醋酸锂(LiAc)等均购自生工生物工程(上海)股份有限公司;培养基YPDA、SD/-Trp、SD/-Leu、SD/-Leu/-Trp(DDO)、SD/-Ade/-His/-Leu/-Trp(QDO)和X-a-Gal (X)均购自北京酷来搏科技有限公司;金担子素(aureobasidin A,AbA)、酵母菌株(Y2HGold)及载体(pGADT7-Rec、pGBKT7-53、pGADT7-T、pGADT7、pGBKT7-Lam和pGBKT7)、酵母转化试剂盒YeastmakerTM Yeast Transformation System 2(Cat.No. 630439)、限制性内切酶BamHⅠ和NdeⅠ及T4DNA连接酶购自TaKaRa公司。
1. 2 酵母双杂交文库构建及鉴定
参照Oligotex mRNA Midi Kit说明书进行mRNA的分离纯化,然后按照CloneMiner说明书进行cDNA文库构建,将cDNA文库质粒转入酵母菌株Y187进行酵母文库构建,收集转化子保存于-80 ℃冰箱,即为酵母双杂交文库。
1. 3 互作蛋白筛选及回转验证
将载体pGBKT7-OsMYB57转入酵母菌株Y2HGold感受态细胞,涂布于SD/-Trp培养基上,30 ℃培养箱培养2~3 d。挑取单菌落接种于SD/-Trp液体培养基,30 ℃下以250 r/min摇瓶培养至OD600为1.0;1000 g离心收集菌体,用1 mL SD/-Trp培养基重悬菌液使细胞数达1.0×108 CFU/mL并转移到2 L锥形瓶中,加入1 mL文库菌液和45 mL 2×YPDA液体培养基;30 ℃下以50 r/min摇瓶培养,16 h后观察是否出现酵母合子细胞,培养时间不超过24 h;1000 g离心收集细胞,用适量0.5×YPDA清洗锥形瓶并收集残余细胞;加入适量0.5×YPDA重悬菌液,涂布于QDO培养基,30 ℃下培养5 d左右。将QDO培养基上生长的菌落转涂于QDO/A培养基上,观察菌落,挑选蓝色克隆继续验证。随机挑选10个可在QDO/X/A培养基上生长的蓝色克隆进行回转验证,分别提取阳性酵母中的pGADT7重组载体质粒,然后再将pGADT7重组载体与pGBKT7-OsMYB57载体共同转入酵母菌株Y2HGold中,涂布于QDO/X/A培养基上,以pGBKT7-53/pGADT7-T组合生长情况为阳性对照,pGBKT7-Lam/pGADT7-T组合为阴性对照。观察酵母是否生长或变蓝,若生长且变蓝,则证明为真实互作,否则可能为假阳性。
1. 4 BiFC蛋白互作验证
将RZFP34、4HTR、BMIPD、GTP1和OsMYB57基因构建到载体pCAMBI-YN-GFP及pCAMBI-YC-GFP上,即pCAMBI-YN-GFP-RZFP34、pCAMBI-YN-GFP-4HTR、pCAMBI-YN-GFP-BMIPD、pCAMBI-YN-GFP-GTP1和pCAMBI-YC-GFP-OsMYB57。pCAMBI-YC-GFP -OsPid2-2和载体pCAMBI-YN-GFP、pCAMBI-YC-GFP转入农杆菌GV3101中,挑取含有目的载体的农杆菌单克隆至含有卡纳霉素和利福平抗生素的3 mL YEB培养基中,28 ℃下200 r/min过夜培养。然后转移1 mL至20 mL含有抗生素和15 μmol/L乙酰丁香酮的YEB中,28 ℃下200 r/min培养至OD600为0.5。5000 r/min离心10 min收集菌体,用浸染液悬浮农杆菌菌体至OD600为1.0。室温静止2.5 h。按照互作验证要求等体积混合对应的YN-GFP和YC-GFP的菌体(RZFP34 YN-GFP+OsMYB57 YC-GFP、4HTR YN-GFP+OsMYB57 YC-GFP、BMIPD YN-GFP+OsMYB57 YC-GFP、GTP1 YN-GFP+OsMYB57 YC-GFP、YN-GFP+OsPid2-2YC-GFP为阳性对照,YN-GFP+YC-GFP为阴性对照),用注射器从烟草叶片背面伤口处注射菌液,做好标记,21 ℃黑暗保湿培养2 d后于倒置荧光显微镜下观察注射周围区域有无荧光。
1. 5 OsRZFP34启动子序列分析
运用在线网站PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析OsRZFP34启动子区域3553 bp序列的顺式作用元件。
2 结果与分析
2. 1 水稻酵母双杂交cDNA文库的建立
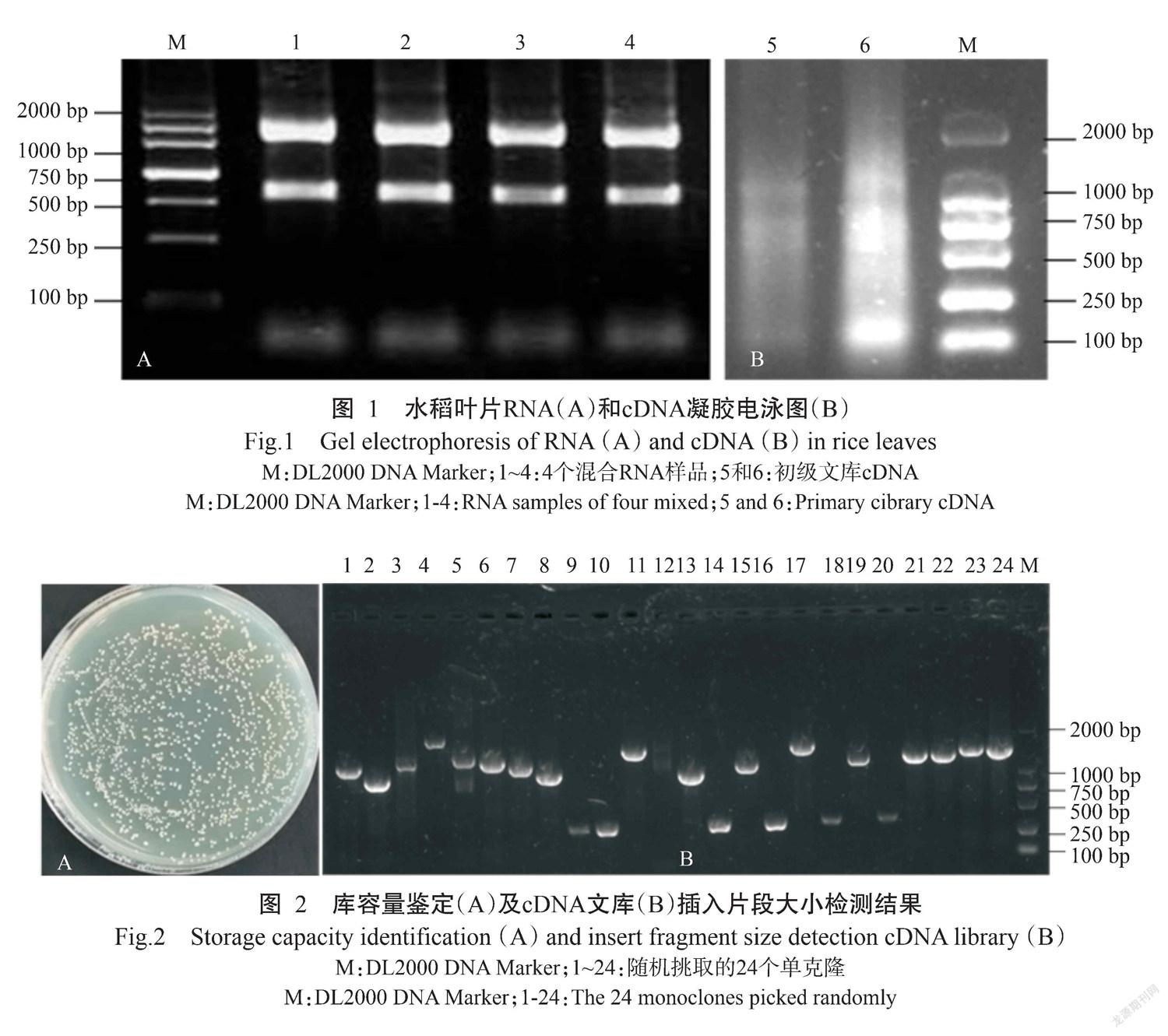
分别取0~20 d不同时间段稗草胁迫的水稻叶片,用TRIzol法提取总RNA,按浓度等比例混合,超微量分光光度计(DS-11)测量RNA的OD260/OD280=1.96,1%琼脂糖凝胶电泳检测结果显示,28Sr RNA、18S rRNA特异条带清晰,且亮度比接近2∶1(图1-A),用Invitrogen的CloneMiner II试剂盒构建的cDNA初级文库经电泳检测片段弥散分布于100~5000 bp(图1-B),说明RNA和cDNA质量良好。
从获得总体积为200 mL的酵母双杂交文库中随机取出100 μL酵母菌液,按1∶100、 1∶1000和1∶10000进行稀释,取100 μL稀释液涂布于SD/-Leu培养基中培养72 h。在稀释度为1∶10000的平板上统计单克隆数,其库容量为1.36×107 CFU/mL(图2-A)。于培养基平板中随机挑取24个酵母单克隆,利用PCR技术对其插入片段进行鉴定。结果显示,所有克隆均能扩增出单一条带且插入片段在250~2000 bp,平均长度大于1000 bp,重組率为100%(图2-B),表明所构建文库的质量良好,可用于后续蛋白互作筛选试验。
2. 2 OsMYB57诱饵载体的构建和自激活检测
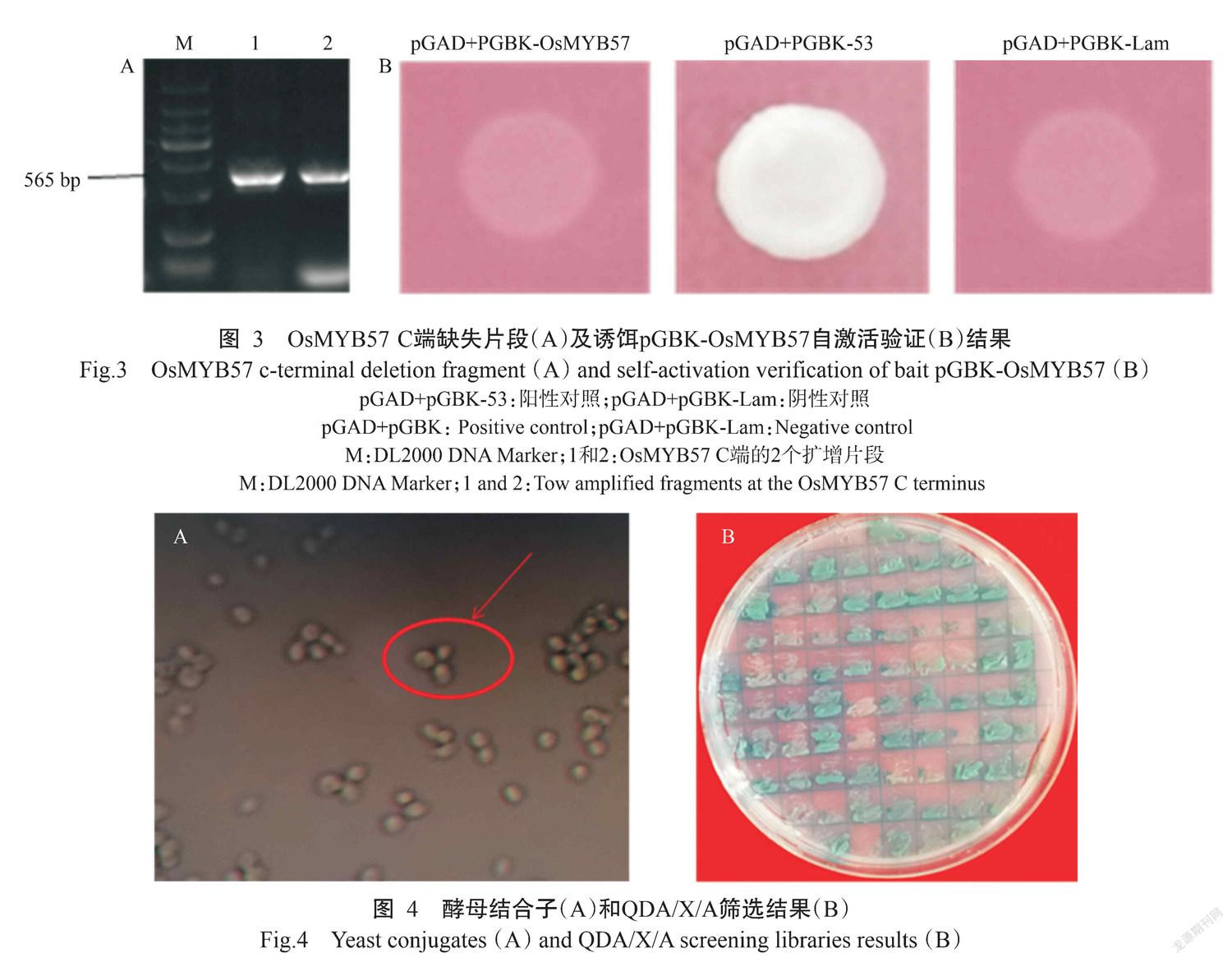
酵母双杂交筛库前要构建pGBKT7-OsMYB57诱饵载体并对其进行自激活检测,由于OsMYB57的C端存在激活域从而使其具有自激活活性,为避免重组诱饵蛋白的毒性作用,设计引物以逆转录后的cDNA为模板,扩增得到OsMYB57 C端缺失的OsMYB57片段(565 bp)(图3-A),并构建到pGBKT7载体上,将诱饵载体pGBK-OsMYB57、pGBK-53和pGBK-Lam分别与pGAD-T7质粒共同转入Y2HGold中,观察到pGBK-OsMYB57和pGBK-Lam不能在QDO/A培养基上生长,说明pGBK-OsMYB57无自激活活性,可进行后续的文库筛选(图3-B)。
2. 3 诱饵pGBK-OsMYB57互作蛋白筛选结果
将转入pGBK-OsMYB57载体的Y2HGold菌株和构建好的酵母文库菌株共培养,30 ℃下50 r/min摇床中培养20 h,在显微镜下观察到如米老鼠头像般的酵母结合子(图4-A),证明酵母培养液中诱饵菌株与文库菌株正常杂交,后继续将酵母细胞涂布于DDO/X/A培养基上,于30 ℃下生长3~5 d,待长出菌落,选择正常生长的蓝色菌落转移到DDO/X/A培养基上继续纯化培养。最后得到48个可正常生长的蓝色菌落(图4-B),即为候选阳性克隆。
2. 4 诱饵载体筛库结果
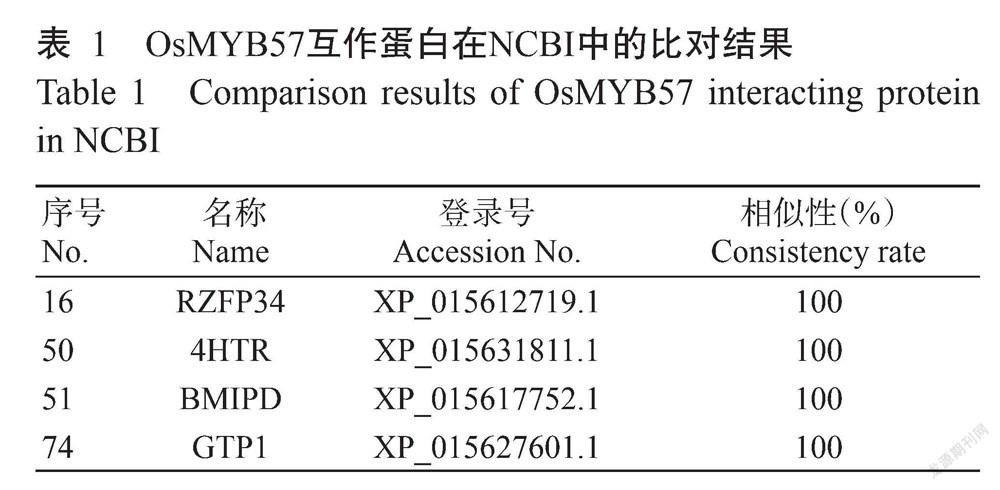
将48个阳性克隆提取pDADT7融合载体质粒并进行测序分析,通过NCBI比对结果并排除假阳性,获得4个具有功能注释的互作蛋白(表1),包括E3 ubiquitin-protein ligase RZFP34 isoform X1(RZFP34,登录号XP_015612719.1)、Probable 4-hydroxy-tetrahydrodipicolinate reductase 2(4HTR,登录号XP_015631811.1)、Probable bifunctional methylthioribμLose-1-phosphate dehydratase/enolase-phosphatase E1(BMIPD,登录号XP_015617752.1)和GTPase activating protein 1(GTP1,登录号XP_015627 601.1),相似性均为100%。
功能注释分析表明,RZFP34、4HTR、BMIPD、GTP1基因全长分别为864、916、919和853 bp;蛋白长度分别为288、305、303和251 aa;分别位于10、3、11和10号染色体(表2)。RZFP34属于E3泛素亚型连接酶,包含环指和CHY锌指结构域;4HTR为二氢甲基吡啶酸还原酶,参与生物合成和新陈代谢过程,在胞质细胞合成中起催化作用,DapB是中二胺肟酸途径中的一种重要酶;BMIPD为双功能甲基硫代酮糖-1-磷酸脱氢酶/烯醇酶磷酸酶E1,参与生物合成及新陈代谢过程,在细胞合成中起催化及水解作用;GTP1为HR病变诱导家族蛋白(表2)。
2. 5 互作蛋白回转验证
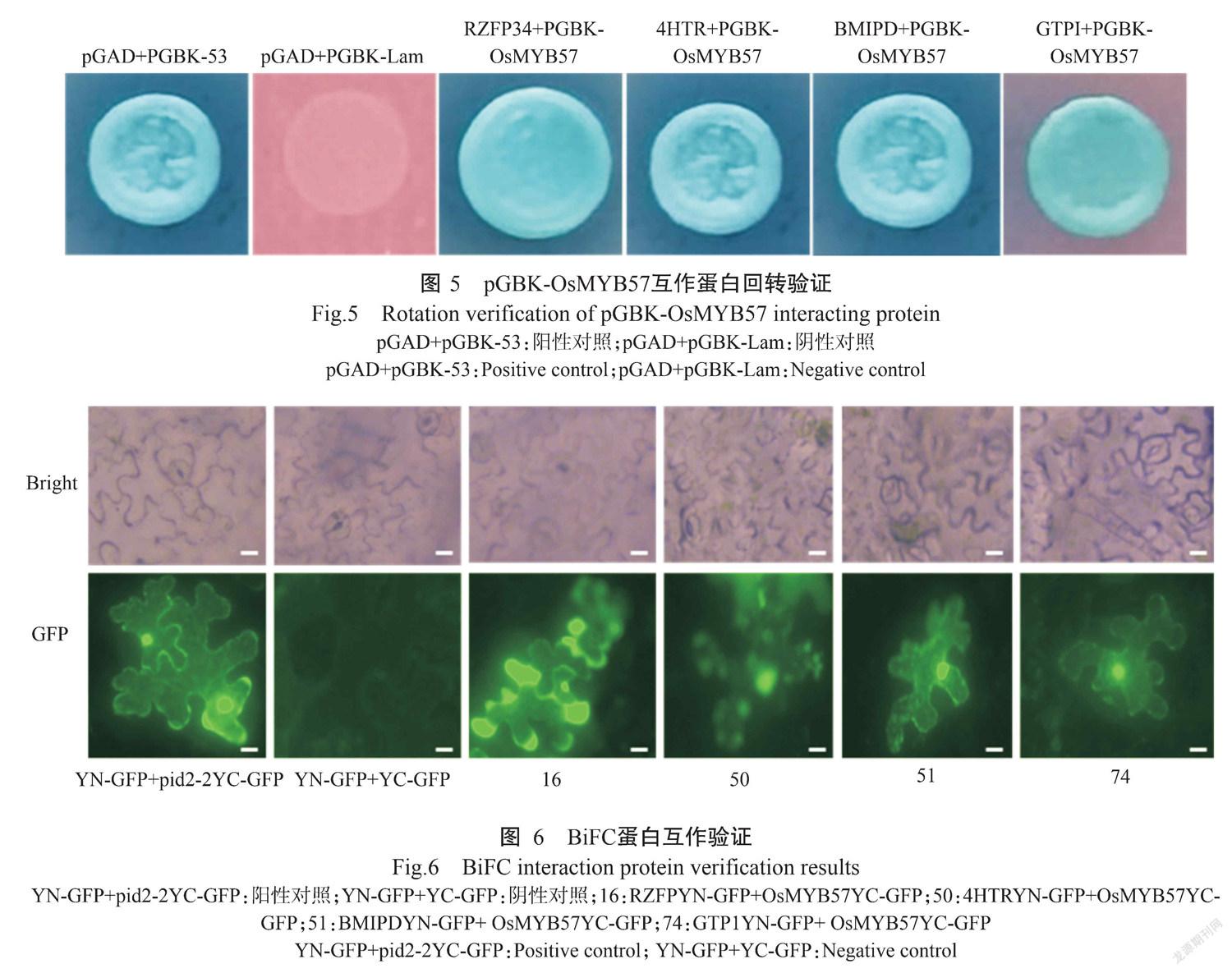
分别将pGAD-Rce-RZFP34、pGAD-Rce-4HTR、pGAD-Rce-BMIPD、pGAD-Rce-GTP1与pGBK-OsMYB57载体共转入酵母菌株Y2HGold中,于DDO培养基上培养,生长3 d后挑选生长良好的菌落,经0.9% NaCl稀释后转至QDO/X/A培养基上继续培养3 d,发现与阴性对照相比,4个克隆可正常生长且为蓝色,表明RZFP34、4HTR、BMIPD、GTP1与OsMYB57互作(图5)。
2. 6 OsMYB57互作蛋白的双分子荧光互补试验
分别将RZFP34、4HTR、BMIPD和GTP1基因构建到pCAMBI-YN-GFP载体,OsMYB57构建到pCAMBI-YC-GFP载体,分别转化农杆菌GV3101,等体积混合含有RZFP34、4HTR、BMIPD、GTP1YN-GFP和OsMYB57YC-GFP质粒的菌体。pCAMBI-YN-GFP-RZFP34、pCAMBI-YN-GFP-4HTR、pCAMBI-YN-GFP-BMIPD、pCAMBI-YN-GFP-GTP1分别与OsMYB57YC-GFP组合,以YN-GFP+pid2-2YC-GFP为阳性对照,YN-GFP+YC-GFP为阴性对照,注射烟草后在倒置荧光显微镜下观察,与阴性对照相比,所有组合均能产生荧光(图6),说明RZFP34、4HTR、BMIPD、GTP1与OsMYB57在植物细胞中相互作用。
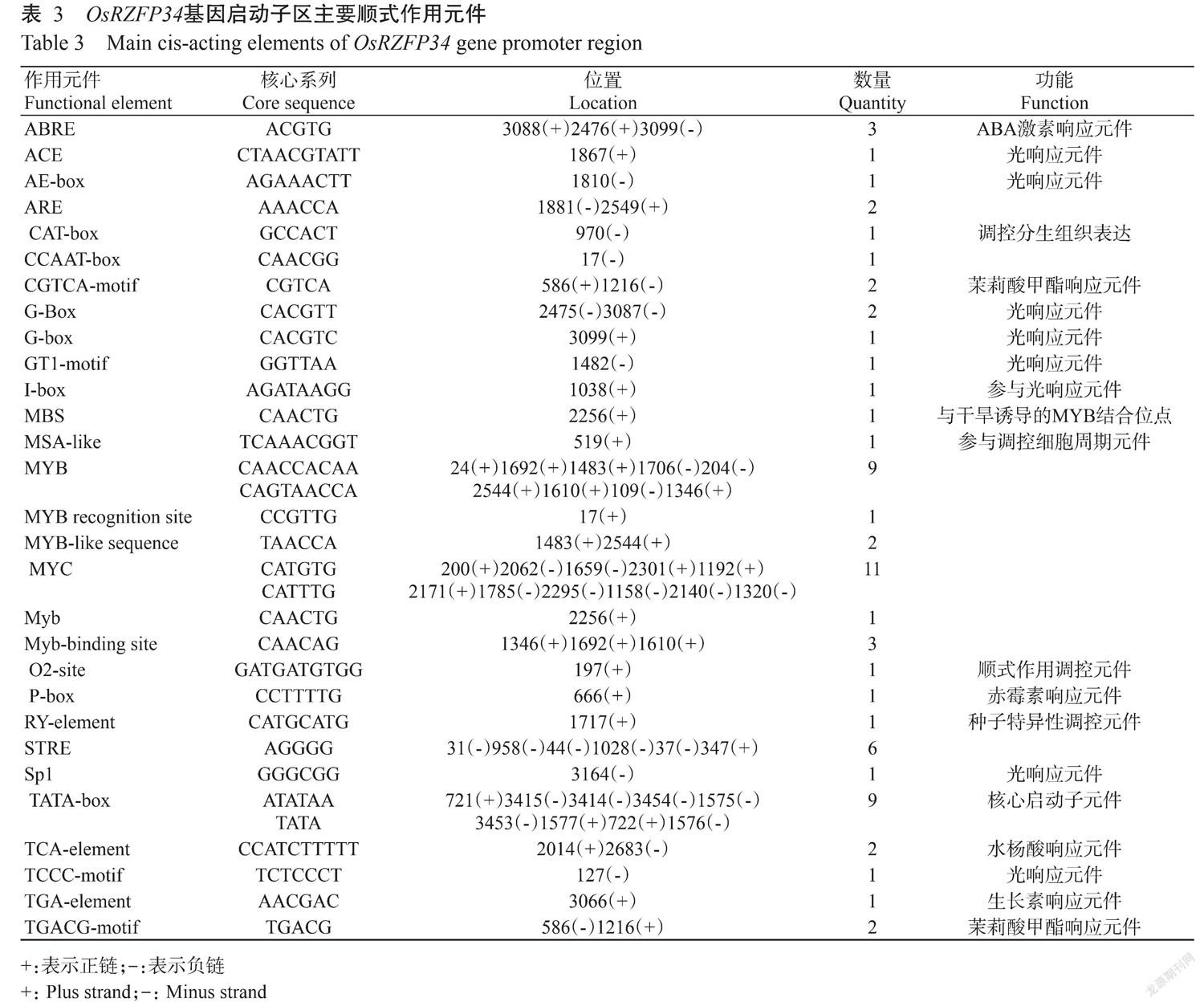
2. 7 RZFP34生物信息学分析
通过PlantCARE在线网站分析RZFP34基因启动子区域3553 bp序列,发现该基因启动子区包含许多参与激素响应、光响应及逆境胁迫相关的顺式作用元件(表3)。这些元件主要包括9个光响应元件(ACE、AE-box、G-Box、G-box、GT1-motif、I-box、Sp1和TCCC-motif),2个与水杨酸响应相关的元件(TCA-element),4个与茉莉酸甲酯响应相关的元件(CGTCA-motif、TGACG-motif),3个与ABA激素响应相关的元件(ABRE),1个与赤霉素响应相关的元件(P-box),1个与生长素响应相关的元件(TGA-element),1个参与调控分生组织表达的元件(CAT-box)和1个与干旱诱导的MYB结合位点(MBS),9个(MYB)、1个(MYB recognition site)、1个(Myb)、11个(MYC)及3个(Myb-binding site)等与转录因子结合相关或转录调控表达相关的顺式作用元件。
3 讨论
近年来,利用作物化感控制稻田杂草的方法因符合农业可持续和生态友好理念而备受关注(Jabran et al.,2015),化感作用通过化感物质发挥作用,化感水稻可通过调控自身次生代谢关键基因的表达,合成重要化感物质酚酸类化合物,从而抑制稗草的生长(Fang et al.,2013)。MYB家族中R2R3型转录因子参与植物的次生代谢相关基因调控,水稻中R2R3型转录因子OsMYB57正向调控稗草胁迫应答(Fang et al.,2020),但OsMYB57的化感抑草網络调控机制仍有待研究,基于此构建了水稻受稗草胁迫不同时间段的酵母cDNA文库,文库质量评估结果表明,其优异的库容量达到孙一丁等(2021)构建的受稻瘟病诱导后不同时间段的含抗性基因Pid2水稻材料的cDNA文库质量水平,为后续酵母文库的筛选提供了保障。酵母双杂交(Y2H)、双分子荧光互补(BIFC)、免疫共沉淀(Co-IP)、Pull-down、蛋白质芯片技术(Protein chip)和邻近生物素识别技术(BioID)等是目前植物蛋白互作的主要研究方法(张恒等,2020),其中酵母双杂交技术以其快速、直接、灵敏的优点将蛋白间微弱的瞬时作用描述出来,从而研究蛋白互作网络及挖掘植物新蛋白的功能(王丽梅和魏传垠,2001;马海蓉和李维琪,2003)。但酵母双杂交的高灵敏度可能导致筛选出的互作蛋白成假阳性,因此还需结合BiFC和pull-down等蛋白互作研究方法对互作蛋白进行验证。
利用酵母双杂交技术筛选出4个有注释的与OsMYB57互作的蛋白,在4個蛋白中,4HTR参与了生物合成和新陈代谢过程,在胞质细胞合成中起催化作用;DapB是中二胺肟酸途径的一种重要酶,是开发新抗生素的潜在靶点(Pote et al.,2018)。BMIPD参与生物合成及新陈代谢过程,在细胞合成中起催化及水解作用;MASA是一种普遍存在的蛋氨酸合成途径中的双功能酶,催化2,3-二酮-5-甲基硫代-1-磷酸戊烷连续反应生成还原型代谢产物(Wang et al.,2005)。GTP1为HR病变诱导家族蛋白,可调节胞质分裂和细胞分化(Wang et al.,2018)。RZFP34是一种E3泛素亚型连接酶,含有环指和CHY锌指结构域,RZFP34在拟南芥中的同源蛋白AtRZFP34可通过SnRK 2.6介导的磷酸化和自身泛素化促进ABA诱导的气孔关闭、产生活性氧并增强拟南芥抗旱性(Ding et al.,2017)。环锌指蛋白基因多受逆境胁迫诱导表达,在白菜中低温、盐和ABA诱导BrRZFP1的表达,BrRZFP1过表达提高了白菜对低温、盐和脱水胁迫的耐受力(Jung et al.,2013)。有研究发现,在水稻中高温胁迫和ABA处理均能诱导OsRZFP34的表达,OsRZFP34过表达通过增大高温胁迫下水稻气孔的张度来降低叶片温度(Hsu et al.,2014)。生物信息学对OsRZFP34分析表明,启动子上具有许多与激素水杨酸、茉莉酸、生长素、赤霉素和其他逆境响应及MYB类转录因子结合位点等相关元件,因此该基因可能参与了植物响应逆境胁迫的信号转导机制。由于水稻化感抗(耐)性与水杨酸和茉莉酸信号途径密切相关(刘亚洲等,2019),推测OsRZFP34可能通过与OsMYB57的相互作用,利用泛素化机制对OsMYB57蛋白进行翻译后修饰,以此影响水稻的化感抗(耐)机制,后期将从泛素化对OsMYB57的降解作用方面进行验证,并利用反向遗传学探究OsRZFP34参与水稻化感的调控作用,以期为研究水稻化感抗(耐)稗草的机制提供依据,也为遗传修饰改良水稻化感性状提供更多的选择。
4 结论
经筛库获得的OsMYB57互作蛋白RZPF34是一种E3泛素亚型连接酶,其参与植物激素应答、非生物逆境胁迫响应及气孔调节等过程,在水稻OsRZPF34基因的启动子中存在与水稻化感作用相关的茉莉酸及水杨酸激素信号转导相关的顺式作用元件,可为RZPF34与OsMYB57互作机制的研究提供新思路。
参考文献:
陈志杰,吴嘉琪,马燕,王沛,顾振新,杨润强. 2018. 植物食品原料中酚酸的生物合成与调控及其生物活性研究进展[J]. 食品科学,39(7):321-328. [Chen Z J,Wu J Q,Ma Y,Wang P,Gu Z X,Yang R Q. 2018. Biosynthesis,metabolic regulation and bioactivity of phenolic acids in plant food materials[J]. Food Science,39(7):321-328.] doi:10.7506/spkx1002-6630-201807047.
高媛,马帅,代敏,王蒙,冯晓元. 2018. 果蔬酚酸生物合成及代谢调控研究进展[J]. 食品科学,39(9):286-293. [Gao Y,Ma S,Dai M,Wang M,Feng X Y. 2018. Progress in research on the biosynthesis pathway and metabolic regulation of phenolic acids[J]. Food Science,39(9):286-293.] doi:10.7506/spkx1002-6630-201809043.
郭玉峰,邓之亮. 2018. 水稻田除草剂的应用及杂草抗药性现状[J]. 农家参谋,(4):78-79. [Guo Y F,Deng Z L. 2018. Application of herbicide in rice field and current situation of weed resistance[J]. The Farmers Consultant,(4):78-79.]
郭怡卿. 2017. 水稻化感从现象、化合物到相关调控基因[C]//中国第八届植物化感作用学术研讨会论文摘要集. 北京:中国植物保护学会植物化感作用专业委员会:35. [Guo Y Q. 2017. Rice allelopathy from phenomena,compounds to related regulatory genes[C]//Abstracts of the 8th Symposium on Allelopathy of Plants in China.Beijing:Allelopathy Committee of Chinese Society for Plant Protection:35.]
孔垂华. 2018. 作物化感品种对农田杂草的调控[J]. 植物保护学报,45(5):961-970. [Kong C H. 2018. Allelopathic crop cultivars for weed management in cropping systems[J]. Journal of Plant Protection,45(5):961-970.] doi:10.13802/j.cnki.zwbhxb.2018.2018926.
李家玉,李立,冯常青,张清旭,张伟彬,何海斌. 2021. 稻/稗共培抑草圈法结合主成分—聚类分析法筛选化感潜力水稻品种[J]. 应用与环境生物学报,27(6):1509-1515. [Li J Y,Li L,Feng C Q,Zhang Q X,Zhang W B,He H B. 2021. Screening allelopathic rice cultivar by inhibitory-circle method in combination with principal component and cluster analysis[J]. Chinese Journal of Applied and Environmental Biology,27(6):1509-1515.] doi:10. 19675/j.cnki.1006-687x.2020.07063.
刘亚洲,张翠,孙一丁,杨奕,李铷,卢红,郭怡卿. 2019. 水楊酸和茉莉酸诱导水稻化感关键基因C4H的表达分析[J].西南农业学报,32(9):1967-1972. [Liu Y Z,Zhang C,Sun Y D,Yang Y,Li R,Lu H,Guo Y Q. 2019. Expression of key gene C4H in allelopathic rice treated by salicylic acid and jasmonic acid[J]. Journal of Southwest Agricultural University,32(9):1967-1972.] doi:10.16213/j.cnki.scjas.2019.9.001.
马海蓉,李维琪. 2003. 酵母双杂交衍生系统[J]. 中国生物工程杂志,23(2):37-41. [Ma H R,Li W Q. 2003. Yeast two-hybrid derived system[J]. Chinese Journal of Bioengineering,23(2):37-41.] doi:10.13523/j.cb.20030208.
孙一丁,杨奕,刘畅媛,马继琼,许明辉. 2021. 水稻酵母双杂交文库构建及PID2胞内结构域互作蛋白的筛选[J/OL]. 分子植物育种:1-14. [2021-02-01] [Sun Y D,Yang Y,Liu C Y,Ma J Q,Xu M H. 2021. Construction a yeast two hybrid library of rice and the validation of a PID2-intracellular domain interaction protein[J]. Molecular Plant Breeding:1-14.] https://kns.cnki.net/kcms/detail/46.1068.S.20210129.1653.024.html.
佟瑶,义珊池,黄梦鸽,刘书宇,韦晨阳,唐文伟. 2021. 广西热区晚稻田稗草种类及其分布特点[J]. 南方农业学报,52(1):95-103. [Tong Y,Yi S C,Huang M G,Liu S Y,Wei C Y,Tang W W. 2021. Distribution characteristics of Echinocloa species in late rice fields in tropical areas of Guangxi[J]. Journal of Southern Agriculture,52(1):95-103.] doi:10.3969/j.issn.2095-1191.2021.01.012.
王丽梅,魏传垠. 2001. 酵母双杂交技术及其在分子生物学中的应用[J]. 医学研究通讯,30(10):28-30. [Wang L M,Wei C Y. 2001. Yeast two-hybrid technology and its application in molecular biology[J]. Journal of Medical Research,30(10):28-30.] doi:10.3969/j.issn.1673-548X. 2001.10.015.
王玉,杨雪,杨蕊菁,王玉霞,杨飞霞,夏鹏飞,赵磊. 2019. 调控苯丙烷类生物合成的MYB类转录因子研究进展[J]. 安徽农业大学学报,46(5):859-864. [Wang Y,Yang X,Yang R J,Wang Y X,Yang F X,Xia P F,Zhao L. 2019. Advance in research of MYB transcription factors in regu-lating phenylpropanoid biosynthesis[J]. Journal of Anhui Agricultural University,46(5):859-864.] doi:10. 13610/j.cnki.1672-352x.20191122.018.
杨小燕. 2017. 田间抑草圈法筛选化感水稻品种[D]. 福州:福建农林大学. [Yang X Y. 2017. Screening allelopathic rice varieties by the inhibit method in field test[D]. Fuzhou:Fujian Agriculture and Forestry University.] doi:10.27018/d.cnki.gfjnu.2017.000115.
曾嘉丽,欧阳林娟,刘家林,贺浩华,朱昌兰,彭小松,贺晓鹏,傅军如,陈小荣,边建民,徐杰,孙晓棠,周大虎,胡丽芳. 2018. 水稻PAL基因的全基因组分析及胁迫表达研究[J]. 基因组学与应用生物学,37(9):3881-3888. [Zeng J L,Ouyang L J,Liu J L,He H H,Zhu C L,Peng X S,He X P,Fu J R,Chen X R,Bian J M,Xu J,Sun X T,Zhou D H,Hu L F. 2018. Whole genome analysis and stress expression research of PAL gene in rice[J]. Geno-mics and Applied Biology,37(9):3881-3888.] doi:10. 13417/j.gab.037.003881.
张恒,陈怡名,张旭,牛影,赵佳,吴承云,郝永利,孙丽,王海燕,肖进,王秀娥. 2020. 白粉菌诱导蔟毛麦叶片酵母双杂交文库构建及CMPG1-V互作蛋白筛选[J]. 南京农业大学学报,43(4):594-604. [Zhang H,Chen Y M,Zhang X,Niu Y,Zhao J,Wu C Y,Hao Y L,Sun L,Wang H Y,Xiao J,Wang X E. 2020. Construction of yeast two-hybrid cDNA library of Haynaldia villosa leaves induced by Blumeria graminis f.sp. tritici and candidate interaction protein screening for CMPG1-V[J]. Journal of Nanjing Agricultural University,43(4):594-604.] doi:10.7685/ jnau.202001036.
张小云,张新虎,沈慧敏,张君霞. 2018. 节裂角茴香的化感作用及化感物质释放途径研究[J]. 甘肃农业大学学报,53(5):69-78. [Zhang X Y,Zhang X H,Shen H M,Zhang J X. 2018. Study on allelopathy and allelochemicals release route of Hypecoum leptocarpum[J]. Journal of Gansu Agricultural University,53(5):69-78. ] doi:10.13432/j.cnki.jgsau.2018.05.010.
赵新梅,陈延智,刘京,杨水平,王军,张东艳,莫静静,何大敏,张雪. 2019. 玄参、川明参枯落物水浸液对烤烟的化感效应[J]. 西南大学学报(自然科学版),41(5):30-36. [Zhao X M,Chen Y Z,Liu J,Yang S P,Wang J,Zhang D Y,Mo J J,He D M,Zhang X. 2019. Allelopathic effects of leaf-stem litter aqueous extracts of Scrophularia ningpoensis and Chuanminshen violaceum on tobacco growth[J]. Journal of Southwest University(Natural Science),41(5):30-36.] doi:10.13718/j.cnki.xdzk.2019.05.005.
赵英. 2019. 丹参SmMYB36基因对萜类和苯丙烷代谢途径调控的研究[D]. 杨凌:西北农林科技大学. [Zhao Y. 2019. Terpeneoids and phenylpropanoids metabolic regulation by SmMYB36 in Salvia miltiorrhiza Bunge[D]. Yangling:Northwest A & F University.]
Ding K,Pei T L,Bai Z Q,Jia Y Y,Ma P D,Liang Z S. 2017. SmMYB36,a novel R2R3-MYB transcription factor,enhances tanshinone accumulation and decreases phenolic acid content in Salvia miltiorrhiza hairy roots[J]. Scientific Reports,7:5104. doi:10.1038/s41598-017-04909-w.
Fang C X,Yang L K,Chen W S,Li L L,Zhang P L,Li Y Z,He H B,Lin W X. 2020. MYB57 transcriptionally regulates MAPK11 to interact with PAL2;3 and modulate rice allelopathy[J]. Journal of Experimental Botany,71(6):2127-2141. doi:10.1093/jxb/erz540.
Fang C X,Zhuang Y E,Xu T C,Li Y Z,Li Y,Lin W X. 2013. Changes in rice allelopathy and rhizosphere microflora by inhibiting rice phenylalanine ammonia-lyase gene expression[J]. Journal of Chemical Ecology,39(2):204-212. doi:10.1007/s10886-013-0249-4.
Hsu K H,Liu C C,Wu S J,Kuo Y Y,Lu C A,Wu C R,Lian P J,Hong C Y,Ke Y T,Huang J H,Ye C H. 2014. Expression of a gene encoding a rice RING zinc-finger protein,OsRZFP34,enhances stomata opening[J]. Plant Molecular Biology,86(1-2):125-137. doi:10.1007/s11103- 014-0217-6.
Jabran K,Mahajan G,Sardana V,Chauhan B S. 2015. Allelopathy for weed control in agricultural systems[J]. Crop Protection,72:57-65. doi:10.1016/j.cropro.2015.03.004.
Jung Y J,Lee I H,Nou I S,Lee K D,Rashotte A M,Kang K K. 2013. BrRZFP1 a Brassica rapa C3HC4-type RING zinc finger protein involved in cold,salt and dehydration stress[J].Plant Biology,15(2):274-283. doi:10.1111/j.1438-8677.2012.00631.x.
Pote S,Pye S E,Sheahan T E,Gawlicka-Chruszcz A,Majorek K A,Chruszcz M. 2018. 4-Hydroxy-tetrahydrodipicolinate reductase from Neisseria gonorrhoeae-structure and interactions with coenzymes and substrate analog[J]. Biochemical and Biophysical Research Communications,503(3):1993-1999. doi:10.1016/j.bbrc.2018.07.147.
Tang N,Cao Z Y,Yang C,Ran D S,Wu P,Gao H M,He N,Liu G H,Chen Z X. 2021. A R2R3-MYB transcriptional activator LmMYB15 regulates chlorogenic acid biosynthesis and phenylpropanoid metabolism in Lonicera macranthoides[J]. Plant Science,308:110924. doi:10.1016/j.plantsci.2021.110924.
Wang C J,Wang W X,Liu Y J,Min Y,Yang Y M,Zhou H G. 2018. Rac GTPase activating protein 1 promotes oncogenic progression of epithelial ovarian cancer[J]. Cancer Science,109(1):84-93. doi:10.1111/cas.13434.
Wang H,Pang H,Ding Y,Li Y,Wu X,Rao Z H. 2005. Purification,crystallization and preliminary X-ray diffraction analysis of human enolase-phosphatase E1[J]. Acta Crystallographica Section F:Structural Biology and Crystallization Communications,61(5):521-523. doi:10.1107/S174430910501184X.
(責任编辑 麻小燕)

