低温下废铁屑对厌氧氨氧化系统的影响
李天皓,徐云翔,郭之晗,黄子川,刘文如,2*,沈耀良,2
低温下废铁屑对厌氧氨氧化系统的影响
李天皓1,徐云翔1,郭之晗1,黄子川1,刘文如1,2*,沈耀良1,2
(1.苏州科技大学环境科学与工程学院,江苏 苏州 215009;2.江苏省环境科学与工程重点实验室,江苏 苏州 215009)
考察了在低温条件下(<20°C)废铁屑及其投加方式对厌氧氨氧化反应器脱氮性能和微生物群落的影响.结果表明,当废铁屑投加量为10g/L时,直接(R2)和间接(R3)投加方式均会对厌氧氨氧化反应造成短期抑制,总氮去除率分别降低4.7%和3.4%;30d连续运行后,2组反应器总氮去除率均提升至70%左右;反应器稳定运行阶段,R2的R(NO2--N与NH4+-N去除量之比)和R(NO3--N生成量与NH4+-N去除量之比)为1.57和0.22, R3的R和R为1.49和0.23,比R2更接近厌氧氨氧化反应理论值.废铁屑在水中发生腐蚀,降低DO并提高pH值,且R2,R3污泥中铁含量分别为对照组的1.64倍和1.93倍,废铁屑不仅改善了厌氧氨氧菌的生境,还满足了其对铁元素的需求.高通量测序结果显示,在20~50d的运行过程中, R1,R2,R3中优势厌氧氨氧化菌属的相对丰度分别增加-1.05%,0.14%和0.96%,废铁屑的投加促进了厌氧氨氧化菌在低温下的生长,且间接投加促进效果更为显著.
厌氧氨氧化;低温;废铁屑;投加方式;脱氮性能
与传统生物脱氮工艺相比,厌氧氨氧化工艺在运行过程中无需投加有机碳源,无需曝气,大大节省了运行成本[1-2].而厌氧氨氧化菌的最适温度范围为30~40℃,在工业生产中很难满足其温度需求,厌氧氨氧化菌在低温下的低生长速率和长倍增时间,限制了厌氧氨氧化工艺的实际应用[3].
铁作为参与厌氧氨氧化菌生长和代谢过程的一种必需元素,与其电子传递息息相关[4-5].有研究表明,在厌氧氨氧化反应器中投加含铁物质可以提高厌氧氨氧化菌活性,缩短厌氧氨氧化启动时间.Esra Erdim等[6]发现在投加nZVI后运行310d的SBR反应器中,厌氧氨氧化菌群占总菌群的比例达到91%~92%.Guo等[7]在厌氧氨氧化反应器中投加100mg/L的mZVI后,厌氧氨氧化启动时间从96d缩短到87d.这些研究都基于厌氧氨氧化菌在其最适温度下生长,而含铁物质的促进效果在低温下是否依然成立却鲜少研究.
本文首次研究了低温条件下废铁屑及其投加方式对厌氧氨氧化反应器脱氮性能的影响,同时利用高通量测序技术分析污泥中微生物群落结构的变化情况.旨在为低温条件下铁屑强化厌氧氨氧化工艺提供理论基础.
1 材料与方法
1.1 实验装置与运行条件
本文采用3个SBR反应器如图1所示.反应器均由有机玻璃制作,有效容积为1.0L.SBR反应器由于其间歇排水的特性,对污泥具有良好的截留能力,可以有效避免厌氧氨氧化菌的流失[8].R1作为对照组,不投加废铁屑图1(a),R2,R3作为实验组,R2将废铁屑直接投加于反应器内图1(b),使其与污泥直接接触,R3将废铁屑投加于反应器之前串联的一个血清瓶中图1(c),使其与污泥间接接触. 废铁屑的活化处理方法参考文献[9].

图1 实验装置示意
1.2 接种污泥和模拟废水
接种污泥取自连续搅拌(CSTR)厌氧氨氧化反应器,该反应器已稳定运行1年以上,具有较高的厌氧氨氧化活性.
模拟废水主要含有NH4+-N和NO2--N以满足厌氧氨氧化菌的生长需求,NH4+-N和NO2--N分别由NH4Cl和Na2NO2提供,浓度按需配制.NaHCO31000mg/L,KH2PO440mg/L, MgSO4·7H2O 100mg/L,微量元素I和微量元素II 1.0mL/L.微量元素I的成分:FeSO4·7H2O 5000mg/L,EDTA 5000mg/L;微量元素II的成分:ZnSO4·7H2O 430mg/L,CoCl2·6H2O 240mg/L,MnCl2·4H2O 990mg/L,CuSO4·5H2O 250mg/ L,NaMoO4·2H2O 220mg/L,NiCl2·6H2O 190mg/L, NaSeO4·10H2O 210mg/L,H3BO414mg/L,EDTA 15000mg/L.模拟废水pH值调节在7.0~7.5.每次更换模拟废水前先用氮气吹脱,以保证反应体系在整个实验过程中处于厌氧状态.
1.3 分析及测试方法
水质指标测定方法均按照《水和废水监测分析方法》[10].NH4+-N采用纳氏试剂分光光度法,NO2--N采用N-1-萘基乙二胺分光光度法,NO3--N采用紫外分光光度法,pH值采用便携式pH计测定,DO采用哈希便携式溶解氧测定仪(HQ30d)测定.污泥中铁含量采用火焰原子吸收光谱法,污泥中铁价态采用XPS光谱分析表征.扫描电镜观察前,废铁屑的预处理方法参考文献[11].
1.4 微生物分析
本文委托上海美吉生物医药科技有限公司(上海,中国)进行微生物高通量测序及种群分析,利用细菌16S rRNA基因的V3-V4区通用引物 338F/806R,对上述步骤中提取的总DNA进行PCR扩增和纯化,然后在Illumina测序平台进行MiSeq PE 300高通量测序,得到的原始图像数据文件经碱基识别分析转化为原始测序序列.然后对各样本数据的质量进行质控过滤,得到各样本有效数据,之后再进行OTU聚类分析和物种分类学分析.相关图表采用Origin 2021和R语言进行绘制.
2 结果与讨论
2.1 不同投加方式对反应器脱氮效能的影响
3个反应器温度及出水氮素浓度变化如图2所示.为避免反应器运行初期高浓度的NO2--N对微生物产生毒害作用[12],前10d内进水NH4+-N和NO2--N浓度分别维持在50和60mg/L左右,并且整个实验过程中只通过增加进水NH4+-N和NO2--N浓度提高反应器运行负荷.
接种初期测得3个反应器出水NH4+-N浓度持续升高,这主要由于进水中未含有有机物,部分异养微生物因缺乏碳源发生细胞自溶,释放出了少量的NH4+-N[13].第12d开始,3个反应器中出水NO2--N浓度接近0,且测得出水中开始有NO3--N的积累,这可能是因为接种污泥中残存的反硝化菌以微生物死亡释放的有机物为底物进行反硝化作用,去除了部分NO2--N[14].这一时期,3个反应器总氮去除率的提高是硝化菌,反硝化菌与厌氧氨氧化菌共同作用的结果.
在10d~20d内,出水NH4+-N和NO2--N浓度开始同步下降,并且出水NO3--N的积累量也保持稳定.第20d时3个反应器的脱氮效能趋于稳定,以不同投加方式向反应器中投加经预处理的废铁屑,投加量为10g/L.投加废铁屑后R2出水NH4+-N和NO2--N浓度迅速上升,总氮去除率比对照组R1降低15.2%; R3出水氮素浓度未观察到明显变化.第24d时, R2出水NH4+-N,NO2--N浓度分别为44.43和34.25mg/ L,R3出水NH4+-N,NO2--N的浓度分别为25.83和20.69mg/L,R2,R3的总氮去除率分别降低至32.7%和52.1%.从第32d开始,R2出水氮素浓度开始下降,然而并不能恢复至原有水平,观察到反应器内污泥表观上的红色也逐渐褪去.与之对应的是R3的脱氮性能进一步提升,出水NH4+-N和NO2--N浓度明显低于对照组,这可能是由于R3反应器中厌氧氨氧化菌逐渐适应了环境,表现出较好的厌氧氨氧化活性.
38d时环境温度骤降,3个反应器均出现了严重失稳现象,表现在出水NH4+-N和NO2--N浓度急剧升高.R2总氮去除率下降最为明显,最低降至13.8%, R3总氮去除率则下降至29.8%,略优于对照组R1的28.9%,R2抗冲击能力明显较差.一方面与反应器内厌氧氨氧化菌含量有关,另一方面长期直接接触废铁屑可能会影响厌氧氨氧化菌的活性.温度是影响厌氧氨氧化反应的关键因素,特别是在环境温度低于15°C时,厌氧氨氧化活性会显著降低[15],低温下厌氧氨氧化脱氮系统对铁的需求量也不同.然而低温对厌氧氨氧化菌的抑制是可逆的,随着环境温度的升高,污泥活性逐渐恢复,3个反应器脱氮效能逐渐提高.
区别于已有研究[6,16-18],向厌氧氨氧化反应器中投加铁基材料如废铁屑短期内不但未对厌氧氨氧化菌的活性有提升作用,反而抑制了其厌氧氨氧化活性,且废铁屑直接接触污泥产生的抑制作用明显强于间接接触.废铁屑在水中能够缓慢而持久地释放铁离子,而低温下厌氧氨氧化菌对铁离子的需求发生变化[19],当铁离子的生成量大于微生物的吸收量时,反应器内出现铁离子大量累积.过量的铁离子会富集在菌种表面及内部,对微生物产生毒害作用,导致细胞不能正常的进行生长代谢,最终导致系统的脱氮性能下降[20].经过30d的连续运行,R3的氮去除效果逐步提升并优于未投加废铁屑的对照组,间接投加的废铁屑在长期运行中表现出对厌氧氨氧化菌活性提升的促进效果,这与Wang等[17]的研究成果相类似.

2.2 不同投加方式对化学计量比的影响
化学计量比是衡量厌氧氨氧化反应的一个重要参数,通常用于判断是否发生厌氧氨氧化反应[21].由式1可知,R(NO2--N与NH4+-N去除量之比)和R(NO3--N生成量与NH4+-N去除量之比)分别为1.32和0.26.一般来说当实验所得化学计量比接近1:1.32:0.26时,反应器中即发生厌氧氨氧化反应.
NH4++1.32NO2-+0.066HCO3-+0.13H+→
1.02N2+0.26NO3-+0.066CH2O0.5N0.15+2.03H2O (1)
接种初期由于反应器中发生细胞自溶现象和反硝化作用[22],R和R与理论值相差较大,R2,R3中R甚至超过2.经过20d的培养驯化后,厌氧氨氧化菌活性开始提升,3个反应器中R和R均开始接近理论值.投加的废铁屑在水中会氧化产生铁离子,生成的铁离子可能会作为电子供体或电子受体被微生物利用,参与到系统的脱氮过程中[23],因此导致了R2, R3中R的波动.此外张蕾等[24]研究发现在系统中添加过量的Fe2+后,厌氧氨氧化反应消耗的NH4+-N多于理论值,这也会导致R的波动.值的注意的是,从第31d开始,R2的R严重偏离理论值,结合其脱氮过程,这段时间内R2的出水NH4+-N浓度持续增加,可能的原因是环境温度的大幅降低严重影响了厌氧氨氧化菌的活性.与此同时R1,R3中的厌氧氨氧化菌趋于成熟,R比较稳定,与理论值接近,这可能由于厌氧氨氧化菌适应了环境从而得到富集,厌氧氨氧化反应已成为系统的主导地位[25].
R1,R2,R3的平均化学计量比在整个实验期间分别为1:1.39:0.24,1:1.57:0.22和1:1.49:0.23,均接近理论比1:1.32:0.26,表明反应器中厌氧氨氧化反应占主导地位[26].投加废铁屑后,由于厌氧氨氧化菌和其他脱氮功能菌的协同作用使得R2和R3的R增大,同时电解产生的铁离子参与反硝化过程还原NO2--N或NO3--N,使得R略低于理论值[27].
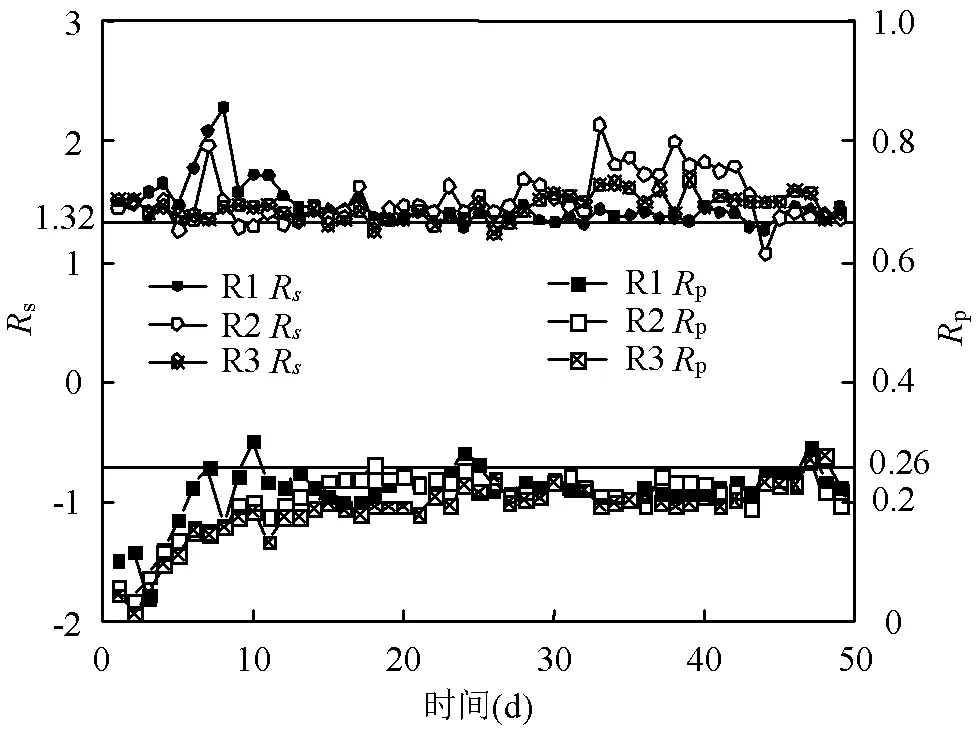
图3 厌氧氨氧化化学计量比变化
2.3 不同投加方式对反应器中DO,pH值的影响
投加的废铁屑可能会影响反应器中DO和pH值的变化,他们是影响微生物活性的重要因素.
整个实验过程中3个反应器中的DO变化如图4所示.R2,R3中的DO均低于对照组R1,这主要是由于废铁屑腐蚀会消耗水中的溶解氧.R2,R3的溶解氧维持在0.2~0.3mg/L,而R1的溶解氧则超过0.3mg/L.在较高的DO水平下,不仅厌氧氨氧化菌的活性会受到抑制,而且亚硝酸盐氧化菌(NOB)会与厌氧氨氧化菌竞争底物,导致厌氧氨氧化菌脱氮效能的下降.因此,在系统中投加适量的废铁屑可以消耗随进水带入的O2,维持厌氧氨氧化菌所需的厌氧环境.

图4 反应器中DO和pH值变化
图4显示了3个反应器在整个实验过程中的pH值的变化情况.根据厌氧氨氧化反应方程式(1),厌氧氨氧化反应是一个消耗酸的过程,反应器中H+不断消耗导致pH值的增加,因此反应器出水pH值理论上应该高于进水pH值,这与实验结果相一致.前13d内3个反应器中厌氧氨氧化反应不占主导地位,pH值不稳定且波动.废铁屑投加进反应器后在水中发生氧化,如式(2)和(3),产生少量OH-释放到水体,R2, R3中的pH值增加至8.0左右,明显高于对照组R1,并在随后的20d内始终维持在高水平.厌氧氨氧化反应的最适pH值范围为7.8~8.1,高pH值条件下反应器中游离氨浓度的增加会抑制厌氧氨氧化菌的活性[28],这为R2脱氮性能的下降提供了解释.第38d开始,R2,R3的pH值开始下降,并逐渐接近对照组R1,推测是由于废铁屑在水中氧化生成的氧化铁逐渐覆盖在表面,阻碍了废铁屑的进一步氧化.此推测在废铁屑的结构变化部分得到进一步证实.
Fe0+2H2O→H2+Fe2++2OH(2)
2.82Fe0+NO3-+0.75Fe2++2.25H2O→
NH4++1.19Fe3O4+0.5OH-(3)
2.4 污泥中铁含量和废铁屑的结构变化
实验结束后取各反应器中污泥测定铁含量,R1, R2,R3分别测得37.97,62.50和73.26mg/L.由于进水中含有微量元素FeSO4·7H2O,因此在对照组R1中也检测出有铁.R2,R3中污泥内铁元素含量明显高于对照组,分别为对照组的1.64倍和1.93倍,这表明废铁屑在水中释放出的铁离子被厌氧氨氧化菌吸收利用.厌氧氨氧化菌在很大程度上依赖含铁的蛋白质来保存能量,厌氧氨氧化菌富集培养物的鲜红色正反映了这种高含量的血红素铁[29].R3中污泥内铁含量较大的原因可能是由于厌氧氨氧化菌活性较高,表现出对铁元素较大的需求量.
废铁屑在投加到反应器前如图5(a)所示,颜色呈黑褐色,片状结构.实验结束后取出R2反应器内剩余的废铁屑,发现部分废铁屑表面覆盖着一层污泥,如图5(b)所示.与投加到反应器之前相比,外观发生较大的变化,表面颜色由之前的黑褐色转变为红色且质地疏松,这可能是由于废铁屑在反应器内发生氧化反应所致.

图5 反应前后废铁屑照片
为进一步观察废铁屑的结构变化,对反应前后的废铁屑进行扫描电镜分析.如图6(a)所示,投加进反应器前的废铁屑成片状,其表面不光滑且存在许多沟壑状纹路.这大幅增加了废铁屑的比表面积,这些沟壑有利于微生物附着在上面.图6(b)为实验结束后从R2中取出的废铁屑,可以清晰观察到大量球状菌附着在铁屑表面及沟壑处,如图6(c).还可以发现球状菌之间相互聚集连接紧密,这可能是由于面对低温及高浓度铁离子的恶劣环境,菌种产生了更多的EPS以保护自身免受外界环境的影响.从图中还可以看到有许多板形的次生矿物,推测是反应生成的氧化物,这些氧化物的形成可能会阻碍废铁屑释放铁离子.

图6 反应前后废铁屑SEM照片
为进一步分析废铁屑对污泥的影响,使用XPS光谱对R1,R2,R3反应器厌氧氨氧化污泥进行分析,结果见表1、图7.

表1 污泥样品中铁元素的结合能和原子数分数
图7(a)为3个反应器中污泥样品的全谱扫描,可以清晰地看到微生物组成的C1s,O1s以及Fe2p的峰位置,证实了R1,R2和R3反应器的污泥均存在铁元素.图7(b)(c)(d)分别为3个反应器中污泥样品的Fe 2p高分辨光谱,可以看到在R1,R2,R3污泥样品中,位于711.1~712.1eV处有较为明显的特征峰,这说明被厌氧氨氧化菌代谢利用的铁离子大多数为三价[30].除此之外,可以较为明显地观察到实验组R2,R3的峰面积大于对照组R1,说明R1中铁元素含量较少,这也表明了在投加废铁屑后,反应器中的厌氧氨氧化菌吸收利用了其电解生成的铁离子. 低温下厌氧氨氧化污泥对铁元素表现出更大的需求量[31],可以通过投加铁基材料如废铁屑进行补充.其原理仍基于零价铁腐蚀的作用过程,所以不同的投加方式不会影响厌氧氨氧化菌对铁元素的代谢利用.

Fig7 XPS spectra of the anammox sludge
2.5 不同投加方式微生物群落组成的影响
对反应器内第20d和第50d的污泥样品进行高通量测序分析,将微生物检测相对丰度>1%的菌门作为主要菌门,运行过程中微生物门水平组成如图8所示.
6组微生物群落中共发现11个主要菌门,分别为绿弯菌门,变形菌门,拟杆菌门,放线菌门,酸杆菌门,浮霉菌门, Patescibacteria,硝化螺旋菌门, Myxococcota,芽单孢菌门,Firmicutes.姚芳等[32]在膨胀污泥颗粒床反应器中分别接种不同来源的污泥启动厌氧氨氧化工艺,其高通量测序结果表明绿弯菌门,变形菌门和拟杆菌门均为反应器中的优势菌门,结果与本文一致.绿弯菌门广泛存在于厌氧氨氧化系统中,是一种兼性厌氧微生物,有助于建立一个严格的厌氧环境,闫冰等[33]在厌氧氨氧化反应器中也发现了相对丰度较大的绿弯菌门.Kindaichi等[34]发现绿弯菌门可以分解利用死亡的厌氧氨氧化细菌,它们的丝状结构还有利于生物膜的形成,可见绿弯菌门在厌氧氨氧化系统中发挥着重要作用.3个反应器中绿弯菌门的相对丰度随运行时间有所下降,可能是由于反应器避光放置导致光照不足.一般而言,与氮素转化相关的功能菌所属菌群主要为变形菌门和拟杆菌门[35],它们的相对丰度在整个运行过程中有较为明显的提高,而脱氮功能菌的变化导致了3个反应器间氮素去除的差异.厌氧氨氧化菌是一类细菌,均属于浮霉菌门.3个反应器20d时浮霉菌门的相对丰度均较小,分别为6.46%,4.06%和4.63%,主要是由于在接种污泥中该门所占比例较小且厌氧氨氧化菌增殖速度较慢.反应器连续运行50d后,R1中浮霉菌门丰度降低至4.90%,下降了24.1%;R2中浮霉菌门丰度上升至4.43%,增加了9.1%;R3中浮霉菌门丰度上升至6.19%,增加了33.7%.厌氧氨氧化菌在低温环境下活性受到抑制,生长速度缓慢,导致了R1中浮霉菌门相对丰度的减少,而投加废铁屑的R2,R3中浮霉菌门丰度均得到不同程度的提高,因此可以认为投加铁基材料如废铁屑可以促进厌氧氨氧化菌的富集[36].而两种投加方式相比,间接投加方式的促进效果更为明显.

图8 污泥样品中门水平优势菌分布

图9 污泥中属水平优势菌分布
将微生物检测相对丰度>1%的菌属作为主要分析对象,运行过程中优势菌属水平分布如图9所示.反应器中厌氧氨氧化菌主要菌属为,其相对丰度占了浮霉菌门的50%以上.运行50d后,R1中相对丰度由3.55%下降至2.50%,R2由2.25%上升至2.39%,R3由3.04%上升至4.00%.废铁屑的加入在一定程度上提高了在菌群中的相对丰度,低温条件下间接投加组的促进效果优于直接投加组.同时,在R2和R3中可以观察到有较为明显的增长.有研究[37]指出可以帮助厌氧氨氧化菌免受外界恶劣环境的干扰,保护厌氧氨氧化菌的活性,由此推测投加的废铁屑导致了相对丰度的提高.此外亚硝酸盐氧化细菌如,反硝化菌如等脱氮功能菌的相对丰度也有不同程度的增加.由此可见,投加的废铁屑可以改善厌氧氨氧化的生境,促进脱氮功能菌的生长,改变微生物群落中种群相对丰度,但始终没有改变作为厌氧氨氧化菌的优势功能菌属.
3 结论
3.1 低温(<20℃)条件下,当废铁屑投加量为10g/L时,直接和间接投加方式均会对厌氧氨氧化菌造成短期抑制;30d连续运行后,间接投加方式对厌氧氨氧化脱氮性能表现出促进作用,与对照组相比, NH4+-N和总氮去除率分别提高10.1%和4.0%.
3.2 废铁屑在水中电解,调节系统DO和pH值,改善了厌氧氨氧菌的生境;同时,释放铁离子,为厌氧氨氧化菌提供铁元素.
3.3为优势厌氧氨氧化菌属,废铁屑的投加促进了厌氧氨氧化菌的生长,其中间接投加促进效果更为显著,未投加,直接和间接投加废铁屑的反应器中的相对丰度分别增加-1.05%,0.14%和0.96%.
[1] Kuenen J G. Anammox bacteria: from discovery to application [J]. Nature Reviews Microbiology, 2008,6(4):320-326.
[2] Ali M, Okabe S. Anammox-based technologies for nitrogen removal: Advances in process start-up and remaining issues [J]. Chemosphere, 2015,141:144-153.
[3] Strous M, Kuenen J, Jetten M. Key Physiology of Anaerobic Ammonium Oxidation [J]. Applied and environmental microbiology, 1999,65(7):3248-3250.
[4] Laura V, Willie J, Elly G, et al. Combined structural and chemical analysis of the anammoxosome: A membrane-bounded intracytoplasmic compartment in anammox bacteria [J]. Journal of Structural Biology, 2008,161(3):401-410.
[5] Ferousi C, Lindhoud S, Baymann F, et al. Iron assimilation and utilization in anaerobic ammonium oxidizing bacteria [J]. Current opinion in chemical biology, 2017,37:129-136.
[6] Erdim E, Yucesoy Ozkan Z, Kurt H, et al. Overcoming challenges in mainstream Anammox applications: Utilization of nanoscale zero valent iron (nZVI) [J]. Science of the Total Environment, 2018,651(Pt 2):3023-3033.
[7] Guo B, Chen Y, Lv L, et al. Transformation of the zero valent iron dosage effect on anammox after long-term culture: From inhibition to promotion [J]. Process Biochemistry, 2019,78:132-139.
[8] 曹天昊,王淑莹,苗 蕾,等.不同基质浓度下SBR进水方式对厌氧氨氧化的影响[J]. 中国环境科学, 2015,35(8):2334-2341.
Cao T H, Wang S M, Miao L, et al. Influence of feeding modes on anammox under different influent substrate concentration in SBR [J]. China environmental science, 2015,35(8):2334-2341.
[9] Xie F, Ma X, Zhao B, et al. Promoting the nitrogen removal of anammox process by Fe-C micro-electrolysis [J]. Bioresource Technology, 2020,297(C):122429-122438.
[10] 国家环境保护局.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002:258-282.
[11] 汪 倩,宋家俊,郭之晗,等.低基质浓度下生物膜亚硝化工艺的快速启动及其运行效能[J]. 环境工程学报, 2021,15(7):2512-2521.
Wang Q, Song J J, Guo Z H, et al. Fast start-up of nitrosation biofilm process and its performance with low strength sewage [J]. Chinese Journal of Environmental Engineering, 2021,15(7):2512-2521.
[12] 袁 砚,周 正,林 兴,等.氨氮对厌氧氨氧化过程的抑制规律及调控策略[J]. 中国环境科学, 2017,37(9):3309-3314.
Yuan Y, Zhou Z, Lin X, et al. Inhibiting regularity and control strategy of NH4+-N on ANAMMOX Process. [J]. China environmental science, 2017,37(9):3309-3314.
[13] Tang C J, Ping Z, Mahmood Q, et al. Start-up and inhibition analysis of the Anammox process seeded with anaerobic granular sludge [J]. Journal of Industrial Microbiology & Biotechnology, 2009,36(8): 1093-1100.
[14] Kartal B, Rattray J, Niftrik L, et al. Candidatus "Anammoxoglobus propionicus" a new propionate oxidizing species of anaerobic ammonium oxidizing bacteria [J]. Systematic and Applied Microbiology, 2007,30(1):39-49.
[15] 宋成康,王亚宜,韩海成,等.温度降低对厌氧氨氧化脱氮效能及污泥胞外聚合物的影响[J]. 中国环境科学, 2016,36(7):2006-2013.
Song C K, Wang Y Y, Han H C, et al. Effect of decreasing temperature on the performance and extracellular polymer substance of anaerobic ammonia oxidation sludge [J]. China environmental science, 2016, 36(7):2006-2013.
[16] Gao F, Zhang H, Yang F, et al. The effects of zero-valent iron (ZVI) and ferroferric oxide (Fe3O4) on anammox activity and granulation in anaerobic continuously stirred tank reactors (CSTR) [J]. Process Biochemistry, 2014,49(11):1970-1978.
[17] Wang H, Peng L, Mao N, et al. Effects of Fe3+ on microbial communities shifts, functional genes expression and nitrogen transformation during the start-up of Anammox process [J]. Bioresource Technology, 2021,320(PA):124326-124335.
[18] Feng L, Li J, Ma H, et al. Effect of Fe(II) on simultaneous marine anammox and Feammox treating nitrogen-laden saline wastewater under low temperature: Enhanced performance and kinetics [J]. Desalination, 2020,478(C):114287-114295.
[19] Ma Y, Zheng X, He S, et al. Nitrification, denitrification and anammox process coupled to iron redox in wetlands for domestic wastewater treatment [J]. Journal of Cleaner Production, 2021,300(10):126953- 126964.
[20] Zhang Z, Xu J, Shi Z, et al. Unraveling the impact of nanoscale zero-valent iron on the nitrogen removal performance and microbial community of anammox sludge [J]. Bioresource Technology, 2017,243: 883-892.
[21] Chen H, Hu H, Chen Q, et al. Successful start-up of the anammox process: Influence of the seeding strategy on performance and granule properties [J]. Bioresource Technology, 2016,211:594-602.
[22] Zekker I, Rikmann E, Tenno T, et al. Nitritating-anammox biomass tolerant to high dissolved oxygen concentration and C/N ratio in treatment of yeast factory wastewater [J]. Environmental technology, 2014,35(9-12):1565-1576.
[23] 吕 冉,李 彬,肖 盈,等.铁对废水微生物脱氮的影响研究进展[J]. 化工进展, 2020,39(2):709-719.
Lv R, Li B, Xiao Y, et al. Research progress on the effects of iron on microbiological nitrogen removal in wastewater [J]. Chemical Industry and Engineering Progress, 2020,39(2):709-719.
[24] 张 蕾,郑 平,胡安辉.铁离子对厌氧氨氧化反应器性能的影响[J]. 环境科学学报, 2009,29(8):1629-1634.
Zhang L, Zheng P, Hu A H, et al. Effect of ferrous ion on the performance of ananammox reactor [J]. Journal of Environmental Sciences, 2009,29(8):1629-1634.
[25] Ren L, Liang S, Ngo H, et al. Enhancement of anammox performance in a novel non-woven fabric membrane bioreactor (nMBR) [J]. RSC Advances, 2015,5(106):86875-86884.
[26] 张泽文,李 冬,张 杰,等.接种单一/混合污泥对厌氧氨氧化反应器快速启动的影响[J]. 环境科学, 2017,38(12):5215-5221.
Zhang Z W, Li D, Zhang J, et al. Effect of Seeding Single/Mixed Sludge on Rapid Start-up of an ANAMMOX Reactor [J]. Environmental science, 2017,38(12):5215-5221.
[27] 雷 欣,闫 荣,慕玉洁,等.铁元素对厌氧氨氧化菌脱氮效能的影响[J]. 化工进展, 2021,40(5):2730-2738.
Lei X, Yan R, Mu Y J, et al. Effect of iron on nitrogen removal efficiency of anaerobic ammonium oxidation bacteria [J]. Chemical Industry and Engineering Progress, 2021,40(5):2730-2738.
[28] Chen H, Ma C, Ji Y, et al. Evaluation of the efficacy and regulation measures of the anammox process under salty conditions [J]. Separation & Purification Technology, 2014,132:584-592.
[29] Miethke M. Molecular strategies of microbial iron assimilation: from high-affinity complexes to cofactor assembly systems [J]. Metallomics : integrated biometal science, 2013,5(1):15-28.
[30] Toru Y, Peter H. Analysis of XPS spectra of Fe2+and Fe3+ions in oxide materials [J]. Applied Surface Science, 2007,254(8):2441-2449.
[31] Li J, Feng L, Basanta K, et al. Bioaugmentation of marine anammox bacteria (MAB)-based anaerobic ammonia oxidation by adding Fe(III) in saline wastewater treatment under low temperature [J]. Bioresource Technology, 2020,295(C):122292-122306.
[32] 姚 芳,刘 波,王德朋,等.不同接种污泥的厌氧氨氧化反应器启动特性及菌群结构演替规律分析[J]. 环境科学学报, 2017,37(7): 2543-2551.
Yao F, Liu B, Wang D P, et al. Start-up of ANAMMOX enrichment with different inoculated sludge and analysis of microbial community structure shift [J]. Journal of Environmental Sciences, 2017,37(7): 2543-2551.
[33] 闫 冰,夏 嵩,桂双林,等.厌氧氨氧化菌富集培养过程微生物群落结构及多样性[J]. 环境科学, 2020,41(12):5535-5543.
Yan B, Xia S, Gui S L, et al. Microbial Community Structure and Diversity During the Enrichment of Anaerobic Ammonium Oxidation Bacteria [J]. Environmental Science, 2020,41(12):5535-5543.
[34] Kindaichi T, Yuri S, Ozkai N, et al. Ecophysiological role and function of uncultured Chloroflexi in an anammox reactor [J]. Water science and technology : a journal of the International Association on Water Pollution Research, 2012, 66(12) : 2556-2561.
[35] [35] Luo J, Liang H, Yan L, et al. Microbial community structures in a closed raw water distribution system biofilm as revealed by 454-pyrosequencing analysis and the effect of microbial biofilm communities on raw water quality [J]. Bioresource Technology, 2013,148(11):189-195.
[36] 王海月,彭 玲,毛念佳,等.三价铁对有机物存在下厌氧氨氧化脱氮的影响[J]. 中国环境科学, 2021,41(4):1672-1680.
Wang H Y, Peng L, Mao N J, et al. Effect of Fe3+ on nitrogen removal of Anammox in the presence of organic matter [J]. China environmental science, 2021,41(4):1672-1680.
[37] Wang C, Liu S, Xu X, et al. Achieving mainstream nitrogen removal through simultaneous partial nitrification, anammox and denitrification process in an integrated fixed film activated sludge reactor [J]. Chemosphere, 2018,203:457-466.
Effect of iron scraps on anammox systems at low temperature.
LI Tian-hao1, XU Yun-xiang1, GUQ Zhi-han1, HUANG Zi-chuan1, LIU Wen-ru1,2*, SHEN Yao-liang1,2
(1.School of Environmental Science and Engineering, Suzhou University of Science and Technology, Suzhou 215009, China;2.Jiangsu Provincial Key Laboratory of Environmental Science and Engineering, Suzhou 215009, China)., 2022,42(4):1688~1695
The effects of iron scraps addition and its dosing methods on the nitrogen removal performance and microbial community of anaerobic ammonia oxidation(anammox)reactors were investigated at low temperature (<20°C). The results showed that when the dosage of iron scraps was 10g/L, both the direct (R2) and indirect (R3) dosing methods caused short-term inhibition of anammox bacteria. Consequently, the total nitrogen removal effieiency reduced by 4.7% and 3.4%, respectively. The total nitrogen removal effieiency of the control group (R1), R2 and R3 all reached to about 70% after 30 days of continuous operation. During the stable operation,R(the ratio of NO2--N removal to NH4+-N removal) andR(the ratio of NO3--N generation to NH4+-N removal) of R2 were 1.57 and 0.22,RandRof R3 were 1.49 and 0.23, which were closer to the theoretical value of anammox than R2. The decrease of DO concentration and the increase of pH was observed likely due to the corrosion of iron scraps in the water. The iron concentration of sludge in R2 and R3 was 1.64 times and 1.93 times higher than that of in control reactor. These results suggested that the iron scraps addition not only improved the living habitats, but also supplyed iron for anammox bacteria. High-throughput sequencing results showed that during the 20~50days operation, the relative abundance of the dominant anammox bacteriain R1, R2, and R3 increased by -1.05%, 0.14%, and 0.96%, respectively. This indicated that the addition of iron scraps promoted the growth of anammox bacteria at low temperature, while the enhancment was more obvious with the indirect addition of iron scraps.
anaerobic ammonia oxidation(anammox);low temperature;iron scraps;dosing methods;nitrogen removal performance
X703
A
1000-6923(2022)04-1688-08
李天皓(1997-),男,江苏南通人,硕士研究生,研究方向为水污染控制工程.发表论文1篇.
2021-09-03
国家自然科学基金资助项目(51808367);城市生活污水资源化利用技术国家地方联合工程实验室开放课题资助项目(2018KF05);江苏省研究生创新计划资助项目(KYCX20_2778)
*责任作者, 副教授, liuwenru1987@126.com

