橙皮苷抑制LPS诱导的肠上皮细胞炎性损伤及其机制研究
钟 佳 , 卞艺斐 , 刘 萍 , 周期律 , 钟 沅 , 刘钟杰
(1. 山西农业大学动物医学学院 , 山西 太谷 032699 ; 2.山东中医药大学中医药创新研究院 , 山东 济南 250355 ;3.浙江农林大学动物科技学院·动物医学院 , 浙江 临安 311300 ; 4.中国农业大学动物医学院 , 北京 海淀 100193)
橙皮苷(Hesperidin,HSD)是一种广泛来源于柑橘类水果的黄酮类化合物,具有抗炎、抗应激、抗氧化、降脂和胰岛素增敏等特性,有利于治疗神经、精神和心血管等疾病[1]。研究发现,橙皮苷可改善试验性结肠炎大鼠肠道吸收功能,缓解肠道炎症,恢复上皮屏障完整性[2]。肠上皮参与调节病原菌诱导的黏膜免疫反应,维持黏膜组织的稳态[3]。在炎症状态下,肠上皮细胞核转录因子NF-κB被激活,触发炎性细胞因子、趋化因子的产生,从而导致多种信号通路启动,并调控炎症基因表达的转录和转录后事件,参与炎症反应,引起细胞损伤。本研究应用脂多糖(Lipopolysaccharide,LPS)诱导大鼠小肠隐窝上皮细胞(IEC-6)炎性损伤模型,探究橙皮苷对肠上皮细胞炎性损伤的保护作用及其作用机制。
1 材料与方法
1.1 药品 橙皮苷标准品(B20182,HPLC≥98%),购自上海源叶生物科技有限公司。
1.2 主要试剂 IEC-6细胞株,购自中国医学科学院基础医学研究所细胞资源中心;高糖DMEM、胎牛血清、胰蛋白酶,均购自Biological Industries公司;LPS(L2630),购自Sigma公司;CCK8试剂盒(CK04),购自东仁化学科技公司;乳酸脱氢酶(Lactate dehydrogenase,LDH)细胞毒性检测试剂盒(C0017),购自上海碧云天生物技术有限公司;大鼠肿瘤坏死因子(TNF-α)ELISA试剂盒(438204),购自BioLegend公司;NLRP3、Caspase-1、IL-1β、p-NF-κB p65、NF-κB p65、p-IκB和IκB大鼠单克隆抗体,均购自Abcam公司。
1.3 主要仪器 CO2培养箱(日本Sanyo公司);酶标仪(Thermo Scientific公司);高速离心机(美国Scilogex公司);蛋白电泳仪、电泳槽(BIO-RAD公司);化学发光成像仪(上海勤翔科学仪器有限公司)。
1.4 试验方法
1.4.1 IEC-6细胞培养 参照文献[4]所述方法培养IEC-6细胞。
1.4.2 CCK-8试验筛选橙皮苷作用浓度 IEC-6细胞以1×104个/孔接入96孔细胞培养板中,待细胞长至70%~80%融合状态,用含不同浓度橙皮苷(0~80 μmol/L)的培养基替换原培养基,培养24 h后吸弃药液,加入含10% CCK-8的DMEM培养基100 μL,37 ℃避光培养2 h,450 nm波长检测吸光度。
1.4.3 LDH试验检测IEC-6细胞膜完整性 按照1.4.2所示方法接种IEC-6细胞并用含不同浓度的橙皮苷培养基预处理细胞24 h,吸弃培养基,加入100 μL含40 μg/mL LPS的培养基,培养12 h后收集细胞上清,参照LDH检测试剂盒说明书检测LDH释放量。
1.4.4 细胞划痕试验检测上皮细胞细胞迁移能力 IEC-6细胞以106个/孔接种到6孔板中,当细胞增长至70%时,培养基置换为含或不含20 μmol/L橙皮苷的培养基,预处理细胞24 h后,使用200 μL的枪头,垂直于培养板划出3条直线。PBS缓冲液清洗细胞碎片2~3次后,分别加入含或不含40 μg/mL LPS的培养基,并在刺激0、12 h和24 h时使用倒置显微镜观察各组细胞的迁移变化,每个孔选择6个固定位点进行拍照。
1.4.5 细胞TNF-α分泌量的测定 细胞以106个/孔接种到6孔板,并培养至细胞达到90%单层融合状态。用橙皮苷(10 μmol/L和20 μmol/L)预处理细胞24 h,后清除培养基,加入100 μL含10 μg/mL LPS的培养基继续培养12 h,收集细胞上清,根据大鼠ELISA试剂盒说明书进行炎性因子TNF-α分泌水平的测定。
1.4.6 Western blot检测NLRP3、Caspase1、IL-1β、p-NF-κB p65、NF-κB p65、p-IκB、IκB蛋白的相对表达 经1.4.5步骤处理后,贴壁细胞用冷PBS洗2次,加入RIPA细胞裂解液裂解20 min,提取总蛋白,BCA法测定蛋白浓度。各组取蛋白质20 μg/孔,通过10%的SDS-PAGE,半干转膜法转移至PVDF膜,用5%脱脂牛奶封闭2 h,一抗4 ℃孵育过夜。TBST缓冲液清洗3次,加入二抗继续孵育1 h,ECL显色液显影。
1.4.7 数据处理 IBM SPSS 17.0软件对试验结果进行分析处理。试验数据以平均值±标准误(Mean±SEM)表示,单因素方差分析(One-way ANOVA)检验试验组间差异性。P<0.05 为差异有统计学意义。
2 结果
2.1 橙皮苷对IEC-6细胞活性的影响 由图1可知,与空白对照组相比,5~80 μmol/L橙皮苷作用组IEC-6细胞活性无明显变化(P>0.05)。选择5、10、20、40 μmol/L和60 μmol/L橙皮苷作用浓度用于后续试验。

图1 橙皮苷对IEC-6细胞存活率的影响Fig.1 Effect of hesperidin on IEC-6 viability
2.2 橙皮苷对LPS诱导IEC-6细胞损伤的影响 由图2可知,与空白对照组(不加LPS和HSD)相比,40 μg/mL LPS作用IEC-6细胞12 h(模型对照组)显著增加了细胞LDH释放率(P<0.05)。而橙皮苷(5~60 μmol/L)预处理24 h显著抑制了LPS诱导的LDH释放率增加(P<0.05)。

图2 橙皮苷对LPS诱导IEC-6细胞LDH释放率的影响Fig.2 Effect of hesperidin on LDH release rate in IEC-6 induced by LPS*:与空白对照组比较,P<0.05; #:与模型对照组比较,P<0.05;下图同*:Compared with control group,P<0.05; #:Compared with LPS group, P<0.05. The same as below
2.3 橙皮苷对LPS诱导IEC-6细胞迁移的影响 由图3可知,与空白对照组相比,40 μg/mL LPS作用IEC-6细胞24 h显著抑制了细胞划痕愈合率(P<0.05),而20 μmol/L橙皮苷预处理24 h显著逆转了LPS对IEC-6细胞划痕愈合的抑制作用(P<0.05)。此外,LPS刺激细胞12 h并未引起IEC-6细胞划痕愈合率的显著变化(P>0.05)。

图3 橙皮苷对LPS诱导IEC-6细胞划痕愈合率的影响Fig.3 Effect of hesperidin on wound closure in IEC-6 induced by LPSA:IEC-6细胞在LPS刺激12 h和24 h时细胞迁移情况(20×); B:划痕愈合率A:Migration of IEC-6 cells stimulated by LPS for 12 h and 24 h (20×); B:Scratch healing rate
2.4 橙皮苷对LPS诱导炎性因子TNF-α分泌的影响 由图4可知,与空白对照组相比,10 μg/mL LPS刺激IEC-6细胞12 h引起TNF-α分泌水平的升高(P<0.05),而橙皮苷(10 μmol/L和20 μmol/L)预处理24 h抑制了LPS诱导的这种变化(P<0.05)。
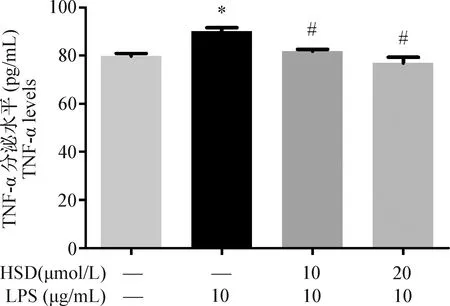
图4 橙皮苷对LPS诱导IEC-6细胞TNF-α分泌的影响Fig.4 Effect of hesperidin on release of TNF-α in IEC-6 induced by LPS
2.5 橙皮苷对NLRP3通路蛋白表达水平的影响 由图5可知,与空白对照组相比,10 μg/mL LPS诱导pro-Caspase-1和Caspase-1的蛋白表达量,且Caspase-1/pro-Caspase-1比值显著升高(P<0.05)。与模型对照组相比,橙皮苷(10 μmol/L和20 μmol/L)预处理24 h显著降低pro-Caspase-1 和Caspase-1(p10)蛋白表达水平及Caspase-1/pro-Caspase-1比值(P<0.05)。10 μg/mL LPS在存在或不存在橙皮苷(10 μmol/L和20 μmol/L)预处理下均未引起NLRP3和IL-1β的蛋白表达量显著改变(P>0.05)。
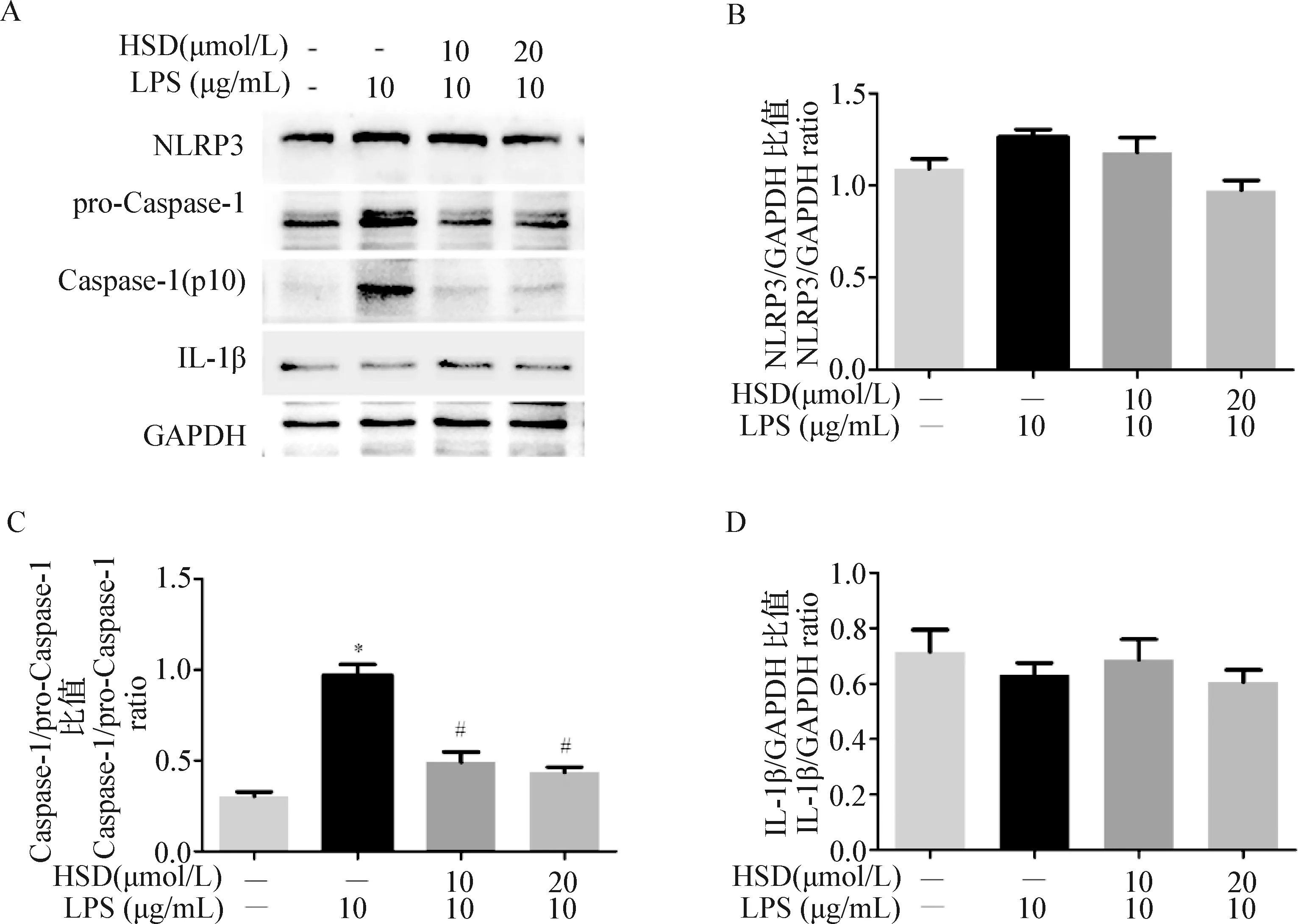
图5 橙皮苷对LPS诱导IEC-6细胞NLRP3,pro-Caspase-1,Caspase-1和 IL-1β蛋白表达水平的影响Fig.5 Effect of hesperidin on NLRP3,pro-Caspase-1,Caspase-1 and IL-1β protein expression in IEC-6 induced by LPS
2.6 橙皮苷对NF-κB通路蛋白表达水平的影响 由图6可知,与空白对照组相比,10 μg/mL LPS诱导p-IκB/ IκB比值显著降低(P<0.05)。与模型对照组相比,橙皮苷(20 μmol/L)预处理24 h显著增加了p-IκB/ IκB比值(P<0.05)。10 μg/mL LPS在存在或不存在橙皮苷(10 μg/mL、20 μmol/L)预处理下均未引起p-NF-κB p65和NF-κB p65的蛋白表达量显著改变(P>0.05)。

图6 橙皮苷对LPS诱导IEC-6细胞p-NF-κB p65、NF-κB p65、p-IκB和 IκB蛋白表达水平的影响Fig.6 Effect of hesperidin on p-NF-κB p65、NF-κB p65、p-IκB and IκB protein expression in IEC-6 induced by LPS
3 讨论
黄酮类化合物作为一类植物源性膳食化合物,因其强大的抗氧化和抗炎作用而备受关注[5]。肠道炎作为危害牲畜健康和生产性能的重要疾病,严重影响畜牧业的发展。研究表明,橙皮苷通过其抗氧化和抗炎作用发挥保护肠道的作用[6]。体内试验发现,橙皮苷能够保护肠上皮细胞的存活,恢复上皮屏障的完整性[7]。然而,橙皮苷对LPS诱导的肠上皮细胞炎性损伤的作用及其作用机制还未有相关报道。本研究利用LPS刺激大鼠小肠隐窝上皮细胞(IEC-6)建立体外上皮细胞炎性损伤模型,从肠上皮炎性损伤层面评估了橙皮苷在肠源细菌性疾病进程中的作用。
肠道上皮损伤与肠道病原体和细菌性毒素引起的许多疾病的发病机制有关[8]。本研究结果发现,橙皮苷抑制高浓度LPS诱导的IEC-6细胞的LDH释放率增加,反映了橙皮苷能够维持肠上皮细胞细胞膜的完整性。另外,橙皮苷显著逆转了LPS对IEC-6细胞迁移能力的抑制作用,这在一定程度上说明橙皮苷有增强肠上皮单层损伤愈合的能力。
在细菌感染过程中,模式识别受体(Pattern recognition receptor,PRRs)识别相应病原相关分子模式(Pathogen-associated molecular pattern,PAMP)并启动固有免疫,通过降解IκB介导NF-κB信号通路激活,启动IL-1β和TNF-α等炎性因子转录,诱发细胞炎性损伤。研究表明,活化的NF-κB可诱导细胞炎性小体形成[9]。NLRP3 炎性小体是目前研究最广泛的炎性小体,当NLRP3 活化后,与ASC 发生相互作用,招募Caspase-1 前体蛋白,并诱导自我催化,形成p20和p10亚基,进而形成具有活性的Caspase-1,成熟的Caspase-1能够活化IL-1β和IL-18,进而诱发级联放大炎性反应,直接影响上皮细胞的活性与功能。研究表明,NF-κB和炎性小体在维持肠上皮屏障功能中发挥重要的作用[10]。本研究检测了LPS作用下IEC-6细胞炎症相关核转录因子NF-κB及炎性小体通路蛋白的表达,结果发现,橙皮苷显著抑制了LPS诱导的Caspase-1和IκB的激活,进而抑制了炎性因子TNF-α的分泌增加。
在肠道炎症反应中,上皮细胞以其独特的定位,被视作是肠道免疫的主要参与者,LPS等多种细菌致病产物直接作用于肠上皮细胞,广泛激活黏膜免疫应答,加速免疫介导的肠道炎症的发生和发展。本研究证明了橙皮苷可以通过调控NF-κB和炎性小体通路蛋白的表达以抑制LPS诱导的肠上皮细胞炎性损伤,为橙皮苷等黄酮类化合物在肠源性疾病中的运用提供理论支持。

