锁阳乙酸乙酯提取物对阿尔茨海默病小鼠肠道菌群紊乱的调节作用*
李鑫洁,陈建新,鲁艺
北京中医药大学,北京 100029
锁阳为锁阳科植物锁阳(CynomoriumsongaricumRupr.)的干燥肉质茎[1],主要分布于我国西北部荒漠地域,素有“沙漠人参”之称[2]。在中医临床中,锁阳常用于治疗肾阳虚引起的阳痿、不孕、腰膝酸软及肠燥津枯引起的大便干燥等[3]。基于天然中草药具有多成分、多功效、不良反应小等特点,现代研究者对锁阳进行了大量研究,以求在各个领域发挥最大的利用价值。中医认为,阿尔茨海默病的发病机理是肾精不足、脑髓渐空,临床上常选用补肾益精中药来治疗与阿尔茨海默病相似的症状,如记忆力减退,理解能力降低、情绪低落等。研究表明,中药锁阳的乙酸乙酯提取物可有效改善小鼠的学习和记忆障碍[4],提高氧化损伤模型SK-N-SH人神经母细胞瘤细胞的存活率[5],具有体外神经细胞保护作用。
阿尔茨海默病(Alzheimer disease,AD)不仅严重影响病人自主活动、自理能力,给身边亲属带来精神和心理压力[6]。目前,关于阿尔茨海默病的发病假说有很多,如Aβ蛋白沉积、Tau蛋白异常等,但并没有开发出效果甚佳的药物。随着肠道微生物组学研究的迅速发展,有学者提出“微生物-脑-肠轴”假说,认为AD的治疗也可以从肠道菌群方向开展[7]。研究表明,肠道菌群失调在AD的发生发展中发挥着一定的作用,调节肠道菌群可以减少Aβ蛋白沉积、降低Tau蛋白过度磷酸化、减轻炎症反应等方式改善AD的症状[8-9]。如由于益生菌的不断减少,机体抵抗力下降,炎症反应加剧,神经细胞将不能进行正常的生理活动而凋亡,从而引发AD[10]。因此,本课题以AD转基因模型小鼠为研究对象,基于肠道菌群丰度与多样性的变化,探讨锁阳乙酸乙酯提取物(ethyl acetate extract of cynomorium songaricum,ECS)对AD模型小鼠肠道菌群紊乱的调节作用。
1 材料
1.1 动物8周龄雄性SPF级5xFAD阿尔茨海默病转基因小鼠16只,体质量20~30 g,购买于上海虔碧生物科技有限公司,生产许可证号:SCXK(苏)2018-0006。使用PCR及电泳技术检测小鼠的基因组DNA,鉴定小鼠为5xFAD阿尔茨海默病转基因小鼠。8周龄雄性SPF级C57BL/6小鼠8只,体质量20~30 g,购买于北京维通利华实验动物有限公司,生产许可证号SCXK(沪)2017-0011。所有小鼠单笼饲养,自由摄食和饮水,并按照动物中心饲养标准饲养于北京中医药大学SPF级动物房(温度 20~25 ℃,光照和黑暗各12 h),定期观察小鼠生长情况,按时更换垫料、饲料及饮用水,适应性饲养1周后用于实验研究。本实验经北京中医药大学医学与实验动物伦理委员会审查通过,伦理批号:BUCM-4-2019083002-3102。
1.2 药物与试剂锁阳(北京国医堂,产地:内蒙古,货号:701002539)。乙醇(纯度:≥95%)、乙酸乙酯(纯度:≥99%)、石油醚(纯度:≥99%)、生理盐水(北京通广精细化工厂,货号:101057、101028、105119、111541);Illumina Nextera 试剂盒、QIAamp DNA Stool Mini Kit试剂盒(北京奥维森基因科技有限公司,货号:1311001、56104)。
1.3 仪器BSA223S-CW型分析天平(德国赛多利斯股份有限公司);101FAB-2型电热鼓风干燥箱(上海一恒科学仪器有限公司);R-1001型旋转蒸发仪(上海增森仪器科技有限公司);Sigma1-15PK型高速冷冻离心机(德国Sigma公司);KW-MWM 型Morris 水迷宫系统(南京卡尔文生物科技有限公司);BW-YLS-3TB型小鼠跳台记录系统(上海软隆科技发展有限公司);Dura Pro型组合式超纯水系统(美国Millipore公司);Illumina Miseq高通量测序仪(北京德利卡生物技术有限公司)。
2 方法
2.1 药物制备根据实验室前期研究基础,将锁阳饮片用10倍量的70 %乙醇浸泡过夜,超声提取3次,每次1 h,收集提取液,抽滤,加热回流,浓缩直至无醇味。加少量水溶解,石油醚萃取4~5次,收集下层水层。乙酸乙酯萃取收集的水层4~5次,萃取至无色,收集上层有机层,合并萃取液,旋转蒸发仪减压浓缩,干燥,得黄棕色粉末,称重,测得ECS提取率为2.36%。经鉴别,该粉末中杂质<2%,总灰分<12%,符合2015年版《中华人民共和国药典》标准。
2.2 分组与给药适应性饲养1周后,8周龄5xFAD小鼠随机分为模型组和ECS组,以野生型C57BL/6小鼠为对照组,每组8只。ECS组小鼠以20 mL·kg-1的剂量灌胃给予47 mg·kg-1ECS,对照组和模型组分别灌胃等量去离子水,每天1次,连续84 d。
2.3 Morris水迷宫(Morris water maze,MWM)实验直径1.2 m的黑色圆柱形水池注水,使水平面高于站立平台1~2 cm,水温保持在25 ℃左右,加适量牛奶变为乳白色,并将圆柱形水池分为西北(northwest,NW)、东北(northeast,NE)、东南(southeast,SE)、西南(southwest,SW)四个象限,用数字摄像机实时记录小鼠的运动轨迹和时间,并用软件分析。前4天为隐匿平台学习训练,每天4次,随机从不同的象限面朝池壁放入,若小鼠在60 s内找到平台,允许其在平台上休息30 s,记录搜索到平台的时间(即为逃避潜伏期);小鼠在60 s内未找到平台,则由实验者将其引向平台且同样休息30 s。第5天进行空间探索实验,撤去平台,将小鼠从西北象限放入,记录60 s内小鼠穿越原平台次数。
2.4 跳台实验跳台箱为黑色长方形,被黑色隔板划分为5个“小房间”,每个“小房间”中心均为大小统一的白色绝缘体高站台,跳台箱底部为通电流的铜栅。设置电流大小为30 mA,通电时间为300 s,将脚底沾湿的小鼠置于高站台,正常情况下,当小鼠接触到底部铜栅后,会被电击而跳回高站台。小鼠有一定的电击记忆储存时间,所以短期内不会继续下跳。此实验为期2天,第1天为学习阶段,让小鼠具有一定的电击记忆,学习阶段若小鼠未跳下站台则弃去;第2天为测试阶段,记录小鼠第一次跳下绝缘站台的时间(即为跳台潜伏期)及300 s内受到电击的次数(即为错误次数),以此反映小鼠的记忆功能。
2.5 微生物多样性测序及分析
2.5.1 粪便样品的收集实验动物完成所有行为学实验后,禁食不禁水12 h。按4 mL·kg-1的剂量腹腔注射1 %戊巴比妥麻醉小鼠,迅速解剖取出小鼠肠组织,用无菌镊子取出2粒粪便(约200 mg左右),迅速转移至灭菌的冻存管中,于-80 ℃保存备用。获得粪便样本共24个,每组8个。
2.5.2 基因提取及PCR扩增和纯化根据QIAamp DNA Stool Mini Kit试剂盒说明书提取粪便样本中的总DNA,使用1 %琼脂糖凝胶电泳对得到的DNA进行检测并定量。使用通用引物(F:5′-CCTACGGGNGGCWGCAG-3′,R:5′-GACTACHVGGGTATCTAATCC-3′)扩增细菌16S rDNA 的V3~V4区。所有样品上样量为10 ng,每个样本重复检测3次。反应体系:1 μL正向引物,1 μL反向引物,10 μg DNA模板,10 μL HiFi buffer,加超纯水补至20 μL。反应条件:95 ℃反应3 min,95 ℃反应30 s,72 ℃反应30 s,60 ℃反应30 s,循环20次,再72 ℃反应3 min,4 ℃存放24 h后,室温下加入 16 μL 磁珠,5 min后置于磁架上进行分层,弃去上清液。加入200 μL乙醇,室温放置挥发乙醇。加入40 μL水后吹打,静置5 min,置于磁架上分层,取上清液移至离心管中。配制25 μL反应物(1 μL正向引物+1 μL反向引物+2 μg DNA模板+12.5 μL HiFi buffer+超纯水),按上述条件进行再次扩增,4 ℃ 存放24 h后,重复上述PCR纯化步骤,最终将扩增纯化好的PCR存于新的离心管中。
2.5.3 Miseq文库构建及上机测序连接“Y”字形(外悬)接头,使用磁珠筛选去除接头自连片段后,利用PCR扩增进行Miseq文库模板的富集,使用氢氧化钠变性,产生单链DNA片段。DNA片段与引物碱基互补,固定在芯片上,另一端随机与附近的另外一个引物互补,也被固定住,形成“桥”(Bridge),PCR扩增后产生DNA簇,DNA扩增子线性化成为单链后,加入改造过的DNA聚合酶及带有4种荧光标记的dNTP。每次循环只合成一个碱基,用激光扫描反应板表面,读取每条模板序列第一轮反应所聚合上去的核苷酸种类,将“荧光基团”和“终止基团”化学切割,恢复3′端黏性,继续聚合第二个核苷酸,统计每轮收集到的荧光信号结果。
2.5.4 多变量统计分析将相似度大于97 %的有效序列聚合成为一个操作分类单元(operational taxonomic units,OUT),进行物种分类。基于OUT进行Alpha多样性分析(包括稀释曲线、chao1指数、observed species指数、PD whole tree指数及shannon指数分析)及物种分析(包括物种组成分析、属水平进化发生树、物种聚类柱状图及热图分析);基于unifrac进行Beta多样性分析[包括主坐标分析(principal coordinates analysis,PCOA分析)、偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA分析)]等。采用LEfSe分析,找出不同组间在丰度上存在显著性差异的物种。
2.6 统计学方法检测结果均采用SPSS 20软件进行统计学分析处理,多组间比较采用单因素方差分析,继以进行LSD多重比较,P<0.05表示差异具有统计学意义。
3 结果
3.1 MWM实验结果与对照组比较,模型组小鼠逃避潜伏期显著延长(P<0.05),穿越平台次数显著减少(P<0.05);与模型组比较,ECS组小鼠逃避潜伏期显著缩短(P<0.05),穿越平台次数显著增加(P<0.05)。提示,ECS可显著改善AD模型小鼠的空间记忆与学习能力。见图1。

注:A:不同时间各组小鼠逃避潜伏期结果比较;B:各组小鼠穿越平台次数结果比较;与对照组比较,*P<0.05;与模型组比较,#P<0.05
3.2 跳台实验结果与对照组比较,模型组小鼠跳台潜伏期明显缩短(P<0.05),且错误次数显著增加(P<0.05);与模型组比较,ECS组小鼠跳台潜伏期显著延长(P<0.05),且错误次数明显减少(P<0.05);提示,5xFAD小鼠有记忆下降的特征,且ECS可显著改善AD模型小鼠的记忆能力。见图2。

注:A:各组小鼠跳台潜伏期结果比较;B:各组小鼠跳台错误次数结果比较;与对照组比较,*P<0.05;与模型组比较,#P<0.05
3.3 数据质控及OTU分析粪便样本共24个,总共获得有效序列2511096条,所测样本中最高序列条数为276135,最低序列条数为130384。使用 UPARSE聚类法共生成975个OTU,按样本最低序列条数进行抽平处理,得到924个OTU。在OTU水平上对不同样本间的异同进行统计,并通过Venn图展现不同样本之间共有或特有的OTUs。结果显示,对照组OTU 757个,模型组OTU 651个,ECS 组OTU 730个,提示,AD小鼠的菌群多样性降低,给予ECS干预后,小鼠的菌群多样性明显升高;对照组与模型组非共有的OTU 330个,表明,AD小鼠粪便菌群组成发生显著变化;ECS 组与模型组非共有OTU 215个,对照组与ECS组非共有OTU 295个,表明 ECS 可改善5xFAD小鼠粪便菌群多样性。见图3。

注:颜色代表分组;数字表示各组间特有或共有的OTU数目
3.4 Alpha多样性分析
3.4.1 稀释性曲线分析随机抽取样本,计算并作图,其中X轴代表每个样本随机抽取的序列条数,Y轴代表随机抽取序列的OTU数量,当曲线趋向平坦时,说明测序数据量合理。结果表明,每个样本随机抽取的序列条数与OTU数量曲线均趋向于平坦状态,表明各组小鼠粪便样本取样数量合理。见图4。

注:C:对照组;M:模型组;E:ECS
3.4.2 Alpha多样性指数分析Alpha多样性指数分析可以反映一个特定区域环境内的微生物群落丰富度和多样性,observed_species指数反映实际观测到的OTU数目,chao1和PD whole tree 指数用于估算样本OTU总数,这三种指数都反应样本群落真实的物种数量,即群落丰富度;而shannon指数用于估算样品中群落多样性,值越大,则群落多样性越高。chao1与observed species指数结果显示,与对照组比较,模型组群落丰富度显著下降(P<0.05);与模型组比较,ECS组群落丰富度显著上升(P<0.05)。PD whole tree指数和Shannon指数结果显示:各组间微生物的丰富度和多样性均无明显差异(P>0.05)。见图5。

图5 Alpha多样性指数分析
3.5 Beta多样性分析
3.5.1 PCoA与PLS-DA分析对各组样本进行多元化统计分析,研究样本组内或组间群落整体组成的差异性或相似性。结果显示:模型组与对照组明显聚为两类,表明模型组与对照组的微生物物种存在显著差异;ECS组与模型组明显聚为两类,且向正常组靠近,表明给予ECS后,AD小鼠的肠道微生物组成得到明显的改善,趋于恢复正常。见图6。

注:A:PCoA分析图;B:PLS-DA分析图
3.5.2 Hcluster分析聚类分析(hierarchical cluatering,Hcluster)是一种树枝结构,用于阐述和比较样本间微生物进化的相似性和差异性,基于群落组成关系的距离矩阵,运用非加权组平均法(unweighted pair group method with arithmetic mean,UPGMA)进行聚类。结果显示,对照组、模型组和ECS组各组组内样本的微生物进化相似;与对照组比较,5xFAD小鼠肠道菌群结构发生了显著变化,而ECS可以显著改善5xFAD小鼠粪便菌群的整体结构。见图7。

注:C:对照组;M:模型组;E:ECS组
3.6 物种分析
3.6.1 物种组成分析
3.6.1.1 门水平(Phylum)结果显示,OTU主要归至细菌界的7个门,分别是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、Saccharibacteria(TM7)、软壁菌门(Tenericutes)和蓝细菌门(Cyanobacteria),其中厚壁菌门和拟杆菌门所占丰度最高。与对照组比较,模型组拟杆菌门丰度下降,厚壁菌门丰度上升;与模型组比较,ECS组拟杆菌门丰度上升,而厚壁菌门丰度下降;ECS组与对照组细菌门的所占比例相似。见图8-A,图8-B。
3.6.1.2 目水平(Order)结果显示,OTU主要归至10个目,分别是拟杆菌目(Bacteroidales)、梭菌目(Clostridiales)、丹毒丝菌目(Erysipelotrichales)、乳酸菌目(Lactobacillaceae)、弯曲杆菌目(Campylobacterales)、Coriobacteriales目、脱硫弧菌目(Desulfovibrionales)、Gastranaerophilales目、厌氧原体目(Anaeroplasmatales)、双歧杆菌目(Bifidobacteriales),其中丰度排名前四的为拟杆菌目、梭菌目、乳酸菌目及丹毒丝菌目。与对照组比较,模型组小鼠粪便中拟杆菌目、丹毒丝菌目菌群丰度降低,梭菌目菌群丰度升高;给予ECS组后,小鼠粪便中拟杆菌目、丹毒丝菌目菌群丰度升高,梭菌目菌群丰度降低。见图8-C,图8-D。
3.6.1.3 属水平(Genus)结果显示,样本中菌群落组成中丰度前20的菌属分别是:拟杆菌目 S24-7(Bacteroidales_S24-7_group)、乳杆菌属(Lactobacillus)、毛螺菌科NK4A136(Lachnospiraceae_NK4A136_group)、普雷沃氏菌科UCG-001(Prevotellaceae_UCG-001)、Odoribacter、理研菌属(Rikenellaceae)、unclassified_Lachnospiraceae、拟杆菌属(Bacteroides)、瘤胃菌科UCG-014(Ruminococcaceae_UCG-014)、Lachnoclostridium、Alloprevotella、螺杆菌属(Helicobacter)、罗斯氏菌(Roseburia)、Rikenella、毛螺菌属UCG-001(Lachnospiraceae_UCG-001)、肠杆菌属(Enterorhabdus)、Allobaculum、Candidatus_Saccharimona、粪球菌属(Coprococcus)和梭菌属(Anaerotruncus)。与对照组比较,模型组拟杆菌目S24-7及普雷沃氏菌科UCG-001丰度显著下降(P<0.05),而乳杆菌属、毛螺菌科NK4A136丰度显著上升(P<0.05),Odoribacter有上升趋势(P>0.05),瘤胃菌科UCG-014及Alloprevotella丰度有下降趋势(P>0.05);与模型组比较,ECS组瘤胃菌科UCG-014及Alloprevotella丰度有上升趋势(P>0.05),并显著增加杆菌目S24-7及普雷沃氏菌科UCG-001丰度(P<0.05),而对Odoribacter无显著影响。见图8-E,图8-F。

图8 粪便菌群不同分类水平的相对丰度柱状图
3.6.2 Heatmap分析通过聚类分析可将高丰富和低丰度的物种分块聚集,通过颜色相似程度或颜色变化反映样本在不同分类水平上群落结构的相似性和差异性。结果显示:对照组与模型组菌群结构明显不同,给予ECS干预后,ECS组菌群结构明显改善,趋于恢复正常。见图9。

注:C:对照组;M:模型组;E:ECS组
3.7 Anosim分析Anosim相似性分析用来判别分组是否有意义,R值为Anosim的统计量,数值介于-1和1之间,表明组间样品差异与组内样品差异的差值大小。R值越接近1,表明组间样品差异越大,同时组内样品差异越小,分组效果越好;R=0,表明分组之间不具有统计学差异;R值越接近-1,表明组内样品差异超过组间样品差异,样品分组效果较差。结果表明,三个组R值均在(0,1)间,分组有意义。P值反映了Anosim分析结果的统计学显著性,P<0.05,表明各样品分组之间有显著性差异。与对照组比较,模型组有显著性差异(P=0.001),ECS组无显著性差异(P=0.10);与模型组,ECS组有显著性差异(P=0.011)。该结果进一步说明对照组与模型组小鼠菌群存在显著差异,而给予ESC后,小鼠菌群逐渐恢复正常。见表1。
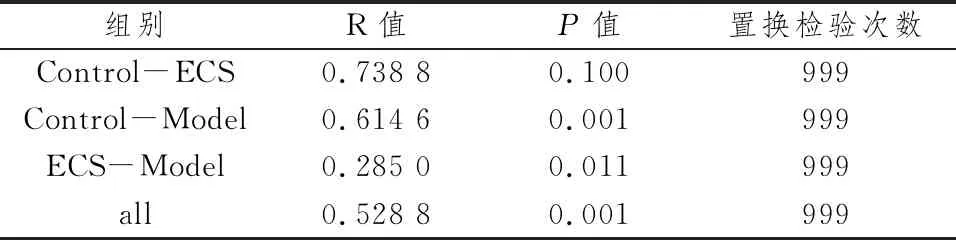
表1 Anosim分析结果
3.8 LEfSe分析LEfSe(LDA Effect Size)分析方法可用于多组(或内部亚组)比较,设定LDA得分值>3找到组间丰富度存在显著差异的物种。结果表明,与对照组比较,模型组的差异性物种主要集中在属水平,分别为罗斯氏菌(Roseburia)、粪球菌-1(Coprococcus_1)、产醋菌属(Acetatifactor);ECS组差异性物种涉及纲、目、科、属四个水平,其中起重要作用的前四个微生物类群分别是:拟杆菌目S24-7(Bacteroidales_S24-7_group)、普雷沃菌属(Prevotella)、Odoribacter属、放线菌门(Actinobacteria);与模型组相比,ECS组差异性物种涉及门、纲、目、科、属五个水平,其中起重要作用的前四个微生物类群分别是:拟杆菌门(Bacteroidetes)、拟杆菌目(Bacteroidales)、普雷沃氏菌科(Prevotellaceac)、普雷沃氏菌科UCG-001(Prevotellaceae_UCG-001)。见图10。

图10 LEfSe分析
4 讨论
研究表明,肠道微生物的多样性和丰富性与“肠-脑轴”引发的退行性疾病密切相关[11-13]。从AD患者体内获得的粪便菌群移植到啮齿类动物身上,会引起AD相关症状,并伴有海马杏仁核和齿状颗粒层的神经化学变化[14-16]。使用恩诺沙星对正常小鼠治疗7天后,小鼠表现出空间记忆缺失等AD相关症状,可能与恩诺沙星诱导微生物组成的改变有关[17]。进一步研究发现,AD疾病与大鼠肠道微生物多样性和丰富度的变化以及促炎性细胞因子的增加有关[18-20]。上述研究表明,肠道菌群的异常可能是AD发病的重要因素之一,从调节肠道菌群的角度治疗AD或改善其症状将成为一种新的策略。中医认为,“肾精不足,脑髓渐空”正是 AD 的发病机理,因此常选用补肾益精之药来治疗与 AD 相似的症状,如记忆力减退,理解能力降低、情绪低落等[21-22]。本研究选用的补肾益精中药锁阳,其主要成分为黄酮类化合物,已被证明具有一定的神经保护作用[23-24]。
目前针对AD并没有较好的造模方法[25-26],本研究选取带有5个家族性突变基因的5xFAD小鼠,从根本上解决其他AD模型小鼠可能会出现的个体差异现象或模型不成功的问题。本研究采用水迷宫检测小鼠的空间定位能力,结果易受视觉、运动能力及光线的影响[27],测试需要在严苛特定的条件下进行。小鼠行为学结果显示,ECS可显著增加5xFAD小鼠的学习能力、空间记忆能力与记忆存留时间。肠道菌群结果显示,与对照组比较,5xFAD小鼠粪便菌群群落丰富度显著下降,门水平上,拟杆菌门丰度下降,厚壁菌门丰度上升;目水平上,拟杆菌目的丰度显著降低,而梭菌目的丰度显著升高;属水平上,拟杆菌目S24-7及普雷沃氏菌科UCG-001丰度显著下降,毛螺菌科NK4A136丰度显著上升,而有益菌瘤胃菌科UCG-014及Alloprevotella丰度有下降趋势。给药ECS后,模型组菌群群落丰富度明显改善,其中Alpha多样性分析、Beta多样性分析、物种注释分析等结果均保持一致。临床研究结果表明,AD患者的微生物物种丰度呈现拟杆菌门减少,厚壁菌门、变形菌门富集的现象,这与本研究结果一致[28-30]。
综上所述,ECS可显著改善AD模型小鼠的空间记忆与学习能力,调节粪便菌群紊乱。

