异质金属竞争配位用于混合配体型氯代异烟酸铀酰配合物的合成调控
田文江,梅 雷,孔祥鹤,耿峻山,梁媛媛,曾立雯,胡孔球,夏良树,柴之芳, 3,石伟群
1.南华大学 核科学技术学院,湖南 衡阳 421001;2.中国科学院 高能物理研究所 核能放射化学实验室,北京 100049;3.中国科学院 宁波工业技术研究所 先进能源材料工程实验室,浙江 宁波 315201
配位聚合物(coordination polymers, CPs)是一类基于金属-配体之间配位键合作用的无机-有机杂化晶态材料,因其化学结构和功能性质的可调性和多样性而引起了人们的广泛关注[1-3]。通常情况下,以过渡金属和镧系金属作为CPs类化合物连接节点的相关研究较多,而基于锕系元素的研究则相对较少。锕系元素由于其特殊的物理化学性质[4-5]、有趣的5f轨道键合特性及其在核燃料循环中的重要地位而受到越来越多的关注。对锕系-有机杂化材料的研究将拓展锕系配位化学的研究领域,并为探索锕系-有机杂化材料的新奇理化性质提供重要途径。

影响铀酰配位行为和几何结构的因素很多,如pH、温度、浓度、溶剂摩尔比等,但铀酰离子的配位形式在很大程度上是由有机配体的化学结构和配位行为决定的,不同官能团或空间构型的有机配体会导致不同的铀酰配位模式。同时,在铀酰配位聚合物组装过程中,氢键、卤键(含卤-卤相互作用)、π-π相互作用、静电或离子偶极相互作用等众多弱相互作用往往与配位键协同作用,促进最终产物的形成。相比于较为常见的氢键作用,卤键在构建铀酰配合物[6, 19-23]中的作用及机理的研究仍处于起步阶段[24]。在铀酰配合物中引入卤键或卤-卤相互作用,可以丰富铀酰杂化材料的种类,拓展超分子相互作用在锕系材料构筑中的应用。
基于铀酰的协同配位和超分子组装原理合成铀酰有机杂化材料是本课题组长期关注的课题。在早期的尝试中,从卤素取代的异烟酸配体出发,通过卤-卤相互作用和氢键等弱相互作用[21]的协同作用,构建了铀酰-有机超分子框架。而且,由于卤素取代异烟酸中吡啶N给体的存在,在铀酰-卤代异烟酸体系中引入第二金属中心金属离子,构建了异金属铀酰有机框架材料[22-23]。除第二金属中心外,辅助配体也可以通过模板效应或协同配位作用影响混合配体CPs的配位组装过程[25-27]。在此,期望进一步探索以联吡啶有机碱作为辅助配体的混合配体型卤代异烟酸铀酰配合物。在本工作中,拟利用铀酰与2,6-二氯异烟酸(H-2,6-dcpca)和2,2′-联吡啶(2,2′-bpy)的水热反应,合成混合配体型铀酰异烟酸化合物(化合物1)。进一步地,通过引入不同的异质金属离子(Ag+、Zn2+和Cu2+),实现这一混合配体体系配位组装的调控,制备合成六种同时具有两种金属中心的混合配体型异质金属-铀酰配合物(化合物2—7)。同时,也进一步对这些铀酰配合物中具有高晶相纯度的几种化合物的典型理化性质进行表征。
1 实验部分
1.1 材料和仪器
2,6-二氯异烟酸(H-2,6-dcpca),纯度大于97%,美国Accela公司;2,2′-联吡啶(2,2′-bpy),纯度大于99%,美国Sigma Aldrich公司。六水合硝酸铀酰、氢氧化钠(纯度大于99%)、硝酸银(纯度大于99.85%)、七水合硫酸锌(纯度大于99.5%)、六水合硝酸铜(纯度大于99%)均购于北京国药集团。
D8 VENTURE单晶X射线衍射仪、D8 Advance粉末X射线衍射仪、Tensor27红外光谱仪,德国Bruker科技有限公司;TA Q500热重分析仪,上海莱睿科学仪器有限公司;F-4600荧光光谱仪,日本日立高新技术有限公司;FE-20型pH计、AG245型电子天平(万分之一精度),梅特勒-托利多集团。
1.2 配合物的合成
将UO2(NO3)2·6H2O(12.55 g,0.025 mol)溶于50 mL去离子水中,得到0.5 mol/L硝酸铀酰的水溶液,将此溶液作为铀酰离子储备液用于后续水热反应。
(UO2)(2,6-dcpca)2(2,2′-bpy)(化合物1):将100 μL UO2(NO3)2·6H2O水溶液(0.5 mol/L,0.05 mmol)加入到H-2,6-dcpca(9.6 mg,0.05 mmol)和2,2′-bpy(7.8 mg,0.05 mmol)的悬浮液中,随后加入60 μL的NaOH水溶液(1 mol/L)调节溶液pH值。各反应试剂的摩尔比为1∶1∶1∶1.2。加入超纯水(1 mL),密封并在150 ℃下保持3 d。缓慢冷却至室温后,得到淡黄色棒状晶体化合物1,反应后溶液pH=2.68。晶体产物过滤后用超纯水冲洗,空气氛围下室温自然晾干。产量及收率为:9.9 mg,24.5%(基于铀)。
[(UO2)2(Ag)2(2,6-dcpca)6(2,2′-bpy)2]-[H2(2,2′-bpy)](化合物2):将UO2(NO3)2·6H2O水溶液(0.5 mol/L,100 μL,下同)和AgNO3(1 mol/L,100 μL)依次加入到H-2,6-dcpca(19.2 mg,0.10 mmol,下同)和2,2′-bpy(15.6 mg,0.10 mmol,下同)的悬浮液中,随后加入NaOH水溶液(1 mol/L,100 μL)调节溶液pH值。各试剂的摩尔比为1∶2∶2∶2∶2。将超纯水(1.0 mL,下同)加入12 mL高压釜中,密封并在150 ℃下保持3 d。缓慢冷却至室温后,得到亮黄色块状晶体化合物2,反应后溶液的pH=2.17。晶体产物用超纯水洗涤数次,空气氛围下室温自然晾干。产量及收率为:6.2 mg,39.1%(基于铀)。
[(UO2)2(2,6-dcpca)6][Zn(2,2′-bpy)2(2,6-dcpca)]2(化合物3):将UO2(NO3)2·6H2O和ZnSO4(1 mol/L,100 μL)依次加入到H-2,6-dcpca和2,2′-bpy的悬浮液中。各试剂的摩尔比为1∶2∶2∶2。将超纯水加入12 mL高压釜中,密封并在150 ℃下保持3 d。反应体系冷却到室温,得到浅黄色棒状晶体化合物3,同时伴有少量黄色絮凝物,反应后溶液pH=1.87。晶体产物用超纯水洗涤数次,空气氛围下室温自然晾干。
[(UO2)4O2(OH)2(2,6-dcpca)4][Zn(2,2′-bpy)3](化合物4):将UO2(NO3)2·6H2O和ZnSO4(1 mol/L,100 μL)依次加入到H-2,6-dcpca和2,2′-bpy的悬浮液中,接着加入NaOH水溶液(1 mol/L,150 μL)调节溶液pH值。各试剂的摩尔比为1∶2∶2∶2∶3。加入超纯水,密封并在150 ℃保持3 d。反应体系冷却到室温,得到黄色层状晶体化合物4,反应后溶液pH=4.79。晶体产物用超纯水洗涤数次,空气氛围下室温自然晾干。
[(UO2)2(Cu)2(2,6-dcpca)6(C2O4)(2,2′-bpy)2]0.5(化合物5)和[(UO2)(H2O)(2,6-dcpca)3][CuCl(2,2′-bpy)2]·H2O(化合物6):将UO2(NO3)2·6H2O和Cu(NO3)2(1 mol/L,100 μL)依次加入H-2,6-dcpca和2,2′-bpy的悬浮液中。各试剂的摩尔比为1∶2∶2∶2。加入超纯水,密封并在150 ℃保持3 d。反应体系冷却到室温,得到蓝色块状晶体化合物5和绿色块状晶体化合物6,反应后溶液的pH=1.49。晶体产物用超纯水洗涤数次,空气氛围下室温自然晾干。
(UO2)Cu(2,6-dcpca)4(2,2′-bpy)(化合物7):将UO2(NO3)2·6H2O和Cu(NO3)2(1 mol/L,100 μL)依次加入H-2,6-dcpca和2,2′-bpy的悬浮液中。接着加入NaOH水溶液(1 mol/L,50 μL)调节溶液pH值。各试剂的摩尔比是1∶2∶2∶2∶1。加入超纯水,密封并在150 ℃保持3 d。反应体系冷却到室温,得到浅绿色块状晶体化合物7,反应后溶液的pH=1.95。晶体产物用超纯水洗涤数次,空气氛围下室温自然晾干。
1.3 X射线单晶结构测定
化合物1—7的单晶数据在X射线单晶衍射仪上收集。该型号仪器装配有铜靶和钼靶两种光源,其中铜靶提供Kα射线(λ=1.541 78 Å,1 Å=0.1 nm),钼靶提供Kα射线(λ=0.710 73 Å)。所有晶体结构均采用直接法(SHELXS-97)[28]解析,并用SHELXL程序进行全矩阵最小二乘优化以进行结构精修[28-29]。所有化合物的晶体数据列入表1。涉及的所有晶体数据均已上传至剑桥晶体数据中心(Cambridge Crystallographic Data Centre, CCDC),可由该数据库获取相应晶体学数据。化合物1—7的CCDC序列号依次为2077141、2077142、2077143、2077144、2077145、2077146、2077147。

表1 化合物1—7的晶体学数据和精修结构Table 1 Crystallographic data and structure refinement results for compounds 1-7
1.4 化合物的表征
对相纯度较高的化合物1、2和4进行X射线粉末衍射、荧光光谱和红外光谱分析,并进行热重分析。
2 结果与讨论
2.1 晶体结构描述
化合物1是由铀酰和H-2,6-dcpca配体在2,2′-bpy作为辅助配体的条件下合成的。晶体结构分析表明,化合物1属于单斜空间群P21/c,是一个简单的铀酰配合物。其不对称单元由一个[UO2]2+基元、两个[2,6-dcpca]-配体和一个2,2′-bpy分子组成,如图1(a)。结构单元中的中心铀原子采用扭曲的六角双锥体几何结构,赤道面配位的四个氧原子(O1—O4)和两个氮原子(N3和N4)分别来自两个双齿螯合[2,6-dcpca]-配体(U—O键,2.432(3)~2.505(5) Å)的四个氧和双齿2,2′-bpy分子的两个氮原子(U—N键,2.611(8) Å和2.616(3) Å),如图1(b)和表S1(具体见网络版本的补充材料中的补充表格1,下同)。值得注意的是,由于[2,6-dcpca]-配位羧基的空间位阻影响,联吡啶分子的配位氮原子略微偏离铀酰赤道面,偏转角为34.881(68)°,如图1(c)。这种配合物结构单元可以通过丰富的弱相互作用在三维(3D)晶格中进行连接并形成最终的超分子框架(图1(d)),包括π-π堆积相互作用(相邻芳环之间的距离约为3.44 Å)、卤-卤相互作用和氢键(见网络版补充材料中的表S2)。例如,Cl(2)…Cl(3)和Cl(1)…Cl(4)这两种卤-卤相互作用促进了相邻铀酰超分子结构的交联,而C—H…N氢键作用使晶格的三维堆积更加紧密。值得一提的是,化合物1是迄今为止报道的第一例混合配体型氯代异烟酸铀酰化合物。由于2,2′-bpy成功参与化合物1的形成并作为其结构的重要组成部分,化合物1中的铀酰配位环境及其晶格堆积方式与纯铀酰-二氯异烟酸体系有明显差别。化合物1的这一变化表明,辅助配体可以通过参与配位显著影响铀酰离子的配位环境。
与化合物1相比,化合物2的晶体是在加入AgNO3条件下合成的。晶体学分析表明,化合物2的结构单元同时包含[UO2]2+和Ag+中心,如图2(a)。由于Ag+在掺入后与2,2′-bpy发生了配位,铀酰离子的配位层全部由[2,6-dcpca]-占据,从而形成由[2,6-dcpca]-桥联的铀酰二聚体[(UO2)2(2,6-dcpca)6]2-。这个铀酰二聚体由两个具有五角双锥体几何形状的七配位铀酰中心组成,如图2(b)所示。其中羧基单齿配位的U—O距离为2.285(7) Å和2.270(5) Å,与文献[30]报道的体系类似,而桥联双齿配位的U—O键范围为2.329(6)~2.344(6) Å。双齿螯合配位模式中U—O键的距离稍长(2.461(1)~2.527(9) Å)。这些铀酰二聚体通过Ag+的桥联作用进一步连接形成方波状的铀酰-银异金属配位聚合物一维链(图2(c))。此外,相邻一维链之间的亲银相互作用下促进了三维晶格堆积(Ag1-Ag1,3.916(1) Å;Ag2-Ag2,4.138 Å),如图2(d)和图S1(具体见网络版本的补充材料中的补充图1,下同)所示。这种特殊的组装模式导致沿着一维链的延伸方向产生自由通道,而质子化的[H2(2,2′-bpy)]2+分子刚好适合填充于其中(图2(e))。详细的结构分析表明,[H2(2,2′-bpy)]2+与周围的铀酰-银异金属骨架的一维链通过[C—H…Cl]和[N—H…Cl]氢键相互作用,这些弱相互作用有助于捕获和稳定化合物2晶格中游离的[H2(2,2′-bpy)]2+对离子(图2(f)和表S2)。

橙色的球棍模型表示2,2′-bpy(下同)(a)——化合物1的不对称结构单元;(b)——化合物1的铀酰配位环境以及[2,6-dcpca]-配体与2,2′-bpy与铀酰中心的结合模式;(c)——沿c轴看的铀酰配位多面体侧视图;(d)——参与化合物1的三维晶格堆积的多种弱相互作用,包括π-π堆积(左)、卤-卤相互作用和氢键(右)图1 化合物1的结构示意图Fig.1 Schematic diagram of structure of compound 1

(a)——化合物2的不对称结构单元;(b)——铀酰阳离子与Ag+的配位环境;(c)——从侧面和顶部看,铀酰-银异金属配位聚合物的方波状一维链;(d)——基于一维铀酰-银异金属链间亲银相互作用所形成的三维超分子框架;(e)——三维超分子骨架层间通道中游离的[H2(2,2′-bpy)]2+对离子;(f)——[H2(2,2′-bpy)]2+通过[C—H…Cl]和[N—H…Cl]氢键与周围的铀酰-银杂金属骨架发生相互作用图2 化合物2的结构示意图Fig.2 Schematic diagram of structure of compound 2
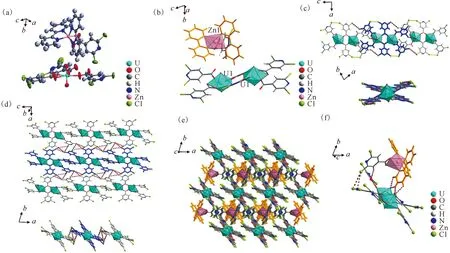
(a)——化合物3的不对称结构单元;(b)——铀酰中心和锌中心的不同配位环境;(c)——邻近的铀酰二聚体[(UO2)2(2, 6-dcpca)6]2-之间的卤-卤相互作用和卤键(上图,沿b轴视图;下图,沿c轴视图);(d)——基于相邻铀酰二聚体间双“X3”型卤-卤相互作用的二维超分子网络;(e)——位于二维铀酰二聚体超分子网络层间的以Zn2+为中心的抗衡离子[Zn(2,2′-bpy)2(2,6-dcpca)]+;(f)——以Zn2+为中心的抗衡离子与邻近的铀酰二聚体之间的弱相互作用图3 化合物3的结构示意图Fig.3 Schematic diagram of structure of compound 3
这些二维薄层结构可以通过它们之间的不同强度的弱相互作用(图3(f)和表S2)在层内空间(图3(e))中容纳以Zn2+为中心的抗衡离子([Zn(2,2′-bpy)2-(2,6-dcpca)]+)。
在H-2,6-dcpca、2,2′-bpy和ZnSO4的存在下,当加入一定量的NaOH到硝酸铀酰反应体系中以调节pH时,将可以获得另一个铀-锌异金属配位化合物4。化合物4的晶体学分析表明,其结构单元也包含两种金属节点(U和Zn),即由四个[2,6-dcpca]-配体配位的多核[UO2]2+基元和一个被三个2,2′-bpy配体包围的Zn2+中心,如图4(a)所示。由于在较高pH值下铀酰离子水解程度增加,因此化合物4中的铀酰中心变成具有四个晶体学独立铀原子的聚合铀酰链,而不是化合物3中所见的由[2,6-dcpca]-配体所桥联的铀酰二聚体(图4(b))。在这些聚合铀酰链的侧面,[2,6-dcpca]-配体通过单齿或桥联双齿配位模式连接到聚合铀酰链上。除了铀酰种态和配位模式的差异外,化合物4中Zn2+的配位层(图4(c))也与化合物3略有不同。对于化合物4的三维晶格堆积,聚合铀酰链通过卤-卤相互作用和卤键交联以形成超分子框架,如图4(d)、(e)所示。进一步地,[Zn(2,2′-bpy)3]2+作为抗衡离子通过一系列氢键与铀酰超分子框架发生相互作用,从而填充于三维超分子框架的孔隙中(图4(f))。
在铀酰/H-2,6-dcpca/2,2′-bpy的水热反应体系中引入Cu2+,得到3种不同的铀酰-铜异金属配合物5—7。这里首先讨论化合物5,其不对称单元由一个[UO2]2+、一个Cu2+、三个[2,6-dcpca]-配体、一个2,2′-bpy和半个草酸离子组成,如图5(a)所示。实际上,化合物5中的铀酰中心以[2,6-dcpca]-桥联的铀酰二聚体形式成对出现,这与化合物2和3中的情况相似。由于存在原位形成的草酸根配体,Cu2+也是通过草酸根的桥联而成对出现。这里观察到的草酸根可能源自H-2,6-dcpca配体的热分解,这在其它通过水热合成法制备的铀酰化合物体系中也有报道[31-32]。每个Cu2+中心的四方锥型配位构型由一个封端的2,2′-bpy和来自[2,6-dcpca]-配体的桥联双齿羧基完成,该羧基通过其两个羧基氧原子分别结合铀酰和Cu2+,如图5(b)所示。通过这种[2,6-dcpca]-配体的桥联作用,可以形成具有交替出现的铀酰二聚体和铜二聚体的一维链(图5(c))。此外,在晶格中这些一维链可以通过氢键相互作用(表S2),最终形成三维异金属铀酰-有机超分子框架(图5(d))。

(a)——化合物4的不对称结构单元;(b)——化合物4中铀酰中心和聚合铀酰链的配位环境;(c)——Zn2+中心的配位环境[Zn(2,2-bpy)3]2+;(d)——以[Zn(2,2-bpy)3]2+作为抗衡离子填充孔隙的聚合物铀酰链的三维堆积;(e)——相邻聚合铀酰链之间的卤-卤相互作用和卤键;(f)——[Zn(2,2-bpy)3]2+抗衡离子与邻近聚合铀酰链之间的弱相互作用图4 化合物4的结构示意图Fig.4 Schematic diagram of structure of compound 4
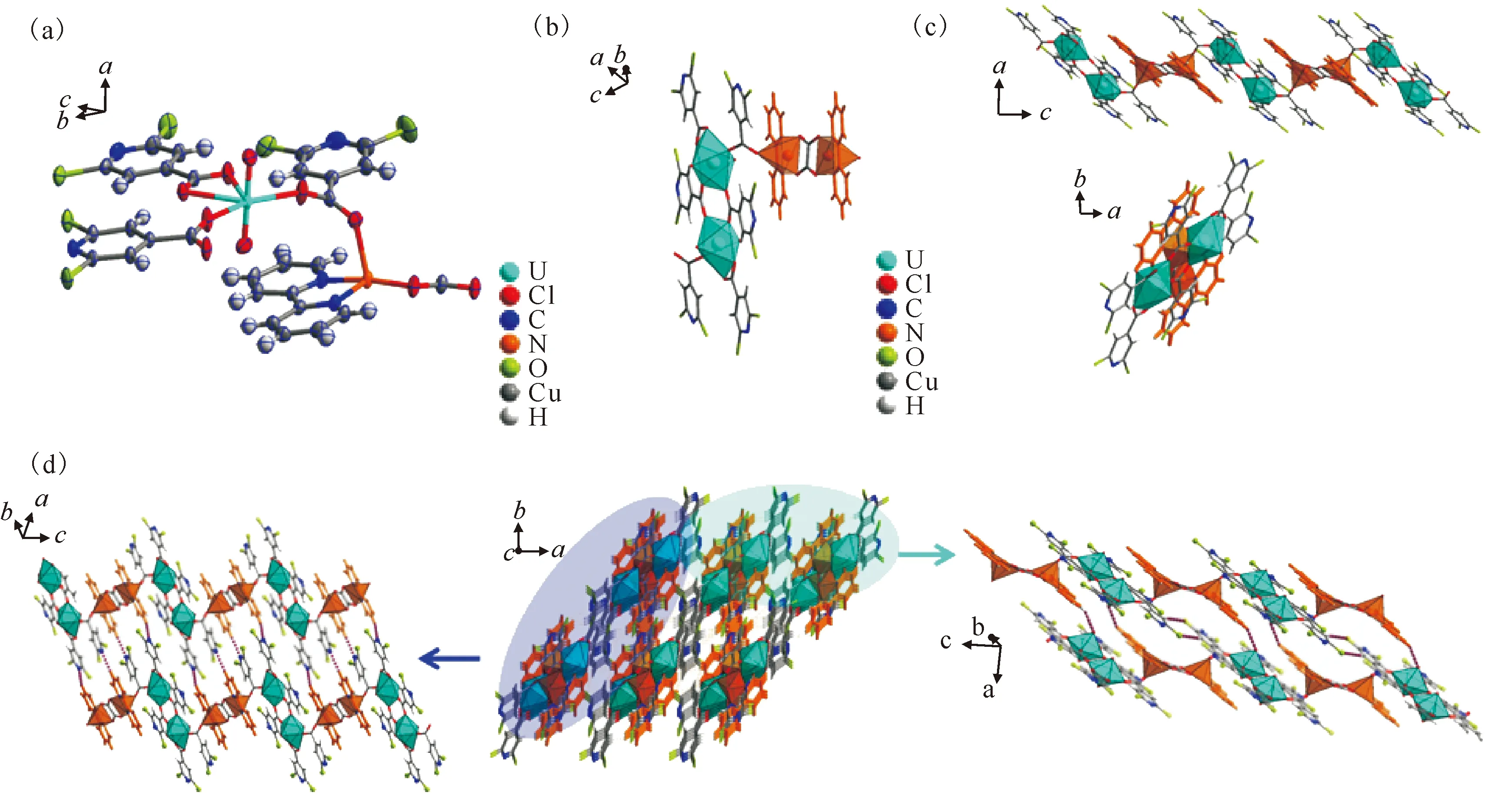
(a)——化合物5的不对称结构单元;(b)——铀酰和Cu2+中心的不同环境;(c)——从b轴(上)和c轴(下)两个方向看,具有铀酰二聚体和铜二聚体交替的一维链;(d)——铀酰-铜异金属一维链通过相邻铀酰链间的氢键进行三维堆积图5 化合物5的结构示意图Fig.5 Schematic diagram of structure of compound 5

随着反应pH的增加,将可以得到第三个铀酰-铜异金属配合物7。化合物7的不对称单元由一个铀酰离子和一个Cu2+组成,两者通过一对桥联双齿的[2,6-dcpca]-配体连接在一起,如图7(a)所示。铀酰中心呈现五角双锥体几何结构,其配位环境中除了桥联双齿[2,6-dcpca]-配体外,还包含一个双齿[2,6-dcpca]-配体和一个以μ2-(κ1,κ2)-模式配位的[2,6-dcpca]-配体,而Cu2+呈现扭曲八面体构型(图7(b))。与化合物5的情况类似,化合物7通过交替出现的单核铀酰和单核铜形成了异金属一维链(图7(c))。最后,借助相邻一维链之间的多重氢键和卤键(图7(d)和表S2),最终构筑了化合物7的三维超分子框架。

球模型的颜色:U,天蓝色;Cu,棕黄色;C,灰色;O,红色;N,深蓝色;Cl,亮绿色;H,白色;橙色的球棍模型表示2,2′-bpy(a)——化合物6的不对称结构单元,(b)——铀酰和Cu2+中心的配位环境,(c)——相邻单核铀酰基元之间以及铀酰基元与铜基元之间的弱相互作用,(d、e)——从两个不同方向看化合物6的晶格堆积图6 化合物6的结构示意图Fig.6 Schematic diagram of structure of compound 6
2.2 铀酰配合物合成及结构调控的影响因素
在前述部分,通过辅助配体和第二金属离子的引入系统调控了氯代异烟酸铀酰配合物的配位结构和晶格堆积。首先通过在铀酰和H-2,6-dcpca配体混合体系中添加N杂环辅助配体2,2′-bpy,成功制备了混合配体铀酰化合物1。由于2,2′-bpy参与铀酰配位,化合物1的结构与仅包含[2,6-dcpca]-配体(U-dcpca,图8)的铀酰配合物的结构有着显著不同。同时,通过进一步引入第二金属离子,利用引入的金属离子对2,2′-bpy和[2,6-dcpca]-配体的竞争配位能力,显著改变了目标化合物中铀酰离子的配位模式,从而获得了一系列具有不同配位模式和晶格堆积方式的异金属卤代异烟酸铀酰配合物。
如图8所示,对比了目前所报道的所有基于H-2,6-dcpca配体的铀酰化合物,包括化合物1—7、U-dcpca和U-Ag-dcpca,以此来讨论影响这些铀酰化合物水热合成的关键因素。显然,第一个需要考虑的因素是用于合成的反应底物,如辅助配体(即2,2′-bpy)或第二金属源(如Ag+、Zn2+和Cu2+)。这些额外引入的反应原料对合成过程的调控可以从相应条件下所获得的不同水热产物得到证明,并且这种调控的潜在机制应归因于这些调节剂多样化的竞争配位行为,这将在下一小节中进行详细讨论。除了反应物的化学组成外,水热合成的反应条件也起着至关重要的作用。以溶液的酸碱度为例,溶液的pH值可以在几个方面发挥作用:一是影响有机酸或碱配体的脱质子或质子化能力,进而影响其配位行为;二是影响金属离子的水解行为和最终的存在形态,如铀酰离子的种态在很大程度上受溶液pH的影响。一般来说,低酸度的铀酰溶液可能导致铀酰水解形成低聚物,如化合物4中观察到的聚合铀酰链。此外,溶液酸度、温度、反应时间等其它反应条件也会对有机配体的化学稳定性产生影响。化合物5和6中发现的Cl-和草酸根应该与H-2,6-dcpca配体的原位分解有关。
2.3 不同金属离子(Ag+、Zn2+和Cu2+)的竞争配位行为比较
对于这一系列混合配体型铀酰化合物(图8),最有趣的是异金属离子的多样化竞争配位行为,为此对铀酰与不同异金属离子配位行为进行详细分析。可以发现,在混合配体型卤代异烟酸铀酰配合物中,第二配体2,2′-bpy的引入改变了U-dcpca中铀酰中心的配位方式。进一步引入过渡金属离子(Ag+、Zn2+和Cu2+)作为第二金属中心,这些离子将与铀酰离子竞争并优先与2,2′-bpy进行配位,从而促使铀酰中心的配位模式恢复到没有2,2′-bpy配位的状态,即与U-dcpca或U-Ag-dcpca中铀酰的配位环境类似(图9)。异金属离子优异的配位能力是因为它们是比铀酰更软的路易斯酸,因此更容易与2,2′-bpy中更软的吡啶氮原子进行配位。在没有联吡啶参与配位的情况下,化合物2—6中的单体铀酰或羧基桥联二聚铀酰基元与U-dcpca和U-Ag-dcpca中发现的情况相似(图8)。另一方面,与[2,6-dcpca]-和2,2′-bpy进行配位的这些异质金属节点的配位行为存在显著差异(图9)。具体来说,Ag+是一种较软的路易斯酸,具有良好的结构变形性,除了与2,2′-bpy配位外,还可以继续参与[2,6-dcpca]-配体上氮原子的配位。与Ag+不同,Zn2+更硬且不易变形,从而难以与[2,6-dcpca]-的吡啶氮配位,但它可以与来自[2,6-dcpca]-的单羧基进行配位。Cu2+和Zn2+在离子半径和电荷密度方面非常相似,但由于杨-泰勒效应的存在,Cu2+的配位构型比Zn2+更复杂,因此Cu2+也会参与铀酰中心周围的羧基残留位点的配位,并形成由羧基桥联或交联的铀酰-铜异金属一维链结构。以上讨论结果表明,在所获得的异质金属-铀酰化合物中,可以观察到这些外加的异质金属离子对H-2,6-dcpca或2,2′-bpy配体的竞争配位现象,即:异金属离子的加入可以通过不同程度的协同或竞争配位机制实现对混合配体型铀酰配合物合成的有效调控。

dcpca:[2,6-dcpca]-;bpy:2,2′-bpy图8 混合配体型异金属卤代异烟酸铀酰化合物2—7与无第二金属中心的化合物1的结构对比Fig.8 Diversified competitive coordination in mixed-ligand heterometallic uranyl dichloro isonicotinate compounds2-7, with compound 1 without second metal center involved as control
2.4 典型理化性质的表征
如上所述,添加不同的异金属离子可以有效调节由H-2,6-dcpca和2,2′-bpy组成的混合配体型铀酰配合物的配位行为和晶格堆积模式。化合物1、2和4的X射线粉末衍射图示于图10。通过与对应的理论粉末衍射图进行比对,表明这三个化合物具有较高的相纯度,可以用于后续表征测试。于是,进一步探讨了这些铀酰化合物在理化性质上的差异。

图9 本工作中异金属离子配位模式的差异及铀酰化合物中铀酰中心配位环境的演化Fig.9 Difference in coordination patterns of heterometallic ions and evolution of coordination environment of uranyl center in uranyl compounds reported here

图10 化合物1(a)、2(b)、4(c)的X射线粉末衍射图Fig.10 X-ray powder diffraction patterns of compounds 1(a), 2(b), and 4(c)

1——化合物2,2——化合物4图11 化合物2和4的荧光光谱Fig.11 Fluorescence spectra of compounds 2 and 4

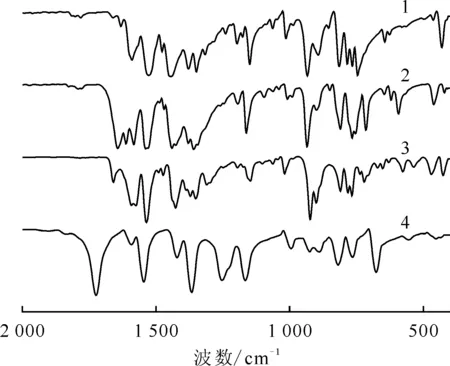
1——化合物1,2——化合物2,3——化合物4,4——H-2,6-dcpca图13 化合物1、2、4的红外光谱(以H-2,6-dcpca为参考物质)Fig.13 Infrared spectra of compounds 1, 2, and 4 with H-2, 6-dcpca as control

1——化合物1,2——化合物2,3——化合物4图14 化合物1、2、4的热重分析结果Fig.14 Thermogravimetric analysis results of compounds 1, 2, and 4
3 结 论
从卤素取代的二氯异烟酸配体和辅助联吡啶配体出发,合成了一系列包含或不包含第二金属节点的混合配体二氯异烟酸铀酰化合物。对所制备的7种化合物进行了详细的晶体结构分析,并对铀酰配位聚合物的键合方式、主客体的相互作用、合成机理等进行了进一步探究。以上研究结果表明,辅助配体和异质金属离子的加入可以通过不同程度的协同或竞争配位机制实现对铀酰化合物产物结构的有效调控,特别是通过外加第二金属离子的多重竞争配位机制,使得这些异金属铀酰化合物呈现出丰富的结构多样性。同时,溶液的pH值对铀酰离子的配位影响不可忽视:pH值影响有机酸或碱配体的去质子或质子化能力,进而影响它们的配位行为。另外,配体分子的卤素取代也改变了异烟酸配体的配位能力及弱相互作用方式,将可以通过卤-卤相互作用和氢键影响配位网络的晶格稳定性。总之,本工作所使用的混合配体方法和多样化的竞争配位方式扩展了锕系配位化合物的类别,未来有望用于更多功能性锕系杂化材料的合成和结构调控。

