中蜂蜂毒和意蜂蜂毒抑菌作用分析
黄 丽,周天尧,彭 竹,赵淑果,赵慧婷
(1.山西农业大学 生命科学学院,山西 太谷 030801;2.山西农业大学 农学院,山西 太谷 030801)
目前市面上针对致病菌引起的疾病主要是通过抗生素治疗,虽然抗生素治疗某些细菌疾病具有显著成效,但其机制主要是通过阻断细菌的大分子生物合成发挥抑菌作用[1],所以,目前很多细菌如链球菌、假单胞菌、沙门氏菌等已经对抗生素产生了耐药性,且抗生素还具有药残性,给人类健康造成了严重隐患[2],因此,寻找一种能够作为辅助抗生素的新型抑菌药物显得尤为重要。现已报道的抗生素辅助品种类繁多,但归纳后大致可以分为4类:酶制剂、活菌制剂、植物提取物和中药[3]。中药作为抗生素的辅助品具有天然性和实践性、来源广泛、多功能性、不产生药残和抗药性等优势,所以,中药极有可能成为辅助传统抗生素的最佳候选对象。蜂毒作为中药中的一类动物药,其生化特性、抗菌和药理作用已在多项研究中进行了报道[4-7]。
蜂毒是工蜂在遇到威胁时通过螫针从毒腺中排出来的具有芳香气味的物质,它是一种具有生物学活性和药理学活性的复杂混合物,其中以多肽类为主,包括蜂毒肽、蜂毒明肽以及肥大细胞脱粒肽等10余种活性肽。此外,蜂毒中还含有透明质酸酶、磷脂酶A 2等50多种酶类物质[8]。已有研究表明,蜂毒具有抗炎[9]、抗衰老[10]、镇痛[11]、抗病毒[12]、抗辐射[13]、抗肿瘤[14]等功效。还有大量研究表明,蜂毒具有抑菌作用。
近年来,有大量研究表明,蜂毒在抑菌方面具有显著效果。KONG等[15]采用最小抑菌浓度法检测蜂毒对造成小鼠MRSA肺炎模型中的耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus)的抑菌作用,发现蜂毒可抑制该致病菌的毒力和肺组织中存在的细菌细胞数量,从而减轻小鼠的肺炎症状。该研究表明,蜂毒可能是治疗耐甲氧西林金黄色葡萄球菌感染引起的肺炎的候选物质。HEGAZI等[16]采用最小抑菌浓度法评估了3种不同蜂毒作为抗菌剂的潜在用途,包括金黄色葡萄球菌(Staphylococcus aureus)、化脓性链球菌(Streptococcus pyogenes)、肺炎克雷伯菌(Klebsiella pneumoniae)、大肠杆菌(Escherichia coli)和铜绿假单胞菌(Pseudomonas aeruginosa)。结果表明,蜂毒可抑制细菌菌株的生长和存活,并且蜂毒可用作对抗病原菌的补充抗菌剂。PARK等[17]选用3种不同蜂毒对从患有乳腺炎的奶牛乳房中分离出来的44种细菌进行琼脂平板法和最低抑菌浓度(MIC)测定,对3种蜂毒的抗菌活性和效力进行了确认和比较。结果表明,3种蜂毒均能有效抑制金黄色葡萄球菌(Staphylococcusaureus)和凝固酶阴性葡萄球菌(Coagulase-negative Staphylococcus),抑制部分大肠杆菌(Escherichia coli)的生长,而对其他细菌(在超过500μg/mL的浓度下)没有抑制功效。ZOLFAGHARIAN等[18]采用抑菌圈和最小抑菌浓度法对蜂毒和庆大霉素的抑菌功效进行比较研究,发现蜂毒可作为庆大霉素的有效替代品。SURENDRA等[19]获取东方蜜蜂(Apis cerana)、大蜜蜂(Apis dorsata)和小蜜蜂(Apis florea)3种蜜蜂蜂毒后通过体外试验检测它们对5种病原细菌和真菌的抑制作用。结果显示,5种病原菌对东方蜜蜂、大蜜蜂和小蜜蜂的蜂毒都具有一定的敏感性。HAN等[20]也研究发现,蜜蜂毒液对耐甲氧西林金黄色葡萄球菌具有抗菌活性。蜂毒对部分细菌和真菌的生长都有抑制作用,但对同一细菌的最小抑菌浓度和抑菌圈有所不同,可能由于蜂毒种类或纯度不同。中华蜜蜂(A.cerana cerana)和意大利蜜蜂(A.mellifera ligustica)是我国目前饲养的两大主要蜂种,但是由于意蜂管理难度较低、饲养面积大、获取的蜂产品产量高等特点,因此,对意蜂开展的基础性研究远多于中蜂。本研究探讨中蜂蜂毒、意蜂蜂毒抑菌特性的差异,旨在为开发一款无耐药性药物作为传统抗生素药物的补充抗菌剂提供基础数据。
1 材料和方法
1.1 试验材料与仪器
1.1.1 试剂 蜂毒由安徽金蜂蜂毒生物科技开发有限公司提供,为冻干粉;NaCl、葡萄糖购自鞍山智奥化学试剂研究所;酵母浸膏、蛋白胨购自Oxiod公司;血琼脂平板购自上海研生实业有限公司;脑心浸液肉汤购自青岛高科技工业园海博生物技术有限公司;青霉素、PDA和PDB购自北京索莱宝科技有限公司。
1.1.2 供试菌株 革兰氏阳性菌:金黄色葡萄球菌(STAU)、枯草芽孢杆菌(BASU)、白色葡萄球菌(STAL)、苏云金芽孢杆菌(BATH)、无乳链球菌(STAG);革兰氏阴性菌:大肠杆菌(ESCO)、伤寒杆菌(SATY)、沙门氏菌(SALM);真菌:尖孢镰孢菌(FUOX)。以上菌株均由山西农业大学生命科学学院提供。
1.1.3 主要试验仪器 摇床、恒温培养箱、分光光度计、超净工作台、酶标仪、正置显微镜、移液器、培养皿、三角涂棒、滤纸、游标卡尺和实验室其他常规设备等。
1.2 试验方法
试验于2019年6—8月在山西农业大学生命科学学院实验室进行。
1.2.1 菌种的活化培养 细菌:将各菌株接种于适宜的液体培养基中,摇床扩大培养至对数生长期;真菌:将菌株培养在PDA培养基上,再用接种针将菌丝接种到PDB中振荡培养至对数生长期。
1.2.2 抑菌圈的测定 将中蜂蜂毒和意蜂蜂毒冻干粉分别用灭菌蒸馏水配制成10、20、40 mg/mL 3种不同质量浓度的蜂毒溶液。取浓度为106~107cfu/mL的各菌悬液200µL分别加入到20 mL温度适宜的琼脂培养基中混匀,凝固后将灭菌的滤纸片置于培养基上。再将中、意蜂不同质量浓度的蜂毒各5µL置于滤纸片上,阳性对照为5 mg/mL的青霉素,阴性对照为无菌水。将平皿置于适宜温度的恒温培养箱中倒置培养,12 h后取出,观察记录抑菌情况,并用游标卡尺测量抑菌圈直径。试验重复3次。
1.2.3 最小抑菌浓度的测定 将中蜂蜂毒、意蜂蜂毒冻干粉配制成1、5、10、15、20、25、30 mg/mL的蜂毒溶液。取浓度为106~107cfu/mL的各菌悬液60µL和不同质量浓度的中蜂蜂毒、意蜂蜂毒溶液60µL混匀,混匀后分别用三角棒均匀涂抹在琼脂培养基上。将平皿置于适宜温度的恒温培养箱中倒置培养,12 h后取出,观察抑菌情况。试验重复3次。
1.2.4 意蜂蜂毒对无乳链球菌抑制作用的验证
1.2.4.1 蜂毒对菌液光密度的影响 空白对照组为脑心浸液肉汤培养基(BHI液体培养基),阴性对照组为106~107cfu/mL的无乳链球菌悬液50μL接入5 mL BHI液体培养基中培养,试验组和阳性对照组分别采用浓度为106~107cfu/mL的无乳链球菌悬液50μL接入含有0.5、2.5、5.0 mg/mL意蜂蜂毒和1、5 mg/mL青霉素的5 mL BHI液体培养基中培养12 h,每隔2 h测一次OD值。试验重复3次。
1.2.4.2 细菌荧光显微镜观察 对照组是将活化后的菌液50μL接入5 mL BHI液体培养基中培养,试验组是将菌液接入含有1、5 mg/mL意蜂蜂毒的5 mL BHI液体培养基中培养。阳性对照组选用含有1、5 mg/mL青霉素的5 mL BHI液体培养基中进行培养。在培养12 h后,采用正置荧光显微镜观察细菌的生长情况。
1.3 数据分析
利用Microsoft Excel 2016进行数据记录及整理、利用SPSS 21.0进行单因素方差分析,利用Graph Pad Prism 8.0软件绘图。
2 结果与分析
2.1 中蜂蜂毒和意蜂蜂毒抑菌圈对比分析
中蜂蜂毒和意蜂蜂毒对抑菌圈的影响如表1、2所示。
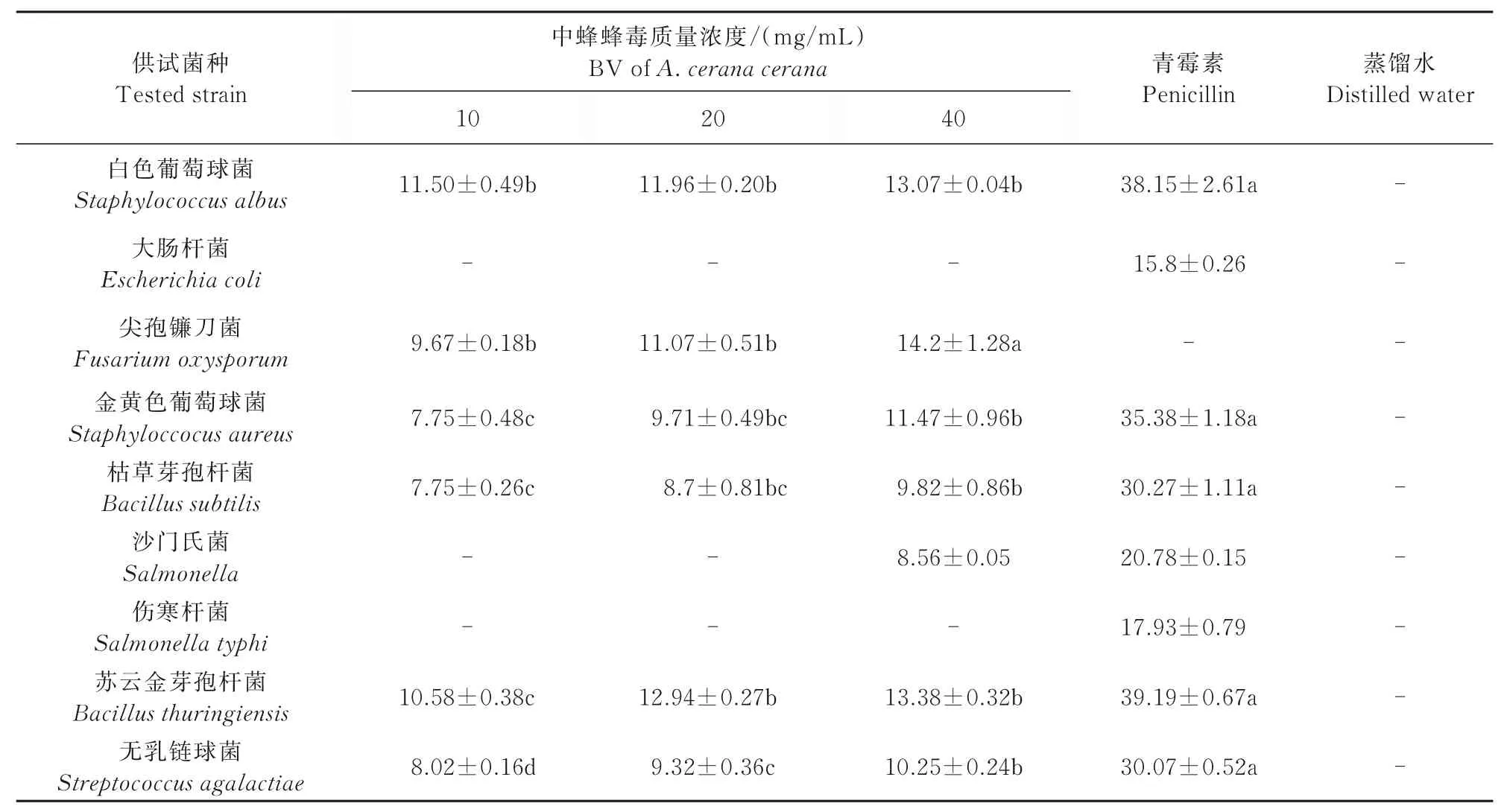
表1 中蜂蜂毒对供试菌抑菌圈的影响Tab.1 Effect of BV of A.cerana cerana on bacteriostatic zones of tested strains mm
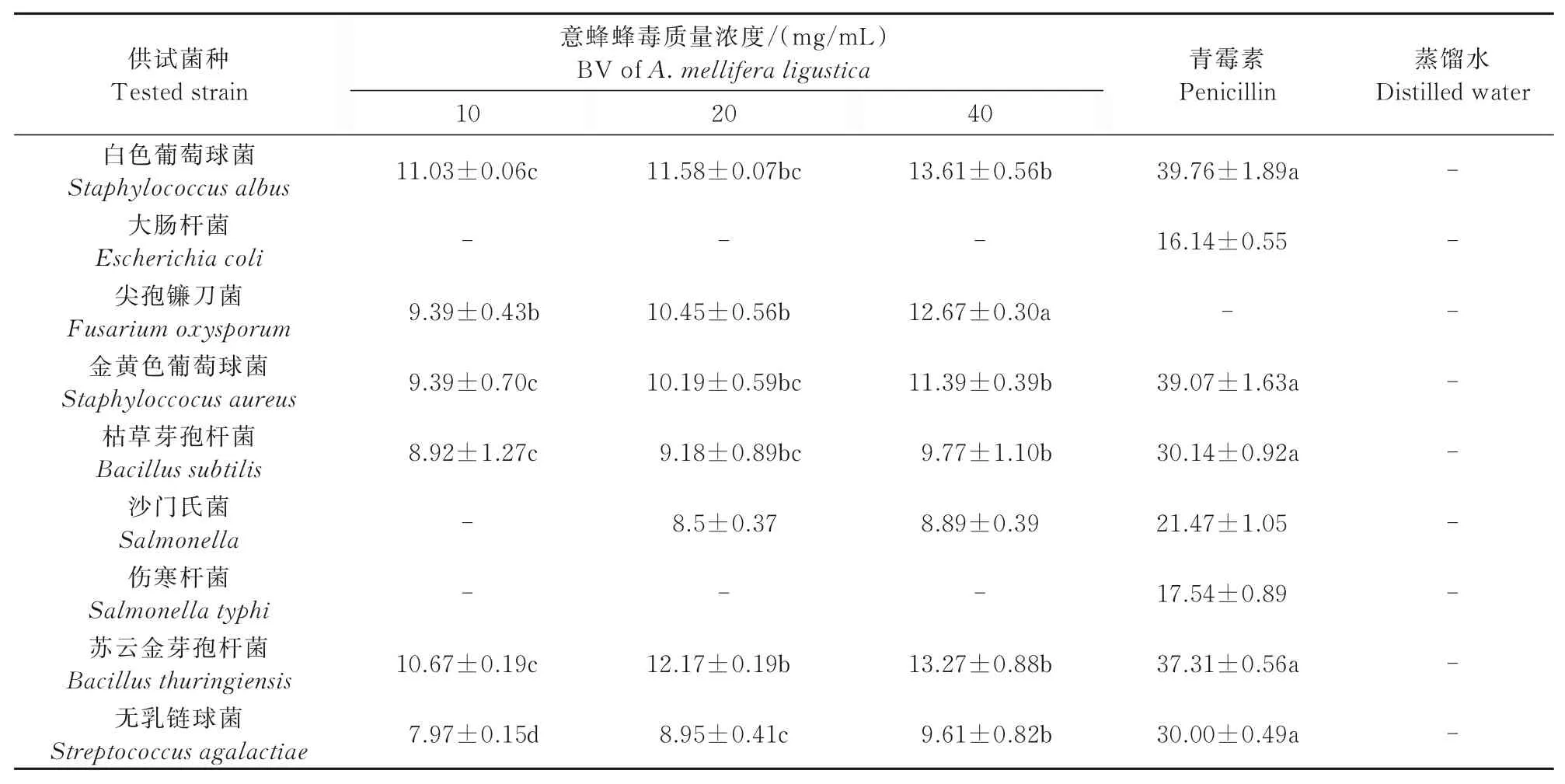
表2 意蜂蜂毒对供试菌抑菌圈的影响Tab.2 Effect of BV of A.mellifera ligustica on bacteriostatic zones of tested strains mm
从表1、2可以看出,中蜂蜂毒、意蜂蜂毒对白色葡萄球菌、金黄色葡萄球菌、枯草芽孢杆菌、苏云金芽孢杆菌、无乳链球菌、尖孢镰刀菌和沙门氏菌都有一定的抑制作用。并且随着蜂毒质量浓度的升高,抑菌圈直径增大,抑菌效果愈加明显,说明蜂毒质量浓度与抑菌效果成正相关。根据最大质量浓度下抑菌圈大小判定意蜂蜂毒抑菌作用从大到小依次为:白色葡萄球菌>苏云金芽孢杆菌>尖孢镰刀菌>金黄色葡萄球菌>枯草芽孢杆菌>无乳链球菌>沙门氏菌;中蜂蜂毒抑菌作用从大到小依次为:尖孢镰刀菌>苏云金芽孢杆菌>白色葡萄球菌>金黄色葡萄球菌>无乳链球菌>枯草芽孢杆菌>沙门氏菌;但在本试验中,中蜂蜂毒和意蜂蜂毒对大肠杆菌和伤寒杆菌无明显抑制作用。
由此可见,中蜂蜂毒和意蜂蜂毒二者都对革兰氏阳性菌中白色葡萄球菌、苏云金芽孢杆菌和尖孢镰刀菌具有较强的抑菌功效,但对革兰氏阴性菌的抑菌功效较弱;尖孢镰刀菌、金黄色葡萄球菌、枯草芽孢杆菌、苏云金芽孢杆菌和无乳链球菌随蜂毒质量浓度增加,抑菌效果显著增强。
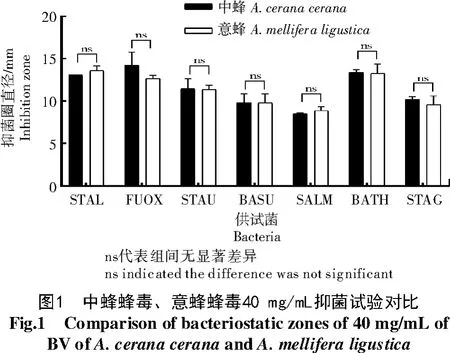
从中蜂蜂毒40 mg/mL和意蜂蜂毒40 mg/mL的抑菌试验对比结果(图1)可以看出,中蜂蜂毒、意蜂蜂毒对供试菌的抑制作用之间没有显著差异(P>0.05)。
2.2 最小抑菌质量浓度(MIC)分析
由表3可知,在本试验设置的浓度中,中蜂蜂毒、意蜂蜂毒对革兰氏阳性菌和真菌的最小抑菌浓度均为5 mg/mL。但对革兰氏阴性菌,在浓度高达30 mg/mL时仍未有明显抑菌效果。说明蜂毒对革兰氏阳性菌和真菌有较强的抑菌作用,而对革兰氏阴性菌的抑菌作用欠佳。
2.3 蜂毒对菌液光密度的影响
由表4可知,在试验组中,加入不同质量浓度的意蜂蜂毒和青霉素后采用酶标仪进行检测,发现菌液的OD值在不同处理组间随时间变化的趋势均有显著差异(P<0.05)。其中,青霉素1、5 mg/mL菌液的OD值无显著差异,但蜂毒对菌液OD值的影响却表现为:5.0 mg/mL>2.5 mg/mL>0.5 mg/mL;阴性对照组菌液的OD值明显上升,说明蜂毒可抑制无乳链球菌的生长。
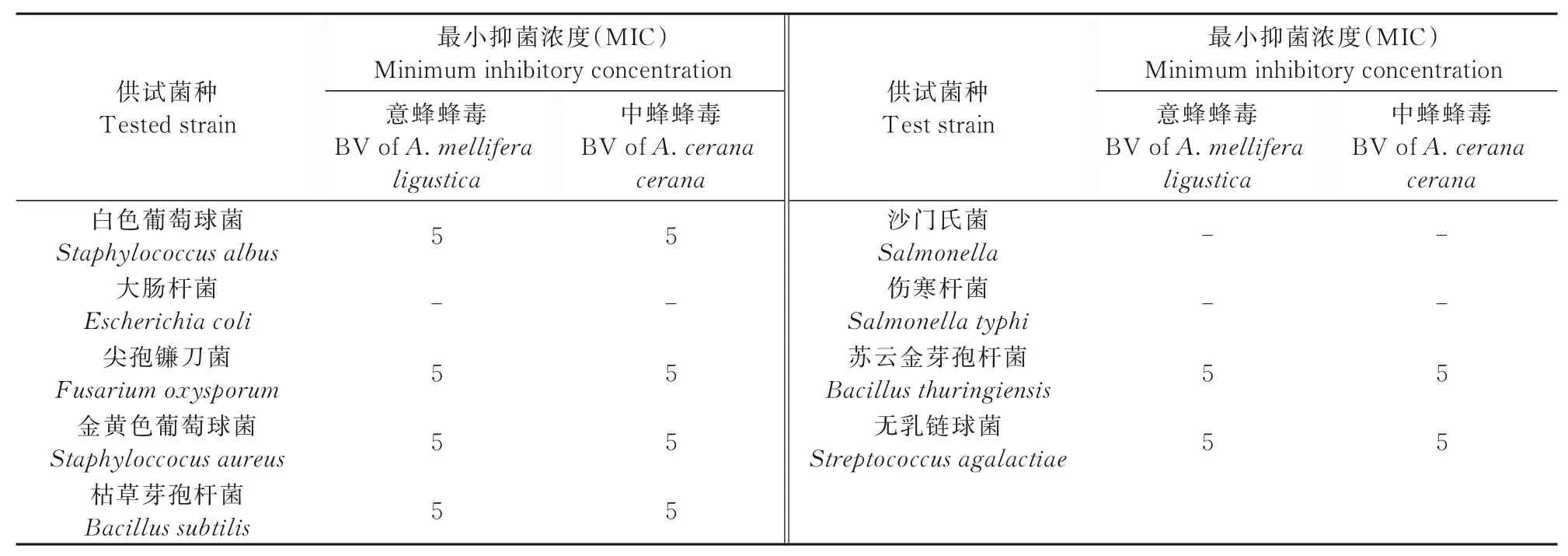
表3 蜂毒对供试菌的MICTab.3 MIC of tested strains treated with BV
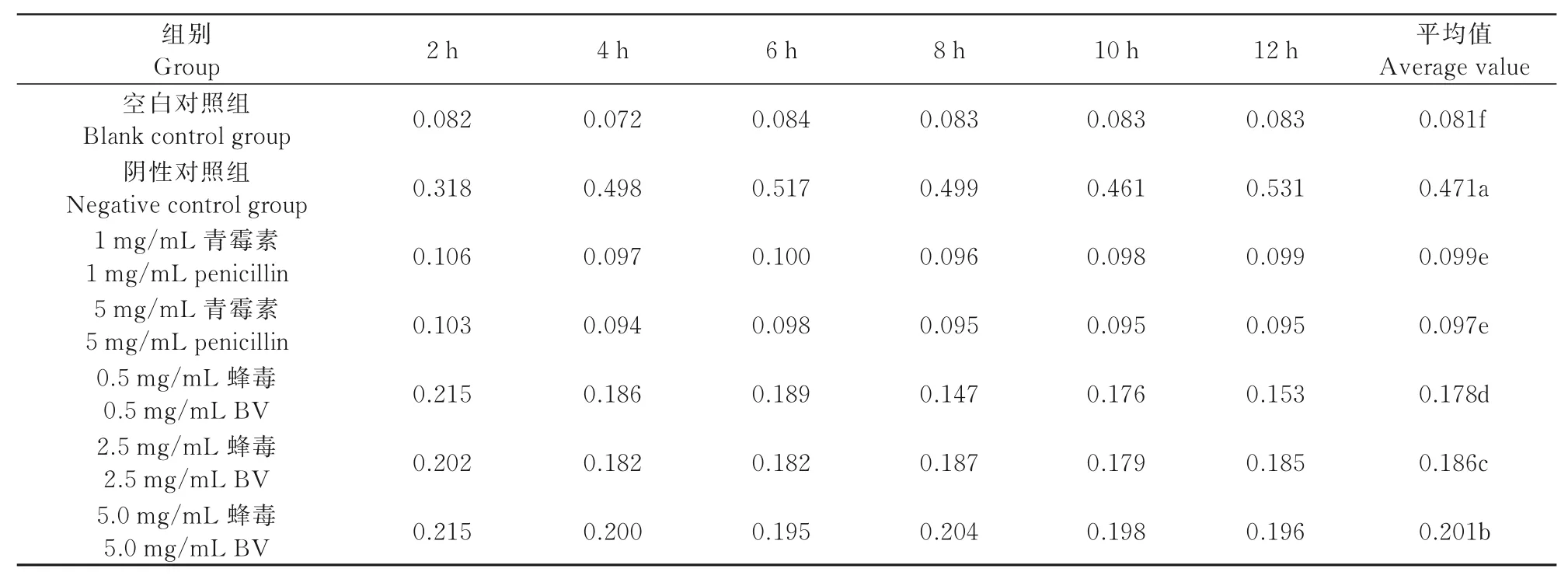
表4 蜂毒作用下无乳链球菌生长的酶标仪测定结果Tab.4 The effect of BV on results determined by microplate reader detecting the growth of Streptococcus agalactiae
2.4 正置荧光显微镜观察细菌生长情况
蜂毒作用下无乳链球菌正置显微镜观察结果如图2所示。

由图2可知,对照组在培养12 h后从正置显微镜下观察到有大量无乳链球菌,呈链状排列,而试验组经过12 h的培养后在正置显微镜下只能观察到很少量的细菌,说明蜂毒对无乳链球菌的繁殖具有较强的抑制作用。在阳性对照组中将青霉素接入活化后的无乳链球菌菌液中培养12 h后,观察不到细菌的存在,表明青霉素在菌液浓度较低时可能对其有杀菌作用。
3 结论与讨论
蜂毒的抗菌作用可能是由于其存在肽、酶、生物活性胺和非肽成分,这些化合物可能与某些细菌的特定分子发生相互作用,而不会影响其他细菌。陈素霞等[21]研究表明,蜂毒肽作为蜂毒中的主要活性成分,是典型的阳离子抗菌肽。这类抗菌肽含有较多的碱性氨基酸和较多的疏水性氨基酸,其抑菌机理为肽的阳离子部分与细菌细胞膜的阴离子发生静电作用,由疏水氨基酸形成的疏水部位与细菌细胞膜的脂链产生疏水作用,从而起到抑菌作用,与抗生素抑菌机理相比,这种独特的抗菌机理使细菌不易产生耐药性。CUJOVA等[22]采用最小抑菌浓度法研究表明,蜜蜂蜂毒中的蜂毒肽及其类似物对革兰氏阳性菌的活性均高于革兰氏阴性菌。同样,ORTEL等[23]定量测定抑菌圈时,发现在低浓度的蜂毒下,革兰氏阳性菌比革兰氏阴性菌更敏感。HEGAZI等[24]研究结果表明,蜂产品对大肠杆菌的效果较差。本研究获得的抑菌数据表明,中蜂蜂毒、意蜂蜂毒可以显著抑制某些细菌和真菌的生长,相比于革兰氏阴性菌,革兰氏阳性菌对蜂毒更敏感,这与前人的研究结果相似。青霉素只能特异性地针对细菌的细胞壁,而对其他微生物的细胞壁无效,所以,青霉素不能抑制真菌,而本试验结果表明,蜂毒对真菌具有一定抑制作用,体现了中药对真菌具有独特的治疗作用[25-27]。另外,中、意蜂2种蜂毒在抑菌效果方面,包括对各种菌的抑菌圈及最小抑菌浓度间均无显著差异,说明两类蜂毒的抑菌作用是相当的。在此基础上,本试验后期选择了革兰氏阳性菌无乳链球菌来进一步探讨蜂毒的抑菌特性;采用正置荧光显微镜观察后发现,加入蜂毒后,可以有效抑制无乳链球菌的生长;酶标仪检测显示,蜂毒可以显著降低无乳链球菌菌液的OD值,该试验结果进一步证实了蜂毒对革兰氏阳性菌具有较强的抑菌作用,也许蜂毒可以作为一种有效的辅助抗菌剂用于对抗特定的致病菌。本试验中仅使用粗蜂毒对比分析了中、意蜂蜂毒的抑菌作用。由于蜂毒成分较复杂,因此,在后续试验中可提取其单一成分,探讨不同成分抑菌作用并对其抑菌机理进行深入研究。
本试验研究了中蜂蜂毒、意蜂蜂毒对5种革兰氏阳性菌、3种革兰氏阴性菌和1种真菌的抑菌效果,证实了中蜂蜂毒和意蜂蜂毒对供试的革兰氏阳性菌、真菌和部分革兰氏阴性菌都有一定的抑制作用,对革兰氏阳性菌和真菌的抑制效果较好,但中蜂蜂毒和意蜂蜂毒在抑菌效果方面无显著性差异。通过酶标仪检测和正置荧光显微镜观察,发现意蜂蜂毒对无乳链球菌有显著的抑制作用,且蜂毒不同浓度间也存在显著的抑菌差异。本研究可为蜂毒作为辅助抗生素药物治疗疾病提供理论依据,同时为丰富其药理学及临床应用奠定了良好的基础。

