IL-6加重蟾酥注射液潜在性心律失常作用
高倩雯,肖钰洁,王羽维,朱晓佳,刘福明,陈可塑,王荣荣,陈 龙,
(1. 南京中医药大学药学院,江苏省中药药效与安全性评价重点实验室,江苏 南京 210023;2. 江苏省中医院,南京中医药大学附属医院,江苏 南京 210029;3.南京大学医学院,江苏 南京 210093;4. 泰州中国医药城中医药研究院,江苏 泰州 225300)
蟾酥注射液中的主要成分为动物毒素——蟾酥。蟾酥是我国传统名贵药材,为蟾蜍科动物中华大蟾蜍或黑眶蟾蜍耳后腺和皮肤腺分泌的白色浆液加工而成。蟾酥中的主要成分有强心甾烯蟾毒类,其有效成分多为脂溶性成分,蟾蜍甾烯类物质的化学结构与强心苷类化合物类似,具有强心苷样作用。有多种蟾酥类药物制剂应用于临床,包括口服剂型、外用剂型及注射剂型等17种成方制剂[1]。蟾酥具有广泛的药理作用,包括抗肿瘤、强心、升压、镇痛、麻醉等作用。基于蟾酥的这些药理作用,其用于静脉注射的剂型-蟾酥注射液用于清热解毒,急慢性化脓感染[2],以及抗肿瘤辅助用药。然而,作为蟾酥注射液的主要成分蟾酥,其不良反应涉及多器官系统,主要分为神经系统异常、循环系统异常以及消化系统异常,其中心脏毒性尤为突出[3-4]。
蟾酥注射液临床上主要用于抗炎,机体出现炎症时,产生以IL-6为主的炎症因子风暴,IL-6主要由单核-巨噬细胞、T淋巴细胞和纤维母细胞合成。IL-6由184个氨基酸残基组成,有2个丝氨酸和2个苏氨酸可成为蛋白激酶磷酸化位点。IL-6与跨膜型IL-6受体(mIL-6R) (经典信号通路)或血清中可溶性IL-6受体(sIL-6R) (反式信号通路) 结合,IL-6/IL-6R复合体募集普遍表达在细胞膜上的分子量为130 000的糖蛋白130(glycoprotein 130,gp130),形成了由2个IL-6、2个IL-6R和2个gp130 亚基组成的IL-6/IL-6R/gp130六聚复合体。六聚复合体通过多个信号通路,引发下游信号连锁反应[5]。
实际上,有研究表明,IL-6抑制心肌细胞hERG (Ikr)电流而延长心电图QT间期[6],自身免疫性疾病患者的QT间期明显延长[7]。这些从2016起发表的研究成果并没有受到重视,直到新冠肺炎(COVID-19)暴发以后才得以广泛关注。大量研究表明,COVID-19患者体内释放大量炎症因子,导致不同程度的心律失常[8-9],而阻断心肌细胞膜上IL-6受体的托珠单抗(tocilizumab)能够有效对抗COVID-19患者的心律失常[10],以及其他免疫性疾病导致的心律失常[11]。
基于蟾酥注射液临床上用于急慢性化脓感染的炎症疾病,本实验将使用豚鼠在体心电图技术,观察蟾酥注射液对心电图各指标的作用;并研究其对心室肌细胞动作电位、钙电流及钠电流的作用,分析IL-6加重蟾酥注射液潜在心律失常的作用机理。通过本实验评价蟾酥注射液临床使用中,在治疗炎症性疾病可能导致心律失常风险和种类。
1 材料与方法
1.1 实验药品与试剂蟾酥注射液购于泰州市中西医结合医院,规格:2 mL/支,批准文号:国药准字Z32020693;重组人IL-6购于Pepro TECH (USA,No 200-06);其他化学试剂均购自Sigma-Aldrich (USA)。
1.2 实验仪器RM6240BD型多道生理信号采集处理系统,HSS-1(B)恒温水浴槽,Langendorff离体心脏灌流装置均由成都仪器厂生产;膜片钳仪Axopatch 200B和Axon Digidata 1550数模转换器,Axon Instruments,USA;MP-225三维液压微操纵器和P-97微电极拉制仪, Sutter Instruments,USA;Olympus IX53 倒置荧光显微镜(Japan)。
1.3 实验动物豚鼠体质量(250~300)g,雌雄不拘。由南京中医药大学实验动物中心提供,实验动物生产许可证:SCXK(苏) 2019-0005;实验动物使用许可证:SYXK(苏) 2018-0048。
1.4 浓度设计
1.4.1在体实验蟾酥注射液浓度的计算方法 关于人体与动物实验的剂量换算:根据国际标准,按照体表面积系数和每千克体重进行比较[12],豚鼠剂量为人体剂量的4.6倍。并按照说明书规定:注射用蟾酥注射液的成人临床剂量为每人每天20 mL(静脉滴注),即0.33 mL·kg-1(按成人60 kg计算)。换算到豚鼠,则1倍临床剂量为1.5 mL·kg-1[13-14]。蟾酥注射液的豚鼠在体实验对应的临床1、5、10倍临床剂量分别为1.5、7.5、15 (mL·kg-1)。
1.4.2离体实验蟾酥注射液浓度的计算 按照蟾酥注射液说明书规定:成人用量为每人每天20 mL(静脉滴注),即0.33 mL·kg-1。成人细胞外液约占体质量的20%,那么换算成临床血药浓度即为1.7 mL·L-1,基于上述方法,离体实验1倍临床浓度为1.7 mL·L-1[13-14]。蟾酥注射液的豚鼠离体实验对应的临床1、 5、 10浓度分别为1.7、 8.5、17 (mL·L-1)。
1.4.3IL-6在体离体实验剂量及浓度计算 IL-6被用于心肌细胞电生理研究的浓度为(20 μg·L-1)[8],根据上述在体与离体换算比例,离体(20 μg·L-1)的浓度,对应的在体剂量为(18.4 μg·kg-1)。
1.5 在体心电图实验豚鼠由20%乌拉坦(5 mL·kg-1)进行腹腔注射麻醉,仰卧位固定,分离出颈外静脉,引导记录Ⅱ导联心电图。静脉缓慢累计注射蟾酥注射液 (1,5,10倍临床剂量)并稳定5 min,记录前后的心电图;或静脉缓慢注射IL-6(18.4 μg·kg-1),记录前后的心电图,再缓慢累计注射蟾酥注射液 (1, 5, 10倍临床剂量),记录前后的心电图,各组之间稳定5 min。分析心率(HR), P-R, QRS及QTc间期,QTc=QT/RR1/3(ms)[13-14]。在体实验对照实验表明,5 mL生理盐水静脉缓慢注射对心电图无作用(P>0.05,n=5)。
1.6 动作电位、L-type Ca2+及Na+电流记录电流钳法用于记录动作电位[13-14]。酶解法(胶原酶Ⅱ型2 g·L-1)分离豚鼠单个左心室肌细胞[15]。动作电位记录的细胞外液组成为(mmol·L-1):NaCl 117、KCl 5.7、NaHCO34.4、MgCl21.7、CaCl21.8、HEPES 20、葡萄糖20, 用NaOH 调pH至7.3。电极内液为(mmol·L-1):KCl 135、EGTA 10、HEPES 10、葡萄糖 5、K2ATP 3、Tris GTP 0.5, 用KOH 调pH至7.1。分析动作电位复极于90%水平的时程(APD90)。电压钳技术用于记录L-type Ca2+电流,细胞外液组成为(mmol·L-1): NaCl 132、CsCl 5.4、CaCl21.8、MgCl21.8、NaH2PO40.6、4-AP 5、HEPES 10、Glucose 10,用NaOH 调pH至7.3。电极内液为(mmol·L-1): CsCl 130、MgCl22、EGTA 11、HEPES 20、Glucose 10、Na2-ATP 2、Na-GTP 0.1,用CsOH 调pH至7.3。刺激方案: 钳制电位为-80 mV, 然后去极到-40 mV并持续30 ms,再去极到0 mV并持续300 ms,最后钳制电位回到-80 mV[13-14]。用于记录Na+电流的细胞外液组成为(mmol·L-1): NaCl 70、Choline-Cl 70、 KCl 5.4、 MgCl21、 CaCl20.1、 HEPES 10、 Glucose 10、 NaH2PO40.33, 用NaOH 调pH至7.3。电极内液为(mmol·L-1):CsCl 120、 EGTA 11、 HEPES 10、 Na2-ATP 5、 MgCl25、 CaCl21、 Glucose 11, 用CsOH调pH至7.3。刺激方案:钳制电位为-80 mV, 然后去极到-40 mV并持续50 ms,最后钳制电位回到-80 mV[13-14]。被分析的蟾酥注射液(1,5,10倍临床剂量)溶于细胞外液分别灌流,上一浓度被下一个完全取代并稳定5 min后记录电压或电流。

2 结果
2.1 蟾酥注射液、IL-6及合用对豚鼠在体心电图的影响蟾酥注射液5、 10倍临床剂量(7.5, 15 mL·kg-1)、IL-6(18.4 μg·kg-1)以及IL-6 (18.4 μg·kg-1)合用蟾酥注射液1、 5、 10倍临床剂量(1.5、 7.5、 15 mL·kg-1)均明显延长P-R和QTc间期,而对HR, QRS无明显作用。Tab 1、2及Fig 1分别为在体豚鼠ECG数据统计及代表性曲线。Fig 2显示在无与有IL-6(18.4 μg·kg-1)合用条件下,进行P-R及QTc间期比较。蟾酥注射液1, 5, 10倍临床剂量(1.5、 7.5、 15 mL·kg-1)分别使P-R间期从标准化Control (100±5.9)%延长到(107±5.2)%、 (111±8.5)%、 (120±3.2)%;而在IL-6 (18.4 μg·kg-1) 合用条件下,P-R间期从标准化Control的(100±1.8)%延长到(119±7.4)%、 (124±7.8)%、(135±11.2)%。同样QTc间期的变化为:无IL-6 (18.4 μg·kg-1) 合用条件下,从标准化Control的(100±3.2)%延长到(106±6.9)%、(110±5.1)%、(114±5.1)%;与IL-6 (18.4 μg·kg-1)合用条件下,从标准化Control(的100±8.3)%延长到(119±5.0)%, (127±6.2)%、(132±10.5)%。见Fig 2。

Fig 1 Representative in vivo guinea pig ECG curves before and after jugular veins injections of Chan Su (CS) (1, 5, 10 times clinically relevant doses, CRD) (A), or IL-6 plus CS (1, 5, 10 times CRD) (B), respectively.

Fig 2 Histograms of normalized P-R (A) and QTc (B) intervals to controls from in vivo guinea pig ECG, comparisons between Chan Su (CS) (1, 5, 10 times clinically relevant doses, CRD) and IL-6 (18.4 μg·kg-1) plus CS (1, 5, 10CRD)


Tab 2 Effects of IL-6 and combination of IL-6 and CS on HR, P-R, QRS and QTc intervals of guinea pig ECG in vivo n=5)
2.2 蟾酥注射液、IL-6及合用对对豚鼠动作电位的影响蟾酥注射液5、10倍临床浓度(8.5、17 mL·L-1)、IL-6 (20 μg·L-1)以及IL-6 (20 μg·L-1)合用蟾酥注射液1、 5、 10倍临床剂量(1.7、 8.5、 17 mL·L-1)均明显延长APD90。Fig 3为豚鼠左心室肌细胞动作电位代表性曲线以及数据统计直方图。蟾酥注射液1、 5、 10倍临床浓度(1.7、 8.5、 17 mL·L-1)分别使APD90从Control的(413±17.3) ms延长到(432±18.2) ms、 (463±21.0) ms、 (546±30.3) ms;而在IL-6 (20 μg·L-1)合用条件下,APD90从Control的(393±11.6) ms延长到IL-6 (20 μg·L-1)的442±21.6 ms,再延长到(472±23.8) ms、(551±38.6) ms、(611±28.5) ms。蟾酥注射液1, 5, 10倍临床浓度(1.7、8.5、17 mL·L-1)分别使APD90从标准化Control的(100±4.2)%延长到(105±4.4)%、(112±5.1)%、(132±7.3)%;与IL-6 (20 μg·L-1)合用条件下,从标准化Control的100±3.0%延长到(121±6.1)%、(140±9.8)%、(155±7.2)%。见Fig 3。
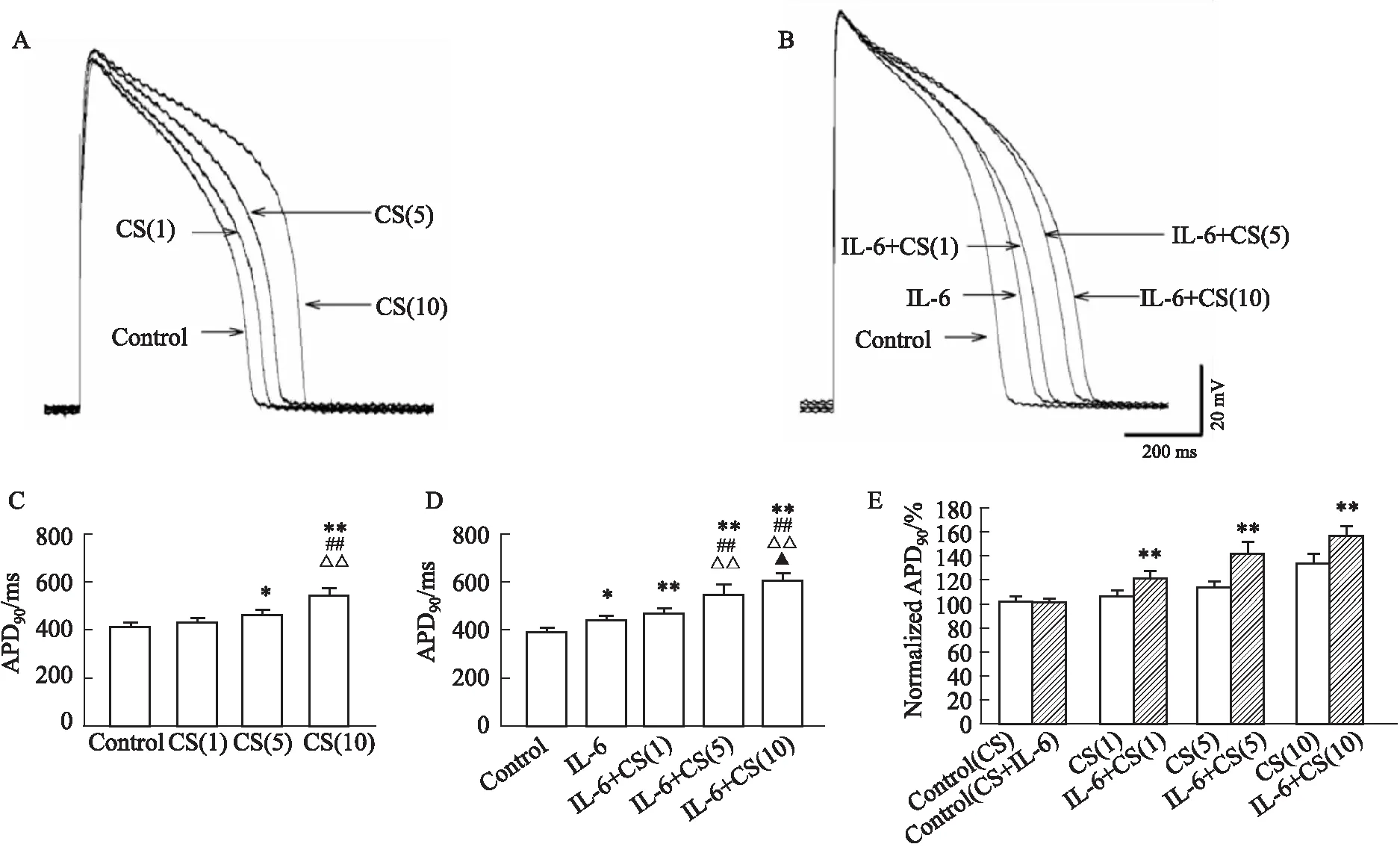
Fig 3 Representative action potential traces of CS (1, 5, 10 CRC) (A) and IL-6 combined with CS (1, 5, 10 CRC) (B), statistical histograms of APD90 by CS (1, 5, 10 CRC) (C) and IL-6 combined with CS (1, 5, 10 CRC) (D) and normalized APD90 (E) compared Chan Su (CS) (1, 5, 10 CRC) with IL-6 (20 mg·L-1) plus CS (1, 5, 10 CRC)
2.3 蟾酥注射液、IL-6及合用对钙电流的影响蟾酥注射液5、10倍临床浓度(8.5、17 mL·L-1)以及IL-6 (20 μg·L-1)合用蟾酥注射液1、5、10倍临床剂量(1.7、8.5、17 mL·L-1)均明显延长APD90。Fig 4为豚鼠左心室肌细胞钙电流代表性曲线以及标准化数据统计直方图。蟾酥注射液1、 5、 10倍临床浓度(1.7、 8.5、 17 mL·L-1)分别使APD90从标准化Control的100±4.8%分别抑制到(91±13.5)%、 (79±12.)2%、 (67±9.8)%;与IL-6 (20 μg·L-1)合用条件下,从标准化Control的(100±14.0)%抑制到IL-6 (20 μg·L-1) (86±12.4)%,再分别抑制到(70±7.5)%、 (60±8.0)%、 (52±5.3)%。见Fig 4。
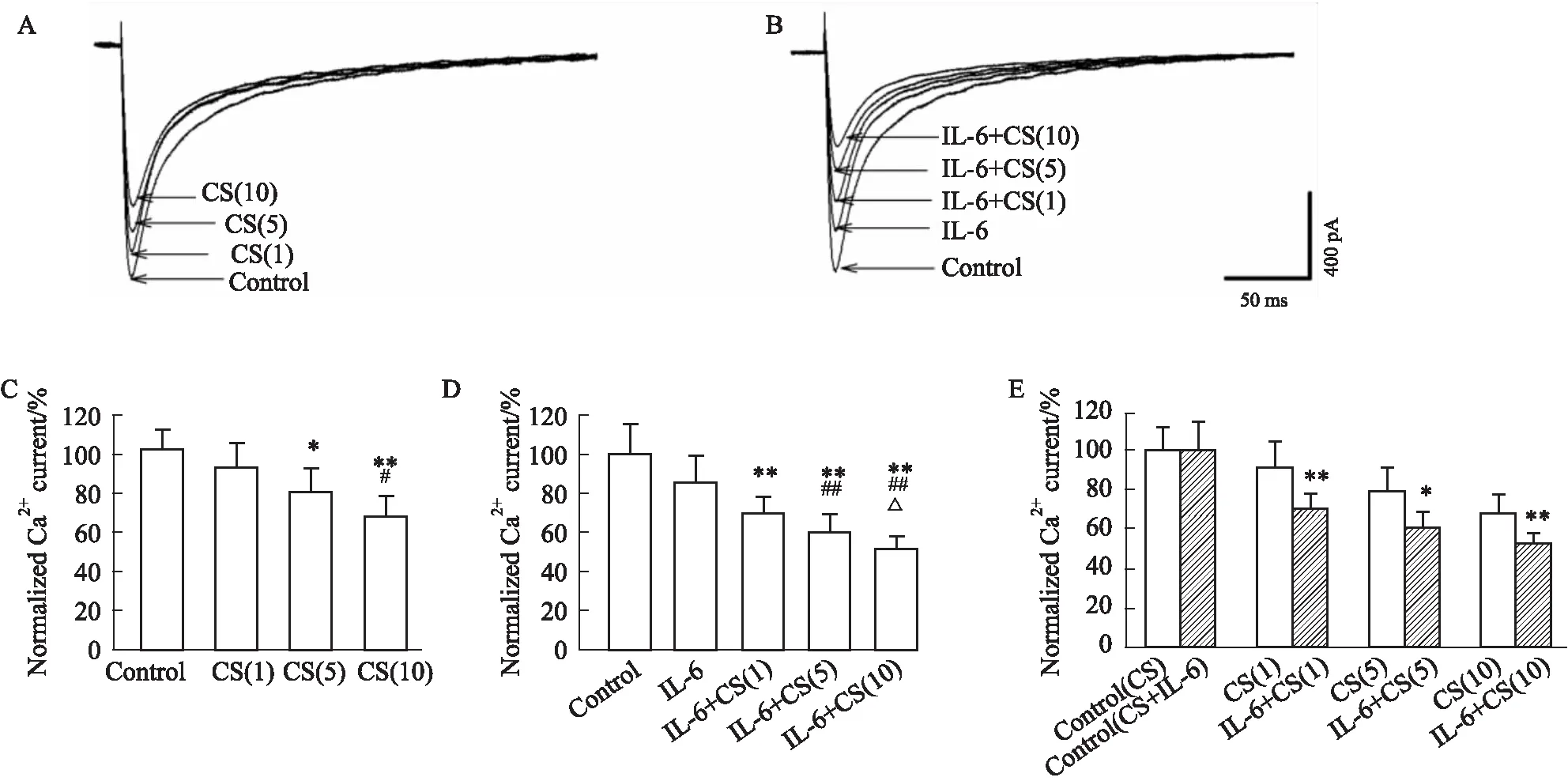
Fig 4 Representative Ca2+ current traces of CS (1, 5, 10 CRC) (A) and IL-6 combined with CS (1, 5, 10 CRC) (B), normalized histograms of Ca2+ currents by CS (1, 5, 10 CRC) (C) and IL-6 combined with CS (1, 5, 10 CRC) (D) and comparisons (E) between Chan Su (CS) (1, 5, 10CRC) with IL-6 (20 μg/mL) plus CS (1, 5, 10CRC)
2.4 蟾酥注射液、IL-6及合用对钠电流的影响蟾酥注射液1、 5、 10倍临床浓度(1.7、 8.5、 17 mL·L-1)、IL-6 (20 μg·L-1)以及IL-6 (20 μg·L-1)合用蟾酥注射液1、 5、 10倍临床浓度(1.7、 8.5、 17 mL·L-1)均未能明显影响钠电流。Fig 5为豚鼠左心室肌细胞钠电流代表性曲线以及标准化数据统计直方图。蟾酥注射液1、 5、 10倍临床浓度(1.7、 8.5、 17 mL·L-1)分别使钠电流从标准化Control的(100±8.5)%改变到(100±8.8)%、 (98±6.2)%、 (96±8.8)%;与IL-6 (20 μg·L-1)合用条件下,从标准化Control的100±12.1%改变到IL-6 (20 μg·L-1)的(97±9.5)%,再分别到(99±12.8)%、 (94±9.0)%、 (92±9.3)%。见Fig 5。

Fig 5 Representative Na+ current traces of CS (1, 5, 10 CRC) (A) and IL-6 combined with CS (1, 5, 10 CRC) (B), normalized histograms of Na+ currents by CS (1, 5, 10 CRC) (C), IL-6 combined with CS (1, 5, 10 CRC) (D) and comparisons (E) between Chan Su (CS) (1, 5, 10 CRC) with IL-6 (20 mg·L-1) plus CS (1, 5, 10 CRC)
3 讨论
心律失常是药物的心脏毒性最重要部分,严重状态下会导致患者猝死。因此,国际人用药物技术要求协调理事会(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)中安全性部分的S7B明确提出,任何一种药物或制剂在进入临床试验前必须进行心律失常风险评估。我国于2017年6月加入ICH组织,标志着许多没有通过心脏安全性评价的制剂需要进行再评价。药物心脏安全性评价是一系列复杂的科学研究,包括在体动物实验、离体心脏实验、心肌细胞动作电位以及多种离子通道实验。
本研究分别研究了单独蟾酥注射液,以及在IL-6与蟾酥注射液合用对豚鼠心电图各指标的作用,及其所基于的离子通道作用机理。蟾酥注射液5倍以上临床剂量条件下,导致在体豚鼠的P-R及QTc间期明显延长;而蟾酥注射液5倍以上临床浓度条件下,APD90明显延长以及Ca2+电流明显被抑制是其心电图改变的机理。此外,IL-6 (18.4 μg·kg-1)同样导致在体豚鼠的P-R及QTc间期明显延长,IL-6 (20 μg·L-1)明显延长APD90。由于IL-6的作用,蟾酥注射液1倍以上临床剂量导致P-R及QTc间期明显延长。对豚鼠左心室肌细胞Na+电流研究表明,蟾酥注射液(10倍临床浓度)、IL-6 (20 μg·L-1)以及IL-6 (20 μg·L-1)合用蟾酥注射液(10倍临床浓度)均未能明显改变Na+电流。
P-R间期是心房开始兴奋到心室开始兴奋的时间,其延长主要是房室结传导的延迟。房室结的去极化主要是钙离子通过钙通道引起的,其传导延迟标志蟾酥注射液具有钙通道的抑制作用。QRS是开始兴奋到兴奋结束的时间,代表心室内浦氏纤维的传导速度,其快速去极化是钠离子通过钠通道形成的。表明蟾酥注射液对浦氏纤维的钠通道无明显作用。QTc是心室开始兴奋到完全回复到静息状态,包括有钠通道介导的去极以及复极过程,而复极是IKr电流介导的[16],表明蟾酥注射液IKr电流具有明显抑制作用,通常某浓度化合物抑制IKr电流10%~20%就可导致APD90和QTc的延长[17]。在随后左心室肌细胞动作电位实验中,证明动作电位复极时程随蟾酥注射液的浓度增加逐步延长。表明蟾酥注射液对IKr电流有明显抑制作用。虽然本研究并没有研究IKr电流,但APD90延长与IKr电流抑制的程度基本成正相关。
被用于心脏安全性评价的化合物最高剂量和浓度,国际上并没有一个明确的规定,但学术界一般认为取决于其临床目的。用于重症疾病(如肿瘤晚期)的药物,10倍于治疗量无心电图及离子通道抑制作用就可接受,用于中等严重疾病(如中风等)的药物需30倍于治疗量,而用于轻微的疾病需100倍以上的治疗量[18]。按照这个标准,蟾酥注射液在临床上存在心律失常的风险,尤其在患者机体处于炎症状态。
综上所述,本研究心电图实验表明P-R及QTc间期延长,而动作电位研究证明了其时程延长。虽然动物实验实现了P-R及QTc间期延长的数字化,但临床上潜在的心律失常发生率取决于蟾酥注射液静脉给药的速度,更关键的是病人本身存在的心律失常的状态。按照ICH国际标准评价,蟾酥注射液存在心律失常高风险,但实际上临床蟾酥注射液并没有出现高心律失常的发生率。其原因是ICH关注的QTc延长的快速性室性心律失常,并不关注以P-R间期为特征的缓慢性心律失常。实际上,QTc延长的快速性心律失常在临床上会采用钙通道阻断剂治疗。也就是说,蟾酥注射液抑制钙通道本身就要治疗自身导致的室性快速性心律失常。因此,蟾酥注射液在临床上易导致房室传导阻滞,而非ICH关注的快速性室性心律失常,有房室传导阻滞以及炎症反应的患者应该谨慎使用蟾酥注射液。
——从一道浙江选考生物学试题谈起

