m iR-520c-3p介导的血管内皮生长因子A低表达对乳头状甲状腺癌细胞增殖、运动和血管再生的影响及其机制
邵建斌,方因,文霆,杨梅兰
1.厦门大学附属第一医院普外科福建厦门 361000;
2.厦门市思明区开元街道社区卫生服务中心健教科福建厦门 361000
甲状腺癌(thyroid cancer)是一种常见的内分泌相关肿瘤,研究显示,其发病率有逐渐上升趋势,且发病年龄越来越年轻化[1-2]。目前研究证明,甲状腺癌可按其病理分类,主要分为4个类型:乳头状甲状腺癌、滤泡状甲状腺癌、髓样甲状腺癌和未分化甲状腺癌[3-4]。目前的治疗方式包括内分泌治疗、化疗、基因治疗以及手术治疗,但手术后副作用较大,患者通常需终生服用甲状腺素片,因此,基因治疗成为目前较为关注的治疗方法之一[5-7]。miR-520c-3p被认为是肿瘤生长的负调节因子,与肿瘤的增殖、运动凋亡密切相关[8-9]。LEI等[10]研究表明,miR-520c-3p可抑制肝癌细胞的增殖,并促进其凋亡。张灵敏等[11]研究表明,miR-520c-3p可抑制结直肠癌细胞的恶性生物学特征。由此推测,miR-520c-3p对乳头状甲状腺癌细胞的增殖、运动和血管再生也有一定影响。
本研究旨在探讨miR-520c-3p介导的血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)对乳头状甲状腺癌细胞增殖、运动和血管再生的影响及其机制,为甲状腺癌的治疗奠定理论基础。
1 材料与方法
1.1细胞及质粒 乳头状甲状腺癌细胞B-CPAP由中科院协和细胞库提供;miR-520c-3p mimic、pcDNA-VEGFA、VEGFA野生及突变质粒(Luc-VEGFA 3′UTR wt和Luc-VEGFA 3′UTR mut)由上海禾午生物科技有限公司提供。
1.2主要试剂及仪器 双荧光素酶报告基因试剂盒、HRP标记的山羊抗兔/鼠抗体和ECL发光剂购自上海碧云天生物技术有限公司;兔源VEGFA、Ki67、PCNA、E-cadherin抗体、Vimentin抗体及鼠源GAPDH抗体购自美国Abcam公司;RPMI1640培养基和胎牛血清购自美国Hyelone公司;CCK-8检测试剂盒购自南京莱富赛生物科技有限公司;Transwell小室购自美国Corning Coseter公司;蛋白电泳及转膜仪购自美国Bio-Rad公司。
1.3细胞培养 用含100 U/mL青霉素和100 U/mL链霉素的RPMI1640培养基,于37℃,5%CO2培养箱内培养B-CPAP细胞,待细胞生长至对数生长期时进行后续试验。
1.4细胞转染及分组处理 将B-CPAP细胞分为Control、NCmimic、miR-520c-3p mimic、pcDNA vector、VEGFA和mimic+VEGFA组,其中Control组不做任何处理,NC mimic组转染mimic阴性对照物,miR-520c-3p mimic组单独转染miR-520c-3p mimic,pcDNA vector组转染pcDNA vector,VEGFA组转染pcDNA-VEGFA,mimic+VEGFA组联合转染miR-520c-3p mimic和pcDNA-VEGFA。该部分试验由上海基尔顿生物科技有限公司完成。
1.5靶向关系的验证 利用生物信息学软件Target Scan 7.2预测VEGFA是否为miR-520c-3p的结合片段。将VEGFA野生及突变质粒(Luc-VEGFA 3′UTRwt和Luc-VEGFA 3′UTRmut)分别与NCmimic、miR-520c-3p mimic转染B-CPAP细胞,使用双荧光素酶报告基因试剂盒检测各组的荧光素酶活性。
1.6相关基因表达水平检测 采用RT-PCR法。提取各组细胞总RNA,反转录合成cDNA,以其为模板进行PCR扩增,采用2-ΔΔCt法计算RNA的相对表达量,以GADPH为内参。miR-520c-3p基因上游引物:5′-ACACTCCAGCTGGGAAAGUGCTTCCTTT-3′,下游引 物:5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCACCCTCTA-3′[12];GAPDH基因上游引物:5′-GGTATCGTGGAAGGACTC-3′,下游引物:5′-GTAGAGGCAGGGATGATG-3′;VEGFA基因上游引物:5′-VEGFAGACGGACAGACAGACAGACAC-3′,下游引物:5′-CCGCCTCGGCTTGTCACAT-3′[13]。引物由武汉源深生物科技有限公司合成。
1.7相关蛋白表达水平检测 采用Western blot法。取各组B-CPAP细胞,4℃恒温条件下12 000×g离心10 min,加入裂解液裂解后,加入Loading Buffer缓冲液,测定蛋白浓度。经10%SDS-PAGE分离总蛋白,转移至PVDF膜上,置于5%脱脂牛奶中室温封闭2 h;分别加入兔源VEGFA(1∶1 000稀释)、Ki67(1∶1 500稀释)、PCNA(1∶1 000稀释)、E-cadherin(1∶2 000稀释)、Vimentin(1∶1 000稀释)抗体及鼠源GAPDH抗体(1∶1 000稀释),4℃孵育过夜;TBS洗膜5次,8 min/次,加入HRP标记的山羊抗兔/鼠抗体(1∶2 000稀释),室温孵育1 h;TBST洗膜5次,8 min/次,滴加ECL发光剂,暗室中发光显影。以GADPH为内参,目的蛋白条带与内参条带灰度值的比值为相对蛋白表达水平。
1.8细胞增殖能力的检测 采用CCK-8法。取各组细胞,调整细胞浓度为1×105个/mL,接种于96孔板中,37℃,5%CO2条件下培养,分别于1、2、3、4 d进行CCK-8检测,按照试剂盒说明书操作,酶标仪测波长为570 nm。
1.9细胞侵袭能力的检测 采用Transwell小室试验。用移液器在PVPF聚碳酸滤膜外表面均匀涂抹纤粘连蛋白,膜内侧涂matrigel。取各组细胞,按2×105个/孔接种于Transwell小室,37℃,5%CO2培养4 h;去除小室中膜内侧表面多余的细胞,用多聚甲醛固定,于显微镜400倍视野下随机选取10个视野,双盲计数法统计膜下表面的细胞数平均值,试验重复3次。
1.10微管结节数检测 采用微管形成试验。取各组细胞,按1×105个/mL接种于铺Matrigel基质胶的24孔板上,37℃,5%CO2培养,每隔4 h在显微镜下观察B-CPAP细胞的微管样结构,继续培养16 h后,计数细胞微管形成数目。
1.11统计学分析 采用SPSS 22.0软件对试验数据进行统计学分析,利用Graph Pad Prism 5软件作图,组间比较采用单因素方差分析,组间两两比较采用LSD法,以P<0.05为差异有统计学意义。
2 结果
2.1靶向关系的验证 生物信息学软件预测结果显示,miR-520c-3p与VEGFA 3′UTR192-198位点处存在结合位点,见图1。双荧光素酶报告基因检测结果显示,各组细胞荧光素酶相对活性差异有统计学意义(F=70.374,P<0.001),其中与Luc-VEGFA 3′UTR wt+NC mimic组比较,共转染Luc-VEGFA 3′UTR wt与miR-520c-3p mimic组细胞中荧光素酶相对活性明显降低(t=16.706,P<0.001),见图2。各组细胞miR-520c-3p表达水平差异有统计学意义(F=186.788,P<0.001),其中与NC mimic组比较,miR-520c-3p mimic组miR-520c-3p表达水平明显升高(t=23.676,P<0.001),见图3。
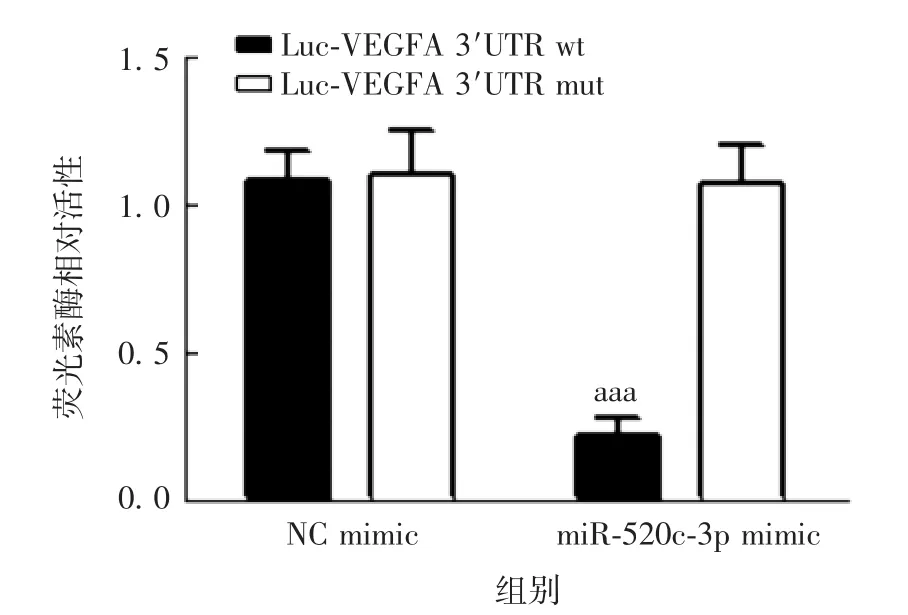
图2 双荧光素酶报告基因检测各组B-CPAP细胞的荧光素酶活性Fig.2 Determination of luciferase activities of B-CPAPcells in various groups by dual luciferase reporter gene assay

注:红色处表示结合位点。

图3 靶向关系验证试验各组B-CPAP细胞中miR-520c-3p的表达水平Fig.3 Expression levels of miR-520c-3p in B-CPAP cells of various groups in verification for targeting relationship
2.2各组B-CP A P细胞miR-520c-3p及VE GFA表达情况
2.2.1基因表达水平 各组细胞miR-520c-3p的表达水平差异有统计学意义(F=422.931,P<0.001),与Control组比较,miR-520c-3p mimic组miR-520c-3p表达水平明显升高(t=40.989,P<0.001),VEGFA组miR-520c-3p表达水平明显降低(t=9.624,P<0.001);与VEGFA组比较,mimic+VEGFA组miR-520c-3p表达水平明显升高(t=12.574,P<0.001),见图4。各组细胞VEGFAmRNA的表达水平差异有统计学意义(F=197.540和345.011,P均<0.001),其中与pcDNA vector组比较,VEGFA组VEGFAmRNA的表达水平明显升高(t=24.382,P<0.001);与Control组比较,miR-520c-3p mimic组VEGFAmRNA的表达水平明显降低(t=7.815,P<0.001);与VEGFA组比较,mimic+VEGFA组VEGFAmRNA的表达水平明显降低(t=32.117,P<0.001)。见图5。
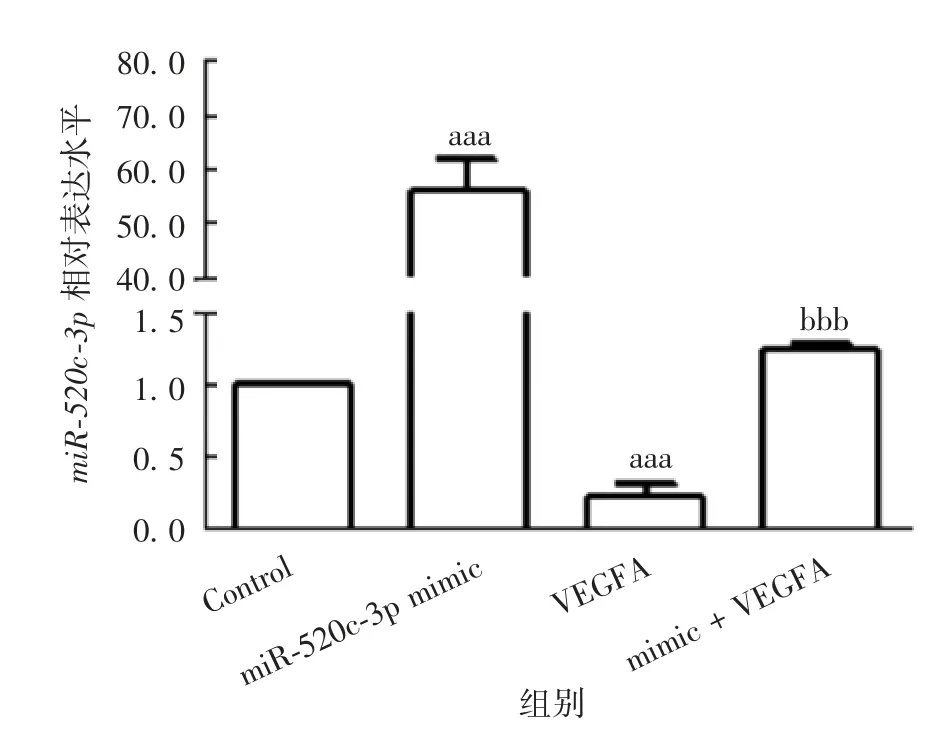
图4 靶向关系验证试验各组B-CPAP细胞中miR-520c-3p的表达水平Fig.4 Expression levels of miR-520c-3p in B-CPAP cells of various groups in verification for targeting relationship
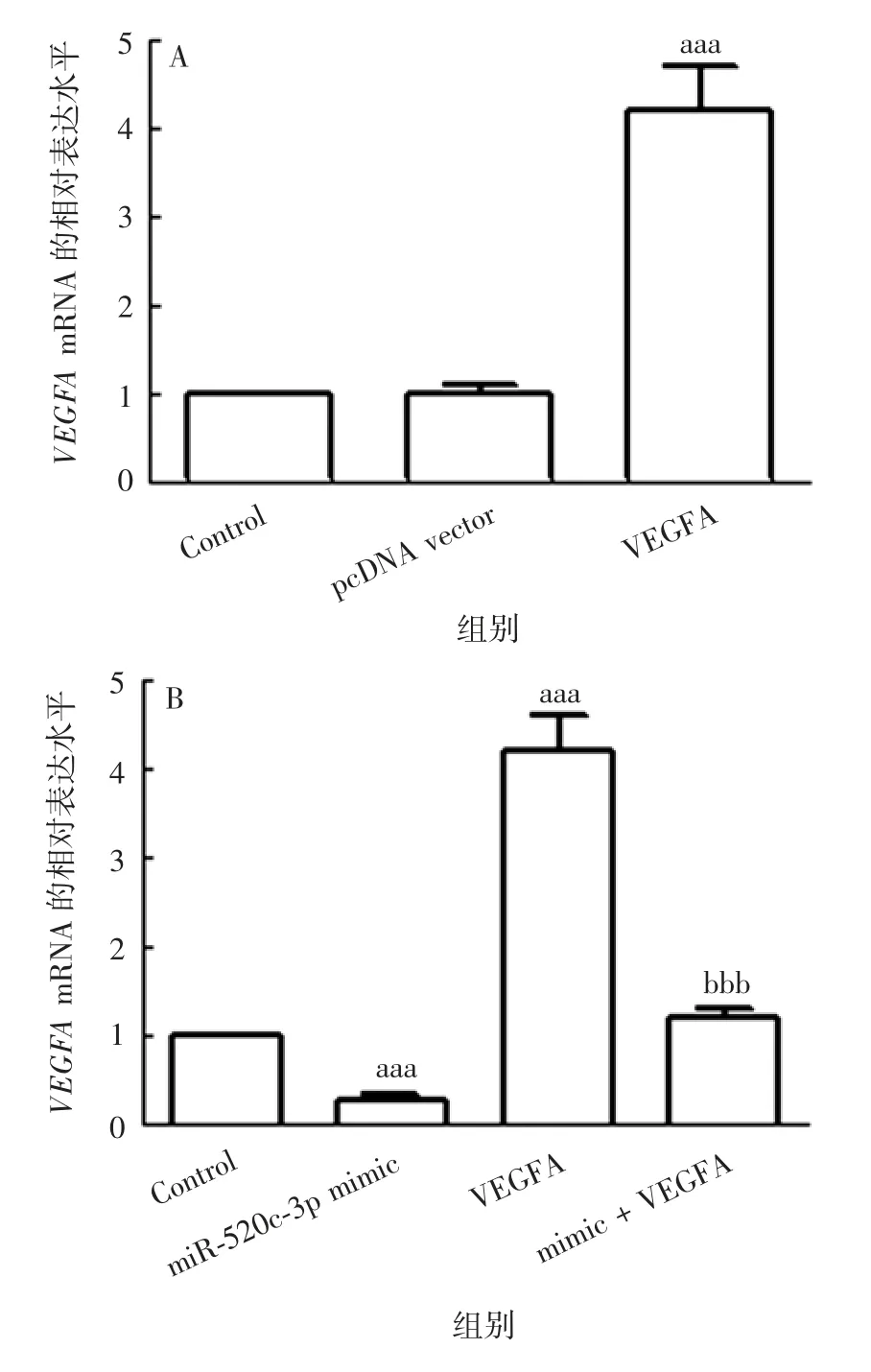
图5 各组B-CPAP细胞中VEGFA mRNA的表达水平Fig.5 Expression levels of VEGFA mRNA in cells of various groups
2.2.2蛋白表达水平 各组细胞VEGFA蛋白表达水平差异有统计学意义(F=55.265,P<0.001),与Control组比较,miR-520c-3p mimic组VEGFA蛋白表达水平明显降低(t=3.894,P=0.014),VEGFA组VEGFA蛋白表达水平明显升高(t=13.274,P<0.001);与VEGFA组比较,mimic+VEGFA组VEGFA蛋白表达水平明显降低(t=12.389,P<0.001)。见图6和图7。

图6 Western blot分析各组B-CPAP细胞中VEGFA蛋白的表达Fig.6 Western blotting of VEGFA expressions in B-CPAP cells of various groups

图7 各组B-CPAP细胞中VEGFA蛋白的表达水平Fig.7 Expression levels of VEGFA protein in B-CPAPcells of various groups
2.3miR-520c-3p介导VE GFA对B-CP A P细胞增殖能力的影响
2.3.1细胞增殖活性 各组细胞培养4 d时的增殖活性差异有统计学意义(F=43.561,P<0.001),与Control组比较,miR-520c-3p mimic组细胞增殖活性明显降低(t=5.379,P=0.002),VEGFA组细胞增殖活性明显升高(t=10.489,P<0.001);与VEGFA组比较,mimic+VEGFA组细胞增殖活性明显降低(t=9.548,P<0.001)。见图8。

图8 各组B-CPAP细胞的增殖活性Fig.8 Proliferation activities of B-CPAP cells in various groups
2.3.2增殖相关蛋白的表达 各组细胞Ki67和PCNA蛋白的表达水平差异有统计学意义(F分别为147.127和82.599,P<0.001),与Control组比较,miR-520c-3p mimic组Ki67和PCNA蛋白的表达水平均明显降低(t分别为5.914和5.506,P分别为<0.001和0.001),VEGFA组Ki67和PCNA蛋白的表达水平均明显升高(t分别为22.179和15.733,P均<0.001);与VEGFA组比较,mimic+VEGFA组Ki67和PCNA蛋白的表达水平均明显降低(t分别为18.647和14.859,P均<0.001)。见图9和图10。

图9 Western blot分析各组B-CPAP细胞中增殖相关蛋白的表达Fig.9 Western blotting of expressions of proliferationassociated proteins in B-CPAPcells of various groups

图10 各组B-CPAP细胞中增殖相关蛋白的表达水平Fig.10 Expression levels of proliferation-associated proteins in B-CPAPcells of various groups
2.4miR-520c-3p介导VE GFA对B-CP A P细胞侵袭能力的影响
2.4.1细胞侵袭能力 各组细胞侵袭数差异有统计学意义(F=45.865,P<0.001),与Control组比较,miR-520c-3p mimic组细胞侵袭数明显降低(t=8.606,P<0.001),VEGFA组细胞侵袭数明显升高(t=7.934,P<0.001);与VEGFA组比较,mimic+VEGFA组细胞侵袭数明显降低(t=9.144,P<0.001)。见图11和图12。
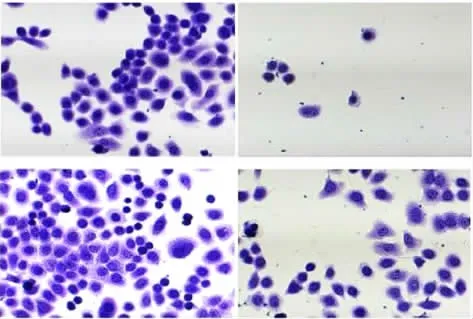
图11 各组B-CPAP细胞侵袭能力的显微镜观察(×400)Fig.11 Microscopy of invasion abilities of B-CPAP cells in various groups(×400)
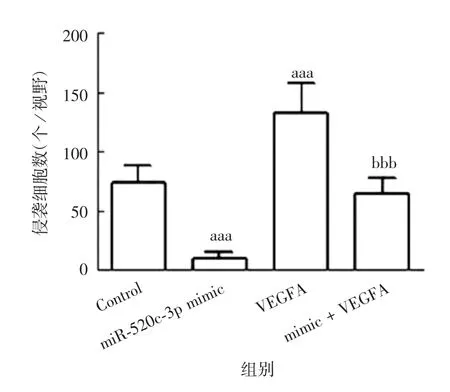
图12 各组B-CPAP细胞的侵袭能力Fig.12 Invasion abilities of B-CPAPcells in various groups
2.4.2侵袭相关蛋白的表达 各组细胞E-cadherin和Vimentin蛋白的表达水平差异有统计学意义(F分别为62.296和51.111,P均<0.001),与Control组比较,miR-520c-3p mimic组E-cadherin蛋白的表达水平明显升高,Vimentin蛋白的表达水平明显降低(t分别为14.935和3.770,P分别为<0.001和0.043),VEGFA组E-cadherin蛋白的表达水平明显降低,Vimentin蛋白的表达水平明显升高(t分别为5.384和12.147,P均<0.001);与VEGFA组比较,mimic+VEGFA组E-cadherin蛋白的表达水平明显升高,Vimentin蛋白的表达水平明显降低(t分别为3.849和13.822,P分别为0.038和<0.001)。见图13和图14。

图13 Western blot分析各组B-CPAP细胞中侵袭相关蛋白的表达Fig.13 Western blotting of invasion-associated proteins in B-CPAPcells of various groups
2.5miR-520c-3p介导VE GFA对B-CP A P细胞微管形成的影响 各组细胞微管结节数差异有统计学意义(F=45.412,P<0.001),与Control组比较,miR-520c-3p mimic组细胞微管结节数明显降低(t=6.336,P<0.001),VEGFA组细胞微管结节数明显升高(t=10.031,P<0.001);与VEGFA组比较,mimic+VEGFA组细胞微管结节数明显降低(t=8.975,P<0.001)。见图15和图16。
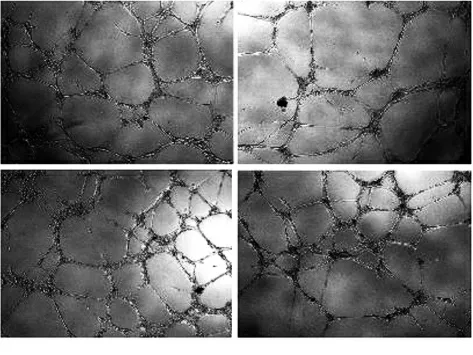
图15 各组B-CPAP细胞微管结节数的显微镜观察(×100)Fig.15 Microscopy of numbers of microtubule nodules in B-CPAPcells of various groups(×100)
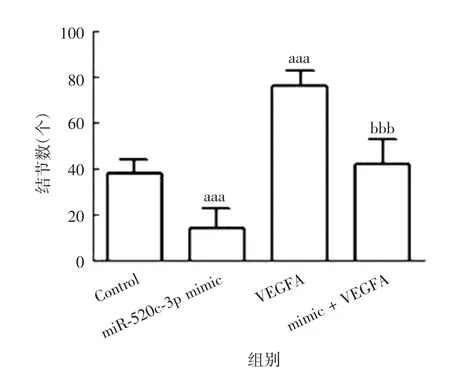
图16 各组B-CPAP细胞的微管结节数Fig.16 Numbers of microtubule nodules in B-CPAP cells of various groups
3 讨论
VEGFA是VEGF的一个亚型,也是对血管内皮细胞增殖和分化影响最大的亚型,多项研究表明[14-15],VEGFA在实体瘤和血液肿瘤中异常高表达,参与肿瘤的发生发展。本研究利用生物信息学软件预测VEGFA为miR-520c-3p的靶基因,并通过双荧光素酶报告基因检测验证其靶向关系。为进一步验证转染效率,采用B-CPAP细胞单独或联合转染miR-520c-3p mimic和pcDNA-VEGFA,经Western blot和RTPCR检测发现,VEGFA组VEGFAmRNA相对表达水平较对照组显著升高,miR-520c-3p mimic组miR-520c-3p相对表达水平显著升高,VEGFA mRNA及蛋白相对表达水平显著降低;与VEGFA组比较,联合转染的mimic+VEGFA组VEGFA mRNA及蛋白相对表达水平均显著降低,miR-520c-3p相对表达水平显著升高。表明成功地将miR-520c-3p和VEGFA导入了B-CPAP细胞中。
肿瘤的恶性生物学特征包括恶性增殖、侵袭与转移等,其中肿瘤的恶性增殖与相关蛋白和增殖相关蛋白密切相关[16-17]。Ki67是一种重要的增殖相关蛋白,当Ki67高表达时,细胞的有丝分裂加速[18]。PCNA是增殖细胞核抗原,与细胞增殖分化密切相关,当PCNA高表达时,细胞增殖加速[19]。本研究通过CCK-8染色试验发现,miR-520c-3p mimic组细胞增殖活性显著降低,表明miR-520c-3p mimic可明显抑制B-CPAP细胞增殖活性。为了探究其机制,本研究采用Western blot法检测增殖相关蛋白的表达,与VEGFA组比较,mimic+VEGFA组Ki67和PCNA蛋白表达水平显著降低,表明miR-520c-3p可靶向抑制VEGFA表达,并下调增殖相关蛋白表达,使B-CPAP细胞的增殖受到抑制。李庆贺等[20]研究表明,长链非编码RNA可通过靶向下调VEGFA表达,进而抑制癌细胞增殖、侵袭和迁移,并促进细胞凋亡,与本研究得到的结论相类似。
肿瘤的侵袭与转移也是其重要的恶性生物学特征,这种特征受上皮间质转化(epithelial mesenchyml transition,EMT)可使得上皮细胞极性丧失并获得移动能力[21-23]。EMT过程受相关蛋白的调控,如Ncadherin、E-cadherin及Vimentin等[24]。E-cadherin为E-钙黏蛋白,也是调节EMT过程的重要蛋白,Ecadherin减少会使间质细胞标志物如Vimentin、纤联蛋白等表达上调,使得上皮细胞失去黏附连接作用,增强细胞的侵袭及转移能力[25-26]。本研究通过Transwell检测细胞侵袭情况,发现mimic+VEGFA组侵袭迁移能力显著降低。为了验证其作用机制,本研究采用Western blot检测相关蛋水平白的表达,结果显示,与VEGFA组比较,mimic+VEGFA组Vimentin蛋白表达量显著降低,E-cadherin蛋白表达水平显著升高,表明miR-520c-3p介导VEGFA低表达可通过EMT过程抑制肿瘤细胞的运动能力。这与方淑芬等[27]研究指出下调VEGFA的表达可调控肿瘤细胞的EMT过程的结论相类似。
综上所述,本研究结果表明,miR-520c-3p可通过介导VEGFA低表达实现抑制甲状腺癌细胞增殖和运动的能力。

