基于生物信息学分析STMN1基因在肝细胞癌中预后及免疫浸润的临床意义
0 引言
肝细胞癌(hepatocellular carcinoma,HCC)是癌症相关死亡的第四大原因
.HCC通常由乙型肝炎(hepatitis B virus,HBV)感染和慢性肝病引起,导致关键驱动基因(如p53和CTNNB)的基因畸变
.虽然系统化治疗显著提高了肝癌患者的五年生存率,但探索肝癌的潜在分子机制对于帮助制定更有效的治疗策略是非常必要的.
(stathmin 1)是一种属于微管失稳蛋白家族
的基因,被功能性肿瘤抑制蛋白p53
转录抑制.STMN1首次被鉴定为一种细胞磷酸化蛋白,并于1983年在白血病中过度表达
.STMN1在多种癌症中被发现上调,如非小细胞肺癌、乳腺癌和胃癌,其可以在实体肿瘤中诱导细胞分化、增殖和迁移,并与不良的临床预后相关
.然而,STMN1在肝细胞癌中的作用和机制仍不清楚.
本研究中,我们探索了
基因在肝细胞癌中的表达情况.此外我们探索了STMN1表达与肝细胞癌预后和免疫浸润的相关性,以期为肝细胞癌的诊治提供理论依据.
1 材料和方法
1.1 材料 从癌症基因图谱(https://portal.gdc.cancer.gov,TCGA)数据库下载肝细胞癌患者的临床信息和高通量RNA测序数据.共424份
基因表达谱样本(374份HCC样本和50份癌旁样本).
使用R语言包将肝细胞癌的原始转录组测序数据(level 3,HTSeq-FPKM)转换为TPM(transcripts per million reads)格式的数据进行差异分析和生存分析.在后续分析中,根据Z-score标准化的中值(4.681),将肝细胞癌分为高STMN1表达组和低STMN1表达组分析
基因表达与患者临床特征的关系.
高职院校的学生十分重视教师及同学的认可,教师及同学认可激发学生学习的积极性。因而,学生在完成每个任务之后,教师均需积极鼓励学生,使学生感受到教师的重视,激发其学习积极性。同时,教师还需及时对学生任务完成情况进行评价,使学生认识到自己的不足并加以改正。另外,教师还需采取多种评价方式对学生学习行为进行评价(比如:采用学生评价),以达到提升教学效果的目的。
此外,还进行了单因素Cox回归分析,结果表明T分期、M分期、临床分期、肿瘤状态和STMN1高表达均为影响患者预后的因素(
<0.05).多因素Cox回归分析显示STMN1的高表达是肝细胞癌患者预后的独立危险因素[HR=1.808(1.288-2.234),
=0.014,表3].肿瘤状态和STMN1表达用于构建肝细胞癌的临床预后风险评分(图2D).同时,使用校准图评估模型的预测精度(图2E),结果表明,STMN1表达水平可以更好地预测患者的1年、3年和5年生存率.总之,所有这些结果表明STMN1表达水平与肝细胞癌患者的预后相关.
1.3
基因富集分析 基因集富集分析(gene set enrichment analysis,GSEA)
方法用于分析STMN1表达相关通路,数据集c2.cp.v7.2.symbols.gmt[Curated]用于通路的分析,用缺省加权富集法进行富集分析,随机组合1000次.具有统计学意义的GSEA分析的阈值设置为校正后的
<0.05和FDR<0.25.使用校正的
值和归一化的富集分数(NES)表征富集分析的结果.ggplot2包用于GSEA富集分析和可视化.
1.4 免疫浸润分析 24种不同免疫细胞类型的标记来自Bindea的研究
.使用ssGSEA方法分析了肿瘤中24种免疫细胞类型的浸润.采用Spearman相关法分析
与上述24种免疫细胞的相关程度,以及STMN1高低表达组间免疫细胞浸润的分析.GSVA
包用于可视化分析.
所有统计分析均在R(v3.6.2)软件中进行.Mann-Whitney
检验用于分析肝细胞癌组织和正常组织的表达差异,而配对样本
检验用于配对样本分析.受试者工作特征(receiver operating characteristic curve,ROC)曲线用于分析STMN1表达是否可以作为诊断标志物.卡方检验或Fisher精确检验用于分析STMN1表达与临床病理特征之间的关系.Cox风险回归分析用于评估STMN1表达的预后价值.由于TCGA数据库中的临床信息不完整,并非每个样本都记录了年龄、TNM分期、治疗结果等临床基线信息,因此不可能对每个临床类别进行完整分析.因此,在结果部分的表格中,样本总数与不同临床类别的样本数之间存在差异.以
<0.05为差异具有统计学意义.
2 结果
2.1 STMN1表达与临床特征的关系 对肝细胞癌和正常组织中的
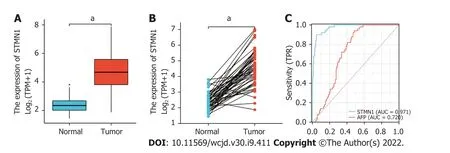
表达进行了分析,揭示了STMN1在肿瘤组织中高表达(
<0.001,图1A).同时,分析STMN1在肝细胞癌组织和配对相邻非肿瘤组织中的表达,结果也表明STMN1在肿瘤组织中高表达(
<0.001,图1B).此外,采用ROC曲线分析STMN1的诊断价值,ROC曲线下面积(area under ROC curve,AUC)为0.971,结果表明同甲胎蛋白(alpha-fetoprotein,AFP)相比STMN1的预测能力有较高准确性,可能是一种潜在的诊断生物标志物(图1C).
此外,采用卡方检验或Fisher精确检验分析STMN1表达与临床特征之间的关系.
基因低表达组和高表达组在总体生存率(
=0.013)、T分期(
=0.002)、TNM分期(
=0.008)、年龄(
=0.006)和肿瘤分级(
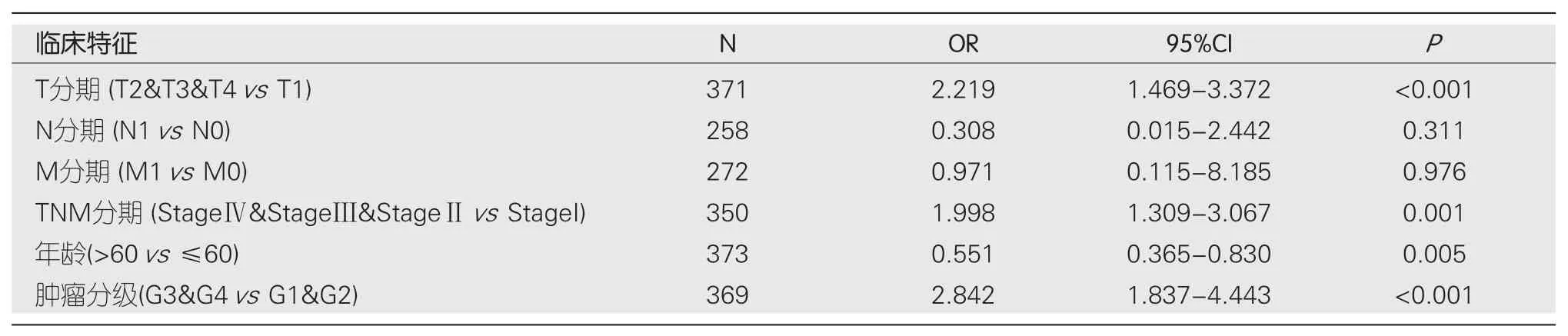
<0.001)方面比较,差异具有统计学意义(表1).此外,STMN1表达的单变量Logistic回归也表明STMN1与临床特征之间存在密切关系,包括T分期[OR=2.219(1.469-3.372),
<0.001],TNM分期[OR=1.998(1.309-3.067),
=0.001)],年龄[OR=0.551 (0.365-0.830),
=0.005]以及肿瘤分级[OR=2.842 (1.837-4.443),
<0.001] (表2).在与N分期、M分期的关系中未发现显著差异[OR=0.308 (0.015-2.442),
=0.311]、[OR=0.971(0.115-8.185),
=0.976].

肝癌是全球第六大常见癌症,也是第四大癌症死亡原因
.慢性肝病和肝硬化是肝癌最重要的危险因素,其中病毒性肝炎和过量饮酒是世界范围内的主要危险因素.糖尿病和肥胖症等慢性疾病会增加患肝癌的风险.研究还发现
,由于睾酮水平较高,男性的发病率高于女性.肝细胞癌占原发性肝癌的80%以上
,是最常见的肝癌之一,发病率和死亡率都很高.大多数肝癌患者的预后较差,虽然肝硬化患者的监测可用于早期肝肿瘤的诊断,但大多数肝癌患者在诊断时已为晚期
,这使得肝癌的治疗充满挑战.目前,只有原位肝移植或手术切除才能治愈
,但治疗效果也取决于肿瘤的大小和位置以及肝脏的状态.尽管化疗和放疗可以延长患者的总体生存期,但由于肿瘤复发和癌细胞的耐药性,结果仍然不令人满意
.因此,发现肝癌组织中异常表达的蛋白并确定其作用机制,将为肝癌的诊疗提供新的作用靶点.
1.2 方法
基因表达与患者临床特征及预后关系的分析.我们使用R软件,利用pROC包[1.17.0.1版本](用于分析)和ggplot2包[3.3.3版本](用于可视化)分析了来自TCGA肝细胞癌项目中RNAseq数据,以明确STMN1在预测肝细胞癌能力的准确性;使用Kaplan-Meier法分析高表达组和低表达组患者总体生存率、无进展生存率和无病生存率的差异,利用survminer包[0.4.9版本]和survival包[3.2-10版本]用于可视化及生存资料的统计分析.用单因素和多因素Cox回归分析研究STMN1在肝细胞癌中的预后价值,利用survival包[3.2-10版本]用于生存资料的统计分析.


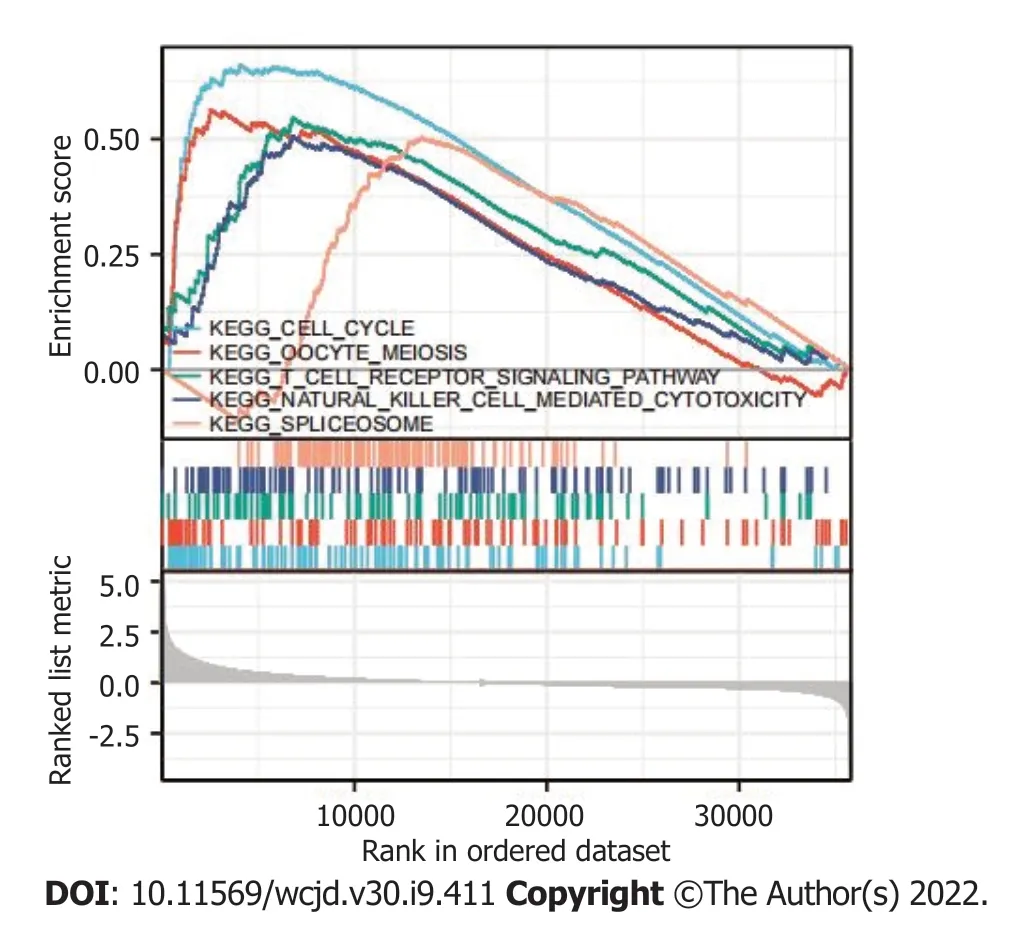
2.3 STMN1表达的GSEA分析 GSEA富集分析用于确定STMN1低表达和高表达之间的功能和生物学途径.根据标准化富集分数(NESs),选择在
基因表达方面最显著的富集信号通路(图3和表4).GSEA分析结果表明,
基因在肝细胞癌中主要参与细胞周期、卵母细胞减数分裂、T细胞受体信号通路、自然杀伤细胞介导的细胞毒性及剪接体等.

2.4 STMN1表达与免疫浸润的关系 接下来,在肝细胞癌中评估
表达与24种不同免疫细胞类型之间的关系.STMN1表达与辅助T细胞2、滤泡辅助T细胞和辅助性T细胞密切正相关,与中性粒细胞、辅助T细胞17、树突状细胞等密切负相关(图4A).进一步的研究表明,STMN1高低表达组间的免疫细胞包括TFH细胞、Th2细胞、中性粒细胞、NK CD56
细胞、pDC细胞、DC细胞等存在显著差异(图4B-D).

3 讨论
2.2 STMN1在肝细胞癌中表达的预后价值 STMN1表达与总生存率(overall survival,OS)、无进展生存率(progress free survival,PFS)和疾病特异性生存率(disease specific survival,DSS)预后结果的关系如图2A-C所示:
基因高表达组的总生存率、无进展生存率以及疾病特异性生存率均低于低表达组,统计值分别为[危险比(hazard ratio,HR)=1.89(1.33-2.69),
<0.001,图2A]、[HR=1.88(1.40-2.52),
<0.001,图2B]和[HR=1.96(1.25-3.07),
=0.004,图2C].
在本研究中,笔者利用TCGA数据库,发现在肝癌患者的癌症组织中STMN1 mRNA表达量高于正常组织.单因素Logistic回归分析显示STMN1高表达与肿瘤T分期、TNM分期、年龄以及肿瘤分级相关.以上结果说明STMN1高表达与肝癌的发生、发展相关.其次,采用ROC曲线分析STMN1的诊断价值,表明其对肝癌的预测能力具有较高准确性.Kaplan-Meier生存曲线结果表明,STMN1高表达导致肝癌患者生存率下降,Cox回归分析显示STMN1表达量是患者预后的独立危险因素,即STMN1高表达导致了肝癌患者的不良预后.GSEA分析结果表明,
基因在肝细胞癌中主要参与细胞周期、卵母细胞减数分裂、T细胞受体信号通路、自然杀伤细胞介导的细胞毒性及剪接体等信号通路.
互联网+技术的优势在于低投入、速度快、覆盖面广,并能将思维与阅读方式进行有效融合,使阅读推广的模式不断增加。互联网+模式的应用能将阅读推广形式和阅读推广规模进行全面转变,从而更好的掌握目标群体的阅读需求变化。
步骤1 建立模糊判断矩阵R=(rij)n×n,rij表示本层次中第i个元素与第j个元素之间模糊关系的相关度(即相对重要程度)。为了能够定量地描述任意两个路由度量之间的相对重要程度,本文采用表2所示的0.1~0.9标度法[8]。
综上所述,结合时代的发展和经济体系的改革来看,对于人才的需求和整体培养模式相比,过去已经出现很多不同。因此,对于商学院而言,在人才培养路径构建方面,必须要不断的创新,提升资源利用的有效性,确立特色人才培养目标,革新相关理念,在完善人才培养路径和理念指引下,培养出专业化、现代化全球化适应市场发展,满足经济体系要求的毕业生,为社会发展贡献更多人才。政府、社会和其他相关机构也应当为商学院的发展提供一定的帮助,在政策条件、资金支持和社会鼓励等多元措施的帮助下,促进商学院发展,提升整体的教学效率和质量。
STMN1最初被鉴定为一种对细胞信号(如生长因子
)作出磷酸化反应的细胞质蛋白.STMN1也是微管动力学的关键调节器,通过结合微管蛋白二聚体
使微管降解.STMN1参与多种疾病,在细胞过程中发挥关键作用.作为癌细胞生物学中的一个癌基因,STMN1在包括细胞增殖、分化和细胞周期在内的各种癌症进展中发挥作用.据报道,胰腺癌中的STMN1水平高于相应的正常组织
.在前列腺癌中STMN1的敲除导致细胞增殖和侵袭、肿瘤生长和转移的减少
.在前列腺癌中,将转染了抗STMN1腺病毒的癌细胞暴露于紫杉醇中可诱导完全抑制增殖和克隆形成,并显著增加凋亡
.在胃癌中,STMN1的表达与癌症的可治愈性、复发和对辅助治疗的耐药性有关,
基因的敲除抑制了胃癌细胞的增殖,并使细胞对紫杉醇敏感
.
4 结论
工草隶,善丹青。七八岁时学书,羲之密从后掣其笔,不得,叹曰:“此儿后当复有大名。”尝书壁为方丈大字,羲之甚以为能,观者数百人。桓温尝使书扇,笔误落,因画作乌驳犊牛,甚妙。[9](《王献之传》,P2105)
此外,在肝细胞癌中我们分析了STMN1表达与24种不同免疫细胞类型之间的关系,显示STMN1表达与辅助T细胞2、滤泡辅助T细胞和辅助性T细胞密切正相关,与中性粒细胞、辅助T细胞17、树突状细胞等密切负相关,但STMN1与肿瘤浸润免疫细胞的直接关系仍需要组织样本及细胞实验进一步研究.
政策的再次收紧让物流企业不得不重新思量,经济的多重化使物流再次陷入不确定,在变与不变之间,再次处于历史交口的中国物流业,尤为重要的是总结多年开放的经验,不忘初心,继往开来。建设物流强国是新时代赋予新物流的新使命,近期需要重点突出务实推进。
综上所述,STMN1在肝细胞癌中表达异常升高,与患者的恶性进展特征相关,有望成为肝细胞癌患者的独立预后因素和潜在分子治疗靶点.但本研究结果为基于数据库挖掘分析,具有一定的局限性,关于
基因是如何调控并促进肝癌的发生、发展及其与各相关信号通路之间的关系仍不甚明确,尚需大量基础实验及临床试验进一步探讨.
肝细胞癌是癌症相关死亡的第四大原因,其通常由乙型肝炎感染和慢性肝病引起,导致关键驱动基因的基因畸变.虽然系统化治疗显著提高了肝癌患者的五年生存率,但防控形势依旧严峻.因此,寻找新的肝癌标志物和潜在治疗靶点,研究其在肝癌发病过程中的分子机制对于肝癌防控具有重要意义.
2.1 两组阴道分泌物炎性因子比较 观察组阴道分泌物炎性因子均高于对照组,且观察组中不同分类与病程者的阴道分泌物炎性因子比较,差异有统计学意义(P<0.05),见表1。
通过生物信息学探索STMN1在肝细胞癌中的潜在临床意义.
经过多年不懈的努力,我国政府部门预算改革已经取得长足进步,这个成果的进一步巩固、发展,需要通过提高预算绩效管理水平来完善。作为强大的科学有效的现代管理手段,预算绩效管理的作用并没有得到充分发挥,作用尚有待加强。主要体现在以下几个方面:
探究S T M N1是否与肝细胞癌免疫浸润有关,探索STMN1是否影响肝细胞癌患者的预后.
式中: xi表示峰的中心位置;ωi表示半峰宽;Ai表示峰的面积;y0表示调整基线的位置。则含噪的微流控芯片信号模型可表示为:
通过生物信息学分析STMN1在肝细胞癌中的表达情况.探索STMN1对肝细胞癌患者预后的影响.分析STMN1表达与肝细胞癌免疫浸润的相关性.
基因在肝细胞癌中呈高表达.STMN1高表达的肝癌患者预后差.STMN1表达与肝细胞癌的免疫细胞浸润相关.
基因在肝癌患者呈高表达且与免疫浸润有关.
基因可能为潜在的肝癌免疫治疗和预后标志物.
1 Villanueva A.Hepatocellular Carcinoma.
2019;380:1450-1462 [PMID:30970190 DOI:10.1056/NEJMra1713263]
2 Craig AJ,von Felden J,Garcia-Lezana T,Sarcognato S,Villanueva A.Tumour evolution in hepatocellular carcinoma.
2020;17:139-152 [PMID:31792430 DOI:10.1038/s41575-019-0229-4]
3 Holmfeldt P,Sellin ME,Gullberg M.Predominant regulators of tubulin monomer-polymer partitioning and their implication for cell polarization.
2009;66:3263-3276 [PMID:19585080 DOI:10.1007/s00018-009-0084-5]
4 Sellin ME,Holmfeldt P,Stenmark S,Gullberg M.Global regulation of the interphase microtubule system by abundantly expressed Op18/stathmin.
2008;19:2897-2906 [PMID:18434595 DOI:10.1091/mbc.e08-01-0058]
5 Mistry SJ,Atweh GF.Role of stathmin in the regulation of the mitotic spindle:potential applications in cancer therapy.
2002;69:299-304 [PMID:12415323]
6 Rubin CI,Atweh GF.The role of stathmin in the regulation of the cell cycle.
2004;93:242-250 [PMID:15368352 DOI:10.1002/jcb.20187]
7 Sobel A,Tashjian AH Jr.Distinct patterns of cytoplasmic protein phosphorylation related to regulation of synthesis and release of prolactin by GH cells.
1983;258:10312-10324 [PMID:6411711]
8 Hsieh SY,Huang SF,Yu MC,Yeh TS,Chen TC,Lin YJ,Chang CJ,Sung CM,Lee YL,Hsu CY.Stathmin1 overexpression associated with polyploidy,tumor-cell invasion,early recurrence,and poor prognosis in human hepatoma.
2010;49:476-487 [PMID:20232364 DOI:10.1002/mc.20627]
9 Zheng P,Liu YX,Chen L,Liu XH,Xiao ZQ,Zhao L,Li GQ,Zhou J,Ding YQ,Li JM.Stathmin,a new target of PRL-3 identified by proteomic methods,plays a key role in progression and metastasis of colorectal cancer.
2010;9:4897-4905 [PMID:20806969 DOI:10.1021/pr100712t]
10 Subramanian A,Tamayo P,Mootha VK,Mukherjee S,Ebert BL,Gillette MA,Paulovich A,Pomeroy SL,Golub TR,Lander ES,Mesirov JP.Gene set enrichment analysis:a knowledge-based approach for interpreting genome-wide expression profiles.
2005;102:15545-15550 [PMID:16199517 DOI:10.1073/pnas.0506580102]
11 Bindea G,Mlecnik B,Tosolini M,Kirilovsky A,Waldner M,Obenauf AC,Angell H,Fredriksen T,Lafontaine L,Berger A,Bruneval P,Fridman WH,Becker C,Pagès F,Speicher MR,Trajanoski Z,Galon J.Spatiotemporal dynamics of intratumoral immune cells reveal the immune landscape in human cancer.
2013;39:782-795 [PMID:24138885 DOI:10.1016/j.immuni.2013.10.003]
12 Hänzelmann S,Castelo R,Guinney J.GSVA:gene set variation analysis for microarray and RNA-seq data.
2013;14:7 [PMID:23323831 DOI:10.1186/1471-2105-14-7]
13 Bray F,Ferlay J,Soerjomataram I,Siegel RL,Torre LA,Jemal A.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries.
2018;68:394-424 [PMID:30207593 DOI:10.3322/caac.21492]
14 Balogh J,Victor D 3rd,Asham EH,Burroughs SG,Boktour M,Saharia A,Li X,Ghobrial RM,Monsour HP Jr.Hepatocellular carcinoma:a review.
2016;3:41-53 [PMID:27785449 DOI:10.2147/JHC.S61146]
15 Yang JD,Hainaut P,Gores GJ,Amadou A,Plymoth A,Roberts LR.A global view of hepatocellular carcinoma:trends,risk,prevention and management.
2019;16:589-604 [PMID:31439937 DOI:10.1038/s41575-019-0186-y]
16 In der Stroth L,Tharehalli U,Günes C,Lechel A.Telomeres and Telomerase in the Development of Liver Cancer.
2020;12 [PMID:32722302 DOI:10.3390/cancers12082048]
17 Allemann P,Demartines N,Bouzourene H,Tempia A,Halkic N.Long-term outcome after liver resection for hepatocellular carcinoma larger than 10 cm.
2013;37:452-458 [PMID:23188527 DOI:10.1007/s00268-012-1840-5]
18 Cassimeris L.The oncoprotein 18/stathmin family of microtubule destabilizers.
2002;14:18-24 [PMID:11792540 DOI:10.1016/s0955-0674(01)00289-7]
19 Ringhoff DN,Cassimeris L.Gene expression profiles in mouse embryo fibroblasts lacking stathmin,a microtubule regulatory protein,reveal changes in the expression of genes contributing to cell motility.
2009;10:343 [PMID:19643027 DOI:10.1186/1471-2164-10-343]
20 Steinmetz MO.Structure and thermodynamics of the tubulinstathmin interaction.
2007;158:137-147 [PMID:17029844 DOI:10.1016/j.jsb.2006.07.018]
21 Yip YY,Yeap YY,Bogoyevitch MA,Ng DC.cAMP-dependent protein kinase and c-Jun N-terminal kinase mediate stathmin phosphorylation for the maintenance of interphase microtubules during osmotic stress.
2014;289:2157-2169 [PMID:24302736 DOI:10.1074/jbc.M113.470682]
22 Suzuki K,Watanabe A,Araki K,Yokobori T,Harimoto N,Gantumur D,Hagiwara K,Yamanaka T,Ishii N,Tsukagoshi M,Igarashi T,Kubo N,Gombodorj N,Nishiyama M,Hosouchi Y,Kuwano H,Shirabe K.High STMN1 Expression Is Associated with Tumor Differentiation and Metastasis in Clinical Patients with Pancreatic Cancer.
2018;38:939-944 [PMID:29374725 DOI:10.21873/anticanres.12307]
23 Li J,Hu G,Kong F,Wu K,Song K,He J,Sun W.Elevated STMN1 Expression Correlates with Poor Prognosis in Patients with Pancreatic Ductal Adenocarcinoma.
2015;21:1013-1020 [PMID:25791566 DOI:10.1007/s12253-015-9930-y]
24 Chakravarthi BVSK,Chandrashekar DS,Agarwal S,Balasubramanya SAH,Pathi SS,Goswami MT,Jing X,Wang R,Mehra R,Asangani IA,Chinnaiyan AM,Manne U,Sonpavde G,Netto GJ,Gordetsky J,Varambally S.miR-34a Regulates Expression of the Stathmin-1 Oncoprotein and Prostate Cancer Progression.
2018;16:1125-1137 [PMID:29025958 DOI:10.1158/1541-7786.MCR-17-0230]
25 Mistry SJ,Atweh GF.Therapeutic interactions between stathmin inhibition and chemotherapeutic agents in prostate cancer.
2006;5:3248-3257 [PMID:17172428 DOI:10.1158/1535-7163.MCT-06-0227]
26 Bai T,Yokobori T,Altan B,Ide M,Mochiki E,Yanai M,Kimura A,Kogure N,Yanoma T,Suzuki M,Bao P,Kaira K,Asao T,Katayama A,Handa T,Gombodorj N,Nishiyama M,Oyama T,Ogata K,Kuwano H.High STMN1 level is associated with chemo-resistance and poor prognosis in gastric cancer patients.
2017;116:1177-1185 [PMID:28334732 DOI:10.1038/bjc.2017.76]

