宣肺止咳合剂对LPS 诱导的急性肺损伤模型大鼠AQP1 蛋白表达及炎症反应的调节作用
何 潆 王 莹 计仁华 汪翼凡
急性肺损伤(acute lung injury,ALI)引起急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是机体经受严重的感染、创伤、休克后引起的以肺部通透性增加、呼吸窘迫为主要表现的临床危重症,致死率高达30%[1]。当前肆虐全球的新型冠状病毒肺炎,其重症患者也常发展为ARDS[2]。寻找新的药物和治疗靶点,对早期预防和治疗ALI 显得极为迫切。浙江大学医学院附属杭州市胸科医院自主研制的宣肺止咳合剂是治疗上呼吸道感染、急性肺炎等的临床常用方。课题组前期药理实验研究发现,宣肺止咳合剂能抑制内毒素(LPS)导致的急性肺损伤小鼠的肺组织水肿,降低血清中一氧化氮(NO)水平以及减轻肺泡间质炎性细胞浸润,但作用机制尚不明确[3]。
LPS 是ALI 首要的致病因子,炎症反应的失衡是其主要的发病机制,肺水肿是内毒素性ALI 并发急性呼吸功能衰竭的主要病理基础[4-5]。水通道蛋白(aquaporins,AQPs)是一组与水通透性有关的细胞膜转运蛋白,在维持肺脏水液代谢平衡和肺泡水肿液的清除中发挥着重要的作用[6]。其中,AQP1 与肺损伤关系最为密切,可能是防治ALI 的重要靶点[7]。本实验探讨宣肺止咳合剂是否通过调控AQP1 蛋白表达及炎症反应的平衡,从而对LPS 诱导的大鼠ALI 起治疗作用,为宣肺止咳合剂的药理机制提供实验依据。
1 实验材料
1.1 实验动物 健康SPF 级雄性Wistar 大鼠60只,由上海西普尔-必凯实验动物有限公司提供,动物生产许可证号SCXK(沪)2013-0016。饲养条件:恒温,温度(22±2)℃,湿度50%~60%,14h 光照和10h黑暗的环境明暗交替,换风次数15~20 次/h。由浙江中医药大学动物实验研究中心饲养。实验饲养室许可证号SYXK(浙)2013-0184。
1.2 试剂 宣肺止咳合剂(院内制剂,批号180102);LPS(Sigma 公司,批号039M4004V);苏木素染液(servicebio,批号G1004);伊红染液(珠海贝索生物技术有限公司,批号613101);地塞米松(DEX)(源叶生物,批号H07N9Z74419);AQP1(affinity 公司,批号AF5231);β-actin(华安生物,批号EM21002);BCA蛋白定量试剂盒(Solarbio,批号pc0020);化学发光检测试剂(Solarbio,批号PE0010);Trizol(生工,批号B511311);SYBR Green qPCR 试剂盒(康为世纪,批号CW2601);逆转录试剂盒(康为世纪,批号CW2569);RIPA 裂解液(碧云天;批号P0013D);白介素-1(IL-1)酶联免疫试剂盒(批号March-2019);IL-4 酶联免疫试剂盒(批号March-2019);IL-6 酶联免疫试剂盒(批号March-2019);IL-10 酶联免疫试剂盒(批号March-2019);肿瘤坏死因子-α(TNF-α)酶联免疫试剂盒(批号March-2019)。
1.3 主要仪器 倒置荧光显微镜(日本尼康,型号Nikon Eclipse);病理切片机(上海徕卡仪器有限公司,型号RM2016);酶标仪(MD,型号CMaxPius);电泳仪(天能,型号EPS300);化学发光仪(勤翔,型号610020-9Q);实时荧光定量PCR 仪(罗氏,型号LightCycler 96);核酸定量仪(Thermo Scientific,型号Nanodrop one);生化培养箱(上海齐欣科学仪器有限公司,型号LRH-150)。
1.4 动物分组及处理 取健康SPF 级雄性Wistar大鼠60 只,随机数字表法分为六组:正常对照组(灌胃生理盐水,尾静脉注射生理盐水);LPS 模型组(灌胃生理盐水,尾静脉注射LPS 5mg/kg);宣肺止咳合剂低剂量组(灌胃7.5mg/kg 宣肺止咳合剂,尾静脉注射LPS 5mg/kg);宣肺止咳合剂中剂量组(灌胃15mg/kg 宣肺止咳合剂,尾静脉注射LPS 5mg/kg);宣肺止咳合剂高剂量组(灌胃30mg/kg 宣肺止咳合剂,尾静脉注射LPS 5mg/kg);阳性对照组(灌胃DEX 0.135mg/kg,尾静脉注射LPS 5mg/kg)。其中生理盐水剂量与给药剂量一致。每天灌胃2 次,连续灌胃14d。末次给药0.5h,除正常对照组外,其余各组尾静脉注射LPS 5mg/kg,注射12h 后处死大鼠。
1.5 HE 染色观察肺组织切片炎症细胞浸润和组织损伤情况 末次给药后,取血后处死大鼠,取大鼠一叶左肺放于4%多聚甲醛中固定,取材包埋切片染色。图像采集和分析:通过显微镜拍照(200 倍镜下观察),采集分析样本相关部位。
1.6 免疫组化观察LPS 诱导急性肺损伤大鼠肺组织AQP1 表达 组织切片常规脱蜡、水化、枸橼酸盐缓冲液微波抗原修复,3% H2O2孵育10min 以消除内源性过氧化物酶活性,PBS 冲洗3 次。滴加封闭液(5%BSA),在湿盒中室温30min。用滤纸擦去封闭液,滴加适宜浓度的一抗(均1∶50)置湿盒中4℃孵育过夜,用PBS 洗去一抗。滴加生物素化二抗工作液,室温置湿盒中孵育20min,用PBS 洗去二抗。滴加辣根酶标记链霉卵白素工作液,室温置湿盒中孵育20min,用PBS 洗去。DAB 显色剂显色,自来水充分冲洗。再进行苏木素复染,脱水,透明,中性树胶封片。切片在10×20 倍显微镜下随机选取组织不重复6个视野。
1.7 Western blot 检测AQP1 蛋白表达 取100mg肝脏组织样品,剪碎,加入1mL 冷Lysis Buffer,组织匀浆机中进行匀浆,离心取上清,用BCA 试剂盒测浓度后,进行蛋白变性,加入Loading buffer 保存待用;吸取适量样品上清加入样品孔中,经SDS-PAGE凝胶电泳80V 分离2h,350mA、90min 湿转至PVDF膜。用5%脱脂奶粉的BSA 封闭2h,剪膜后分别加入一抗,4℃孵育过夜。TBST 洗膜后,分别加入相应的二抗,室温下避光孵育1h,TBST 洗膜后ECL 化学发光仪显影。用Image Studio Ver 2.0 软件对蛋白灰度进行半定量分析。
1.8 qPCR 检测AQP1 mRNA 表达 提取肺组织总RNA,按照康为世纪逆转录试剂盒说明书进行逆转录反应,反应条件:42℃,15min;85℃,5min;按照康为世纪SYBR Green qPCR 试剂盒进行实时荧光定量PCR 反应。反应条件:95℃,10min 变性;95℃,15s;60℃,60s;40 次循环。PCR 反应:Real time PCR 仪使用ABI7500 实时荧光定量PCR 仪,PCR 程序已优化。将已点好样的8 连管板置于Realtime PCR 仪上进行PCR 反应。引物序列分别为:AQP1 上游引物:5′-ACCTGCTGGCCATTGACTAC3′-;AQP1 下游引物5′-CCAGGGCACTCCCAATGAAT3′-;GAPDH 上游引物:5′-AGGAGCGAGACCCCACTAACA3′-;GAPDH下游引物:5′-AGGGGGGCTAAGCAGTTGGT3′-。
1.9 ELISA 法检测血清TNF-α、IL-1、IL-6、IL-10、IL-4 水平 大鼠心脏取血后,3500r/min 离心15min,分离血清,酶联免疫吸附法检测血清TNF-α、IL-1、IL-6、IL-10、IL-4 的含量。操作步骤按试剂盒说明,反应终止后15min 内,用450nm 波长测量各孔的吸光值(OD 值)。
1.10 统计学方法 应用SPSS 16.0 统计软件进行数据分析,所有符合正态分布数据以均数±标准差()表示。组间比较,方差齐性者采用两独立样本t检验,方差不齐者采用Kruskal-Wallis H 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 HE 染色观察宣肺止咳合剂对LPS 诱导急性肺损伤大鼠肺组织病理学改变的影响 正常对照组肺泡结构完整,肺泡间质无明显渗出。LPS 模型组肺泡间质渗出明显,肺泡正常结构几乎消失,可见大量炎性细胞浸润。在给予宣肺止咳合剂或DEX 治疗后,可见低剂量组大鼠肺组织无明显改变,说明低剂量宣肺止咳合剂治疗效果不明显。中、高剂量组及阳性对照组大鼠肺组织肺泡简直可见炎性细胞渗出,肺泡结构可见,损伤较模型组明显减轻。见图1。
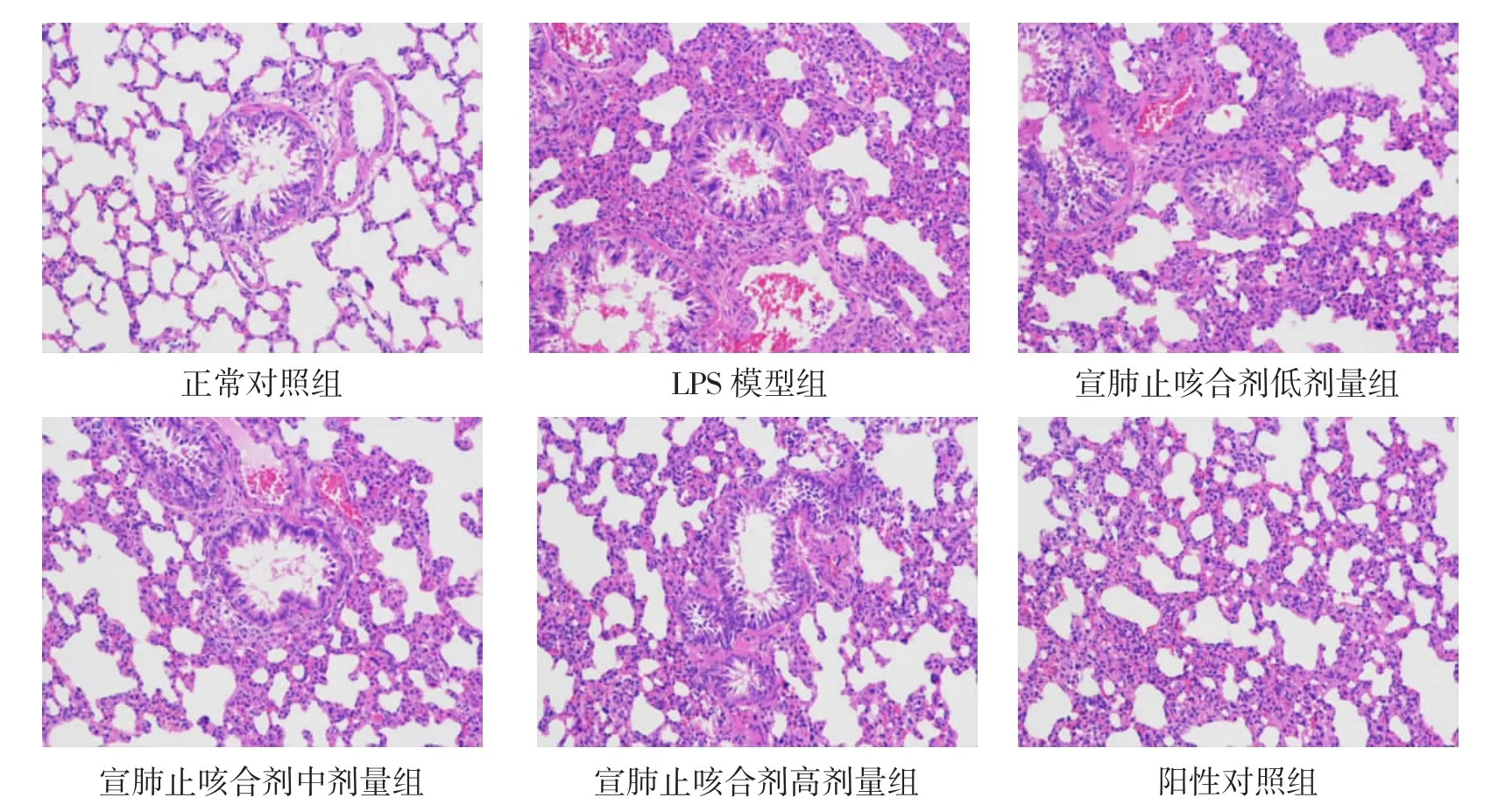
图1 宣肺止咳合剂对LPS 诱导急性肺损伤大鼠肺组织病理学改变的影响(HE 染色,200 倍)
2.2 免疫组化观察宣肺止咳合剂对LPS 诱导急性肺损伤大鼠肺组织AQP1 表达的影响 与正常对照组相比,LPS 模型组中AQP1 阳性表达明显降低(P<0.01)。给予宣肺止咳合剂或DEX 治疗后,与LPS 模型组相比,宣肺止咳合剂低剂量组AQP1 阳性表达无明显改变(P>0.05)。宣肺止咳合剂中、高剂量组及阳性对照组AQP1 阳性表达明显升高,且具有显著性(P<0.01)。见表1。
表1 宣肺止咳合剂对LPS 诱导急性肺损伤大鼠肺组织AQP1 表达的影响()

表1 宣肺止咳合剂对LPS 诱导急性肺损伤大鼠肺组织AQP1 表达的影响()
注:正常对照组予生理盐水;LPS 模型组予生理盐水;宣肺止咳合剂低剂量组予7.5mg/kg 宣肺止咳合剂;宣肺止咳合剂中剂量组予15mg/kg宣肺止咳合剂;宣肺止咳合剂高剂量组予30mg/kg 宣肺止咳合剂;阳性对照组予地塞米松0.135mg/kg;除正常对照组外,其余各组给药14d 后给予LPS 5mg/kg 尾静脉注射;Area 为面积参数值;LPS 为内毒素;IOD 为累积光密度参数值;与正常对照组比较,aP<0.01;与模型组比较,bP<0.01
2.3 宣肺止咳合剂对LPS 诱导急性肺损伤大鼠肺组织AQP1 蛋白表达的影响 与正常对照组比较,LPS 模型组大鼠肺组织AQP1 蛋白表达水平显著下调(P<0.01)。与LPS 模型组比较,给药组大鼠肺脏组织AQP1 蛋白表达水平呈现上调趋势,宣肺止咳合剂不同给药剂量呈现浓度依赖性,其中宣肺止咳合剂中剂量组和宣肺止咳合剂高剂量组有显著性差异(P<0.05 或P<0.01),阳性对照组显著上升趋势(P<0.01)。见表2 和图3。
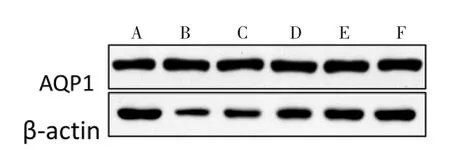
图3 宣肺止咳合剂对LPS 诱导急性肺损伤大鼠肺组织中AQP1 蛋白表达的影响
表2 宣肺止咳合剂对LPS 诱导急性肺损伤大鼠肺组织AQP1 蛋白表达的影响()

表2 宣肺止咳合剂对LPS 诱导急性肺损伤大鼠肺组织AQP1 蛋白表达的影响()
注:正常对照组予生理盐水;LPS 模型组予生理盐水;宣肺止咳合剂低剂量组予7.5mg/kg 宣肺止咳合剂;宣肺止咳合剂中剂量组予15mg/kg宣肺止咳合剂;宣肺止咳合剂高剂量组予30mg/kg 宣肺止咳合剂;阳性对照组予地塞米松0.135mg/kg;除正常对照组外,其余各组给药14d 后给予LPS 5mg/kg 尾静脉注射;LPS 为内毒素;与正常对照组比较,aP<0.01;与LPS 模型组比较,bP<0.05,cP<0.01

图2 免疫组化观察宣肺止咳合剂对LPS 诱导急性肺损伤大鼠肺组织中AQP1 表达的影响(200 倍)
2.4 宣肺止咳合剂对LPS 诱导急性肺损伤大鼠肺组织AQP1 mRNA 水平的影响 与正常对照组相比,LPS 模型组大鼠肺组织中AQP1 mRNA 水平显著降低(P<0.01)。与LPS 模型组相比,给药组大鼠肺组织中AQP1mRNA 水平有升高趋势,其中仅有宣肺止咳合剂低剂量组无显著性变化(P>0.05),其余各组显著升高(P<0.01 或P<0.05)。见表3。
表3 宣肺止咳合剂对LPS 诱导急性肺损伤大鼠肺组织AQP1 mRNA 水平的影响()
注:正常对照组予生理盐水;LPS 模型组予生理盐水;宣肺止咳合剂低剂量组予7.5mg/kg 宣肺止咳合剂;宣肺止咳合剂中剂量组予15mg/kg宣肺止咳合剂;宣肺止咳合剂高剂量组予30mg/kg 宣肺止咳合剂;阳性对照组予地塞米松0.135mg/kg;除正常对照组外,其余各组给药14d 后给予LPS 5mg/kg 尾静脉注射;LPS 为内毒素;与正常对照组比较,aP<0.01;与LPS 模型组比较,bP<0.05,cP<0.01
2.5 宣肺止咳合剂对LPS 诱导急性肺损伤大鼠血清TNF-α、IL-1、IL-6、IL-10、IL-4 的影响 与正常对照组比较,LPS 模型组大鼠血清TNF-α、IL-1、IL-6、IL-10、IL-4 水平显著升高(P<0.01)。与LPS 模型组相比,给药组中TNF-α、IL-1、IL-6 水平有降低趋势,IL-10、IL-4 有升高趋势,其中宣肺止咳合剂低剂量组大鼠血清仅有趋势而无显著性(P>0.05);宣肺止咳合剂中、高剂量组与LPS+阳性对照组大鼠血清呈显著性趋势(P<0.05 或P<0.01)。见表4。
表4 宣肺止咳合剂对LPS 诱导急性肺损伤大鼠血清TNF-α、IL-1、IL-6、IL-10、IL-4 水平的影响(pg/mL,)

表4 宣肺止咳合剂对LPS 诱导急性肺损伤大鼠血清TNF-α、IL-1、IL-6、IL-10、IL-4 水平的影响(pg/mL,)
注:正常对照组予生理盐水;LPS 模型组予生理盐水;宣肺止咳合剂低剂量组予7.5mg/kg 宣肺止咳合剂;宣肺止咳合剂中剂量组予15mg/kg 宣肺止咳合剂;宣肺止咳合剂高剂量组予30mg/kg 宣肺止咳合剂;阳性对照组予地塞米松0.135mg/kg;除正常对照组外,其余各组给药14d 后给予LPS 5mg/kg 尾静脉注射;LPS 为内毒素;与正常对照组比较,aP<0.01;与LPS 模型组比较,bP<0.05,cP<0.01
3 讨论
ALI 是ARDS 的早期阶段,如果没有得到有效的治疗会进展成为ARDS,严重威胁患者的生命[8]。传统中医药对ALI 的早期防治有着广阔的应用前景。本院自主研制的宣肺止咳合剂(原名清肺饮,由麻黄、杏仁、生石膏、葛根、僵蚕、知母、甘草七味药组成),具有清热宣肺,止咳平喘之功,是用于治疗上呼吸道感染、急慢性支气管炎、小儿毛细支气管炎、急性肺炎等病症的临床常用方[9-12]。本研究结果发现,给予宣肺止咳合剂或DEX 治疗后,能明显改善LPS 模型组肺泡间质渗出,减少炎性细胞浸润,且中、高剂量组及阳性药物组较低剂量组损伤明显减轻。
ALI 发病机制错综复杂,主要涉及炎症反应失控、氧化还原失衡、肺水代谢紊乱等许多层面。现代医学研究表明,LPS 是ALI 首要的致病因子[13]。肺水肿是内毒素性ALI 并发急性呼吸功能衰竭的主要病理基础,主要表现为血管通透性增加、肺组织肿胀,组织间隙内大量液体集聚,以及炎性细胞浸润等[14-15]。肺泡水肿液的清除可能是治疗内毒素性肺损伤的关键措施。AQPs 是一组与水通透性有关的细胞膜转运蛋白,大量研究证实AQPs 在肺水肿的形成和消除过程中起非常重要的作用,可能是防治ALI 的重要靶点[16]。其中AQP1 作为最早发现的水通道蛋白亚型,与肺损伤关系最为密切,研究表明,AQP1 敲除鼠,气腔-毛细血管屏障水通透性下降约10 倍[7]。李波等[17]实验研究发现,在LPS 诱导的ALI 模型中,表达于气道和肺泡周围毛细血管内皮细胞内的AQP1 明显减少。钟佰强[18]研究发现,LPS 性肺损伤后AQP1 的表达水平下降,DEX 干预后,AQP1 的表达明显提高。可见,AQP1 在LPS 性ALI 中扮演着重要的角色。本研究结果发现,宣肺止咳合剂给药组大鼠肺脏组织AQP1 蛋白表达、AQP1mRNA 水平较LPS 模型组呈现上调趋势,宣肺止咳合剂不同给药剂量呈现浓度依赖性,其中宣肺止咳合剂中、高剂量组和阳性药对照组有显著性差异(P<0.05 或P<0.01)。
ALI 的另一重要发病机制主要为促/抗炎反应失衡。LPS 诱导后可刺激细胞或组织释放大量炎症介质,包括促炎介质(TNF-α、IL-1、IL-6 等)和抗炎介质(IL-10、IL-4 等),两者之间的平衡失调是ALI 发生发展的关键环节[17-18]。研究表明,TNF-α、IL-1、IL-6 等促炎因子可抑制肺泡上皮细胞和毛细血管内皮细胞上AQPs 的表达,从而减少钠离子的转运及肺泡内液体清除,提示抑制促炎细胞因子的释放及炎性反应能够增加AQPs 的表达,进而促进肺泡内液体清除。本研究采用宣肺止咳合剂干预LPS 诱导的ALI大鼠,检测血清TNF-α、IL-1、IL-4、IL-6、IL-10 水平的表达,结果发现中、高剂量宣肺止咳合剂和阳性药能抑制LPS 引起的TNF-α、IL-1、IL-6 水平升高,增加IL-4、IL-10 水平(P<0.05 或P<0.01)。
综上所述,宣肺止咳合剂对内毒素性ALI 的保护作用可能通过调控AQP1 的表达,抑制TNF-α、IL-1、IL-6 等促炎因子,促进IL-10、IL-4 等抗炎因子的释放,调节促/抗炎平衡来实现的。

