儿童急性T淋巴细胞白血病生物学特征及其预后的回顾性队列研究
胡海蕊 袁 媛 李 君 薛天琳 王 营 刘曙光 高 超 郑胡镛
急性T淋巴细胞白血病(T-ALL)是一组以恶性幼稚T淋巴细胞增殖为特征的异质性疾病,占儿童ALL的10%~15%[1]。尽管目前的高强度化疗使T-ALL患儿诱导缓解率超过95%,但其易发生早期复发,且复发后再缓解困难,故长期预后仍差于儿童B细胞前体ALL[2]。目前,国内外普遍将患儿初诊时外周血WBC计数、强的松实验治疗第8 d外周血幼稚细胞绝对值和化疗早期微小残留病(MRD)作为T-ALL分层治疗的划分标准,其中MRD被认为是最佳的风险预测因素[3]。中国儿童白血病治疗协作组ALL 2008方案(CCLG-ALL 2008)[4]在此基础上,纳入化疗开始后第33 d和第78 d MRD,并以此指导临床调整化疗强度,或作为进行造血干细胞移植(HSCT)治疗的参考指标。本研究回顾性分析2008至2018年首都医科大学附属北京儿童医院(我院)血液病中心应用CCLG-ALL 2008方案治疗的T-ALL患儿的临床和生物学特征,探讨在应用MRD调整治疗强度后,影响T-ALL患儿预后的相关因素,以期为患儿的精准分层提供参考依据。
1 方法
1.1 知情同意 本研究中骨髓细胞形态学检查、免疫表型和融合基因检测及资料收集均取得患儿监护人的书面知情同意。
1.2 研究对象的纳入标准 同事满足以下2项:①2008年3月至2018年9月于我院初诊且原发病为T-ALL的0~18岁连续病例;②应用CCLG-ALL 2008方案[4]治疗。
1.3 研究对象的排除标准 满足任意1项者排除:①确诊后未在我院行CCLG-ALL 2008方案治疗;②缺失基因学和免疫学检测结果。
1.4 治疗方案及危险度分层 参照CCLG-ALL 2008方案诊断、分层和治疗。免疫分型T-ALL为中危组,满足以下任意1项者即升入高危组,并调整为高危化疗方案:①BCR/ABL1融合基因阳性;②MLL基因重排;③强的松实验治疗7 d后,外周血幼稚淋巴细胞绝对值≥1 000个/μL(即强的松实验治疗反应差);④诱导缓解治疗第15 d骨髓形态学示幼稚淋巴细胞>20%,即呈M3;⑤诱导缓解治疗第33 d骨髓形态学未缓解(原始+幼稚淋巴细胞≥5%),即呈M2(≥5%且<20%)或M3;⑥诱导缓解治疗第33 d MRD≥1%或巩固治疗开始前MRD≥0.1%。CCLG-ALL 2008中危和高危治疗方案见表1。
1.5 免疫表型和MRD评估 采用Ficoll-Hypaque淋巴细胞分离液(美国Thermo Fisher Scientific公司)分离患儿单个核细胞,流式细胞术检测荧光偶联单克隆抗体标记的白血病细胞,阳性表达阈值胞膜抗原为>20%,胞浆抗原为>10%。T-ALL患儿免疫表型根据欧洲白血病免疫分型协作组(EGIL)的抗原积分系统确定[5]。通过多参数流式细胞术检测患儿初诊时白血病相关抗原的表达,作为MRD的跟踪标志,检测步骤参照美国St. Jude儿童医院指导方案[6]。于诱导缓解治疗结束时和巩固化疗开始前进行MRD检测,检测时每管中至少含1×105单个核细胞。白血病细胞检测水平低于骨髓有核细胞的0.01%判定为阴性。
1.6 融合基因检测 分离患儿初诊骨髓样本中的单个核细胞,根据Trizol(美国Life Technology公司)试剂盒说明书提取总RNA,采用紫外分光光度计测定RNA纯度和浓度。采用随机逆转录引物(美国Invitrogen公司)将2 μg RNA反转录为cDNA。采用多重巢式聚合酶链法(RT-PCR)和1%琼脂糖凝胶电泳检测融合转录本。常规融合基因检测包括:SIL-TAL1、SET-CAN、MLL重排、BCR-ABL、TEL-AML1、E2A-PBX1、TLS-ERG、E2A-HLF等共29种[7]。
1.7 随访 入组患儿除已在病历系统中记录死亡者外,其余在完成治疗时以及完成治疗后的第3~6、12、24、36个月进行随访;并于2020年8月1日行电话随访,询问患儿存活或死亡情况。总生存期(OS)定义为从确诊之日起至患儿死亡或随访截止日未死亡的时间;无事件生存期(EFS)定义为患儿初次诊断T-ALL至末次随访或出现事件的时间,事件包括复发、第2次肿瘤和任何原因引起的死亡。
1.8 临床资料截取 ①患儿性别、年龄;②初诊时外周血WBC计数、危险度评估;③免疫表型和融合基因检测结果;④强的松实验治疗反应(经过强的松治疗7 d后,第8 d检测外周血白细胞数目<1×109·L-1);⑤早期治疗反应评估:第15 d和33 d骨髓幼稚细胞百分比,第15 d、33 d和78 d MRD;⑥随访:EFS和OS。
1.9 统计学方法 采用SPSS 21.0软件进行统计分析。符合正态分布的计量资料采用均数±标准差表示,组间比较采用两独立样本t检验;计数资料采用n(%)表示,组间比较采用χ2检验。生存分析采用Kaplan-Meier法,组间比较采用Long-rank检验;Cox回归采用逐步向前法进行多因素预后分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 符合本文纳入标准的T-ALL患儿共114例,排除未化疗即死亡2例、确诊后未在我院行CCLG-ALL 2008方案治疗3例、骨髓异常增生综合征(MDS)转为T-ALL 1例、缺失基因学或免疫学检测结果7例,最终101例纳入本文分析。其中男76例(75.2%),女25例。患儿年龄1岁2个月至14岁6个月,中位年龄7岁6个月。101例T-ALL患儿转归见图1。
2.2 免疫表型标志 101例T-ALL患儿均表达cyCD3和CD7,T系免疫标志CD2和CD5的表达率分别为85.1%(86例)和98.0%(99例)。B系免疫表型标志CD10、cyCD79a、CD19和cyIgM的表达率分别为24.8%(25例)、7.9%(8例)、2.0%(2例)和2.0%(2例);Igλ和Igκ均无表达。干细胞标志CD34的表达率为45.5%(46例),幼稚细胞标志HLA-DR的阳性率为11.9%(12例)。髓系免疫表型标志CD117、CD13、CD33、MPO和CD41的阳性率分别为8.0%(8/100)、5.0%(5例)、13.9%(14例)、0(0例)和2.0%(2例)。CD56异常表达率为31.0%(9/29)。
2.3 融合基因 28例(27.7%)患儿检出融合基因阳性,分别为SIL-TAL122例(21.8%);SET-CAN1例(1.0%);MLL基因重排5例(5.0%),包括MLL-ENL3例、MLL-ELL和MLL-AF6各1例。
2.4 生物学特征与临床表现和治疗反应的相关性 表2显示,CD2阳性患儿初诊外周血WBC计数≥100×109·L-1的比例显著高于阴性者,诱导缓解治疗第15 d骨髓幼稚细胞未获得M1者的比例显著低于阴性者。表达CD10者强的松实验治疗反应差的比例低于阴性患儿。表达CD33者诱导缓解治疗第15 d和化疗第33 d的形态学未获得完全缓解的患儿比例及MRD>1%的患儿比例均高于CD33阴性患儿,差异均有统计学意义。
表达CD34者强的松治疗反应差、第15 d骨髓形态学≥5%和MRD≥10%的比例均高于阴性患儿,最终归入高危的患儿比例也高于阴性患儿,差异均有统计学意义。其他免疫分型分子cyCD79a、CD117、HLA-DR均未发现与临床特征和治疗反应的相关性。SIL-TAL1阳性患儿初诊临床特征和早期治疗反应与阴性患儿差异均无统计学意义,但其最终划入高危的比例显著高于阴性患儿。
2.5 生物学特征与患儿预后的关系 截止至2020年8月1日,中位随访时间44(1.7~140.5)个月,5年EFS和OS分别为(70.7±4.7)%和(74.2±4.5)%。各免疫表型标志的表达均与患儿预后不相关(表2)。
表3显示,SIL-TAL1阳性、强的松实验治疗反应不良、治疗第15 d骨髓形态学不缓解和第33 d MRD≥1%与不良的EFS和OS相关。表3和图2显示,第33 d MRD≥1%和SIL-TAL1基因阳性亦是EFS和OS的独立影响因素,HR分别为第33 d MRD≥1%对EFS为1.96(95%CI:1.114~3.452,P=0.020),对OS为2.062(95%CI:1.138~3.734,P=0.017);SIL-TAL1阳性对EFS为2.536(95%CI:1.053~6.104,P=0.038),对OS为2.921(95% CI:1.144~7.457,P=0.025)。
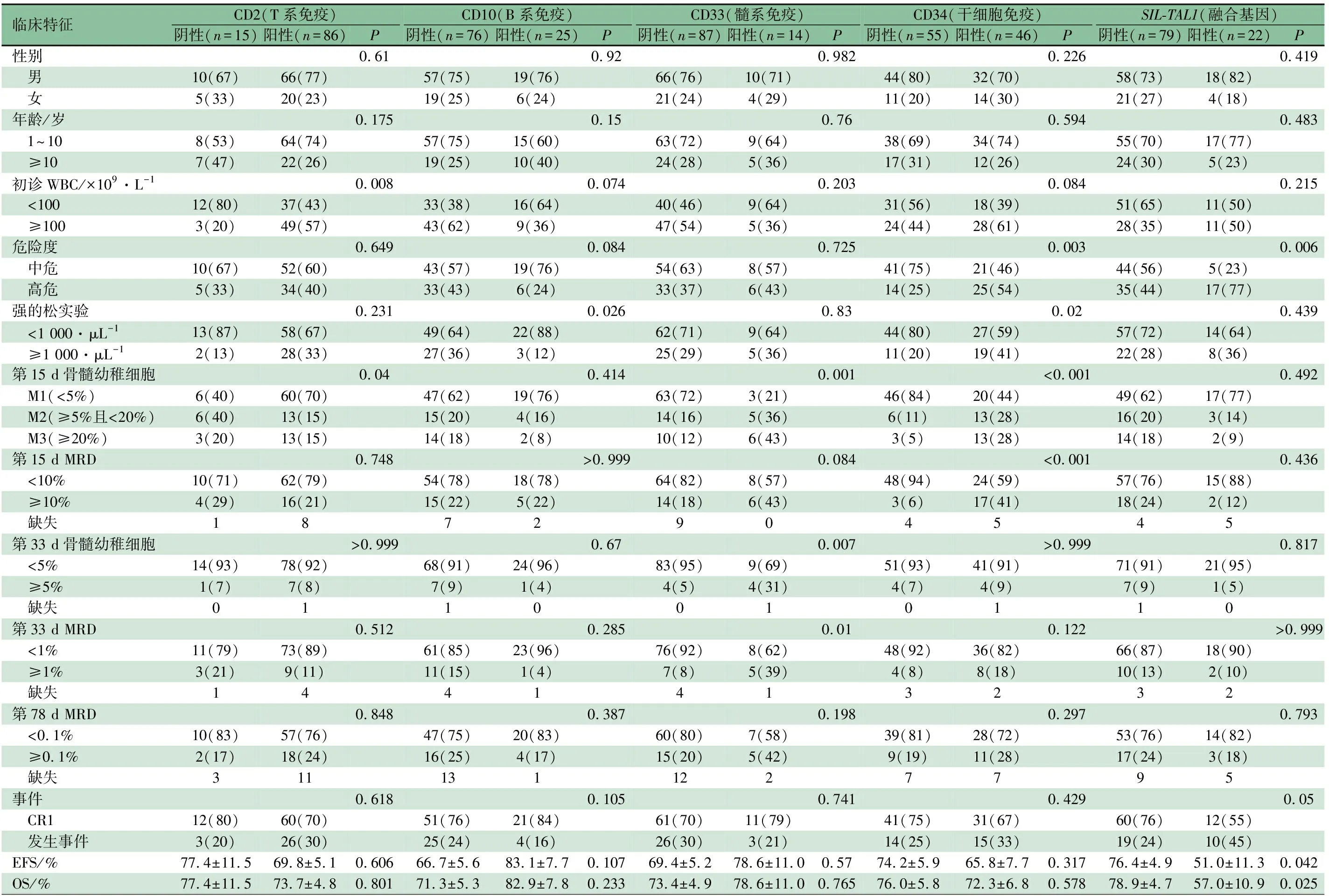
表2 T-ALL患儿生物学特征与临床表现和治疗反应的相关性[n(%)]
3 讨论
本研究共纳入T-ALL患儿101例,男孩占比(75.2%)显著高于女孩;初诊时WBC≥100×109·L-1的患儿占51.5%,>10岁患儿占28.7%,这些临床生物学特征与既往文献报道的儿童T-ALL相似[8-10]。
既往研究显示,T-ALL普遍存在跨系抗原的异常表达[11]。本研究中,B系抗原CD10、干细胞标志CD34以及CD56的异常表达率均>20%,髓系抗原CD33表达率也达10%。虽然既往研究显示所有免疫标志均与患者预后不相关[12, 13],但本研究CD34和CD33阳性患儿与不良的初诊临床特征和早期治疗反应相关,而CD10阳性者强的松实验反应良好者的比例高于阴性者。
早年DCOG-ALL7研究显示,CD34阳性T-ALL患儿的预后差于阴性者[14],但是其他研究均未证实这一结果。本研究显示,虽然CD34阳性患儿最终预后与阴性者无差异,但是CD34阳性者强的松治疗反应不佳、诱导缓解治疗早期第15 d骨髓形态学M2或M3及MRD>10%的患儿比例显著高于阴性者,且最终纳入高危的患儿比例也高,提示根据患儿早期治疗反应增加化疗强度,或许可以改善CD34阳性患儿的预后。本研究还发现,CD33阳性患儿第33 d未获得完全缓解的比例和高MRD的比例显著高于阴性者。廖红艳等[15]在青少年和成人T-ALL的研究中发现35%的CD33阳性患者和64.1%的CD33阴性患者分别达到CR,差异有统计学意义,与本研究结果一致。此外,Sayed等[3]的研究纳入71例T-ALL患儿,结果显示CD33的表达是唯一显著影响患儿5年OS的预后因素。目前人源化抗CD33抗体吉妥单抗(GO)已被批准用于治疗复发的急性髓系白血病,部分研究正在尝试使用GO治疗CD33阳性的ALL,且取得了一定的成效[16]。
融合基因SIL-TAL1是儿童T-ALL中常见的分子遗传学异常,TAL1基因编码具有螺旋-环-螺旋基本结构的转录因子,参与造血干细胞功能的调控,而SIL基因与TAL1基因融合后导致TAL1蛋白过表达,从而参与T-ALL的发生发展。成人和儿童SIL-TAL1的发生率相差不大,为16%~26%[17-19]。该基因与患者不良的临床特征相关,但其对预后的影响,各临床研究中心报道结果不一致。本研究中SIL-TAL1阳性患儿的EFS和OS都显著低于阴性患儿,这与中国台湾儿童TPOG-ALL-2002方案、巴西儿童T-ALL方案、中国武汉同济医院CALLG2008方案的治疗结果相似[18-20]。此外,意大利AIEOP协作组BFM-ALL-2000方案和我院BCH-ALL-2003方案治疗的T-ALL患儿,SIL-TAL1阳性与阴性患儿的预后并无差异[17, 21]。由此提示,SIL-TAL1白血病细胞对化疗方案中不同药物的组合和剂量敏感性不同,深入研究各种药物对这型白血病的作用机制,有助于提高患者疗效。
本研究结果显示,早期治疗反应,包括强的松实验治疗反应、第15 d骨髓形态学分级和诱导缓解结束时的MRD是预后相关因素;诱导缓解结束时MRD是独立的预后相关因素。在中国1项T-ALL的临床研究中[22],同样应用CCLG-ALL-2008治疗方案,发现患者第15 d骨髓形态学M3、强的松实验治疗反应不佳、诱导治疗结束时MRD>1%与不良预后相关,与本文第33 d MRD具有独立预后价值结论相似,均提示MRD在T-ALL患者风险评估中的重要作用。此外,本研究还发现,患儿高危与不良预后相关,但不是独立预后因素,提示临床医生根据MRD水平及时调整治疗方案,如进行HSCT,可能会改善患儿的预后。

