花后低温条件下小麦颖果发育的显微结构观察
杨佳庆,郝 朵,冉莉萍,李 波,熊 飞,余徐润*
(1 江苏省作物遗传生理重点实验室/江苏省作物栽培生理重点实验室,扬州大学 农学院;江苏省粮食作物现代产业技术协同创新中心,扬州大学,江苏扬州 225009;2 扬州大学 广陵学院,江苏扬州 225128;3 江苏沿江地区农业科学研究所,江苏南通 226541)
小麦是世界上最重要的粮食作物之一,种植面积位居全球粮食作物之首。中国长江中下游地区主要分布半冬性小麦和春小麦,而该产区生长的小麦时常会遭遇冬季低温冻害以及倒春寒冷害,使小麦产量下降、品质变差[1]。有研究发现,低温处理后小麦叶片的电导率、可溶性糖含量、丙二醛含量以及超氧化物歧化酶活性升高[2],但过氧化物酶活性会降低[3]。前人研究还发现,不同时期的低温胁迫对小麦幼穗发育有不同的影响。例如,药隔期的低温胁迫会直接影响幼穗发育和穗部小花的形成,降低小麦的结实率和千粒重[4-5];小麦穗分化的中后期遭遇低温,会引起小花退化数目增多,造成产量降低[6]。李春燕等[7]通过人工气候室对小麦药隔期、孕穗期和开花期三个时期进行低温处理,发现低温处理后小麦小穗数、穗粒数及千粒重显著下降。雌雄蕊分化期的低温处理会导致小麦穗粒数下降,且下降幅度比其他时期低温处理更为明显,说明该时期是小麦幼穗对低温响应的最敏感时期[8]。余徐润等[9]指出雌雄蕊分化期的低温处理会降低小麦颖果胚乳充实度。从以上研究中可以看出,小麦在不同发育时期遭受低温胁迫对其生理生化功能、幼穗发育、籽粒充实及产量形成等多方面均会产生影响。
随着全球气候的不稳定性增加,小麦花后冷害出现的频率也在升高,如1991年河南商丘、2006年安徽亳州、2013年安徽淮北、2020年山东济宁等地区均发生过花后低温冷害[10-12]。长江中下游地区小麦开花多在4月6日到15日左右,在此期间若温度突然降低,雌雄蕊将遭遇冷害,造成小花退化或者小穗不育,严重影响产量。2020年淮北地区的温度波动较大,4月14日上午在新浦等地区出现雨夹雪、雪等天气,使得小麦中上部小穗,特别是顶端小穗产生不育、缺粒等现象[13]。马魁侠等[10]发现从1956年以来,在涡阳县几乎每5年遭遇一次低温,低温时5月平均温度低于16 ℃,在1998年和2006年的最低温度甚至低于10 ℃。2006年5月12日2:00~6:00最低温度低于10 ℃,此时正值小麦灌浆中期,低温造成小麦的灌浆速率减缓,甚至降为负值[10]。此外,低温冷害的发生也和小麦的播期有关,早播小麦开花早,容易遭遇花后低温冷害,而晚播小麦开花晚,该现象则不容易发生。小麦穗部小花开花后即完成双受精过程,胚乳细胞进入分化阶段,然后小麦籽粒进入灌浆阶段[14],该阶段贮藏淀粉体和蛋白的积累对低温十分敏感[15]。然而目前有关花后低温条件下小麦颖果胚乳细胞和养分运输组织的微观结构报道较少。本试验以春小麦品种‘扬麦15’和半冬性小麦品种‘烟农19’为材料,在花后6~8 d进行人工低温处理,从细胞水平上观察了低温处理下小麦颖果果皮的消亡、胚乳储藏物质的积累和养分运输组织的显微结构特征。研究结果将有助于解析小麦颖果发育对低温的响应机制,可为抗寒小麦品种的选育提供形态学鉴定指标,也为降低晚春冷害造成的小麦减产提供理论依据。
1 材料和方法
1.1 实验材料与处理
本研究以春性小麦‘扬麦15’(YM15)和半冬性小麦‘烟农19’(YN19)为实验材料,种子由江苏省里下河科学研究所提供。两小麦品种在2019年11月至2020年5月盆栽于江苏省作物遗传与生理重点实验室扬州大学实验棚内。盆钵尺寸38 cm×24 cm,所用土壤为沙壤土,有机质含量24.5 g·kg-1,速效磷33.8 mg·kg-1, 碱解氮106 mg·kg-1,速效钾66.4 mg·kg-1。实验组和对照组各6盆小麦,每盆在三叶期间苗后保留6株。在小麦种植前施入过磷酸钙和硫酸钾,用量均为150 kg·hm-2。在小麦生长期进行常规水分管理,确保长势一致。在小麦开花期时,使用记号笔点颖和植株挂牌相结合的方式对小麦穗中部(6个小穗位置)、小穗基部1、2位当日开花的小麦进行标花,连续标花4 d,筛选标记麦穗开花量最大时期作为开花日期,在花后6 d时,将标花后的小麦盆栽置于人工气候箱内进行低温处理。低温处理组的温度为白天(8:00~18:00)10 ℃,黑夜(18:00~8:00)4 ℃,常温处理组模拟当季室外平均温度,约为白天(8:00~18:00)20 ℃,黑夜(18:00~08:00)10 ℃,相对湿度设定为75%,光照强度为4 000 lx。连续处理3 d之后小麦盆栽搬回实验棚里继续生长。
1.2 小麦颖果形态观察及鲜干重测定
取花后8、16、24、32 和48 d的小麦颖果,在体视显微镜(LM,Leica,德国)下拍摄颖果形态。同时每个处理取10粒颖果,称量单粒颖果鲜重(48 d小麦颖果仅称干重),然后在42 ℃烘箱中烘至恒重,计算单粒颖果干重。
1.3 小麦颖果显微结构观察
取花后8、16、24和32 d的小麦颖果,参考熊飞等[16]的方法取中部厚度为2 mm 组织进行树脂包埋。而后使用超薄切片机(Ultracut R,Leica,德国)将树脂样品切为1 μm厚的树脂切片。然后利用0.5%甲基紫溶液对树脂切片进行染色10 min,待晾干后放置于光学显微镜下进行观察,并使用连有CCD相机的显微镜(DMLS,Leica,德国)对中央胚乳进行拍照。每组包含3个重复的颖果。
1.4 胚乳淀粉体和蛋白体面积统计
参考余徐润等[17]的方法,使用Photoshop CS6和Image-Pro Plus 6.0图像分析软件对拍摄的显微图像进行数据分析。首先利用Photoshop软件图片进行预处理,将淀粉体和蛋白体分别着色,去污点后利用Image-Pro Plus统计淀粉体和蛋白体的面积,以相同像素和分辨率的显微结构照片为背景,计算淀粉体和蛋白体的相对面积,两者之和为胚乳充实度。在每组样品中均随机挑选3粒颖果作为数据重复,并且每粒颖果均拍摄3张显微图片,以便后续对数据进行统计分析。
1.5 数据统计与分析
使用Microsoft Excel对实验数据进行处理和分析。采用SPSS 19.0进行显著性检验,通过t检验对数据进行显著性检验(P<0.05)。
2 结果与分析
2.1 花后低温下小麦颖果发育过程
花后低温条件下小麦颖果发育过程及单粒颖果鲜、干重变化趋势如图1所示。对于春性品种‘扬麦15’而言,在花后8~32 d,常温处理组颖果发育较快,低温处理组颖果发育较慢,其中花后8 d和16 d,常温处理组颖果表面已能观察到部分区域呈绿色,而低温处理组颖果表面主要呈蜡白色,绿色较少;花后24 d和32 d,常温处理组颖果颜色比低温处理组深(图1,A)。对于半冬性品种‘烟农19’而言,花后8 d和16 d,颖果发育规律与‘扬麦15’类似,低温处理组颖果发育比常温处理组缓慢;在花后32 d,低温处理组颖果表面黄色深,果皮/种皮已出现皱缩,而常温处理组颖果表面较为光滑(图1,B)。在花后48 d,即成熟期,各处理颖果表面均呈黄色,同时体积收缩,但两小麦品种低温处理组颖果尺寸明显小于常温处理组。同时,从低温处理前后两小麦品种颖果鲜、干重变化趋势来看,低温处理显著降低了小麦颖果的鲜重(图1,C)与干重(图1,D);其中,在花后32 d,低温处理组的‘扬麦15’颖果鲜重显著高于常温处理组,而同期低温处理组的‘烟农19’颖果鲜重显著低于常温处理组。
2.2 花后低温下小麦颖果果皮凋亡及淀粉粒降解显微结构特征
从图2可见,花后低温对两个小麦品种果皮的显微结构有较为明显的影响,主要表现在果皮细胞的凋亡以及中果皮细胞中淀粉粒的降解。其中,在花后8 d,两小麦品种常温处理组果皮细胞已出现明显的程序性细胞死亡特征,中果皮细胞凋亡,内部贮藏的淀粉粒开始降解,出现凋亡空腔(图2,A、I);对于‘扬麦15’而言,低温处理组颖果果皮细胞尚未出现程序性死亡现象,中果皮细胞中积累了较多的淀粉粒(图2,E);对于‘烟农19’而言,颖果中果皮细胞表现出了凋亡现象,内部淀粉粒开始降解,但残留的淀粉粒较常温处理组多(图2,M)。在花后16 d,两品种小麦颖果果皮细胞程序性死亡现象加剧,中果皮细胞凋亡得多,仅剩余2~3层细胞(图2,B、J);但低温处理组中果皮细胞残留得比常温处理组多,剩余4~5层,果皮细胞厚,残留的淀粉粒也比常温处理组多(图2,F、N)。在花后24 d和32 d,两小麦品种中果皮细胞进一步凋亡,仅有少量残留折叠的细胞壁,果皮中淀粉粒已完全降解,可以清晰地观察到外果皮、中果皮和内果皮细胞,其中外果皮和中果皮细胞壁较厚(图2,C、D、K、L);此时常温处理组与低温处理组果皮细胞显微结构无明显差异(图2,G、H、O、P)。
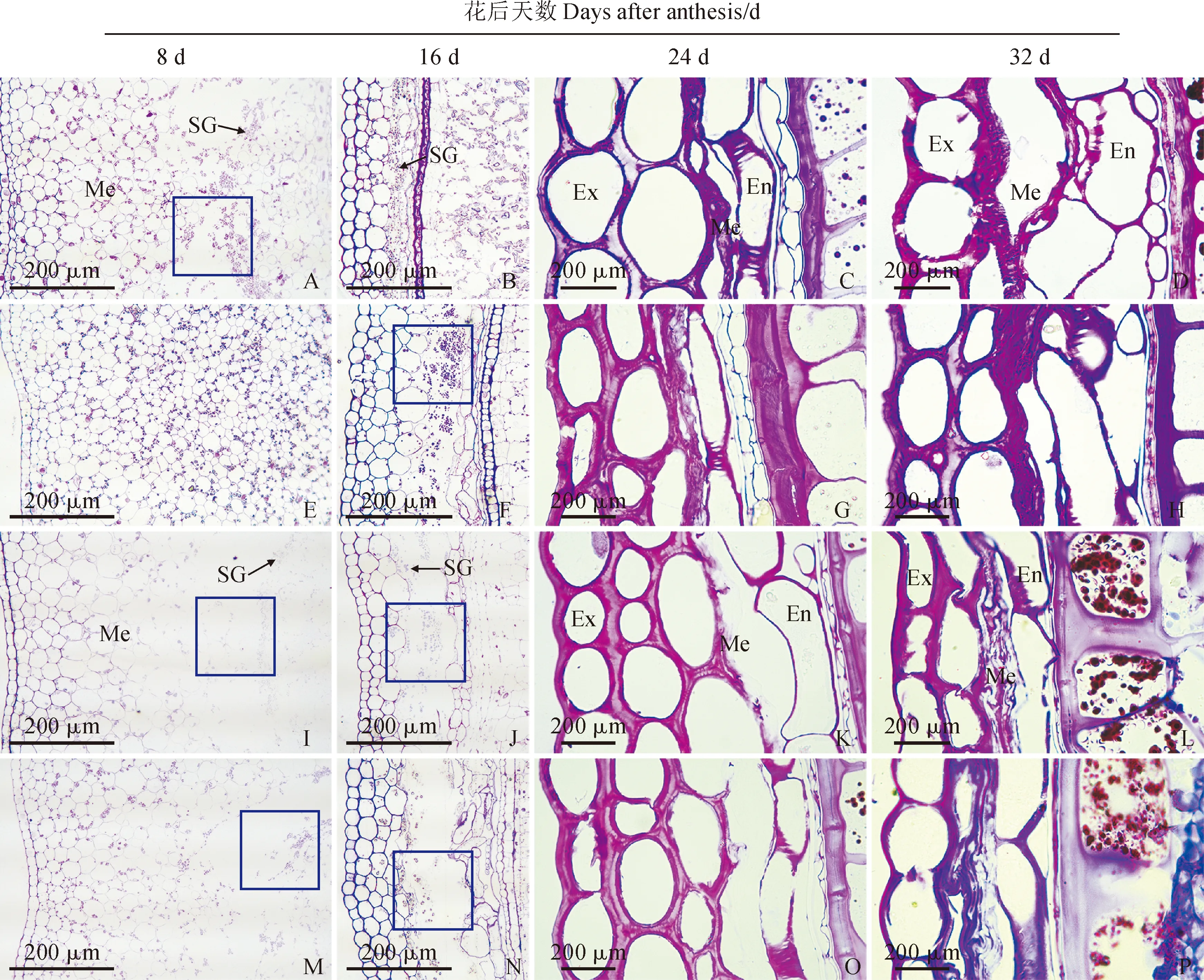
A-H. 扬麦15:A-D. 常温处理组;E-H. 低温处理组;I-P. 烟农19:I-L. 常温处理组;M-P. 低温处理组;En. 内果皮;Ex. 外果皮;Me. 中果皮;SG.淀粉粒;图中蓝色方框示凋亡中的中果皮图2 花后低温下小麦颖果果皮细胞显微结构A-H. YM15: A-D. Normal temperature treatment group; E-H. Low temperature treatment group; I-P. YN19: I-L. Normal temperature treatment group; M-P. Low temperature treatment group; En. Endocarp; Ex. Exocarp; Me. Mesocarp;SG. Starch granule; The blue box in the figure shows the mesocarp in apoptosisFig.2 Microstructure of pericarp cells under low temperature after anthesis
2.3 花后低温下小麦胚乳淀粉体和蛋白体发育显微结构特征
图3和图4显示,在花后8 d,‘扬麦15’常温处理组胚乳细胞中靠近细胞核的位置积累了少量小颗粒淀粉体(图3,A),而其低温处理组胚乳细胞中未发现淀粉体(图3,E),‘烟农19’常温处理组胚乳细胞中已积累一定量的淀粉体和极少量小的蛋白体(图3,I),而低温处理组也尚未发现淀粉体(图3,M);同时,统计结果显示,两小麦品种常温处理组胚乳细胞中淀粉体相对面积、胚乳充实度及蛋白体相对面积均显著高于低温处理组(图4,A-C)。在花后16 d,两个小麦品种常温处理组胚乳细胞中淀粉体淀粉体相对面积均大于低温处理组(图3,B、F、J、N;图4,A);‘扬麦15’常温处理组胚乳细胞中蛋白体相对面积明显大于低温处理组(图3,B,F;图4,B),而‘烟农19’常温处理组与低温处理组蛋白体相对面积无明显差异(图3,J、N;图4,B);在胚乳充实度方面,两小麦品种常温处理组均显著高于低温处理组(图4,C)。在花后24 d,两个小麦品种常温处理组胚乳细胞中淀粉体和蛋白体相对面积均显著大于低温处理组(图3,C、G、K、O;图4,A、B),且‘扬麦15’常温处理组胚乳充实度也显著高于低温处理组(图4,C)。在花后32 d,两小麦品种胚乳细胞已被淀粉体和蛋白体充实(图3,D、L),蛋白体被淀粉体挤压变形,充实在淀粉体的间隙中,导致蛋白体无法正确统计,而两小麦品种常温处理组与低温处理组胚乳细胞中淀粉体的相对面积无显著差异(图3,A);但从显微结构图可以看出,‘扬麦15’低温处理组胚乳充实度较常温处理组高(图3,D、H),而‘烟农19’常温处理组与低温处理组胚乳充实状况类似,胚乳均被淀粉体和蛋白体充实(图3,L、P)。
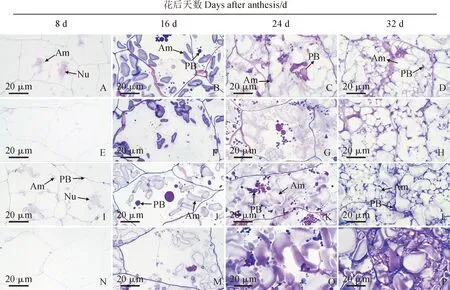
A-H. 扬麦15:A-D. 常温处理组;E-H. 低温处理组;I-P. 烟农19:I-L. 常温处理组;M-P. 低温处理组;En. 内果皮;Ex. 外果皮;Me. 中果皮;图中蓝色方框示凋亡中的中果皮;Am. 淀粉体;Nu. 细胞核;PB. 蛋白体图3 花后低温下小麦胚乳显微结构A-H. YM15: A-D. Normal temperature treatment group; E-H. Low temperature treatment group; I-P. YN19: I-L. Normal temperature treatment group; M-P. Low temperature treatment group; En. Endocarp; Ex. Exocarp; Me. Mesocarp;The blue box in the figure shows the mesocarp in apoptosis; Am. Amyloplast; Nu. Nucleus; PB. Protein bodyFig.3 Microstructure of wheat endosperm cells under low temperature after anthesis
2.4 花后低温条件下小麦颖果韧皮部显微结构特征
在花后8 d,‘扬麦15’小麦颖果韧皮部发育进程明显晚于‘烟农19’,这可以从韧皮部薄壁细胞形态看出:‘扬麦15’常温处理组可以观察到韧皮部薄壁细胞细胞核,而其低温处理组韧皮部薄壁细胞细胞核明显,这也说明了低温条件下韧皮部发育更缓慢(图5,A、E);而‘烟农19’常温处理组和低温处理组韧皮部薄壁细胞形态无明显差别(图5,I、M)。在花后16 d,‘扬麦15’常温处理组韧皮部薄壁细胞细胞核大部分解体,仅有少数细胞能观察到细胞核,而其低温处理组韧皮部有较多薄壁细胞有细胞核,这说明低温处理组韧皮部发育缓慢,细胞核解体进程延迟(图5,B、F);‘烟农19’常温处理组与低温处理组韧皮部薄壁细胞形态无明显差别,但从图中可以看出低温处理组筛管数量和范围要明显小于常温处理组(图5,J、O)。在花后24 d和32 d,两个小麦品种的颖果韧皮部筛管和薄壁细胞在低温处理前后无显著差异;但从韧皮部分布区域来看,低温处理组筛管分子数量和面积要小于常温处理组(图5,C、D、G、H、K、L、N、P)。
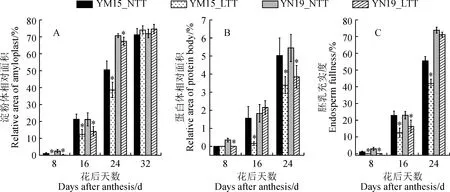
柱形图上方星号(*)表示常温处理组和低温处理组间数据存在显著性差异(P<0.05)图4 花后低温下小麦胚乳贮藏物质相对面积统计Asterisks (*) above the bar chart indicate the significant difference between the normal temperature treatment group and the low temperature treatment group (P<0.05)Fig.4 Statistics of relative area of wheat endosperm storage material under low temperature after anthesis
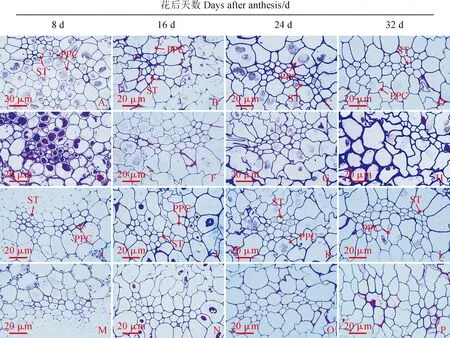
A-H. 扬麦15:A-D. 常温处理组;E-H. 低温处理组;I-P. 烟农19:I-L. 常温处理组;M-P. 低温处理组;PPC. 韧皮部薄壁细胞;ST. 筛管图5 花后低温下小麦颖果韧皮部显微结构A-H. YM15: A-D. Normal temperature treatment group; E-H. Low temperature treatment group; I-P. YN19: I-L. Normal temperature treatment group; M-P. Low temperature treatment group; PPC. Phloem parenchyma cells; ST. Sieve tubesFig.5 The microstructure of the phloem of wheat caryopsis under low temperature after anthesis
2.5 花后低温下小麦传递细胞显微结构特征
小麦传递细胞由糊粉层传递细胞和胚乳传递细胞构成,糊粉层传递细胞位于胚乳的外侧,与质外体腔相连,胚乳传递细胞位于糊粉层传递细胞的内层(图6)。在花后8 d,两小麦品种胚乳表层细胞开始分化为传递细胞,其中‘烟农19’的发育进程较快,已出现了细胞壁加厚现象,意味着壁内突形成(图6,A、I);与常温处理组相比,两小麦品种低温处理组传递细胞发育较缓慢,其中‘扬麦15’低温处理组仍处于细胞化状态(图6,A、E),‘烟农19’低温处理组传递细胞壁内突比常温处理组少(图6,I、M)。在花后16 d,两小麦品种传递细胞分化为糊粉层传递细胞和胚乳传递细胞,前者不积累或很少积累淀粉体,后者积累较多淀粉体(图6,B、J),而‘烟农19’传递细胞分化仍然快于‘扬麦15’,因为‘烟农19’胚乳传递细胞内淀粉体体积较大;‘扬麦15’常温处理组糊粉层传递细胞和胚乳传递细胞细胞壁壁内突较为明显,出现了典型的加厚现象,染色较深(图6,B),其低温处理组仅糊粉层传递细胞出现了加厚的壁内突,胚乳传递细胞未能观察到壁内突(图6,F);‘烟农19’常温处理组和低温处理组糊粉层传递细胞和胚乳传递细胞均有明显的壁内突,其中常温处理组分化更为明显(图6,J、N)。在花后24 d,两小麦品种常温处理组和低温处理组传递细胞显微结构特征(图6,C、G、K、O)与花后16 d(图6,B、F、J、N)规律类似。在花后32 d,两小麦品种传递细胞开始出现皱缩变形现象(图6,D、L);与常温处理组相比,低温处理组糊粉层传递细胞和胚乳传递细胞壁内突数量少,细胞壁薄(图6,D、H、L、P)。
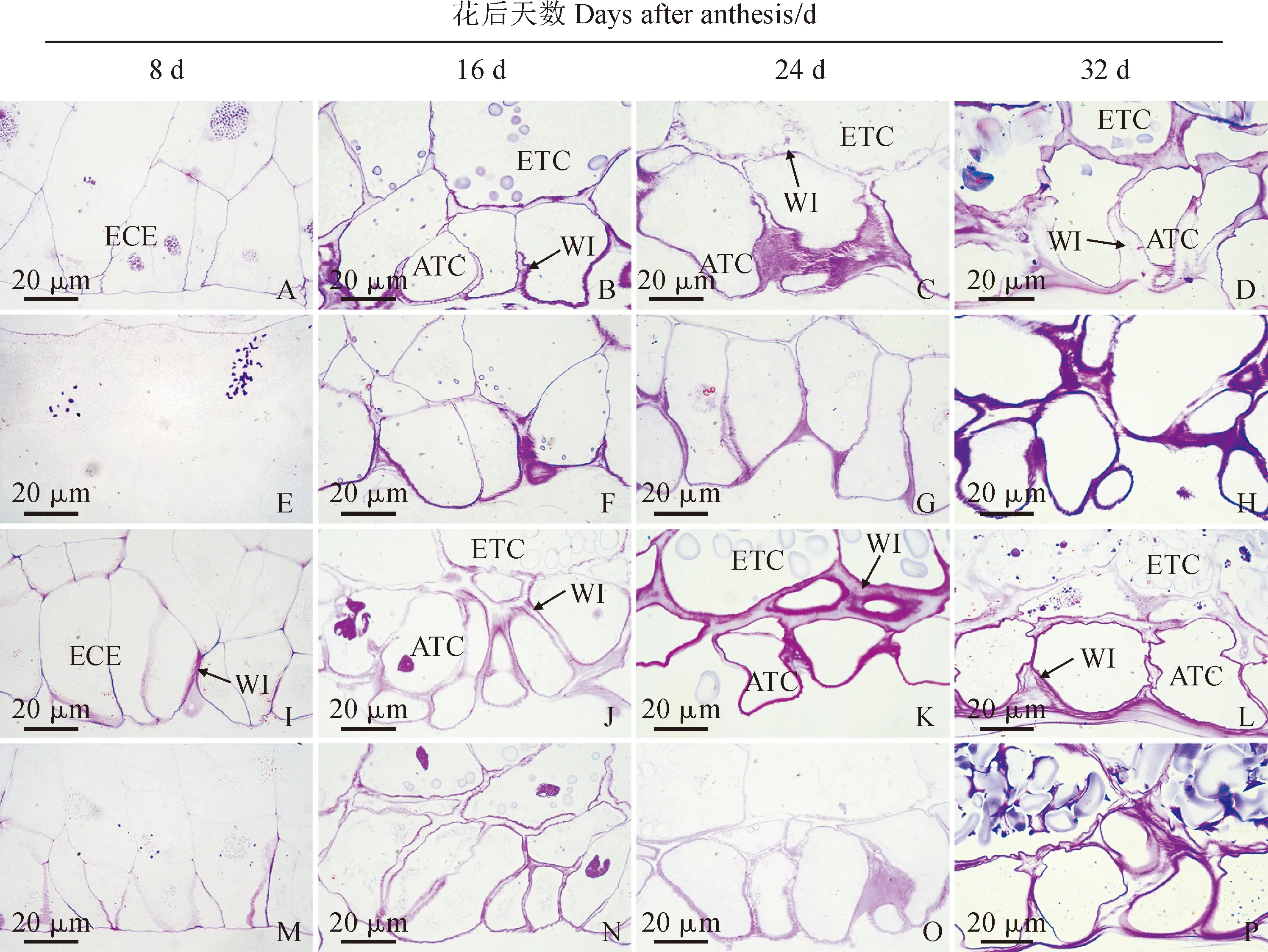
A-H. 扬麦15:A-D. 常温处理组;E-H. 低温处理组;I-P. 烟农19:I-L. 常温处理组;M-P. 低温处理组;ATC. 糊粉层传递细胞;ECE. 胚乳表层细胞;ETC. 胚乳传递细胞;WI. 壁内突图6 花后低温下小麦颖果胚乳传递细胞显微结构A-H. YM15: A-D. Normal temperature treatment group; E-H. Low temperature treatment group; I-P. YN19: I-L. Normal temperature treatment group; M-P. Low temperature treatment group; ATC. Aleurone transfer cells; ECE. Epidermalcells of endosperm; ETC. Endosperm transfer cells; WI. Wall ingrowthsFig.6 Microstructure of wheat caryopsis endosperm transfer cells under low temperature after anthesis
3 讨 论
3.1 花后低温下小麦颖果果皮发育特征
研究表明,小麦的产量和品质不仅受到遗传因素的影响,也会受到环境以及栽培方式的影响[18],其中水分、温度对小麦籽粒营养物质的积累影响较大[19]。果皮是由子房壁发育而来的,可以分为内果皮、中果皮、外果皮3层。在小麦颖果生长发育初期,果皮细胞出现核聚缩、线粒体降解、膜破裂等现象,即经历细胞程序性死亡的过程[20]。这一进程较为缓慢,且持续时间较长,其在胚乳发育过程中起着一定的调节作用。果皮为营养物质积累和运输提供一定的场所,并对胚和胚乳的发育起到保护作用[21]。顾蕴洁等[22]研究表明,环境因素在水稻果皮生长发育过程中扮演着重要的角色。陈昕钰等[23]发现干旱处理使得小麦果皮早期发育速度加快,且抑制了中果皮细胞的降解和果皮中淀粉体的降解。本实验发现小麦花后8~16 d,低温处理组果皮细胞厚度与细胞层数均大于常温处理组,证明花后低温减缓了小麦颖果发育早期果皮的凋亡速率,并且降低了果皮中淀粉体的降解速率。陈思思等[24]发现低温处理使小麦叶片的气孔导度、蒸腾速率以及叶绿素含量均显著降低,从而抑制了小麦果皮的降解速率。Ran等[25]发现,高水平表达的AMY基因可以提高α-淀粉酶活性,从而促进果皮中淀粉体的降解速率。根据以上研究结果,我们推测花后低温处理可能降低了相关基因的表达量,从而减缓了果皮中淀粉体的降解速率。
3.2 花后低温下小麦胚乳的发育特征
胚乳是小麦储藏养分的最主要器官,其发育的好坏以及充实度的高低对籽粒的产量以及品质具有决定性作用[26]。陈昕钰等[23]发现干旱胁迫加速了小麦胚乳组织早期的发育,但是抑制了胚乳组织后期的发育。郭文善等[27]研究发现花后14 d之前进行高温处理,小麦胚乳细胞数目增加,而在花后14 d后高温处理,则会减缓胚乳细胞的分裂。马丽娟[28]也发现在小麦胚乳灌浆期时,温度高于26 ℃或者低于20 ℃,小麦胚乳的灌浆速率均降低,从而降低了小麦产量。本试验发现,花后低温处理降低了小麦胚乳发育早期淀粉体积累量,但对小麦胚乳发育后期淀粉体积累无显著性影响;花后低温处理也使得小麦颖果发育早期和中期淀粉体和蛋白体相对面积较常温组处理小,最终使得胚乳充实度降低。据报道,低温处理虽然影响了植物蔗糖合成和光合速率,但是植物会通过翻译后激活或者酶表达增强来抵消低温带来的影响[29];冷处理期WCS120脱水蛋白mRNA含量迅速升高,增加了小麦耐寒的能力[30];低温降低了小麦叶片的光化学猝灭系数和实际光化学效率、叶绿素含量、蒸腾速率、叶片气孔导度;春季低温会降低了小麦的光合效率,导致光合同化物积累量降低[31-32]。同时,本研究发现花后低温使得小麦颖果韧皮部筛管范围缩小、胚乳传递细胞壁内突数目减少,从而导致了小麦胚乳充实度的降低。
3.3 花后低温下小麦养分运输组织发育特征
小麦颖果营养物质的运输组织由母体运输组织合点、果皮维管束、珠心突起传递细胞和子代运输组织胚乳疏导细胞、传递细胞、糊粉层两部分组成[33]。研究表明养分要进入胚乳,则必须经过腹部维管束中的韧皮部、木质部、合点以及珠心突起等组织[34]。李国辉等[35]发现,通过韧皮部转载营养物质是水稻叶片向籽粒转运的首要关键步骤,其中韧皮部面积增大提高了叶片营养物质向颖果的转运速率。王兵等[26]通过3个小麦品种的比较发现,小麦运输组织发育好的品种,其颖果的灌浆效果比较好,颖果细胞内积累的淀粉体和蛋白质体较多。本研究发现,花后低温使得小麦颖果韧皮部范围缩小,减缓了营养物质的运输速率,从而进一步延缓了小麦颖果细胞内营养物质的积累。胚乳传递细胞是由内层胚乳传递细胞和外层糊粉层传递细胞组成。胚乳传递细胞是胚乳发育过程中分化最早的细胞,它们紧挨着胚乳腔的内层[36]。在颖果发育的后期,胚乳传递细胞的细胞壁向内皱缩,细胞凋亡[37]。其胚乳传递细胞的主要作用是负责将灌浆物质从胚乳腔中转移到内胚乳组织[36],故胚乳传递细胞在小麦胚乳灌浆过程中起到极其重要的作用。余徐润等[9]发现春季低温使得小麦颖果珠心突起传递细胞面积增大。刘大同等[39]报道,推迟播种‘扬麦16’使得小麦的传递细胞壁内突数目增加,从而影响到小麦胚乳的灌浆。本研究发现,花后低温减缓了早期胚乳传递细胞的发育进程,导致胚乳传递细胞壁内突数目减少,从而使养分运输效率降低。吴青霞[40]等在8个小麦品种的药隔期进行低温处理,发现低温对不同小麦品种产量的降低程度,以及使小麦产生的生理生化机制都存在显著差异。
3.4 花后低温下不同小麦品种颖果的发育差异
本试验中虽然花后低温使得‘扬麦15’的灌浆延迟、‘烟农19’的灌浆提前,但最终均降低了两小麦品种的粒重,这意味着小麦颖果中干物质的积累量在花后低温影响下均会显著下降,该现象与杜世州等所报道的低温影响小麦的灌浆速率并降低产量等研究结果一致[41]。在本研究中,低温处理组的‘扬麦15’颖果鲜重在花后24~32 d上升趋势较大,而常温处理组的上升趋势较为平缓,因此低温使‘扬麦15’的灌浆时间延长。对于‘烟农19’而言,常温处理组的颖果鲜重在花后24~32 d持续增加,但低温处理组的增加趋势较为平缓,所以低温处理缩短了‘烟农19’的灌浆时间。‘扬麦15’为春性小麦,春化时间较短,前人研究[14]表明‘扬麦15’灌浆速率较慢,在这样灌浆期长的背景下花后6~8 d小麦胚乳内淀粉粒和蛋白体的积累量很少,相关合成酶基因的表达水平也低于灌浆快的‘烟农19’,因此低温处理后胚乳内基因表达水平发生的改变将与‘烟农19’不同。此外,低温处理后果皮的凋亡速率减慢、壁内突出现较迟也是造成‘扬麦15’灌浆时间延迟的重要原因之一。而‘烟农19’为半冬性小麦,灌浆时间较短,花后6~8 d时胚乳内已积累了部分淀粉,在低温处理的背景下相关基因的表达将会发生改变,从而引发淀粉和蛋白积累量的变化,灌浆时间提前也可能与胡刚元发现的气温对小麦灌浆时间的影响呈抛物线型等结论相关[20]。另外,两种小麦品种灌浆过程中对低温响应的差异也可能与春化效应[42]、品种的特性[39]以及灌浆过程中对温度响应的差异[20]有关
4 结 论
花后低温对小麦颖果果皮的发育、淀粉体和蛋白体的积累、胚乳充实度、维管束面积以及传递细胞均有较大影响。花后低温减缓了小麦颖果发育早期果皮细胞的凋亡以及淀粉体的降解,使得小麦胚乳发育早期和中期淀粉体和蛋白体的积累量以及充实度降低,对小麦胚乳发育后期淀粉体积累量无显著性影响,其中春性品种‘扬麦15’对低温的响应更加敏感。此外,花后低温使小麦颖果韧皮部筛管范围缩小,不利于小麦胚乳传递细胞的发育,导致壁内突减少,从而降低了养分的运输速率,造成灌浆过程物质积累量减少,降低了成熟期颖果干重。

