非洲猪瘟病毒p72蛋白阻断ELISA检测方法的建立
张路捷,高雁怩,夏婷婷,白 娟,姜 平*
(1.南京农业大学 农业农村部动物细菌学重点实验室,南京 210095;2.南京农业大学 动物传染病实验室,南京 210095)
非洲猪瘟(African swine fever, ASF)是由非洲猪瘟病毒(African swine fever virus, ASFV)引起的一种急性、高度致死性的烈性传染病。世界动物卫生组织(OIE)将其列为法定报告动物疫病,同时也是我国重点防范的一类动物疫病。该病于2018年8月在我国首次报道,对我国养殖业造成了巨大经济损失。ASFV为二十面体对称的双链DNA病毒,是非洲猪瘟病毒科()、非洲猪瘟病毒属()的唯一成员,该病毒基因组长度为170~190 kb,有150~167个开放阅读框。ASFV的p72、p54和p30等结构蛋白均具有良好的抗原性和免疫原性,是ELISA等血清学诊断的重要靶点。目前,我国对该病的防控主要依赖于早期诊断、严格的运输控制及其他生物安全措施。
ASF病原学诊断技术主要包括病毒分离、红细胞吸附试验、PCR、real-time PCR、重组酶聚合酶扩增(RPA)等;血清学诊断技术主要有荧光抗体技术、ELISA、胶体金快速免疫层析法(GICA)等。OIE将ELISA作为诊断ASF的首选血清学方法。国外已研发出几种ASFV诊断试剂盒,比如p72蛋白间接ELISA诊断试剂盒(Ingenasa, 西班牙)和p30阻断ELISA诊断试剂盒(IDvet, 法国)。我国已研制成功ASFV p30蛋白抗体检测试剂盒。本研究采用ASFV Pig/HLJ/2018毒株重组p72蛋白及其单克隆抗体6E5,成功建立了阻断ELISA方法,该方法具有较高的敏感性和良好的特异性,为我国ASFV感染诊断和流行病学调查提供了有效方法。
1 材料与方法
1.1 细胞、菌株及主要试剂
宿主菌BL21(DE3)、pET-28a-p72(1-329 aa)重组质粒、ASFV p72蛋白单克隆抗体6E5由本实验室制备、鉴定及保存。ASFV阳性血清、阴性血清及ASFV Pig/HLJ/2018灭活病毒液由中国农业科学院哈尔滨兽医研究所提供,其中,临床ASFV阳性血清来自黑龙江省的农业农村部公布病例。猪伪狂犬病病毒(PRV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪圆环病毒2型(PCV2)、A型塞内卡病毒(SVA)、猪口蹄疫病毒(FMDV)、大肠杆菌(,)、多杀性巴氏杆菌(,PM)、副猪格拉瑟菌(,GPs)和胸膜肺炎放线杆菌(,APP)参考阳性血清均由本实验室收集保存。羊抗鼠IgG(H+L)-HRP、TMB溶液购自上海碧云天生物技术有限公司。HRP-葡萄球菌A蛋白(SPA)(HRP-SPA)购自武汉博士德生物工程有限公司。经欧盟ASFV参考实验室认证的ID ScreenAfrican Swine Fever Competition ELISA试剂盒购自法国IDvet公司。
1.2 重组p72蛋白的表达与纯化
将重组质粒pET-28a-p72(1—329 aa)转化至BL21(DE3)中,加入终浓度为1 mmol·LIPTG诱导表达6 h,超声破碎,4 ℃ 12 000 r·min离心10 min,将沉淀与上清分别进行SDS-PAGE鉴定。重组p72蛋白经尿素透析法纯化。将纯化的蛋白进行Western blot鉴定。重组p72蛋白经BCA法测定蛋白浓度后,保存于-80 ℃备用。
1.3 单克隆抗体的制备、纯化及辣根过氧化物酶(HRP)标记
6E5单克隆抗体杂交瘤细胞株,由本实验室制备,小鼠单抗的亚型属于IgG1型。
利用6E5杂交瘤细胞制备腹水,采用Western blot鉴定其与灭活的AFSV病毒液反应特性。将腹水送至南京金斯瑞生物科技有限公司进行纯化和HRP标记。酶量0.905 mg·mL,IgG量1.923 mg·mL,克分子比值(E/P)1.882,标记率59.89%,ELISA抗体效价为1∶51 200。将纯化后的单抗进行SDS-PAGE鉴定,并置于-80 ℃长期保存。
1.4 阻断ELISA最佳反应条件的选择
用pH 9.6碳酸盐抗原包被液将重组p72蛋白稀释至终浓度为1.0、0.5、0.1 μg·mL,包被ELISA酶标板,每孔100 μL,于37 ℃ 2 h,4 ℃ 12 h,然后用PBST洗涤5次,每次1 min。分别用含5%脱脂乳、2%明胶、1%BSA和0.1%BSA的PBST溶液进行封闭,每孔200 μL,于37 ℃ 2 h,洗涤同上。将ASFV阳性血清和阴性血清用PBST进行1∶2、1∶4、1∶8稀释,每孔100 μL,于37 ℃ 1 h。洗涤后将酶标单抗HRP-6E5用PBST进行1∶2 000、1∶3 000、1∶4 000、1∶5 000稀释,每孔100 μL,于37 ℃作用1 h。洗涤同上,加入TMB底物,于37 ℃避光显色10 min,显色完成后每孔加入50 μL 2 mol·L硫酸终止显色。用酶标仪在450 nm处读取吸光度(OD)值。根据血清OD值计算阻断率,确定最佳反应条件。计算公式:
阻断率=[(阴性对照OD值-待检血清OD值)/阴性对照OD值]×100%。
1.5 阻断ELISA临界值的确定

1.6 敏感性试验
用本研究建立的阻断ELISA方法检测50份ASFV阳性血清(经IDvet公司生产的ASFV抗体检测试剂盒检测验证),以判定该方法的敏感性。
1.7 分析特异性试验
用本研究建立的阻断ELISA方法检测已知的ASFV、PRV、PRRSV、CSFV、PCV2、SVA、FMDV、、PM、GPs和APP抗体阳性血清,以确定该方法的特异性。
1.8 重复性试验
1.8.1 批内重复性试验 用同一批次表达的重组p72蛋白包被酶标板检测20份阳性样品和10份阴性样品,每份样品设置3个重复,计算批内变异系数(coefficient of variation, CV)。
1.8.2 批间重复性试验 用3个不同批次表达的重组p72蛋白包被酶标板检测20份阳性样品和10份阴性样品,计算批间变异系数,评价该方法的重复性。
1.9 临床血清样品检测与符合率试验
用本研究建立的阻断ELISA方法和IDvet公司生产的ASFV抗体检测试剂盒同时检测447份临床猪血清样品,计算相对敏感性、相对特异性和符合率。计算公式:
相对敏感性(%)=[阳性样品数/(阳性样品数+假阴性样品数)]×100;
相对特异性(%)=[阴性样品数/(阴性样品数+假阳性样品数)]×100;
符合率(%)=[(阳性样品数+阴性样品数)/检测总数]×100。
2 结 果
2.1 目的基因的克隆、表达与纯化
将重组质粒转化至大肠杆菌BL21(DE3)感受态细胞,经IPTG诱导后,进行超声裂解,分别将上清和沉淀进行SDS-PAGE鉴定。结果显示,只有诱导沉淀组在40 ku处出现明显条带,大小与预期相符(图1A),说明重组p72蛋白主要以包涵体的形式表达。通过尿素透析法纯化重组p72蛋白。将纯化后的目的蛋白进行Western blot鉴定,ASFV阳性血清用PBST进行1∶100倍稀释作为一抗,HRP-SPA用PBST进行1∶10 000倍稀释作为二抗,结果显示在40 ku处出现特异性条带(图1B),表明重组p72蛋白具有良好的反应原性。

M.蛋白质相对分子质量标准;1.诱导上清;2.诱导沉淀;3.重组p72蛋白纯化后;4.BL21菌体裂解物对照;5.重组p72蛋白纯化后;6.BL21菌体裂解物对照
2.2 单克隆抗体的鉴定、纯化与HRP标记
Western blot结果显示(图2A), 6E5单克隆抗体能与灭活的ASFV发生特异性反应,在72 ku处有特异性的目的条带。纯化的6E5腹水SDS-PAGE鉴定结果(图2B)显示,该抗体具有50 ku(重链)和25 ku(轻链)两个明显条带。HRP标记抗体(HRP-6E5)ELISA工作浓度为1∶4 000。

M.蛋白质相对分子质量标准;1.ASFV Pig/HLJ/2018灭活病毒液;2.猪肺泡巨噬细胞裂解物对照;3.小鼠腹水单抗6E5;4.纯化的小鼠腹水单抗6E5
2.3 阻断ELISA最佳反应条件的确定
通过对阻断ELISA方法的优化,最终确定:最佳抗原包被浓度为0.5 μg·mL;血清稀释度为1∶1(表1),反应条件为37 ℃ 1 h;最佳封闭剂为1% BSA(表2),反应条件为37 ℃ 2 h;酶标抗体稀释度为1∶4 000(表3),反应条件为37 ℃ 1 h;TMB底物37 ℃ 10 min。
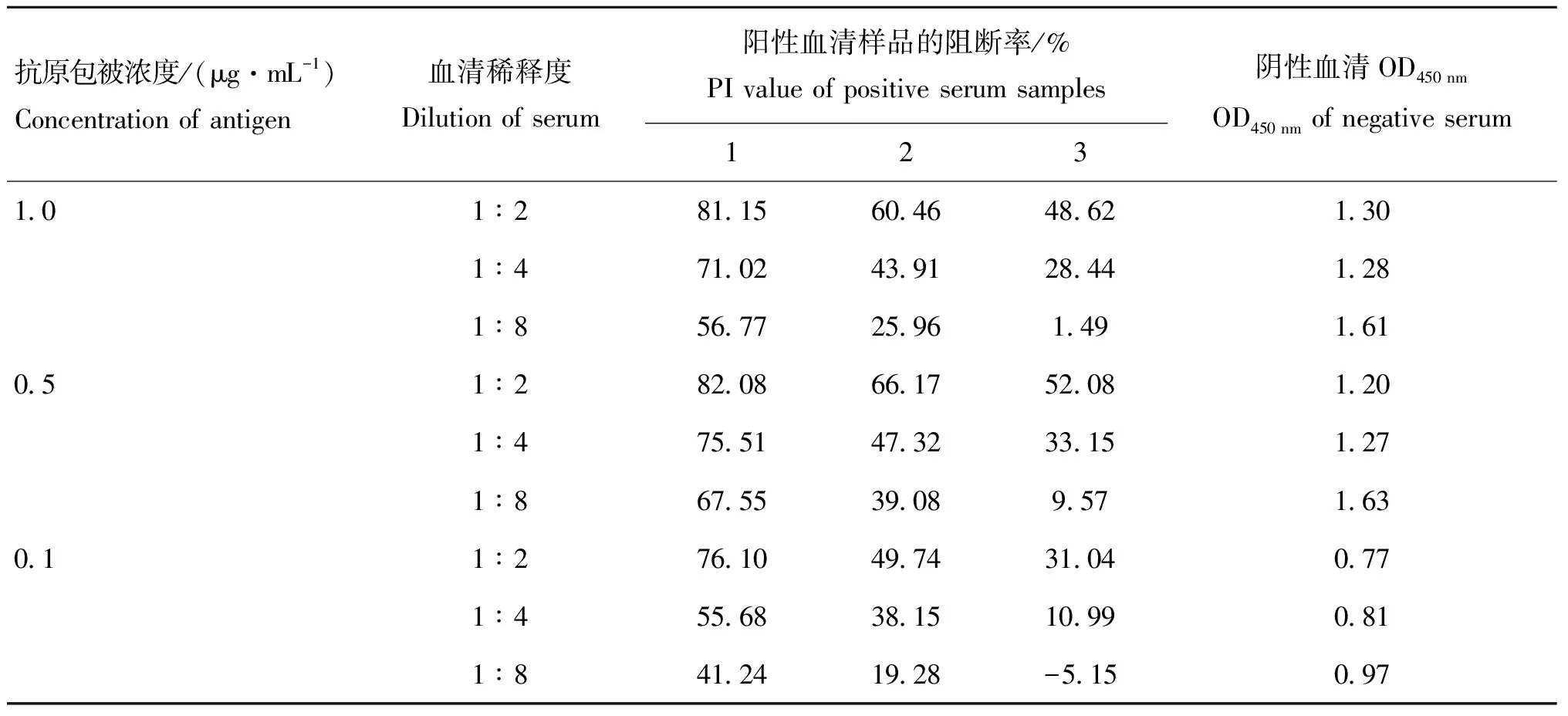
表1 抗原包被浓度和血清稀释度的确定

表2 最佳封闭液的确定

表3 酶标单抗稀释度的确定
2.4 临界值确定


图3 ASFV阴性血清阻断率频率分布分析
2.5 敏感性试验结果
选取50份ASFV阳性血清样品用本研究建立的阻断ELISA方法进行敏感性试验,结果显示,3份血清PI值为35.75%~37.49%,判为阴性,其余47份血清PI值58.01%~95.00%,判为阳性,表明该方法敏感性为94.0%。
2.6 特异性试验结果
采用本研究建立的阻断ELISA方法检测ASFV、PRV、PRRSV、CSFV、PCV2、SVA、FMDV、、PM、GPs和APP抗体阳性血清,结果如表4所示,除ASFV阳性血清检测结果为阳性外,其他均为阴性,证明该方法具有良好的特异性。

表4 阻断ELISA特异性试验结果
2.7 重复性试验结果
选取20份ASFV阳性血清和10份ASFV阴性血清用本研究建立的阻断ELISA方法进行重复性试验。统计学分析结果显示:批内变异系数为0.78%~11.14%,批间变异系数为1.17%~11.56%,表明该方法具有良好的重复性。
2.8 符合率试验结果
用本研究建立的阻断ELISA方法与IDvet公司生产的ASFV抗体检测试剂同时检测447份猪血清样品。结果如表5所示,该方法与商品化试剂盒的相对敏感性为95.3%;相对特异性为94.5%;总符合率为94.9%。

表5 阻断ELISA与商品化试剂盒符合率试验结果
3 讨 论
自2018年8月我国辽宁省沈阳市报告了首例ASF病例以来,该病迅速在全国范围内扩散,严重影响了我国的跨国贸易、食品安全及畜牧业的发展。由于ASF的临床症状与经典猪瘟(CSF)、猪繁殖与呼吸综合征(PRRS)十分相似,无法通过临床症状和病理变化进行鉴别诊断。因此,该病的确诊主要依靠实验室诊断。在病毒血清学检测技术中,ELISA抗体检测方法具有快速、敏感、便捷和批量化等优点,适用于大规模样品检测,故建立一种可靠的ELISA方法,对我国ASF疫情防控十分必要。
我国学者对ASFV抗体检测技术进行了一些研究,比如靳雯雯等建立的ASFV VP73蛋白间接ELISA方法具有良好的特异性和敏感性,检测能力与进口试剂盒相当;曹琛福构建的p54蛋白竞争ELISA抗体检测方法与西班牙Ingenasa试剂盒符合率为98.13%;张蕾等根据p30、p54和p72蛋白设计了3条合成肽,建立了ASFV间接ELISA抗体检测方法,与进口商品化试剂盒的符合为92.9%。目前,针对ASFV p72蛋白的阻断ELISA抗体检测方法研究不多。ASFV检测抗原主要有p72、p30和p54蛋白等,其中,p72蛋白是ASFV中主要的结构蛋白,其氨基酸序列高度保守,在病毒复制周期中持续存在能够刺激机体产生较高滴度的抗体,是ASFV血清抗体阻断方法的理想靶标。本实验室前期制备了12株抗p72蛋白的单克隆抗体,并通过阻断ELISA方法筛选鉴定出一株阻断效果良好的单克隆抗体6E5。本研究利用ASFV p72蛋白单克隆抗体6E5成功建立了ASF阻断ELISA抗体检测方法。该方法与PRV、PRRSV、CSFV、PCV2、SVA、FMDV、、PM、GPs和APP的参考阳性血清均不发生交叉反应,证明该方法具有较高的特异性。该方法的批内、批间试验变异系数均小于规定标准的15%,表明该方法的重复性良好。该方法与ID ScreenAfrican Swine Fever Competition ELISA试剂盒同时检测447份猪临床血清样品,两者总符合率为94.9%。综上所述,本研究建立的ASF阻断ELISA抗体检测方法具有较好的敏感性和特异性,可用于临床血清学检测。
本研究采用的ASFV阳性血清和阴性血清来源于中国农业科学院哈尔滨兽医研究所,临床血清样品来源于规模化猪场。由于阳性血清样品的猪感染AFSV的时间等背景不够清晰,因此该方法能否用于病毒感染的早期诊断尚需进一步研究。
4 结 论
利用ASFV重组p72蛋白及其单克隆抗体6E5,成功建立了ASFV p72蛋白阻断ELISA检测方法,该方法具有良好的敏感性、特异性和重复性,为临床ASFV血清流行病学调查提供了技术手段。

