恶性疟原虫ApiAP2蛋白质家族研究进展
郑雨昕,张义伟,姜 宁
(沈阳农业大学动物科学与医学学院,沈阳 110161)
ApiAP2转录因子家族是植物拟南芥的第二大转录因子。2005年,Balaji等首先发现了顶复门原虫中的一类可能的转录因子,它带有一个Apetala2/ERF(乙烯反应因子)整合酶DNA结合域相似的结构域,随之这个新的转录因子家族被命名为ApiAP2(apicomplexan AP2)。ApiAP2转录因子包括1~3个AP2结构域及其额外的功能区,它们的大小差异很大,相差数量可以达到200至数千个氨基酸,通常在AP2结构域之外几乎没有序列同源性。人们之所以对这种蛋白质感兴趣,是因为作为一种转铁蛋白质,ApiAP2家族可能控制着多种基因的表达。目前,恶性疟原虫ApiAP2家族共有27个成员,不同成员在疟原虫发育的各个阶段都有表达;恶性疟原虫的无性繁殖和性别分化过程与不同基因表达模式有关,复杂的转录因子调控系统严格控制着这些模式;说明与植物同源基因一样,ApiAP2家族参与了虫体整个生活史和分化过程。本文从蛋白质结构、各时期作用、蛋白质组学等多个方面对恶性疟原虫ApiAP2蛋白质家族进行综述。
1 ApiAP2蛋白质的结构
ApiAP2蛋白质结构域大小约为60个氨基酸,通常由3个β链和1个用于稳定β-链的α-螺旋组成,链2和链3之间存在一个突出的发夹状、带有正电荷的结构,这种结构可以增强ApiAP2转录因子与DNA结合的亲和力。在不断的进化过程中,顶复门寄生虫ApiAP2 转录因子产生了特异性适应,因此ApiAP2 转录因子识别与结合基序具有高度灵活性。此外,ApiAP2 转录因子还存在AT-hook结构,此结构有助于转录因子与DNA结合。图1为已知恶性疟原虫ApiAP2蛋白质结构域示意图。
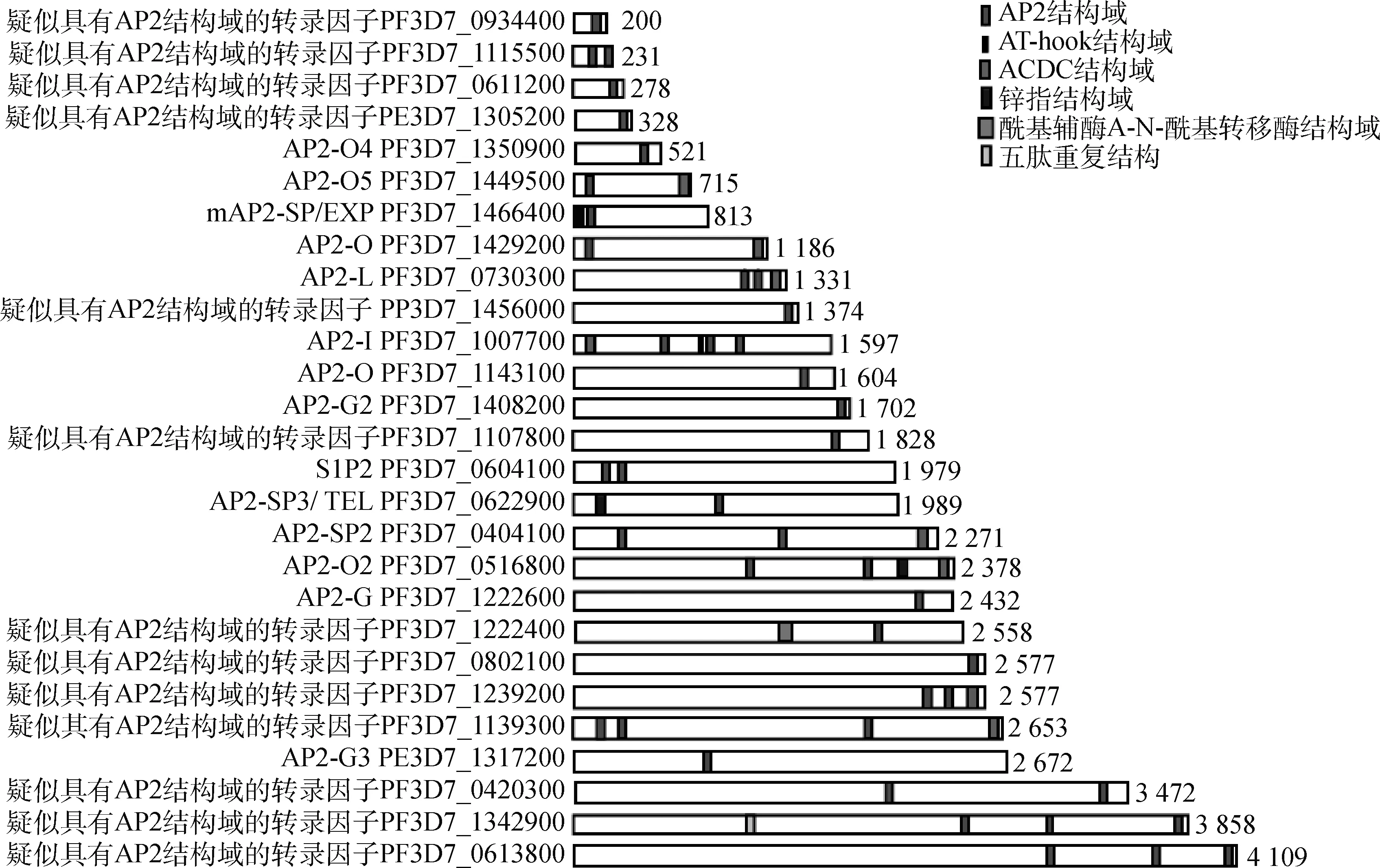
已知恶性疟原虫ApiAP2蛋白质结构域示意图(彩图见OSID开放科学数据与内容),引自杰宁佳等[7]。蛋白质按大小排列,ApiAP2蛋白质结构域用红色标记,ACDC结构域用粉色标记,AT-hook结构域用黑色标记,锌指结构域用深蓝色标记,酰基辅酶A-N-酰基转移酶结构域用浅蓝色标记,五肽重复结构域用黄色标记
2 ApiAP2蛋白质在恶性疟原虫各个寄生阶段的转录作用
在感染人类的5种疟原虫中,恶性疟原虫的危害最为致命。恶性疟原虫的整个生命周期主要包括蚊媒、人类肝和人类血液三大发育阶段。ApiAP2转录因子在恶性疟原虫各个寄生阶段都发挥着不同的转录作用。
2.1 红细胞外期
当含有恶性疟原虫子孢子的雌性按蚊叮咬人体并吸入人体血液时,子孢子会随着按蚊唾液进入人体外周血液,并经由门静脉侵入肝寄生。人体中疟原虫的发育分为2个阶段,分别是红细胞外期和红细胞内期。其中红细胞外期主要是指疟原虫在肝内寄生的阶段,也称为肝内期。最新研究证明,AP2-L(PF3D7_0730300)是迄今为止唯一参与肝内期的特异性转录因子,主要表达在恶性疟原虫和伯氏疟原虫的滋养体时期。AP2-L识别的基序为AATTTCC,并可以识别11个大多与宿主细胞重塑有关的靶基因。研究人员发现AP2-L基因敲除后,子孢子虽然可以正常侵入肝细胞,但其发育会受到干扰。由此可以推测,AP2-L在肝内期可能调控子孢子的生长发育。另一个可能参与肝内期基因调控的ApiAP2转录因子是尚未鉴定的PF3D7_1139300。人们在肝内期特异性基因LISP2(PF3D7_0405300)启动子序列诱变试验中鉴定出了它识别的基序TAGAACA。突变LISP2基因会增强靶基因的表达,所以PF3D7_1139300可能在基因抑制中发挥作用。这些发现让人们对ApiAP2蛋白质在恶性疟原虫肝细胞寄生阶段中发挥的重要作用有了全新认识。
2.2 红细胞内期
该阶段为裂殖子入侵红细胞并在其内发育的过程,包括无性裂殖体增殖循环和配子体的形成。ApiAP2基因在红细胞内期的表达通常可以分为4类,分别对应于疟原虫无性发育的环状体期、滋养体早期、裂殖体早期和裂殖体阶段。在过去的研究中,人们发现很少有ApiAP2基因在红细胞内期发育阶段被成功敲除,这更加说明了它们在疟原虫红细胞内期发育阶段的重要性。在红细胞内期,许多ApiAP2转录因子的结合基序位于其他ApiAP2基因上游,故ApiAP2转录因子还可以被顺序激活。以下有针对性的研究初步揭示了ApiAP2转录因子在红细胞内期的主要功能。
Campbell等发现了3个可能的AP2基序,分别是AP2-EXP(PF3D7_1466400)、SIP2(PF3D7_0604100)和AP2-O(PF3D7_1143100),这3个基序均富含基因启动子。基因家族共有60个成员,但恶性疟原虫在每个生长周期中只能表达1个基因, 且每一代疟原虫表达的基因不尽相同。这种独特的转录调控模式导致疟原虫高度抗原变异,同时也是恶性疟原虫致病、逃避宿主免疫应答的关键。因此这3个AP2基序很有可能在红细胞内期发挥重要的转录作用。在上述研究中,研究人员试图确定AP2-EXP在恶性疟原虫虫株毒力基因调控中的作用,但却发现AP2-EXP缺失后虫体无法正常生存,这说明该转录因子在红细胞内期起着至关重要的作用。AP2-EXP是一个92 ku的蛋白质,其N-末端含有1个AP2结构域和1个AT-hook位点。AP2-EXP识别的DNA基序TGCATGCA是顶复门原虫基因组中基因间隔区表达最多的八聚体,其结合位点在基因家族成员的上游。AP2-EXP参与调节多个基因家族,包括RIFIN、STEVOR、Pfmc-2tm。这些基因家族成员的表达是克隆性变异的,在恶性疟原虫红内期发育过程中会受到高度调控。目前,已知RIFIN基因在滋养体早期转录,STEVOR和Pfmc-2tm基因在滋养体晚期转录,但控制它们激活的确切机制和因素仍在深入研究中。Martins等已证明,AP2-EXP的非DNA结合区域是调节致病基因的关键转录因子。在连接不同亚端粒毒力基因家族表达的过程中,AP2-EXP的作用十分关键。
AP2-I(PF3D7_1007700)由3个AP2结构域、1个AT-hook和ACDC结构域组成,编码1个190 ku的蛋白质。AP2-I是ACDC结构域中位于N-端区中唯一的ApiAP2转录因子;AP2-I的3个AP2结构域分别结合不同的DNA基序。GTGCAC是AP2-D3的DNA结合基序,大部分集中于裂殖体期表达基因的上游,人们预测这些基因可能在裂殖子入侵红细胞中发挥作用。染色质免疫沉淀和深度测序技术(Chip-seq)证实了AP2-I的确与许多侵袭基因启动子相关。在一些研究中发现,AP2-I、溴结构域蛋白(PfBDP1和PfBDP2)、染色质重塑因子这几种物质可以形成复合物。AP2-I还可以和其他AP2蛋白质结合。例如,AP2-I可以在几个编码ApiAP2转录因子基因上游与AP2-G结合,这表明在ApiAP2家族成员之间可能存在复杂的调控互作网络。AP2-I还可能通过诱导染色质重塑和招募转录机制来发挥其调节功能;但是,要彻底明确分子调节机制的细节还需要进一步的研究。
在ApiAP2转录因子家族中,还存在一些功能特殊的成员。它们不调控转录过程,而是与恶性疟原虫SPE2蛋白质相互作用,优先与端粒相关的重复元件区域结合,并在异染色质的形成和维持基因组的完整性方面发挥关键作用,例如SIP2(PF3D7_0604100)。过度表达SIP2的N端片段对基因表达的影响微乎其微,这进一步证实了它的基本功能与转录调控无关。SIP2是1个230 ku的蛋白质,含有2个N端串联排列的AP2结构域,在分裂过程中可以变为1个60 ku的活性N端片段。SIP2的同源基因在所有已测序的疟原虫物种中均可找到,如伯氏疟原虫(PBANKA_0102900)、约氏疟原虫(PY17X_0104500)和微小隐孢子虫(Cdg4_3820)。恶性疟原虫SIP2基因共有序列主要位于染色体内部区域,这表明SIP2基因可能对染色体末端生物学具有额外功能。除了SIP2,在最新的研究成果中,研究人员鉴定了AP2-HC(PF3D7_1456000),该AP2家族成员既不参与调控基因表达,也不参与形成与维持异染色质,而是组成疟原虫异染色质的核心成分。恶性疟原虫克隆性变异基因表达受表观遗传调控,这些基因的沉默正是由异染色质介导完成的。疟原虫共有14条染色体,异染色质位于所有染色体的亚端粒区和部分染色体的内部。一般而言,异染色质比常染色质的DNA修复机制效率低,因此异染色质转录基因的突变率会有所增加。异染色质转录基因控制着表面抗原、入侵因子、营养通道等多种关键因素,对寄生虫生存至关重要。恶性疟原虫异染色体蛋白质1(PfHP1)可以和发生三甲基化的组蛋白3、赖氨酸9结合,并与基因的互斥表达有关。2014年,Brancucci等发现PfHP1缺失会抑制表达多个与抗原变异有关的基因家族,其中包括基因家族。而后更加深入的研究发现,由PfHP1和H3K9me3结合而成的异染色质区域包含了400多个基因(约占基因组中所有蛋白质编码基因的8%)。综上所述,作为组成异染色质的核心成分,AP2-HC可能不只在异染色质区域的DNA修复或染色质重塑过程起调节作用,还在抑制基因表达中起着至关重要的作用。
2013年,人们发现了另一个与端粒生物学相关的ApiAP2家族成员——AP2-TEL(PF3D7_0622900)。AP2-TEL在整个红内期都有表达,并定位于细胞核核周与端粒簇。它具有一个非典型的AP2结构域,即缺乏一种与DNA结合必需的β-Sheet结构。该成员的序列与ApiAP2家族其他成员相比相似性较低(相似性低于27%),全基因Chip-seq分析证实该蛋白质可以和疟原虫所有染色体端粒区域结合。含有溴结构域的蛋白质可能参与维持端粒近端区域染色质稳定,AP2-TEL具有DNA解旋酶和核酸内切酶活性、DNA错配修复活性、锌指域和溴结构域蛋白质。以上研究结果均提示AP2-TEL可能参与调控端粒DNA复制、修复和长度、维持端粒和染色质稳定等过程。
另一个与虫体入侵间接相关的ApiAP2转录因子是PF3D7_0613800,它在滋养体晚期至裂殖体期达到表达高峰。PF3D7_0613800和同ApiAP2家族的PF3D7_0802100还可以将信号传导与转录调控联系起来,协调完成高效转录;在全基因组关联研究中,该基因的变异还与恶性疟原虫对药物奎宁的耐药性有关。迄今为止,疟原虫基因组约有40%尚未阐明,严重阻碍了有效药物和疫苗的开发。PF3D7_0613800在药物反应中的潜在作用为研发高效抗疟药物提供进一步的参考。
2.3 有性生殖阶段
疟原虫在人体内进行了连续几代裂体增殖后,为延续生命周期并确保其传播,少部分裂殖子(<10%)会直接发育成雌雄配子体进入有性生殖发育阶段。恶性疟原虫配子体的发育速度相比其他种类疟原虫迟缓,需要10~12 d,并经过4个中间阶段(I期~IV期)进入成熟的V期配子体。V期配子体是人体内唯一能够随血液流动并感染蚊媒的配子体,对疟疾传播至关重要。因此,抑制配子体发育可以防止疟原虫传播,进而直接有效地切断疟疾传播途径,这是实现根除疟疾的主要目标之一。调控恶性疟原虫配子体发育过程的转录开关是ApiAP2 转录因子AP2-G(PF3D7_1222600)。该转录因子只有1个结构域,在有性生殖阶段和早期配子体中表达;根据其在配子体分化中的作用,该因子被命名为AP2-G,而后得以广泛研究。人们发现它的激活可以直接启动配子体分化过程,这说明AP2-G就是配子体分化的关键调节因子。研究表明,在伯氏疟原虫或恶性疟原虫生活史早期表达AP2-G的靶基因,还可以在相同的细胞周期内启动分化过程。Josling等通过Chip-seq技术阐明了AP2-G的靶基因。它与许多早期配子体基因的启动子区域结合,除此之外还发现它还与入侵基因的启动子区域结合,在裂殖体期达到表达高峰。最新的研究成果不仅证实了AP2-G是配子体基因的激活因子,还预示其可能调节入侵相关基因。除AP2-G外,另一个ApiAP2 转录因子AP2-G2(PF3D7_1408200)可能调控着伯氏疟原虫配子体发育过程。有研究显示,尽管AP2-G2基因敲除的伯氏疟原虫仍然会进行配子生殖,但大多数虫体无法发育成熟,少数形态上发育成熟的配子体也无法再次感染蚊。此外,AP2-G2还会抑制一些伯氏疟原虫肝寄生阶段后期的基因,但其中许多基因还尚未明确。研究表明,AP2-G2敲除后与其结合的基因无一下调,这更加印证它可以抑制基因表达。2020年,人们通过Chip-seq和定量PCR分析发现,AP2-G2可以通过调节PfMDV-1的表达来控制恶性疟原虫配子体的生成和成熟。雄性发育基因1(MDV1),是雄性配子体发育过程中必不可少的调节因子。AP2-G2在恶性疟原虫配子体发育过程中起重要作用,可能是在无性发育阶段通过调控PfMDV-1和其他配子体特异性基因实现的。在最新研究中,人们发现了与雌性配子体发育密切相关的AP2-FG。Chip-seq分析表明,AP2-FG直接调控700多个基因。伯氏疟原虫AP2-FG仅表达在雌性配子体中,在配子体分化过程中通过调控雌性特异性基因表达使早期配子体分化为雌性配子体。在一项利用CRISPR/Cas9技术敲除基因的研究中,人们发现了约氏疟原虫AP2-G3(PY17X_1417400)。AP2-G3在无性生殖阶段和配子体中都有表达,并且定位在细胞核和细胞质。恶性疟原虫同源基因(PF3D7_1317200)也被发现与配子体产生发生有关。一方面,启动AP2-G3触发了AP2-G转录调节的开关;另一方面,敲除AP2-G3后,配子体无法正常形成,且AP2-G的表达也同时减少;这表明AP2-G转录因子之间可能存在级联调控。近来,人们在恶性疟原虫中发现了AP2-G5(PF3D7_1139300),使AP2-G转录因子之间的级联调控第一次得到证实。该因子通过与上游区域和外显子基因结合抑制AP2-G基因的转录活性,从而抑制配子体的产生。ApiAP2转录因子级联调控机制的揭示意义重大,为阻断疟疾传播提供了一个新的靶点。
此外,还有其他几个与恶性疟原虫配子体发生有关的ApiAP2转录因子。例如,在AP2-G表达高峰期,PF3D7_1222400 在AP2-G5之后发生高度表达;在配子体产生阶段,PF3D7_0420300对PF3D7_1342900、AP2-G5、AP2-L这 3个ApiAP2因子均构成了正反馈调节。这种正反馈调节提示这些ApiAP2因子可能会增强AP2-G的转录功能。一些ApiAP2转录因子在配子体中的作用不仅已经得到证实,而且它们的敲除还会影响后期的基因表达,这些转录因子包括PF3D7_1305200、PF3D7_1107800、SIP2(PF3D7_0604100)、AP2-SP2(PF3D7_0404100)和AP2-O(PF3D7_1143100)。目前,有关疟原虫蚊内期ApiAP2转录因子的研究结果很少。有研究表明AP2-O伯氏疟原虫同源基因PBANKA_0905900在蚊内期表达,并可与500多个基因的上游基因组区域特异性结合,大约10%的寄生虫基因组直接受其调控,这些基因可能参与了疟原虫在蚊内期不同的生物学过程,如运动、抵抗蚊免疫系统、卵囊发育等。图2为已知ApiAP2蛋白质在恶性疟原虫生活周期中的阶段表达情况。
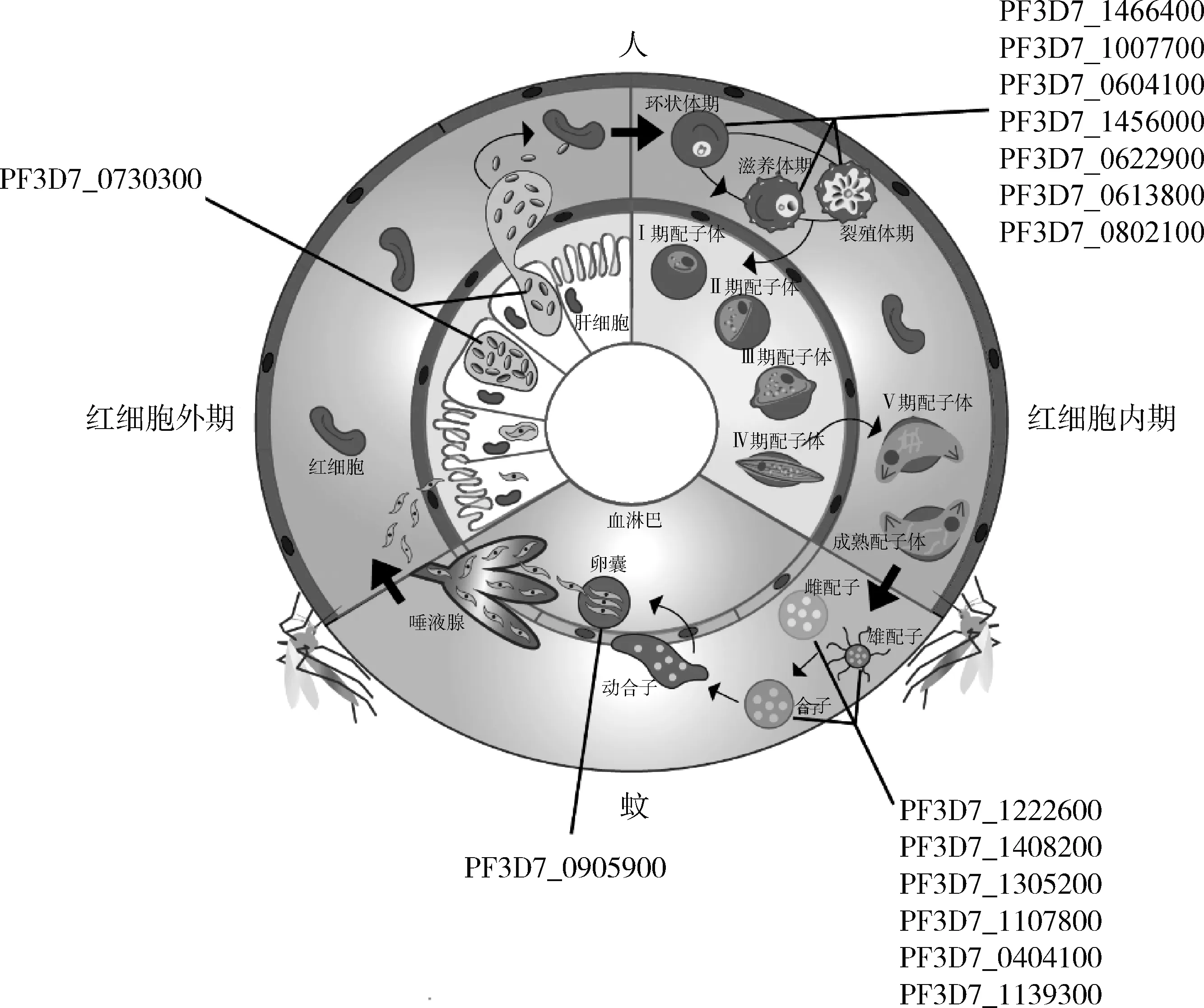
改编自尼尔森等[60]。PF3D7_编号为ApiAP2基因编号
3 ApiAP2蛋白质特异性结合DNA
特异性转录因子调控基因表达,一般通过DNA结合域与特定的DNA基序结合来实现,这种特定DNA基序通常位于靶基因启动子的上游。与植物AP2/ERF蛋白质的结构域不同,在ApiAP2转录因子家族中,每个转录因子含有1~3个AP2结合域,且不是每个转录因子的各个AP2结合域都可以与DNA发生特异性结合。在不断的研究与探索中,人们不仅发现了大多数与AP2结构域优先结合的DNA基序,还发现了AP2蛋白质家族存在家族成员内的分级调控机制,即多个ApiAP2调控级联反应。最新有关伯氏疟原虫的研究还发现,ApiAP2转录因子与DNA结合的位点具有单核苷酸多态性(single nucleotide polymorphism,SNP),并可能作为毒力因子影响宿主对疟原虫的免疫应答。伯氏疟原虫ApiAP2转录因子家族编码的基因中存在2个SNP,分别为PBANKA_0112100和PBANKA_1415700。其中,PBANKA_0112100的SNP会导致表达蛋白质中第1 823位的丝氨酸替换为苯丙氨酸,从而影响ApiAP2的功能。另一项研究还将ApiAP2转录因子与表观基因调控联系起来,研究这些基序是否与某些组蛋白修饰相关。ATAC seq技术通过识别与特异性基因表达相关序列并与ApiAP2转录因子结合的方法,为探索恶性疟原虫生命周期中其他重要的DNA基序提供了可能。
4 恶性疟原虫ApiAP2蛋白质翻译后修饰
近年来,随着蛋白质翻译后修饰逐渐成为国际上的研究热点,人们在探索ApiAP2蛋白质作为转录因子直接调控基因表达的同时,也逐渐被其蛋白质修饰组学吸引视线。已有研究证明,疟原虫在红细胞内发育过程中存在特定的组蛋白修饰,与其基因沉默或激活有关。与其他寄生虫不同,恶性疟原虫的抗原变异受到表观遗传调控。组蛋白去乙酰化抑制剂干扰恶性疟原虫组蛋白H3K9的甲基化状态后, AP2-G(PF3D7_1222600)会发生过度表达,这会直接影响配子体的产生。由此说明,ApiAP2转录因子自身发生蛋白质翻译后修饰,也可以调控转录过程。尽管ApiAP2转录因子家族已被证实与一些特定基因家族的表观遗传调控有关,但其控制寄生虫转录激活的具体机制尚未阐明;有研究表明mRNA也会受到转录后机制的影响。多角度分析ApiAP2转录因子家族将进一步加深人们对疟原虫各个发育阶段的理解,有助于人们更好地掌握和控制其引起的相关疾病。
5 前景与展望
一直以来,疟原虫的研究似乎在畜牧学科中关注度不高;殊不知感染疟原虫对畜牧业的打击有时是毁灭性的,比如目前尚未发现针对鸡疟原虫病和鼠疟原虫病的有效治疗药物。ApiAP2蛋白质家族作为转录因子调控整个顶复门寄生虫的基因转录,任何有关顶复门寄生虫ApiAP2蛋白质的研究对于畜牧业原虫病的预防与攻克都是具有参考价值和意义的。近些年,大量关于ApiAP2蛋白质功能的研究让人们更好地理解了它的作用机制。虽然人们利用先进的体外技术证实了ApiAP2蛋白质家族中许多成员的功能,然而要完全理解ApiAP2转录因子家族在恶性疟原虫生活史中的作用,还需要进行体内特定阶段的DNA结合试验来验证体外试验所得结论,并深入研究它们还可能与哪些蛋白质发生互作。目前,对ApiAP2家族仍然存在很多疑问,比如,还存在哪些ApiAP2蛋白质结构域,这些AP2蛋白质结构域如何参与协调靶基因的抑制或激活;较长ApiAP2蛋白质除AP2结构域的其他结构域还有哪些功能;ApiAP2蛋白质如何通过诱导染色质重塑和招募转录机制发挥其调控功能等;此外,ApiAP2蛋白质发生翻译后修饰的研究领域仍然存在大量空白需要填补。由于缺乏人类同源基因,ApiAP2转录因子无疑成为非常有吸引力的药物靶点,探索与开发ApiAP2转录因子的基本功能为新的疟疾治疗方法提供了新的前景和策略,同时也为弓形虫病、鸡疟原虫病、鼠疟原虫病等原虫寄生虫病疫苗的研发提供参考,进一步推进畜牧业动物寄生虫病的研究。

