Fas对镉暴露致大鼠大脑皮质自噬体形成的影响
闻双全,王 莉,张文华,徐明畅,邹 辉,顾建红,刘学忠,卞建春,刘宗平,袁 燕*
(1.扬州大学兽医学院,扬州 225009;2.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
镉是一种有毒重金属,由于工业活动的增加和日常生活中含镉产品的广泛使用,镉对公共健康构成了严重威胁。长期镉暴露会造成机体多系统和多器官损伤,其中脑是镉毒性作用的重要靶器官之一[1-2]。大量研究表明,镉可通过多种机制诱导神经毒性,包括氧化应激、凋亡和自噬等[3-4]。其中,细胞自噬在镉致神经细胞毒性损伤过程中扮演重要角色。自噬是细胞通过自噬溶酶体途径降解细胞内容物的过程。体内外研究表明,镉可诱导神经细胞自噬发生[4-5]。
Fas是肿瘤坏死因子受体家族的重要一员,通过与其配体结合在镉致神经细胞凋亡过程中起关键作用[6]。但是,Fas在镉致神经细胞自噬中的作用和调控机制尚不清楚。本试验利用RNA干扰技术建立Fas基因沉默大鼠模型,并用镉进行处理,通过透射电镜、Western blot等方法从体内探究Fas在镉暴露致大鼠大脑皮质细胞自噬中的作用及潜在分子机制,为揭示镉的神经毒性机制提供理论依据。
1 材料与方法
1.1 实验动物
21日龄清洁级健康雄性封闭群SD大鼠24只,体重(70±5)g,由江苏大学实验动物中心提供。
1.2 主要试剂
醋酸镉、微管相关蛋白1轻链3(LC3)兔单克隆抗体购自Sigma公司;跨血脑屏障的Fas基因沉默腺相关病毒(FasshRNA,靶序列:5′-GATC-CGGTGCGTGTCAAGCTTTAATCTTCAAGAG-AGATTAAAGCTTGACACGCACCTTTTTTA-3′)和插入非特异性序列的对照病毒(NC shRNA)购自汉恒生物科技有限公司;细胞外信号调节激酶1/2(Erk1/2)、p-Erk1/2、自噬相关蛋白7(ATG7)、自噬相关基因(Beclin-1)、β-actin兔单克隆抗体和辣根过氧化物酶标记山羊抗兔二抗购自CST公司;其他试剂均为国产分析纯。
1.3 主要仪器
脱水机购自DIAPATH公司;包埋机购自武汉俊杰电子有限公司;病理切片机、激光共聚焦显微镜购自Leica公司;透射电镜购自Philips公司;5810R型低温高速冷冻离心机购自Eppendorf公司;高速组织研磨器购自天根生化科技有限公司;电泳仪、转膜仪购自BIORAD公司。
1.4 动物分组与处理
将24只21日龄的健康雄性SD大鼠于清洁、干燥、室温(23±2)℃的环境下预饲1周后随机分为4组,每组6只,分别为对照组(Control组)、镉组(Cd组)、镉与对照病毒共处理组(Cd+NC shRNA组)、镉与Fas基因沉默病毒共处理组(Cd+Fas shRNA组)。试验期间,对照组大鼠自由饮用纯净水,病毒处理组大鼠于第1天以每只1.4×1011vg的剂量通过尾静脉注射相应病毒,4周后镉染毒组大鼠自由饮用镉水(50 mg·L-1),持续90 d。试验结束后,用2%戊巴比妥钠按3 mL·kg-1剂量肌肉注射麻醉大鼠,剥离脑组织,一部分固定于4%多聚甲醛或2.5%戊二醛中,一部分分离大脑皮质于冻存管内,于-80 ℃保存待用。
1.5 透射电镜观察自噬体
取1 mm3大脑皮质组织块于2.5%戊二醛中4 ℃固定过夜,用磷酸盐缓冲液(PBS)漂洗3次,每次15 min;1%锇酸避光室温固定2 h,PBS漂洗3次,每次15 min;经30%、50%、70%、80%、90%、95%、100%的乙醇进行梯度脱水,再用100%丙酮于室温下浸透12 min;用树脂包埋组织块,于60 ℃烘箱内放置48 h;切片,用醋酸双氧铀和柠檬酸铅染色,透射电镜观察大脑皮质自噬体数量。
1.6 Western blot检测相关蛋白的表达
取各组大鼠大脑皮质50 mg于预冷的PBS中剪碎,在4 ℃条件下2 000 r·min-1离心5 min,弃上清,加入含有蛋白酶抑制剂的裂解液,匀浆后置于冰上裂解30 min,每隔5 min震荡1次,细胞超声破碎仪超声20 s,在4 ℃条件下12 000 r·min-1离心10 min,收集上清,即为组织总蛋白。采用BCA法测定总蛋白浓度并将各组浓度调成一致,按照1∶4加入5 × SDS Loading Buffer,混匀后沸水煮10 min,蛋白保存于-80 ℃。
取等量样品进行SDS-PAGE电泳,转印至PVDF膜上,5%脱脂乳室温封闭2 h,4 ℃孵育相应一抗(Erk1/2、p-Erk1/2、ATG7、Beclin-1、LC3、β-actin 抗体按1∶1 000稀释)过夜,室温孵育二抗(1∶3 000)1 h,ECL显影检测蛋白表达情况。使用Image J软件分析条带灰度值,目的蛋白与β-actin灰度值的比值即为目的蛋白的相对表达水平。
1.7 免疫荧光染色检测LC3表达
大脑皮质石蜡切片脱蜡至水后进行抗原修复,PBS洗涤3次;将切片放入3%牛血清白蛋白中,室温封闭30 min,弃去封闭液;4 ℃孵育LC3抗体(1∶100)过夜,PBS洗涤3次;避光室温孵育Cy3标记山羊抗兔荧光二抗(1∶200)1 h,PBS洗涤3次;滴加DAPI染液,避光室温孵育10 min,PBS洗涤3次;滴加抗荧光淬灭剂,封片,激光共聚焦显微镜观察并拍照。
1.8 数据分析
数据采用SPSS 26.0统计软件进行单因素方差分析(one-way ANOVA),再经LSD法进行多重比较,统计结果以“平均值±标准差”表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 Fas基因沉默对镉致大鼠大脑皮质自噬体形成的影响
透射电镜观察大鼠大脑皮质中自噬体数量,结果如图1所示,与对照组相比,Cd组和Cd+NC shRNA 组大脑皮质中自噬体明显增多;与Cd组相比,Cd+Fas shRNA组自噬体减少。
2.2 Fas基因沉默对镉致大鼠大脑皮质Erk1/2磷酸化的影响
Western blot检测大鼠大脑皮质中Erk1/2和p-Erk1/2蛋白表达水平,结果如图2所示,与对照组相比,Cd组和Cd+NC shRNA组大脑皮质Erk1/2磷酸化水平极显著升高(P<0.01);与Cd组相比,Cd+Fas shRNA组Erk1/2磷酸化水平极显著降低(P<0.01)。
2.3 Fas基因沉默对镉致大鼠大脑皮质Beclin-1和ATG7蛋白表达变化的影响
Western blot检测大鼠大脑皮质中Beclin-1和ATG7蛋白表达水平,结果如图3所示,与对照组相比,Cd组和Cd+NC shRNA组大脑皮质Beclin-1和ATG7表达水平极显著升高(P<0.01);与Cd组相比,Cd+Fas shRNA组Beclin-1和ATG7表达水平极显著降低(P<0.01)。

图3 Fas基因沉默对镉致大鼠大脑皮质ATG7和Beclin-1蛋白表达变化的影响
2.4 Fas基因沉默对镉致大鼠大脑皮质LC3蛋白表达变化的影响
免疫荧光染色法检测大鼠大脑皮质中LC3蛋白表达水平,结果如图4所示,与对照组相比,Cd组和Cd+NC shRNA组大脑皮质LC3表达水平增加;与Cd组相比,Cd+Fas shRNA组LC3表达减少。Western blot检测大鼠大脑皮质中LC3蛋白表达水平,结果如图5所示,与对照组相比,Cd组和Cd+NC shRNA组大脑皮质LC3-Ⅱ/LC3-Ⅰ比值极显著升高(P<0.01);与Cd组相比,Cd+Fas shRNA组LC3-Ⅱ/LC3-Ⅰ比值极显著降低(P<0.01)。
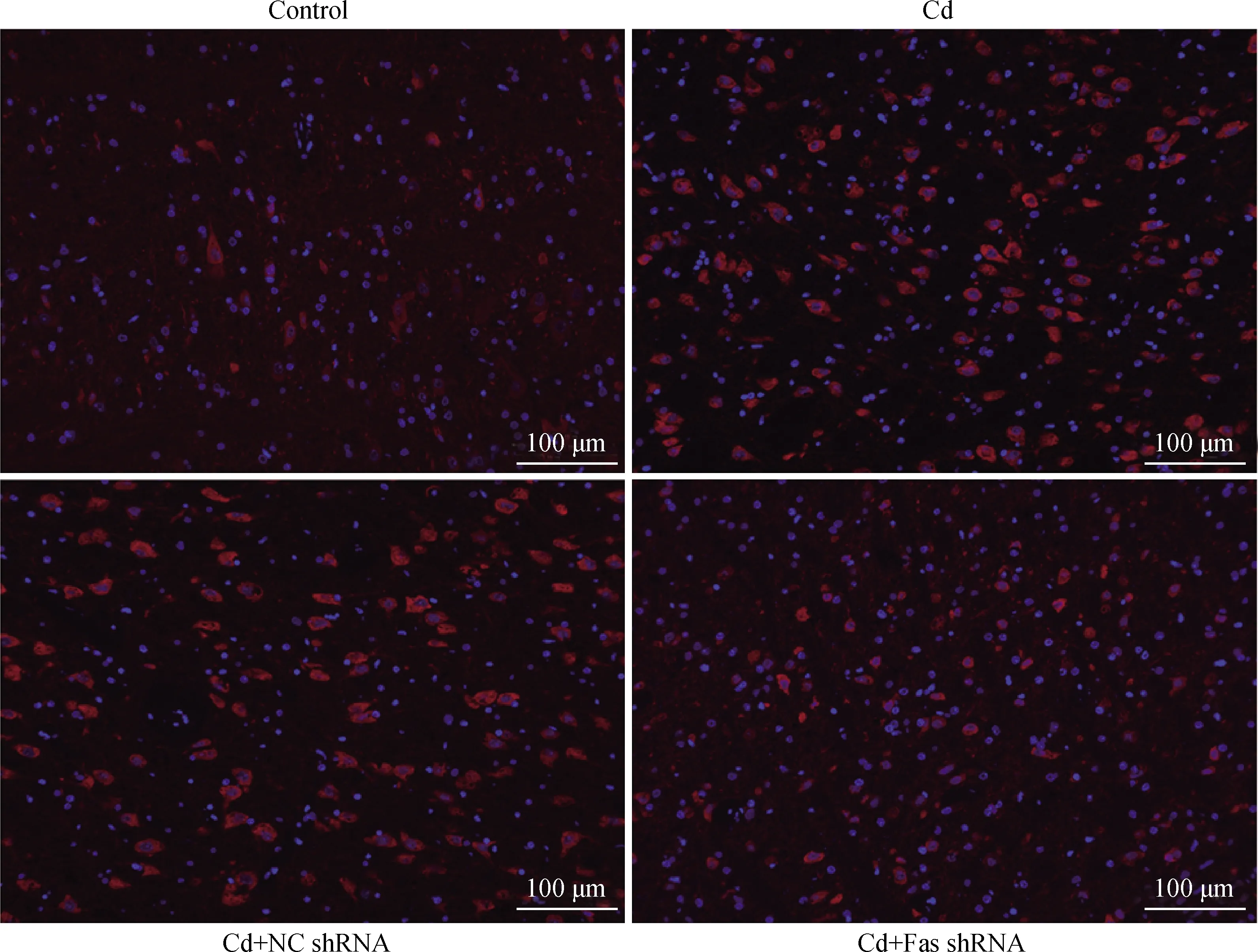
图4 大鼠大脑皮质中LC3表达量变化

图5 Fas基因沉默对镉致大鼠大脑皮质LC3-Ⅱ/LC3-Ⅰ比值变化的影响
3 讨 论
死亡受体是一类细胞表面受体,属于肿瘤坏死因子受体超家族,在细胞凋亡过程中发挥关键作用。Fas是肿瘤坏死因子受体超家族的重要一员,通过与其配体相互作用调控多种细胞凋亡过程[7-8]。本实验室前期体内外研究发现,镉可通过激活死亡受体Fas诱导大鼠大脑皮质神经细胞凋亡[6,9]。随着研究的不断深入,科研人员发现,除细胞凋亡外,Fas还参与了细胞自噬过程。Wang等[10]研究发现,Fas通过上调自噬相关蛋白ATG5-ATG12蛋白复合物、ATG7、ATG10、Beclin-1和LC3的表达水平诱导人肝癌细胞自噬发生。De Giorgio等[11]研究发现,抗神经元抗体通过Fas依赖途径激活人神经母细胞瘤细胞自噬。本研究结果显示,镉引起大鼠大脑皮质自噬体数量增多,Fas基因沉默抑制镉引起的自噬体增加。说明Fas参与镉致大鼠大脑皮质细胞自噬。
自噬是细胞内溶酶体降解受损的细胞器、蛋白聚集物及入侵的微生物的过程,主要包括自噬体的形成和成熟、自噬体对底物的识别、自噬体与溶酶体融合形成自噬溶酶体等过程[12]。细胞自噬的发生与多种自噬基因密切相关,包括Beclin-1、ATG7和LC3等。Beclin-1是首个被确认的参与自噬过程的哺乳动物基因,当细胞受到应激时,Beclin-1及其复合物启动自噬体形成[13]。LC3是自噬体标志蛋白,在自噬体形成过程中,LC3被半胱氨酸蛋白酶ATG4剪切形成LC3-Ⅰ,LC3-Ⅰ在ATG7和ATG3的催化下与磷脂酰乙醇胺发生作用形成膜结合形式的LC3-Ⅱ,并定位于自噬体膜上[14-15]。因此,Beclin-1、ATG7和LC3-Ⅱ的表达水平与自噬呈正相关。自噬体的形成受多条信号通路调控,其中丝裂原活化蛋白激酶家族成员Erk1/2是其上游的重要信号分子[16-18]。付程凯等[19]研究发现,Erk1/2通过上调Beclin-1和LC3-Ⅱ表达水平促进蛛网膜下腔出血大鼠海马区神经细胞自噬。本实验室前期研究发现,利用Erk1/2抑制剂可显著抑制镉引起的大鼠大脑皮质神经细胞LC3-Ⅱ的表达水平升高[20]。另外,大量研究表明,Erk1/2的激活受死亡受体Fas调控[21-22]。本研究结果显示,镉暴露导致大鼠大脑皮质Erk1/2磷酸化水平、Beclin-1和ATG7表达水平及LC3-Ⅱ/LC3-Ⅰ比值极显著升高,Fas基因沉默极显著抑制镉激活的Erk1/2及镉引起的Beclin-1、ATG7表达水平和LC3-Ⅱ/LC3-Ⅰ比值升高。说明Fas通过激活Erk1/2参与镉致大鼠大脑皮质自噬体形成。
4 结 论
镉通过激活Erk1/2诱导大鼠大脑皮质自噬体形成,Fas基因沉默能够抑制镉激活的Erk1/2及镉诱导的自噬体形成,说明镉激活的Fas通过调控Erk1/2参与大鼠大脑皮质自噬体形成;这为揭示镉的神经毒性机制提供了新的理论基础。

