MiR-3200-3p调控Wnt/β-catenin通路影响肝癌细胞的迁移和侵袭
冯 豆,张 洪,范月莹,宋 玲,谭佳杰
(武汉大学a.人民医院药学部; b.研究生院2019级,武汉 430060)
肝细胞癌(hepatocellular carcinoma,HCC)是21世纪最为常见的高发病率、高死亡率的恶性肿瘤之一,严重威胁着人们的生命[1]。目前临床上HCC的治疗策略以手术切除、射频消融、介入、靶向和免疫治疗的多学科综合治疗为主[2],虽然一定程度可以延长患者的生存时间,但由于HCC病程复杂,其发生发展涉及多个基因及多条信号通路的改变,迁移和侵袭性强,导致大多数患者的预后效果仍然不佳。因此发现新的HCC治疗靶点,制定更有效的治疗策略,仍是目前亟待解决的问题。
微小RNA(microRNAs,miRNAs)是一类内源性的小非编码RNA,长度约21~23个核苷酸。目前miRNAs已被证实是参与基因表达调控的一类重要分子,miRNAs调控失常后可以直接或间接地调节原癌基因或抑癌基因的表达水平,从而影响肿瘤细胞的增殖、分化、迁移、侵袭、血管生成等行为,参与肝癌等多种恶性肿瘤的进程[3]。miR-3200-3p是发现较晚的一种miRNA,目前有关miR-3200-3p的研究较少,但已有研究[4-5]表明miR-3200-3p在胃癌、乳腺癌等肿瘤中能发挥抑癌因子作用。然而,miR-3200-3p在HCC中的作用尚未见公开报道,本研究通过体外实验探索miR-3200-3p对HCC细胞迁移和侵袭等生物学行为的影响,并对其可能的分子机制展开探索,希望为HCC的临床治疗提供新的分子靶点。
1 材料与方法
1.1 材料
人肝癌细胞系Bel-7402(北京北纳创联生物科技有限公司);人正常肝细胞HL-7702(武汉大学人民医院消化内科惠赠);293T细胞和大肠杆菌菌株DH5α(上海吉凯基因科技有限公司);DMEM高糖培养基、RPMI-1640培养基和青-链霉素溶液(美国Gibco公司);胎牛血清(FBS)(浙江天杭生物科技股份有限公司);限制性内切酶(美国New England Biolabs公司);Taq Plus DNA聚合酶(南京诺唯赞生物科技股份有限公司);T4 DNA连接酶(美国Thermo Scientific公司);无内毒素质粒中量试剂盒(北京天根生化科技有限公司);PrimeScriptTMRT Reagent Kit(日本TaKaRa公司);SYBR Premix Ex TaqTM(日本TaKaRa公司);Transwell小室(美国Corning公司);Matrigel基质胶(美国BD公司);4%多聚甲醛溶液(武汉赛维尔生物科技有限公司);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);核蛋白提取试剂盒(北京索莱宝科技有限公司);GADPH抗体、β-catenin抗体、基质金属蛋白酶-2(MMP2)抗体、E-cadherin抗体及二抗anti-rabbit IgG(H+L)均购自美国Cell Signaling Technology公司。
1.2 方法
1.2.1 RT-qPCR检测miR-3200-3p的表达
用胰酶消化生长状态较好的HL-7702和Bel-7402细胞,分别接种于6孔板,使其48 h后细胞密度达80%以上。采用Trizol试剂提取细胞的总RNA,测定RNA浓度及纯度。采用RT-qPCR进行扩增,反应程序为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 40 s,39个循环。以U6为内参,用2-ΔΔCT法计算各组细胞中miR-3200-3p的相对表达水平。引物序列如下:U6-上游:5′-CTCGCTTCGGCAGCACA-3′;U6-下游:5′-AACGCTTCACGAATTTGCGT-3′;miR-3200-3p-上游:5′-ACACTCCAGCTGGGCACCTTGCGCTACTCA-3′;miR-3200-3p-下游:5′-TGGTGTCGTGGAGTCG-3′。
1.2.2 miR-3200-3p低表达质粒的构建
从miRBase数据库(http://www.mirbase.org/index.shtml)获得miR-3200-3p的成熟体序列,应用Primer 5.0软件根据其反义序列设计并合成单链引物(引物上游:5′-AATTCAAAAACACCTTGCGCTACTCAGGTCTG-3′;引物下游:5′-CcggCAGACCTGAGTAGCGCAAGGTG TTTTTg-3′),将引物置于90 ℃水浴15 min,然后使其冷却至室温进行退火,从而形成双链DNA。利用T4 DNA ligase将Age I、EcoR I双酶切线性化的hU6-MCS-Ubiquitin-EGFP-IRES-puromycin载体和退火双链DNA于16 ℃连接1~3 h,随后进行转化,挑取阳性克隆并将其接种于LB液体培养基中,于37 ℃培养12~16 h,取一定量的菌液进行测序,并将结果与已知目的基因的序列对比分析。
1.2.3 慢病毒载体的包装及纯化
采用天根无内毒素质粒小提中量试剂盒抽提目的基因载体质粒、病毒包装辅助质粒pHelper 1.0和pHelper 2.0。待293T细胞的汇合度达到70%~80%时,将培养基更换为不含血清的培养基,在一无菌1.5 mL离心管中分别加入20 μg GV280、15 μg pHelper 1.0、10 μg pHelper 2.0载体质粒及相应体积的转染试剂,混匀后于室温静置15 min。随后将上述混合液缓慢滴加至细胞培养液中,培养6 h后弃掉转染液,更换为含10%FBS的完全培养基继续培养48 h。然后收集细胞上清液,4 ℃、4000 r·min-1离心10 min;随后用0.45 μm滤器对上清液进行过滤,过滤后的液体于4 ℃、25 000 r·min-1离心2 h。离心结束后,弃上清,加入病毒保存液,轻轻吹打使其重悬;10 000 r·min-1离心5 min,取上清进行分装并保存于-80 ℃,即完成病毒载体的浓缩及纯化。
1.2.4 miR-3200-3p稳定低表达肝癌细胞株的构建
根据转染病毒质粒的不同将Bel-7402细胞分为2组:LV-control组及LV-inhibitor。待所有细胞汇合度达到40%~50%时进行转染。根据病毒滴度计算出所需加入的病毒量,按照MOI=20配制感染液,于37 ℃感染12~16 h后,更换为完全培养基继续培养。感染72 h后在倒置荧光显微镜下观察,判断其感染效率,确认慢病毒是否成功转入细胞。然后将转染成功的细胞继续培养于含2 μg·mL-1嘌呤霉素的培养基中,每2 d更换培养液,直至未转染成功的Bel-7402细胞全部被杀死。采用RT-qPCR法检测2组肝癌细胞中miR-3200-3p的相对表达水平,验证其敲低效果。
1.2.5 Transwell检测细胞迁移及侵袭能力
采用Transwell实验检测2组细胞迁移和侵袭能力的变化。迁移实验用不含血清的培养基,以 1×105细胞·孔-1密度将细胞接种于Transwell上室,下室则加500 μL提前配好的含20%FBS的1640培养基,于37 ℃细胞培养箱中培养24 h后弃去上室及下室中的培养基,用PBS清洗2次,置于1 mL 的4%多聚甲醛溶液中固定30 min,用PBS轻轻润洗;然后置于1 mL的0.1%结晶紫溶液中染色15 min,用PBS润洗多次直到紫色褪去,用棉签轻轻擦去小室内膜上的细胞,留下迁移到膜背面的细胞、晾干,于倒置显微镜观察并拍照。侵袭实验则将BD Matrigel基质胶用无血清培养基以1:8的比例稀释,50 μL·孔-1均匀添加到上室于37 ℃条件下孵育4~5 h待其凝固。然后以2×105细胞·孔-1密度将细胞接种于Transwell上室,其他条件同迁移实验。
1.2.6 Western blot法检测Wnt通路相关蛋白表达
分别将2组细胞以2×105细胞·孔-1接种于6孔板,待细胞汇合度达85%以上时收集细胞。于冰上加入RIPA裂解液裂解30 min,然后4 ℃、13 000 r·min-1离心15 min,转移上清,即得到细胞总蛋白;用核蛋白提取试剂盒分别抽提出核蛋白和浆蛋白。配置12%的SDS-PAGE分离胶和4%的SDS-PAGE浓缩胶,每孔加20 μg蛋白,80 V恒压电泳1 h,随后120 V恒压电泳1 h至溴酚蓝跑出胶底;恒流200 mA电转2 h,将目的蛋白转至PVDF膜上;5%BSA封闭2 h,然后于4 ℃分别过夜孵育GADPH抗体(1:1000)、β-catenin抗体(1:1000)、MMP2抗体(1:1000)和E-cadherin抗体(1:1000);接着孵育二抗2 h(1:10 000);最后用凝胶成像系统对条带进行扫描并分析其灰度值。
1.2.7 统计学方法

2 结果
2.1 各细胞系中miR-3200-3p的表达水平
RT-qPCR结果显示,与正常肝细胞HL-7702比较,肝癌细胞Bel-7402中miR-3200-3p的相对表达量更高(P<0.001)。见图1。
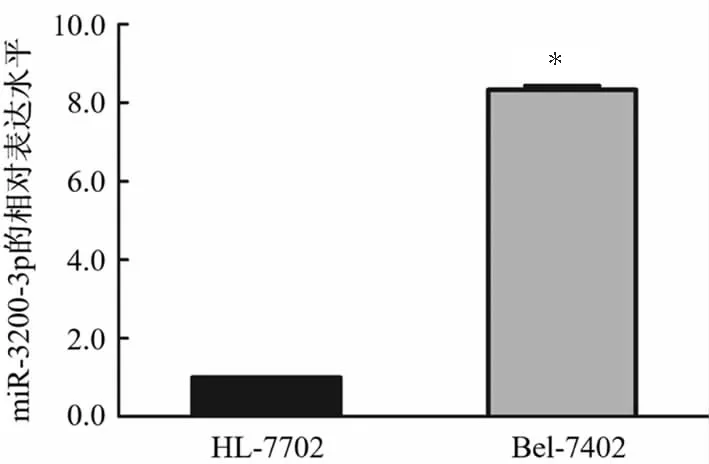
*P<0.001与HL-7702细胞比较。图1 各细胞系中miR-3200-3p的相对表达量比较
2.2 miR-3200-3p稳转肝癌细胞系的鉴定
2.2.1 基因测序
重组载体质粒miR-3200-3p-inhibitor基因测序结果显示,构建的重组载体质粒与目的基因的反义序列相符,且均为单峰,提示重组载体质粒构建成功。见图2。

图2 重组质粒载体基因测序图谱
2.2.2 慢病毒重组载体质粒的转染效率
荧光显微镜观察显示2组的感染效率均为95%以上(图3A)。RT-qPCR结果显示,与LV-control 组比较,LV-inhibitor组细胞中miR-3200-3p的表达显著降低,抑制效率达到80%以上(P<0.001),见图3B。
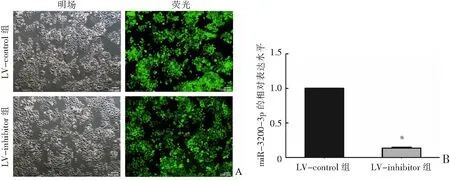
A:倒置荧光显微镜观察转染效率;B:RT-qPCR检测miR-3200-3p的表达水平。*P<0.001与LV-control组比较。
2.3 各组肝癌细胞迁移及侵袭能力比较
Transwell结果显示,敲低miR-3200-3p的表达后,Bel-7402细胞的迁移和侵袭能力均显著降低(P<0.001)。见图4。
2.4 各组肝癌细胞蛋白表达的比较
Western blot结果显示,与对照组比较,敲低miR-3200-3p的表达后总β-catenin蛋白的相对表达量明显降低(P<0.05),胞浆和胞核中的β-catenin蛋白表达亦均显著降低(P<0.001)。此外,抑制miR-3200-3p的表达后,迁移及侵袭相关蛋白MMP2的表达显著降低(P<0.001),而E-cadherin的表达显著上升(P<0.001)。见图5。
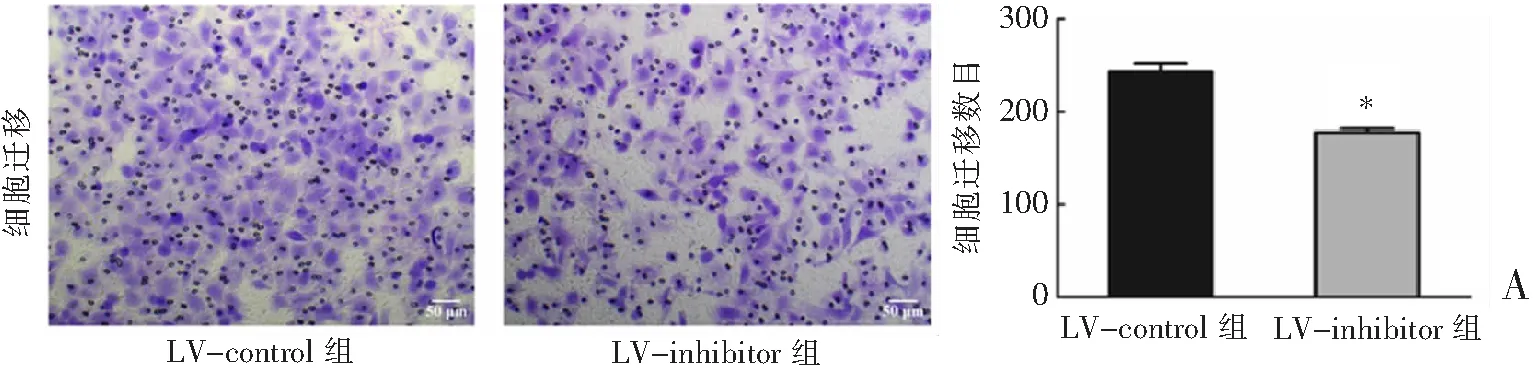
A:细胞迁移能力比较。*P<0.001与LV-control组比较。图4 2组肝癌细胞迁移及侵袭能力的比较
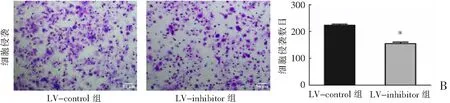
B:细胞侵袭能力比较。*P<0.001与LV-control组比较。图4(续)

A:Western blot图;B:蛋白相对表达水平比较。*P<0.05,***P<0.001与LV-control组比较。
3 讨论
近年研究[6-9]表明miRNAs的异常表达参与了细胞分化、炎症、生长和癌变等多种生命过程的调节,其中在癌症发生发展过程的研究最为广泛和深入,是潜在的肿瘤预后标志物及治疗靶点。miR-3200是由位于22号染色体上的miR-3200基因编码的一类miRNA,含有miR-3200-3p和miR-3200-5p两个成熟体。目前国内外的研究多集中在miR-3200-5p上,对miR-3200-3p的研究较少。最近有研究[4-5]显示miR-3200-3p与恶性肿瘤的进展密切相关,如国内学者WANG等[4]研究发现在胃癌细胞NCI-N87中,敲低LncRNA PEG10的表达可以通过上调miR-3200-3p的表达抑制癌细胞的生长、迁移和侵袭,并促进癌细胞的凋亡,提示miR-3200-3p在胃癌细胞中可能发挥抑癌作用。在对晚期乳腺癌患者的研究中,AL KHANBASHI等[5]发现在新辅助化疗期间患者血清的miR-3200-3p水平下降,且血清miR-3200-3p水平与乳腺癌残留和复发率呈负相关,提示miR-3200-3p可能是乳腺癌的抑制标志物,但其作用机制需要进一步探索。本研究对miR-3200-3p在HCC中的作用进行研究,检测了人肝癌细胞系Bel-7402和正常肝细胞系HL-7702中miR-3200-3p的表达水平,结果显示肝癌细胞中miR-3200-3p的表达显著升高;同时体外敲减miR-3200-3p后可抑制HCC细胞的迁移和侵袭,提示其在HCC中发挥促癌作用。
肿瘤细胞的高迁移、高侵袭能力是引起患者预后效果差、死亡率高的重要原因,但其具体的机制十分复杂。经典的Wnt/β-catenin信号通路是与肿瘤迁移和侵袭密切相关的通路之一,β-catenin是该通路最为关键的蛋白。在缺乏Wnt配体时,β-catenin被由APC、GSK3β、CK1α(casein kinase 1α,CK1α)、Axin、PP2A等组成的降解复合物磷酸化,导致其发生泛素化随后被蛋白酶体降解,使胞内的β-catenin保持在较低的水平。当Wnt通路发生活化后,β-catenin降解复合物的活性被抑制,使得细胞质中的β-catenin不断积累,从而促进部分β-catenin进入细胞核发生活化并与T细胞因子/淋巴增强因子转录因子家族结合,启动下游多种靶基因的转录,促进多种恶性肿瘤的发生发展。因此,β-catenin的表达及亚细胞定位是检测Wnt通路是否激活的重要标志[10-11]。上皮-间充质转化(epithelial-mesenchymal transition,EMT)是一种较为保守的发育程序,是指细胞在多种蛋白的调控下失去上皮特性转化为间充质表型的过程,其机制十分复杂,肿瘤细胞可以通过EMT增强细胞的迁移性、侵袭性、对凋亡的抵抗性等,因此EMT被认为是影响癌细胞侵袭和迁移的关键途径[12-13]。有研究[14-16]表明,在非小细胞肺癌、结直肠癌、胶质瘤等多种肿瘤类型中Wnt/β-catenin信号通路均参与了EMT的调节。E-钙黏蛋白(E-cadherin)是一种Ca2+依赖性跨膜糖蛋白。有研究[17-18]发现,在大多数恶性肿瘤中E-cadherin表达降低可促进肿瘤细胞发生EMT,增强其迁移和侵袭能力。MMP2是基质金属蛋白酶家族的一员,其高表达可以降解细胞外基质而促进肿瘤的迁移和侵袭,表明E-cadherin和MMP2是检测肿瘤细胞迁移和侵袭能力的重要指标[19-20]。本研究发现,敲减miR-3200-3p总β-catenin、胞核β-catenin、胞浆β-catenin和MMP2蛋白表达均显著降低,而E-cadherin蛋白表达显著升高,提示这种抑制作用很可能是通过抑制Wnt/β-catenin通路的活性实现的,但具体的机制仍有待进一步验证。
综上,本实验显示miR-3200-3p在HCC中可能发挥促癌基因作用,敲低其表达能显著抑制肝癌细胞的迁移和侵袭,且这种抑制作用可能是通过影响Wnt/β-catenin通路的活性,进而下调MMP2表达,上调E-cadherin而实现的。
——一道江苏高考题的奥秘解读和拓展

