多酶分步水解法制备菜籽多肽工艺的研究
周 桐,高 盼,2,3✉,王 澍,周 力,胡传荣,何东平,3
(1. 武汉轻工大学 食品科学与工程学院,湖北 武汉 430023;2. 大宗粮油精深加工教育部重点实验室,湖北 武汉 430023;3. 国家市场监管重点实验室(食用油质量与安全),湖北 武汉 430012;4. 武汉食品化妆品检验所,湖北 武汉 430012)
2020年,我国菜籽产量高达1 400万t,为世界菜籽产量第一。菜籽粕中含有35%~42%的蛋白质,且氨基酸平衡,极少检出限制氨基酸,营养价值不亚于酪蛋白和动物蛋白,开发潜力较大[1]。将菜籽蛋白降解成肽类,能使菜籽蛋白的利用率提高,不会产生毒害物质,增加其经济价值。菜籽多肽比菜籽蛋白质结构简单,分子量小,是一类由氨基酸通过肽链相连的化合物,可为机体提供营养,调节生理技能。同时部分低肽不仅能够为人体提供生长发育所需的营养物质,还具备防病治病等特殊功效和一些食品蛋白质或其组成氨基酸所缺乏的独特生物活性,如调节抗氧化、免疫和降低血压等[2-3]。
目前制备菜籽多肽的方法主要有酶法、化学法和固态发酵法,酶法水解有反应效率高、条件温和、反应过程可控且能够保留多肽的营养价值等优势[4]。按照水解方式的不同可分为内切蛋白酶和外切蛋白酶,内切蛋白酶作用于蛋白质分子内部肽键,将蛋白质水解成分子量较小的多肽类。外切蛋白酶作用于蛋白质或多肽分子氨基或梭基末端的肽键,使肽键断裂生成游离氨基酸,外切蛋白酶能够将处于肽链末端的疏水性氨基酸水解出来,从而降低多肽的苦味[5]。酶的选择必须依据氨基酸的组成和酶的专一性结合生成物的结构来选择[6]。目前常见的酶有菠萝蛋白酶、胰蛋白酶、胃蛋白酶、木瓜蛋白酶等,酶法水解的研究热点集中在如何提高菜籽蛋白的酶解效率,郭涛[7]等利用中性蛋白酶水解菜籽蛋白制备菜籽多肽,通过正交实验得到最佳酶解条件,将蛋白质酶解后有75%左右的蛋白质转化为可溶性肽,得到的菜籽多肽點度低,流动性好,热稳定性优良。采用分步酶解能有效地提高蛋白水解度,刘海梅[8]等采用木瓜蛋白酶与碱性蛋白酶对脱脂菜籽饼柏中的蛋白质分两步进行水解研究,在两种蛋白酶的最适反应条件下,水解度可达30.95%。薛照辉[9]等对菜籽清蛋白进行了分步水解,将菜籽蛋白由单酶的水解度 14.72%提高至双酶水解度28.10%。虽然现有的分步酶解法提高了水解度,但总体水解效果仍然较差。同时,酶水解后会暴露出疏水的氨基酸残基,当疏水残基达到一定含量时菜籽多肽有明显苦味,限制了其在食品方面的应用[10-11]。
因此,本研究通过分步水解,优化菜籽肽加工工艺,提高菜籽蛋白水解度,同时优化水解条件,使菜籽肽脱苦,提高菜籽蛋白的开发利用率。
1 材料与方法
1.1 材料与试剂
菜籽蛋白:实验室自制;中性蛋白酶、碱性蛋白酶、复合风味蛋白酶(酶活力分别为 19.8×104U/g、20.1×104U/g、1.5×104U/g):Novo Nordisk公司(北京分公司);木瓜蛋白酶(酶活力为10.6×104U/g):西安隆茂生物科技有限公司;8-苯胺基-1-萘磺酸铵(ANS):吴江东风化工有限公司(98%以上);正己烷、氢氧化钠、盐酸等分析纯试剂:国药集团化学试剂有限公司。
1.2 仪器与设备
PHS-2C型精密酸度计:上海右一仪器有限公司;ZFA-1型旋转蒸发仪、恒温磁力搅拌器、微量凯式定氮仪、pH-Stat装置:上海亚荣生化仪器厂;LXJ-Ⅱ型离心沉淀机:上海医用分析仪器厂;SHB-Ⅲ型循环水式多用真空泵:郑州长城科工贸公司;电热恒温水浴锅:巩义市英峪予华仪器厂;超级恒温水浴糟:常州迈科诺仪器有限公司;低速离心机 LD5-10:北京医用离心机厂;FD-8型冷冻干燥机:北京博医康实验仪器有限公司。
1.3 实验方法
1.3.1 常规成分含量的测定
水份含量的测定:105 ℃恒重法(《GB 5009.3—2016食品安全国家标准 食品中水分的测定》);灰份含量的测定:550 ℃灼烧法(GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》);蛋白质含量的测定:半微量凯氏定氮法(GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》);脂肪含量的测定:索氏抽提法(GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》)。
1.3.2 蛋白酶的选择
选取中性蛋白酶、碱性蛋白酶、木瓜蛋白酶和风味蛋白酶四种蛋白酶对菜籽蛋白进行水解,参照四种酶的最适宜条件进行实验,选取其中水解度最高的酶进行第一步水解。
1.3.3 菜籽蛋白多肽液的制备
取15 g菜籽蛋白粉,以料液比1∶8添加蒸馏水在80~90 ℃进行湿热处理,在添加食品添加剂三聚磷酸钠进行酸化处理,经过湿热处理和酸化处理的蛋白液,可有效地促进菜籽蛋白的水解;将经过预处理后的菜籽蛋白,采用多酶蛋白酶在超声波辅助条件下进行恒温酶解,酶解过程中均匀不断地滴加碱液保持溶液 pH不变,反应结束后再次调节 pH值与反应温度,然后加入复合风味蛋白酶进行第二次酶解。酶解完成后,取出样品进行微波灭酶处理。微波功率为600 W,灭酶温度为80 ℃,灭酶时间约2 min,得到灭酶后的酶解液;将微波灭酶后的浆液使用离心机离心,转速为5 000 r/min,离心时间20 min,取上清液,并计算水解度(DH),将上清液进行冷冻干燥处理,既得成品菜籽肽。
1.3.4 水解度(HD)的测定
采用pH-stat法[12],在水解过程中不断补充碱液,每30 min记录加0.5 mol/L NaOH量,水解完毕,对其进行灭酶处理,根据所添加的NaOH量,计算水解度。水解度计算公式如下:
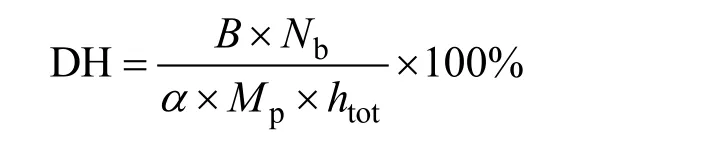
式中:B表示 NaOH消耗量,单位为 mL;Nb表示NaOH浓度,单位为mol/L;Mp表示被水解的蛋白质量,单位为g;htot表示单位质量原料蛋白中肽键的总数,单位为mmol/g。实验采用菜籽蛋白为原料,取htot=7.21。
α—α-NH2在蛋白底物中的平均解离度,可用下式计算而得:
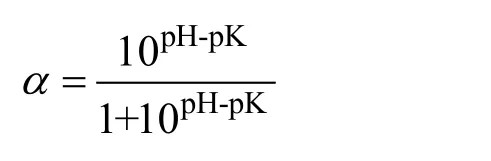
其中,pH表示酶解过程中反应液的pH值;pK表示NH3+的解离常数。
1.3.5 对菜籽蛋白进行湿热处理湿热温度的确定
通过比较四种不同蛋白酶的水解效果,先对菜籽进行不同温度(50、60、70、80、90 ℃)的湿热处理,再用四种蛋白酶中效果最好的一种对经湿热处理后的菜籽蛋白进行水解,通过比较水解度来确定湿热处理较好的温度,以空白为对照。
1.3.6 酶解菜籽蛋酶解条件的单因素实验
取菜籽蛋白,加蒸馏水配置成底物浓度为3%的菜籽蛋白溶液,对菜籽蛋白进行水解,采用pH-stat法测菜籽蛋白的水解率,分别研究水解时间(10、20、30、45、60、75、90、120 min)、水解 pH(8、9、10、11)、水解温度(45、50、55、60、65 ℃)、碱性蛋白酶用量(2 000、4 000、6 000、8 000、10 000 U/g)这四个因素对菜籽蛋白水解度的影响。
1.3.7 酶解菜籽蛋白工艺条件的优化
通过响应面实验探索影响酶解菜籽蛋白的主要因素,以上述四个因素设置单因素实验,根据单因素实验的结果,应用 Design-Expert 8.0.6分析软件,按Box-Behnken实验设计方案,以菜籽蛋白水解度为响应值,选择合适的因素和水平,通过响应面分析得出自变量与响应函数之间的统计模型,确定酶解菜籽蛋白的最优工艺。
1.3.8 疏水性的测定
参考文献[13]方法进行测定。以ANS为探针,此试剂在水中与非极性环境中不产生荧光。ANS与蛋白质中的膜或相对疏水的区域键合时,就会产生荧光,利用这个特性就可以检测蛋白质的表面疏水性。
配制1 mg/mL的蛋白溶液,溶于0.01 mol/L的磷酸缓冲液中(pH 7.0),在20 ℃下处理2 h,于10 000 r/min下离心10 min,测定上清液中的蛋白质浓度。得到的上清液分别稀释到 0.15、0.075、0.038和0.019 mg/mL,在4 mL的蛋白液中加入20 μL的ANS,测定荧光强度,发射光和激发光的波长分别为390 nm和470 nm,以荧光强度对蛋白浓度做出曲线,将曲线的开始斜率定为被检测样品的表面疏水性S0。
ANS溶液的配制:8 mmol/L ANS溶于0.01 mol/L的磷酸缓冲液中,pH值为7.0。
1.4 数据分析
所有样品均检测3次,采用SPSS 16.0软件,对数据进行单因素方差分析,结果采用平均值±标准偏差(SD)表示,以 Duncan多边检验对实验均值进行差异显著性分析(P<0.05)。用Origin 8.5对数据分析作图。
2 结果与分析
2.1 原料成分分析结果
本实验所用菜籽蛋白原料,是实验室对冷榨菜籽饼进行脱脂、粉碎、过筛得到的菜籽蛋白粉,对其进行成分分析,结果见表1。

表1 菜籽蛋白粉主要成分Table 1 Main components of rapeseed protein powder
由表1可知,冷榨菜籽饼中的粗蛋白含量为65.50%,蛋白含量较高,因此,其蛋白适合合成作制备菜籽肽的原料。
2.2 蛋白酶水解度
选取碱性蛋白酶、中性蛋白酶、复合风味蛋白酶和木瓜蛋白酶四种酶分别对菜籽蛋白进行水解,以水解度为考察指标,四种蛋白酶酶解效果比较见表2。
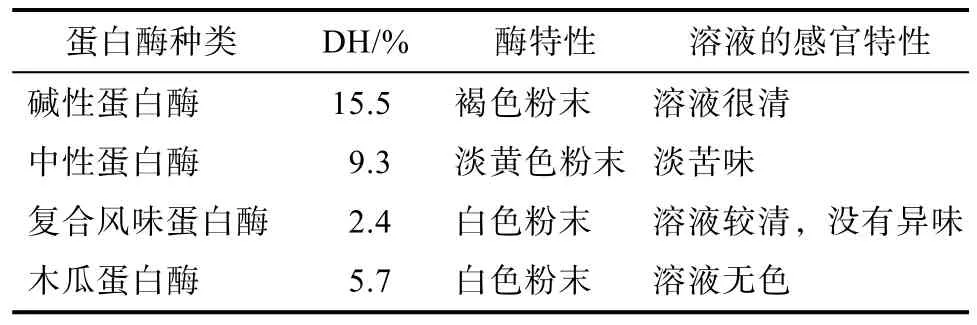
表2 四种蛋白酶的水解效果比较Table 2 Comparison of hydrolysis effects of four proteases
由表2可知,碱性蛋白酶的水解能力是这四种酶中最强的,DH为15.5%,水解度最高,且没有不适感官特性,溶液清亮。因此,首先选择碱性蛋白酶进行菜籽蛋白水解实验,并进一步探讨碱性蛋白酶水解条件。
2.3 对菜籽蛋白进行湿热处理湿热温度的确定
选择碱性蛋白酶进行酶解,选取5个不同温度(50、60、70、80、90 ℃)对菜籽蛋白湿热处理,菜籽蛋白浓度为40 mg/mL,处理时间10 min,底物浓度为 3%,选择碱性蛋白酶添加量为4 000 U/g作为空白对照组,比较不同温度湿热处理水解度,结果见图1。
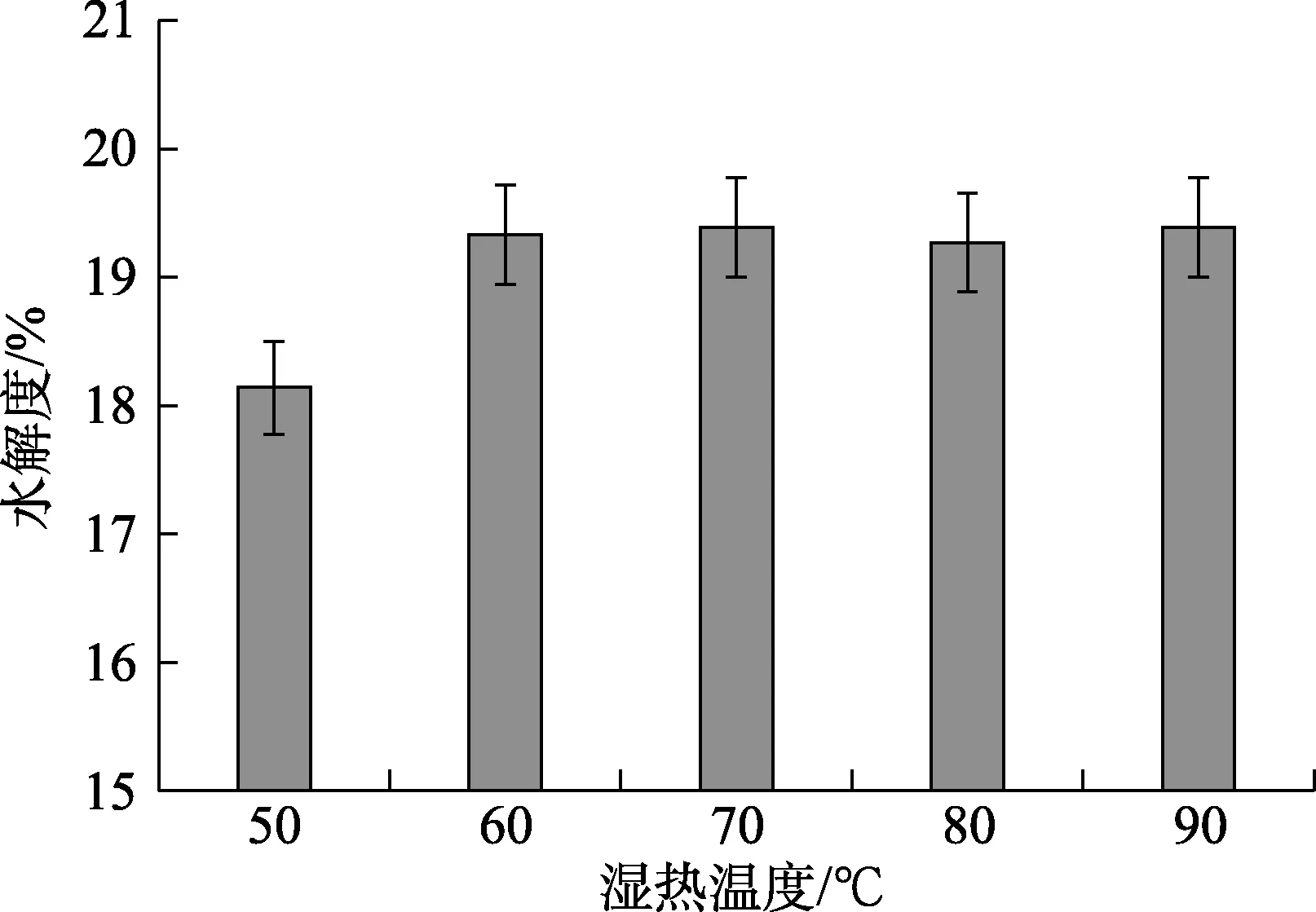
图1 不同湿热预处理的温度对菜籽蛋白水解度的影响Fig.1 Effect of different damp heat pretreatment on hydrolysis degree of rapeseed protein
由图1可知,湿热温度在50~90 ℃范围内时,蛋白酶水解度先上升后趋于稳定,在 50~60 ℃时,水解度随着温度上升而增大,从 50 ℃时,从18.1%增加到60 ℃时的19.3%,上升了1.2%。随着温度继续增加,水解度变化平缓。因此,菜籽蛋白的湿热预处理的温度选取60 ℃。
2.4 多酶法水解菜籽蛋白单因素实验
将菜籽蛋白湿热处理后添加碱性蛋白酶进行第一次水解,对影响碱性蛋白酶水解菜籽蛋白可能的因素如反应温度、反应pH、加酶量及反应时间等进行单因素实验,分别探究反应温度(45、50、55、60、65 ℃)、反应 pH(9.0、9.5、10、10.5、11)、加酶量(4 000、6 000、8 000、10 000、12 000 U/g)及反应时间(30、60、90、120、150 min)这四个因素对碱性蛋白酶水解菜籽蛋白的影响。
2.4.1 反应温度对菜籽蛋白水解的影响
实验条件为:PH 10,加酶量10 000 U/g,反应时间90 min,超声强度1.0 W/cm3,选择5个不同反应温度(45、50、55、60、65 ℃)探讨温度对酶催化菜籽蛋白水解的影响,结果见图2。
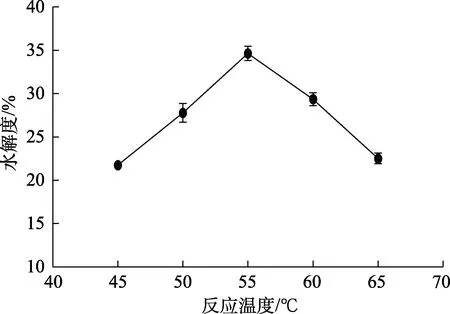
图2 反应温度对碱性蛋白酶水解菜籽蛋白水解效果的影响Fig.2 Effect of reaction temperature on the hydrolysis effect of rapeseed protein hydrolyzed by alkaline protease
如图2所示,水解度随着反应温度增加总体呈先上升后下降,在反应温度为45~55 ℃时,水解度随着温度提高而增加,在55 ℃时达到最高,为35.8%,之后随着温度增加而降低。由此可知,当温度大于 55 ℃时,随着温度继续升高,超过蛋白酶活性适宜温度,活性降低,催化能力下降,因此,选择反应温度为55 ℃,进一步优化实验。
2.4.2 反应pH对碱性蛋白酶水解菜籽蛋白的影响
实验条件为,反应温度 55 ℃,加酶量8 000 U/g,反应时间 90 min,超声强度 1.0 W/cm3,选择5个不同的pH(9.0、9.5、10.0、10.5、11)探讨 pH值对酶催化菜籽蛋白水解效果的影响,结果见图3。
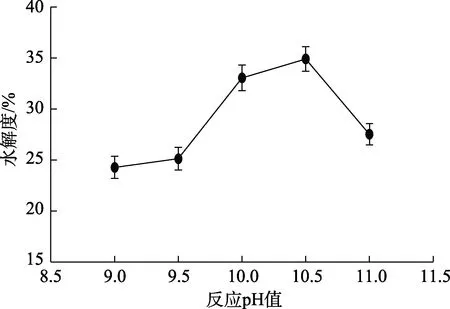
图3 反应pH对碱性蛋白酶水解菜籽蛋白水解效果的影响Fig.3 Effect of reaction pH on the hydrolysis effect of rapeseed protein hydrolyzed by alkaline protease
如图3所示,随着 pH增加,水解度先上升后下降,在pH 9~10.5时,水解度缓慢上升,在pH值10.5时达到最大,为35.3%,之后随着pH值继续增大,水解度快速下降,碱性蛋白酶有最适宜的反应 pH值,过高或者过低时都会影响其催化水解的能力。选择pH值为10.5进一步优化实验。
2.4.3 加酶量对碱性蛋白酶水解菜籽蛋白的影响
实验条件为,反应温度55 ℃,反应pH 10.5,反应时间 90 min,超声强度 1.0 W/cm3,选择 5个不同的加酶量(4 000、6 000、8 000、10 000、12 000 U/g)探讨加酶量对酶催化菜籽蛋白水解效果的影响,结果见图4。
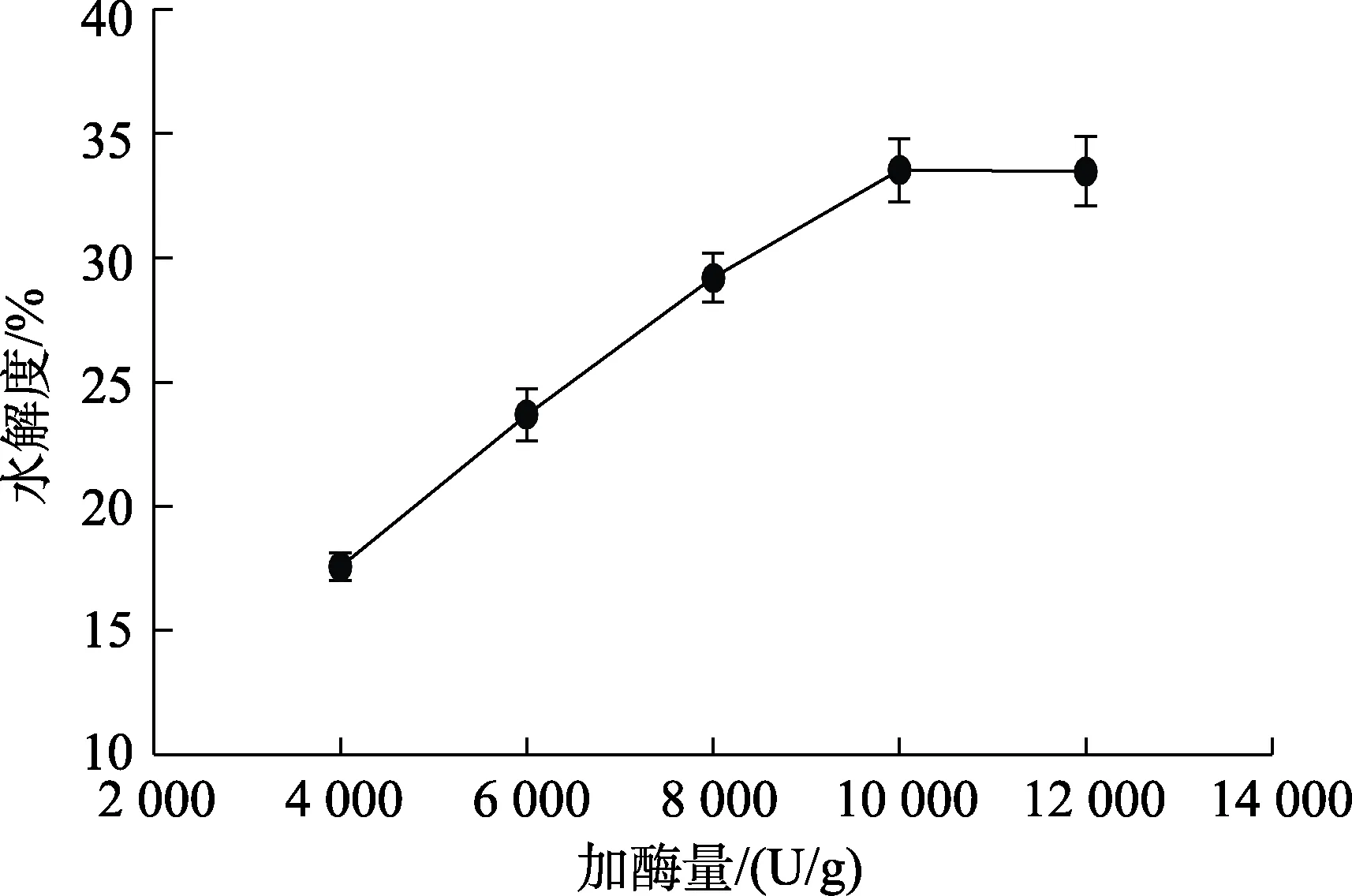
图4 加酶量对碱性蛋白酶水解菜籽蛋白水解效果的影响Fig 4 Effect of enzyme dosage on the hydrolysis effect of rapeseed protein hydrolyzed by alkaline protease
如图 4所示,随着加酶量增大,水解度先上升后趋于稳定。在加酶量4 000~10 000 U/g时,水解度快速增大,随后随着加酶量继续增加水解度趋于稳定,因此,选取加酶量 0.05%(以水溶液重量计算)进行下一步优化。
2.4.4 反应时间对碱性蛋白酶水解菜籽蛋白的影响
实验条件为,反应温度55 ℃,反应pH 10.5,加酶量10 000 U/g,超声强度1.0 W/cm3,选择5个不同的反应时间(30、60、90、120、150 min)探讨加酶量对酶催化菜籽蛋白水解效果的影响,结果见图5。
如图5所示,在30~150 min反应时间内,水解度随着时间增加先增大后趋于稳定。在 30~60 min时,水解度随着时间增加快速增大,在60~90 min时,水解度随着时间增加减速增大,反应时间达到90 min时,水解度随着时间继续增大变化不显著。因此,选择反应时间为90 min。
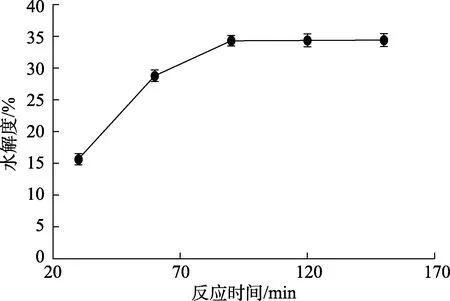
图5 反应时间对碱性蛋白酶水解菜籽蛋白水解效果的影响Fig.5 Effect of reaction time on the hydrolysis effect of rapeseed protein hydrolyzed by alkaline protease
2.5 碱性蛋白酶水解菜籽蛋白工艺条件的优化
在单因素实验的基础上,根据 Box-Behnken实验设计原理,对碱性蛋白酶水解菜籽蛋白的 3个主要影响因素反应温度、反应 pH和加酶量采用3因素3水平的响应面分析方法,实验因素及水平编码见表3。
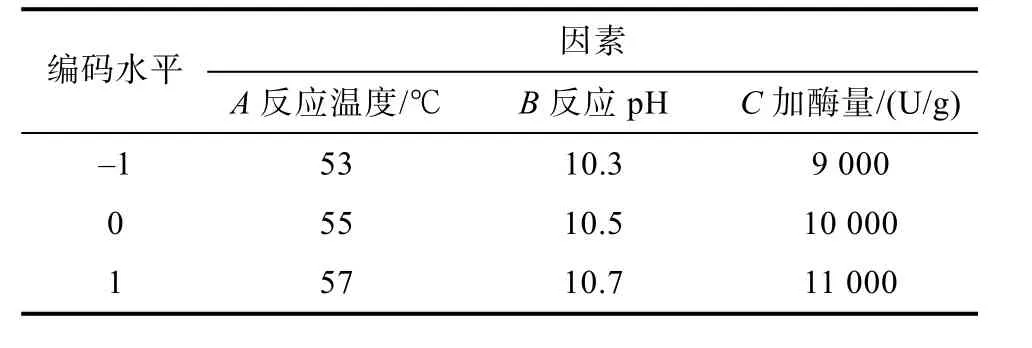
表3 Box-Behnken实验因素及水平编码表Table 3 Box Behnken test factors and level codes
采用Design-Expert 8.0.6 Box-Behnken实验设计方法对反应温度、反应pH和加酶量3个因子进行3因素3水平的响应面分析方法,以菜籽蛋白水解度(Y)为响应值进行响应面分析实验设计。进行5次零水平实验,共17个实验点,碱性蛋白酶水解菜籽蛋白的优化工艺设计及结果见表 4,该模型的回归分析见表5。
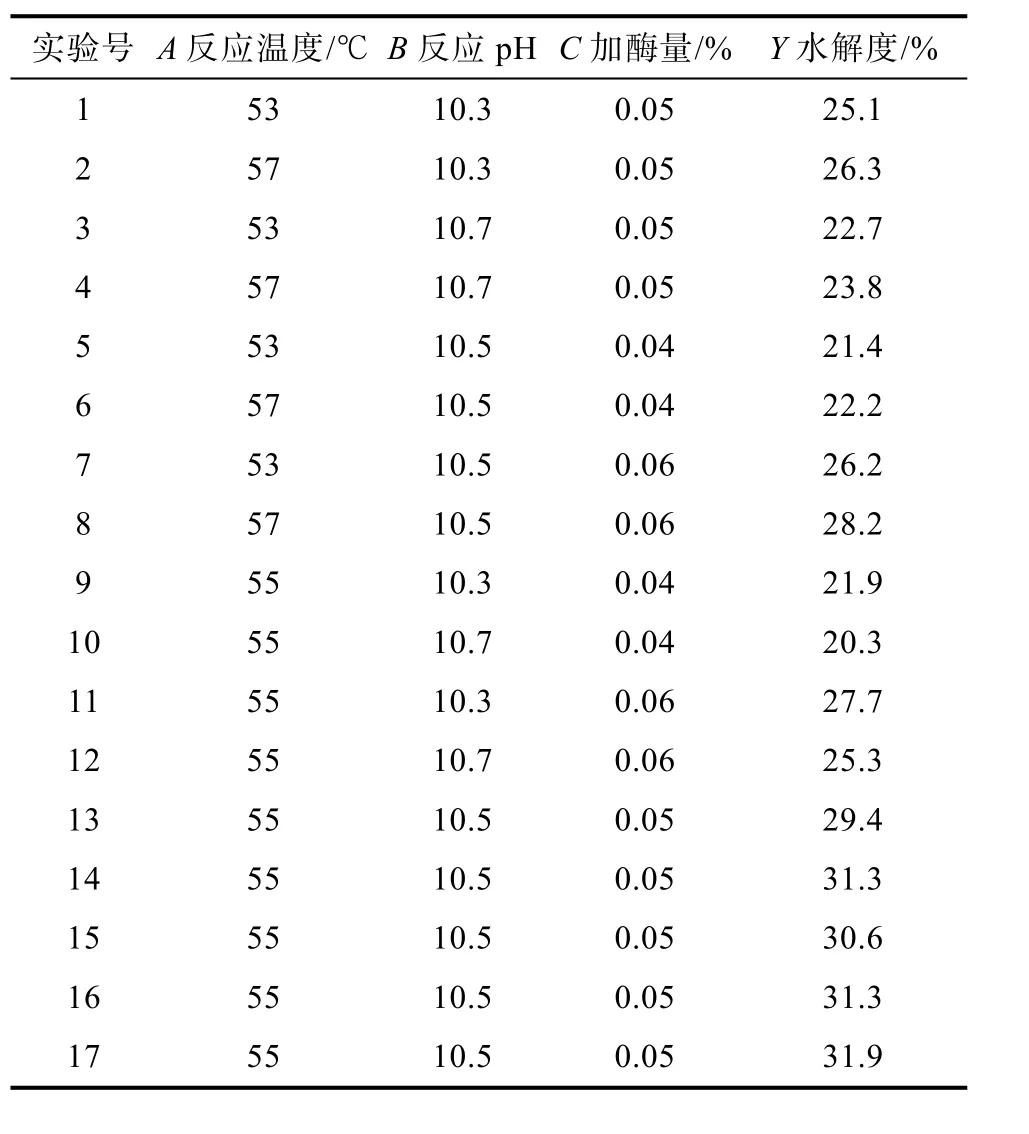
表4 碱性蛋白酶水解菜籽蛋白工艺优化BBD实验设计及结果Table 4 BBD experimental design and results of optimization of rapeseed protein hydrolysis process by alkaline protease
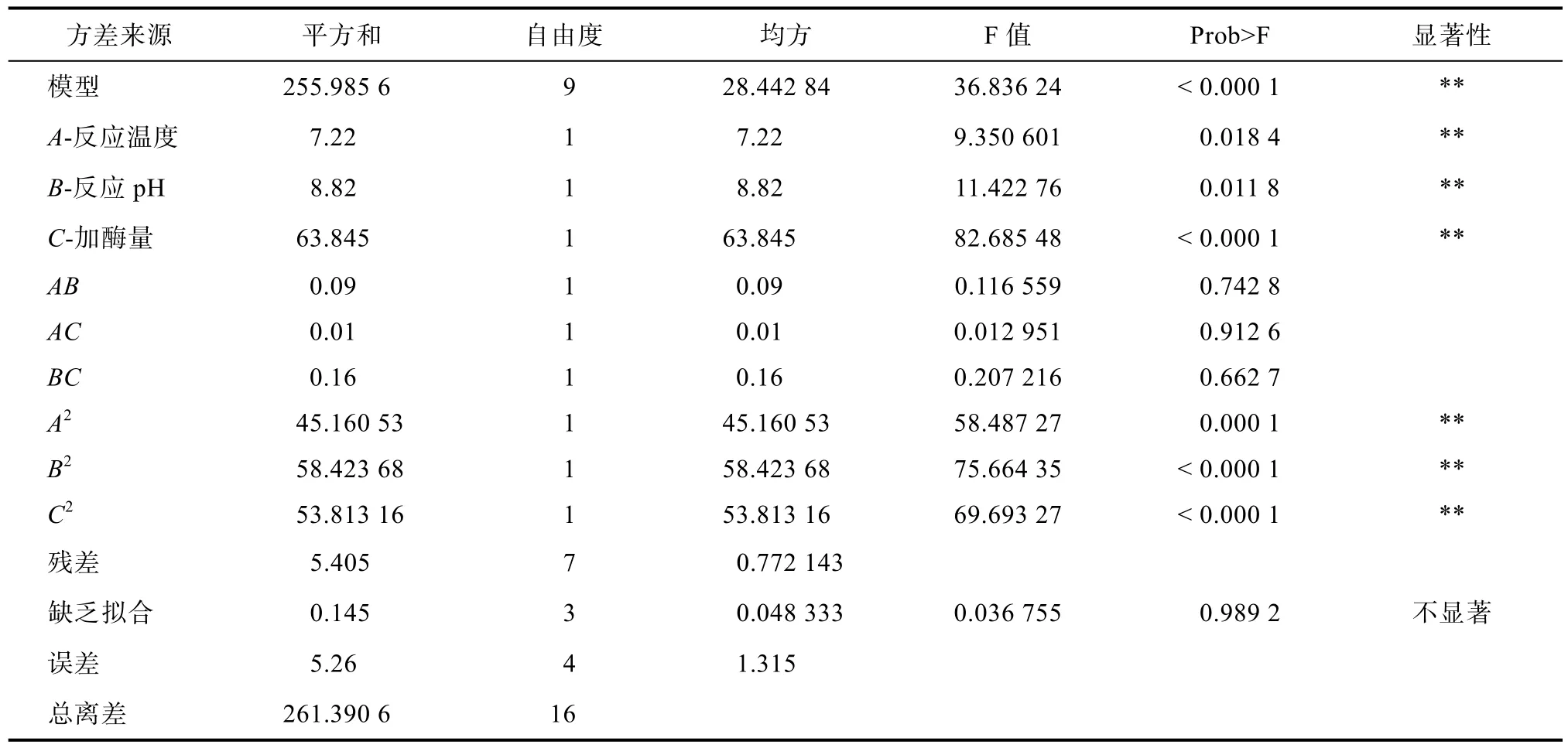
表5 回归方程方差分析表Table 5 Analysis of variance of regression eq uation
由表 5回归方程方差分析表可知,模型P<0.01(非常显著),失拟项 P=0.989 2>0.05(不显著),说明该模型选择正确,拟合程度较好,该模型的预测值与实际值能够很好的吻合。由P值可知,一次项 A、B、C以及二次项 A2、B2、C2对响应值脱胶油中磷脂含量的影响是非常显著的(P<0.01)。拟合所得的回归方程如下:
Y=-13 377.21+94.23A+1 981B+0.083C-0.38AB+0.000 03AC-0.003BC-0.82A2-93.13B2-0.000 003 58C2
在所选取的各因素水平范围内,根据表 6中各因素的 F-value的绝对值大小可以判断出反应温度、反应 pH和加酶量这三个因素对碱性纤维素酶水解菜籽蛋白效果的影响程度大小排序为:加酶量>反应pH>反应温度。
由Design Expert 8.0.6b软件处理得到的各因素交互作用的响应面图,随着各因素的增大,响应值增大;当响应值增大到最大值后,随着因素的增大,响应值变化不明显或逐渐减小;在交互项对碱性蛋白酶水解菜籽蛋白的影响如图 6~8所示。
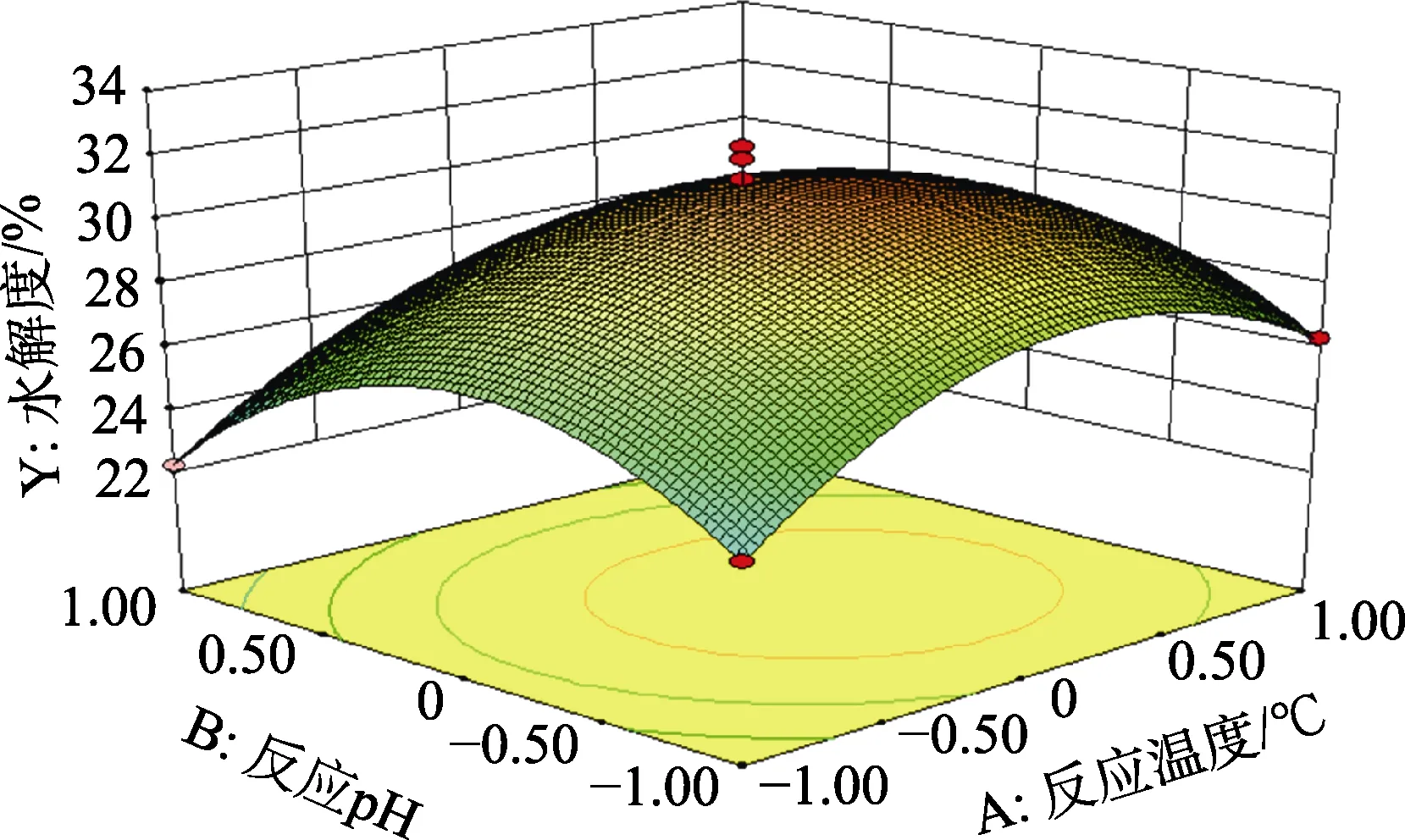
图6 反应温度与反应pH交互作用对碱性蛋白酶水解菜籽蛋白水解效果的影响Fig.6 Effect of interaction between reaction temperature and reaction pH on the hydrolysis effect of rapeseed protein hydrolyzed by alkaline protease
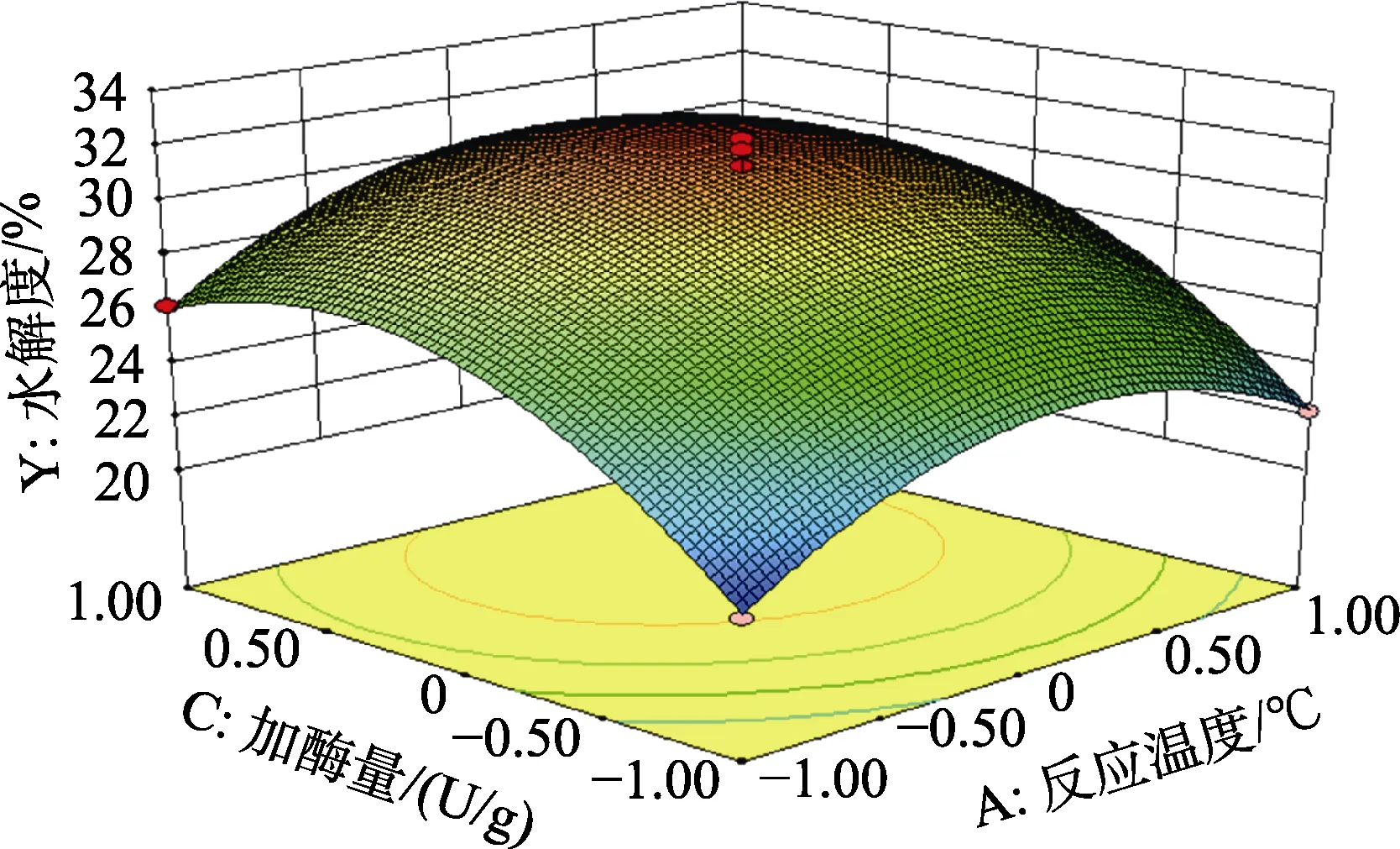
图7 反应温度与加酶量的交互作用对碱性蛋白酶水解菜籽蛋白水解效果的影响Fig.7 Effect of the interaction between reaction temperature and enzyme dosage on the hydrolysis effect of rapeseed protein hydrolyzed by alkaline protease
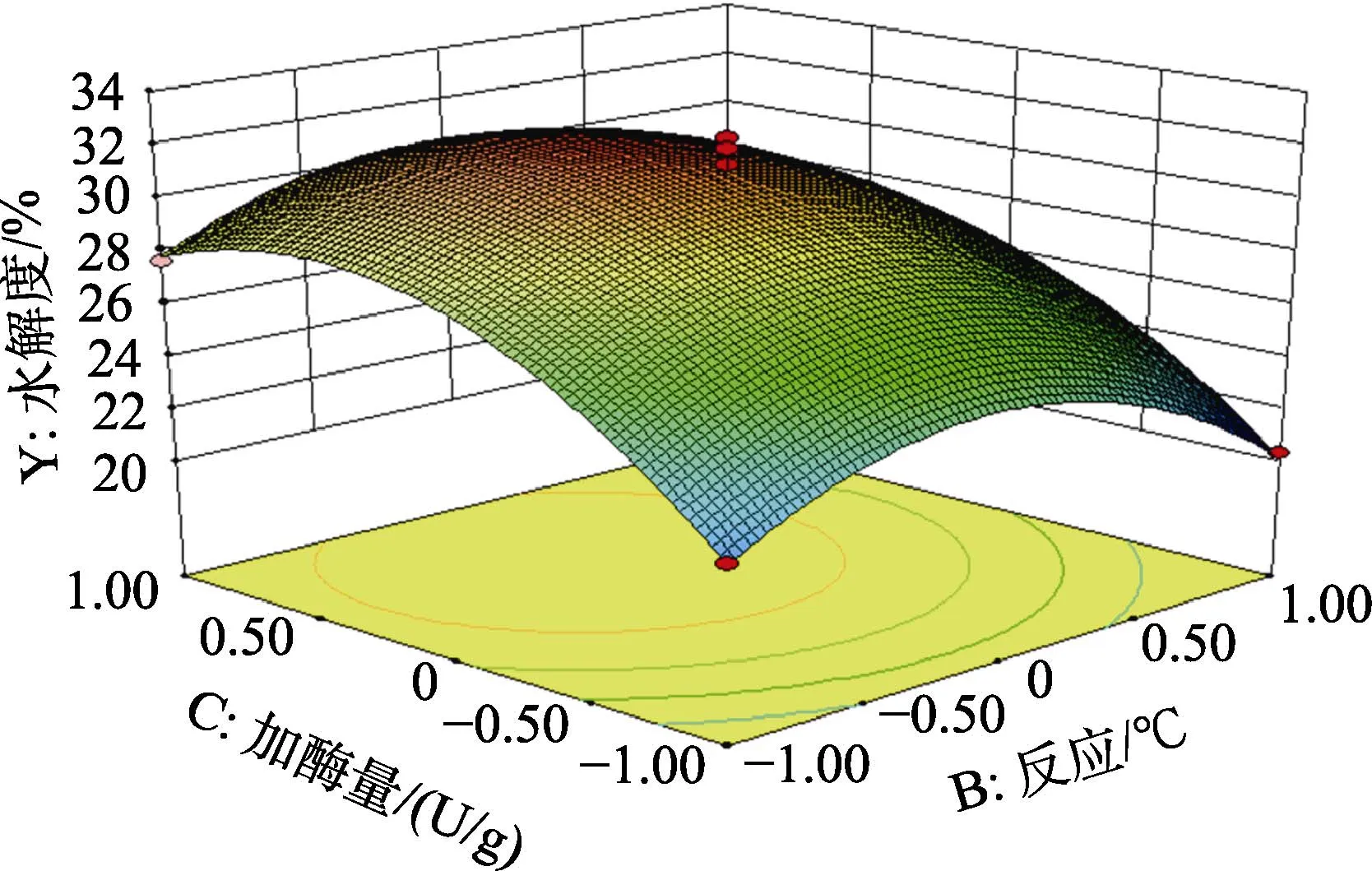
图8 反应pH与加酶量的交互作用对碱性蛋白酶水解菜籽蛋白水解效果的影响Fig.8 Effect of the interaction between reaction pH and enzyme dosage on the hydrolysis effect of rapeseed protein hydrolyzed by alkaline protease
通过响应面回归分析,得出最佳反应条件:反应温度为55.30 ℃,反应pH为10.47,加酶量为10 400.97 U/g,在此优化条件下,菜籽蛋白水解度的理论值为31.82%,与单因素实验结果较为一致,这也验证了预测的准确度。考虑到实际操作与经济效益,对工艺条件进行修正,为反应温度55.5 ℃、反应pH为10.5、加酶量为10 400 U/g。在修正条件下进行验证,重复实验3次,酶催化菜籽蛋白的平均水解度为31.64%,这与所预测的最优值基本吻合,这也进一步表明了回归模型的有效性。
2.6 复合风味蛋白酶二次水解菜籽蛋白
菜籽蛋白经过上一阶段碱性蛋白酶水解之后,将水解后的溶液加热至90 ℃,灭酶10 min。随后将溶液冷却至55 ℃,调节pH为6.2,加酶量为1 200 U/g。添加复合风味蛋白酶进行下一阶段水解,水解曲线见图 9。如图 9所示,水解度随着时间增加先增大后趋于稳定,在0~90 min时,随着时间增加水解度持续增大,之后随着时间继续增加水解度变化平缓。结果表明,使用多酶水解能有效增加菜籽蛋白水解度,水解度由开始时的 30.56%增长到 38%以上,在水解时间 90 min后,继续增加水解时间水解度变化不显著。因此,选择复合风味蛋白酶水解时间90 min。此外,利用复合风味蛋白酶其外切酶作用的特性,将位于肽链端基的疏水性氨基酸残基切下,可有效的减小菜籽蛋白水解液的苦味。
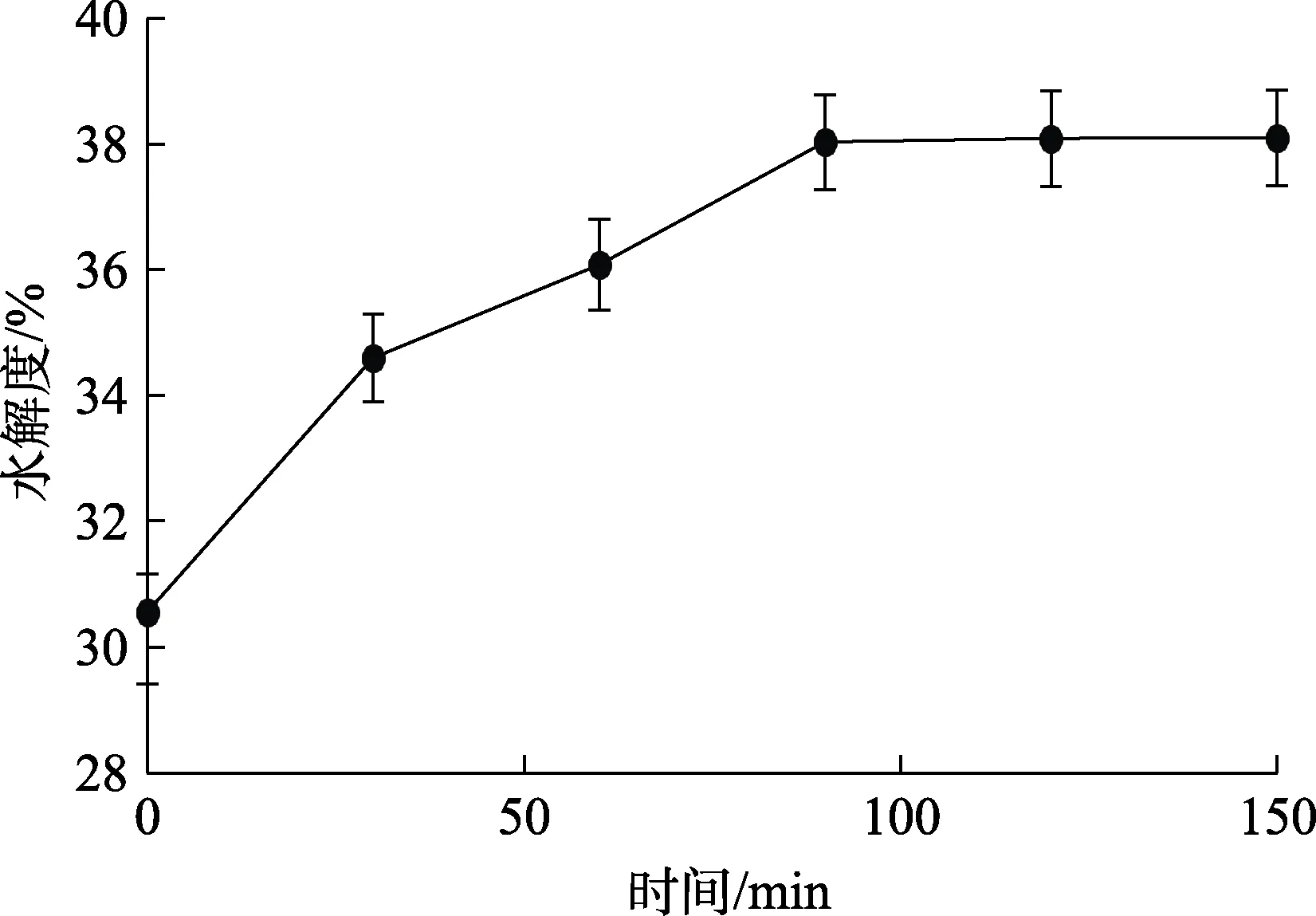
图9 复合风味蛋白酶水解菜籽蛋白酶解液曲线Fig.9 Curve of rapeseed hydrolysate hydrolyzed by complex flavor protease
2.7 菜籽肽疏水基的测定
通过水解菜籽蛋白制备的菜籽肽经常有明显苦味,加入复合风味蛋白酶后,切断分子内部肽键,使形成短肽链。其中含有一定量的疏水氨基酸,因而形成苦肽;在食品加工的过程中添加合适的复合风味蛋白酶,能够水解风味前体物,风味物质被释放,食品的风味得到改善。不同来源的蛋白质和蛋白质水解后的结构特征不同,对水解产物中的苦味影响很大,研究发现平均疏水性大于5.85 kJ/mol残基时,蛋白质或肽才会产生苦味。通过酶解反应,能够切除末端的疏水性氨基酸,使达到脱苦的目的,且复合风味蛋白酶水解产生的肽具有特殊的鲜味,因此以平均疏水性为指标,研究了复合风味蛋白酶对菜籽肽脱苦的影响。菜籽蛋白在水解过程中随着时间的变化对复合风味蛋白酶脱苦的影响如图10所示。
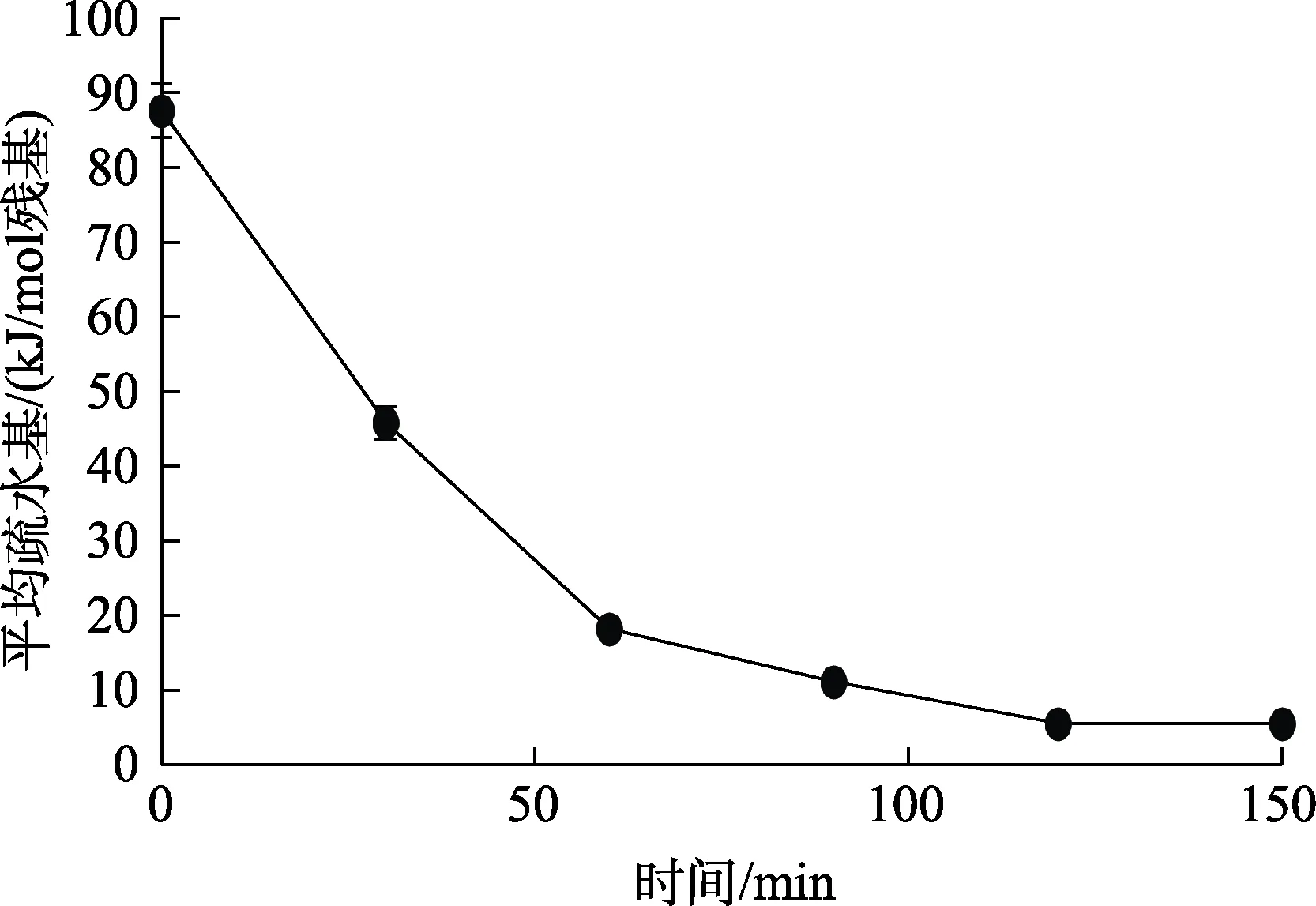
图10 时间的变化对复合风味蛋白酶脱苦的影响Fig.10 Effect of time change on debittering of compound flavor protease
由图 10可知,在未经复合风味蛋白酶水解时,菜籽肽的平均疏水性为87.62 kJ/mol残基,远大于5.85 kJ/mol,疏水残基随着复合风味蛋白酶水解时间增加而减少。在0~60 min时残基急剧下降,由87.62 kJ/mol下降到18.26 kJ/mol残基,在60~120 min时,残基平缓下降,由60 min时18.26 kJ/mol下降到 120 min时平均疏水残基5.62 kJ/mol,小于5.85 kJ/mol,达到理论脱苦效果。
3 结论
通过对比研究碱性蛋白酶、中性蛋白酶、复合风味蛋白酶和木瓜蛋白酶对菜籽蛋白的水解效果,选择碱性蛋白酶,更易于与氨基酸残基反应。水解度随着湿热处理温度、加酶量、反应时间等条件升高变化趋势相同,先上升后趋于稳定。水解度随着反应温度、反应pH值升高先上升后下降。
本实验探讨了不同反应条件对菜籽多肽水解度影响并对工艺进行优化。优化工艺条件为:反应温度 55.5 ℃、反应时间 90 min、反应 pH为10.5、加酶量为 10 400 U/g,该条件下水解度为31.64%。选择分步水解制备菜籽多肽,经过超声辅助碱性蛋白酶和复合风味蛋白酶二次酶解的菜籽肽,水解度达到 38%以上,平均疏水性由87.62 kJ/mol下降到5.62 kJ/mol,达到理论脱苦效果。采用多酶分步水解法制备出来的菜籽多肽产品,水解度高,苦味小,有利于在食品中的应用。

