miR-211-5p在局灶性脑缺血再灌注损伤大鼠模型中表达分析
孙亚云,苏建华,张俊华,马永宾,张尊胜,查全斌
脑缺血和再灌注损伤是缺血性脑卒中的病理机制,造成脑组织内皮细胞和神经细胞损伤,影响大脑功能。一方面脑血流供应受阻能够造成脑组织代谢的严重不平衡,引起脑组织损伤,更重要的是随后的缺血再灌注将促进脑组织中自由基生成,常加剧脑缺血损伤[1]。脑缺血程度和持续时间及再灌注的时间影响脑缺血再灌注损伤的诊治及预后[2]。研究表明,miR-211-5p在多种生物体的病理生理过程中发挥重要作用[3],在大鼠缺血再灌注模型中表达增加可以减轻缺血再灌注损伤[4],但是具体机制仍不清楚。脑源性神经营养因子(BDNF)可以营养神经细胞,减轻急性脑梗死患者缺血再灌注损伤。有研究表明,脑梗死早期梗死灶周围BDNF呈高表达[5]。由此可见,BDNF由梗死灶周围组织代偿性生成以减轻梗死部位(尤其是缺血半暗带区)损伤。因此,探索miR-211-5p是否靶向BDNF以减轻大脑缺血再灌注损伤尤为重要。
1 材料与方法
1.1局灶性脑缺血再灌注(MCAO/R)大鼠模型的建立及分组 选用斯莱克公司SPF级成年大鼠40只,体质量250~280 g。本研究符合相关管理准则及实验动物伦理要求,实验动物许可证号:SCXK(京)2016-0002。大鼠腹腔注射戊巴比妥钠45 mg/kg麻醉。分离右侧颈总动脉,做“V形”切口后插入尼龙栓线至大脑中动脉起始段(约18 mm,可见黑色标记至三岔口),扎紧栓线90 min后拔出,建立MCAO/R大鼠模型,动物给药均在造模前24 h行侧脑室注射。动物随机分为4组,每组10只。假手术组(Sham组):拴线深度5 mm,其他手术过程同MCAO/R+溶剂组(Vehicle组);Vehicle组:造模后注射5 μl 1%DMSO助溶剂;MCAO/R+miR-211-5p组(Mimic组):造模前7 d,以0.1 μl/min颅内立体定位注射miR-211-5p mimic片段溶液8 μl;MCAO/R+anti-miR-211-5p组(Antagomir组):注射miR-211-5p Antagomir的方法同Mimic组。造模相关溶剂类药物均来自美国Sigma公司。
1.2实验方法 ①神经功能缺损评分:采用Longa 5分法[6]评定大鼠神经功能缺损情况。将大鼠放置在桌面上,正常运动记0分,左前肢伸展障碍记1分,行走转圈记2分,行走倾斜记3分,行走障碍记4分;若大鼠在造模后死亡记5分。0~4分纳入统计,5分在数据统计时剔除。 ②脑梗死体积测定:在再灌注72 h后,大鼠麻醉处死取出完整脑组织,-20 ℃速冻30~60 min后,冰上均匀切片。配置1%TTC染液,37 ℃恒温避光孵育脑切片15 min,观察脑组织变化。脑梗死体积百分比采用Image J软件计算。③BDNF与miR-211-5p检测:取-80 ℃冰箱保存的大鼠脑皮质及海马组织,组织匀浆后以10 000×g 4 ℃离心15 min,收集上清。采用Q-PCR检测血清miR-211-5p含量,采用ELISA和Western blot法测定BDNF表达。按照ELISA试剂盒说明书,将含有BDNF的血清标本、标准品、稀释的检测抗体(已被辣根过氧化物酶标记)加入到预先被人BDNF捕获抗体包裹的标板孔中,经过孵育及洗涤,再用底物溶液三甲基六亚甲基二胺显色,催化后采用酶标仪测定450 nm波长下的光密度(OD)值,并根据OD值得出所对应血清的BDNF浓度值。

2 结果
2.1脑梗死大鼠存活率及神经功能缺损评分 Sham组、Vehicle组、Mimic组、Antagomir组大鼠存活率分别为100.00%、50.00%、80.00%、60.00%。Vehicle组存活率较Sham组显著降低,miR-211-5p处理后较Vehicle组显著升高,拮抗miR-211-5p后存活率降低(P<0.05)。对各组大鼠进行Longa评分,Vehicle组较Sham组评分明显升高,应用miR-211-5p后评分降低,拮抗miR-211-5p后评分升高(P<0.05)。见图1。
2.2大脑梗死体积评估 随机选取各组4只大鼠完整脑组织行TTC染色,结果发现与Vehicle组比较,Mimic组脑梗死体积百分比明显降低,应用anti-miR-211-5p后,Antagomir组脑梗死体积百分比高于Mimic组(P<0.05)。见图2。
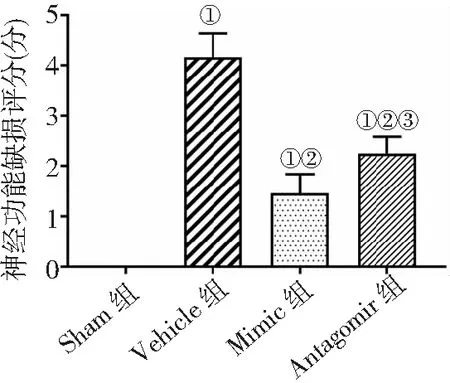
图1 4组MCAO/R大鼠神经功能缺损评分比较
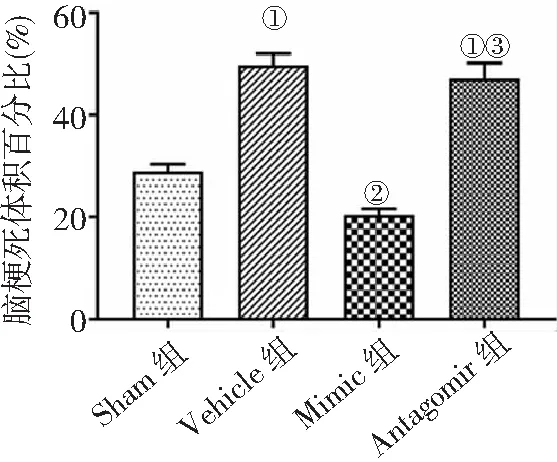
图2 4组MCAO/R大鼠脑梗死体积比较
2.3miR-211-5p表达结果比较 与Sham组和Vehicle组比较,Mimic组miR-211-5p表达量升高,Antagomir组表达量降低,Antagomir组miR-211-5p表达量低于Mimic组(P<0.05)。见图3。
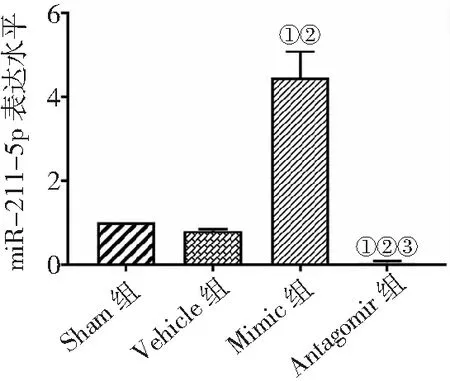
图3 4组MCAO/R大鼠miR-211-5p表达水平比较
2.4ELISA法检测BDNF蛋白表达 Mimic组BDNF表达量高于其他3组,Vehicle组和Antagomir组低于Sham组,Antagomir组低于Vehicle组(P<0.05)。见图4。
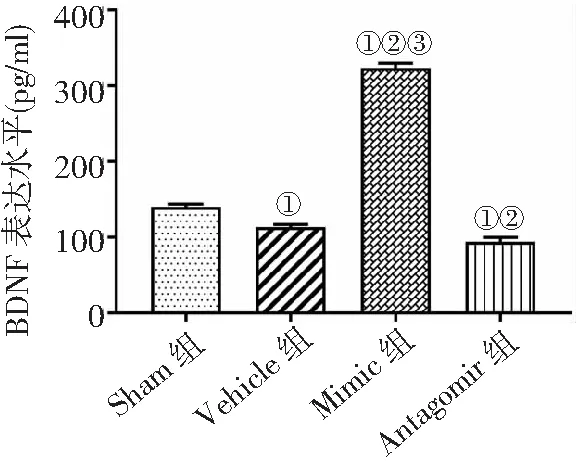
图4 ELISA法检测4组MCAO/R大鼠BDNF蛋白表达水平比较
2.5Western blot法检测BDNF蛋白表达 Mimic组BDNF表达量高于其他3组,Vehicle组和Antagomir组低于Sham组,Antagomir组低于Vehicle组(P<0.05)。见图5。
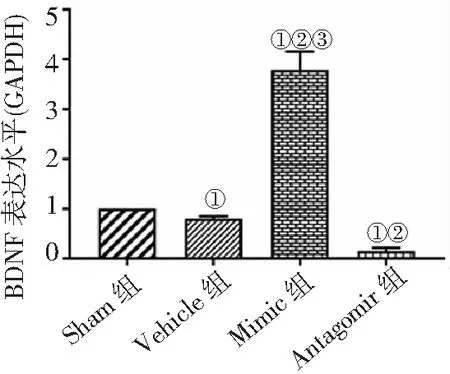
图5 Western blot法检测4组MCAO/R大鼠BDNF蛋白表达水平比较
3 讨论
miRNA可调节神经细胞内多种靶基因,对神经系统发育有重要作用[7]。有研究表明miRNA调控众多炎性介质的细胞内通路[8]。miR-211-5p在多种肿瘤、精神疾病和心脑血管疾病中发挥重要作用[9]。尽管有新的证据表明miRNA在人类和啮齿类动物脑卒中后均会发生改变,但是关于miR-211-5p在脑卒中后炎症反应调节中的作用及机制研究仍然有限。有研究发现,miR-146a可以抑制少突胶质前体细胞(OPC)中IPAK-1,增加髓磷脂蛋白并降低OPC的凋亡,从而改善脑缺血再灌注损伤[10];miR-3473b通过靶向小鼠小胶质细胞BV2细胞株的细胞因子信号转导抑制因子3来降低小鼠的适应性免疫调节[11];抑制miR-19a可以调节葡萄糖代谢和神经细胞凋亡来保护缺血性损伤的神经细胞[12];Mcl-1是Bcl-2家族成员,miR-106b-5p抑制剂可以增强抗神经细胞凋亡效应,从而修复脑缺血再灌注损伤[13]。本研究发现,大鼠侧脑室注射miR-211-5p后,存活率升高而Longa评分降低,大鼠脑梗死体积百分比降低,说明miR-211-5p具有修复大鼠MCAO/R损伤的作用。
miR-211-5p在多种生物体的病理生理过程具有重要的调控作用[14],通过下调胶质细胞源神经营养因子(GDNF)表达进而抑制骨髓间充质干细胞向肠神经节细胞分化[15];miR-211/BDNF轴通过PI3K/AKT途径调节脂多糖诱导的星形胶质细胞增殖,提示其可能成为脊髓灰质损伤后反应性星形胶质细胞增殖干预策略的靶点[16];在新生大鼠MCAO/R模型中,miR-211/GDNF减少Neuro2A细胞凋亡,从而减轻缺氧缺血性损伤[17]。有研究认为,miR-211-5p在缺血性脑病中起重要作用,在大鼠缺血再灌注模型中表达增加并可减轻大鼠缺血再灌注损伤[4]。进一步检测BDNF表达水平发现,BDNF在Mimic组中表达量高于Sham组,Antagomir组表达量最低,说明BDNF能减轻MCAO/R大鼠神经功能损伤,提高生存率;推测BDNF表达变化与miR-211-5p存在一定关系,miR-211-5p通过靶向调控BDNF参与对MCAO/R大鼠的脑损伤保护。
综上,miR-211-5p表达水平与大鼠MCAO/R损伤具有相关性。

