碎米荠超氧化物歧化酶基因家族成员的鉴定和分析
付伟, 李林, 康宇, 龙澜, 杨永康, 殷红清*, 向极钎,梅磊
(1. 恩施土家族苗族自治州农业科学院,湖北 恩施 445000;2. 湖北省富硒产业技术研究院,湖北 恩施 445000;3. 中国科学院植物研究所,北京 100093)
活性氧自由基(reactive oxygen species, ROS)是植物细胞在需氧代谢过程中产生的具有高度化学反应活性的含氧集团,如超氧阴离子自由基(O2-·)、羟基自由基(·OH)、过氧化氢(H2O2)、单线态氧(1O2)等。当植物遭受胁迫时,抗氧化酶系统受到损伤导致活性氧大量积累,引起一系列生理生化紊乱对植物造成损害,甚至导致不可修复性的代谢功能障碍以及细胞死亡[1]。在长期的进化过程中,植物为了抵御氧化伤害,维持正常的生理代谢,形成了抗氧化酶促清除系统和非酶促清除系统协同作用清除活性氧。而超氧化物歧化酶(superoxide dismutase,SOD)作为植物防御系统的第一道防线对清除氧自由基起关键作用,可催化超氧阴离子自由基(O2-·)歧化生成H2O2和O2,再通过过氧化物酶和氧化物酶将H2O2转化为H2O,从而实现活性氧的清除[2],其活性与植物的生长发育以及抗逆性等有密切相关性[3-5]。
超氧化物歧化酶是一种含金属的酶,其通过金属辅因子得失电子清除活性氧自由基。根据SOD 结合的金属辅因子种类,可分为Cu/Zn-SOD、Fe-SOD、Mn-SOD 和Ni-SOD 等4 类[5-6]。其中,Cu/Zn-SOD主要存在于高等植物的叶绿体和细胞质中,与植物抗逆性有密切关系[7]。在小麦(Triticum aestivum)中,组成型表达的Cu/Zn-SOD响应各种非生物胁迫的程度不同[8]。低温胁迫下,茶树(Camellia sinensis)的Cu/Zn-SOD和Mn-SOD基因上调表达,Fe-SOD基因受到抑制[9]。转基因植株中,Cu/Zn-SOD基因的过表达增强了木薯(Manihot esculenta)[10]耐旱性和甘薯(Dioscorea esculenta)[11]的盐胁迫耐受性。而Fe-SOD 和Mn-SOD 主要分布于低等植物中,主要涉及植物的抗逆性[12]。在烟草(Nicotiana tabacum)与苜蓿(Medicago sativa)中,Fe-SOD和Mn-SOD明显增强了植株的抗冷、抗氧化能力[13-14]。Ni-SOD 首次从链霉菌(Streptomyces)中发现,目前报道其仅存在于少数原核生物如绿藻和细菌中[15]。Tsang 等[16]通过亚细胞和系统发育分析表明,仅Cu/Zn-SOD、Fe-SOD和Mn-SOD 在植物中共存。
碎米荠(Cardamine hirsuta)为十字花科(Brassicaceae)碎米荠属碎米荠组植物,分布广泛,全株可作野菜食用和入药[17]。有研究表明,碎米荠组有些植物具有较强的硒耐受性,如弯曲碎米荠(C. flexuosa)[18]和堇叶碎米荠(C. violifolia)[17]等。碎米荠全基因组测序的完成,为ChSOD基因家族的全基因组分析奠定了基础。然而,目前尚未有从全基因组水平上对碎米荠SOD基因功能进行研究的报道。本研究通过生物信息学对碎米荠SOD基因家族进行全基因组鉴定分析,分析其结构、进化关系和染色体定位等信息,为碎米荠抗氧化机制研究提供理论参考。
1 材料和方法
1.1 材料
选取颗粒饱满的碎米荠种子于4 ℃冰箱春化24 h 后,置于培养皿中黑暗催芽4 d。待种子萌发后,将其移至塑料花盆中(蛭石∶营养土=1∶1), 并在光周期为12 h/12 h、25 ℃下培养15 d,分别收集碎米荠幼苗的根、茎和叶,用液氮快速冷冻后保存于-80 ℃冰箱备用。
1.2 SOD 基因家族成员鉴定
通过数据库(http://chi.mpipz.mpg.de/assembly.html)下载碎米荠全基因组数据[19],通过Pfam 数据库(http://pfam.xfam.org/)下载SOD 的隐马氏模型文件(PF00080、PF00081 和PF02777),并以该文件为搜索条件,利用HMMER 3.0 中的Hmmsearch 程序对碎米荠蛋白质序列进行搜索(E<1×10-5),并去除重复,然后通过NCBI-CDD (http://www.ncbi.nlm.nih.g/stuctu/cdd/wrpsb.cgi)和SMART (http://smart.embl heidelberg.de/)进行鉴定和筛选,最终得到碎米荠SOD 家族蛋白质序列。根据碎米荠基因组注释文件信息,获得SOD基因在染色体上的位置分布信息,并利用Map Chart 绘制碎米荠SOD基因在染色体上的定位图。最后,利用ExPASy (https://web.expasy.org/compute_pi/)分析碎米荠SOD 的分子量、氨基酸数量和等电点。
1.3 系统发育关系和分类
从TAIR 数据库(https://www.arabidopsis.org/index.jsp)和RGAP 数据库(http://rice.plantbiology.msu.edu/index.shtml)分别下载拟南芥(Arabidopsis thaliana)和水稻(Oryza sativa)的SOD 氨基酸序列,利用Clustal W 对碎米荠、拟南芥和水稻的SOD 氨基酸序列进行比对,并用MEGA 7.0 软件通过相邻连接法(NJ)构建系统进化树,设置重复次数为1 000,提高进化分支树结果的可靠性。
1.4 基因结构和基序组成
利用在线网站GSDS (http://gsds.cbi.pku.edu.cn/)分析碎米荠SOD基因家族成员的基因结构;利用在线软件MEME (http://memesuite.org/)分析碎米荠SOD 氨基酸序列中的保守基序,设置motif 为10;利用Clustal W 对碎米荠SOD 氨基酸序列进行比对,并用MEGA 7.0软件相邻接法(NJ)构建系统进化树,设置重复次数为1 000。最后利用TBtools 绘制碎米荠SOD基因家族成员的系统进化树、基因组成和基因结构的组合图。
1.5 顺式作用元件分析
提取碎米荠SOD基因编码序列上游1.5 kb 文件,提交到Plant CARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对顺式作用元件进行识别,并利用在线网站GSDS (http://gsds.cbi.pku.edu.cn/)绘制碎米荠SOD基因家族顺式作用元件图[20]。
1.6 SOD 基因表达分析
取碎米荠根、茎、叶冷冻样本各50 mg,采用Trizol 法提取总RNA,采用0.8%的琼脂糖凝胶电泳和Nanodrop 2000 检测RNA 质量,以确保总RNA 的完整性和浓度。参照SuperscriptⅢ first strand cDNA synthesis Kit (天根生化科技有限公司,北京)说明书进行cDNA 第一链合成,置于-20 ℃保存备用。
利用Primer Premier 3.0 进行荧光定量PCR 引物设计(表1),引物由睿博兴科生物技术有限公司广州分公司合成。以GADPH为内参基因,采用Super-Real PreMix Plus (SYBR Green) PCR Kit (天根生化科技有限公司,北京)进行实时荧光定量PCR。扩增体系(20μL):2×SuperReal PreMix Plus 10μL,上下游引物(10μmol/L)各1μL,cDNA 1μL,ddH2O 7μL。反应程序:95 ℃预变性10 min;然后95 ℃ 10 s,60 ℃ 20 s,72 ℃ 30 s,共45 个循环。采用2-ΔΔCT法进行数据分析,并用Graph Pad Prism 8绘制柱状图。

表1 qRT-PCR 引物Table 1 qRT-PCR primers
1.7 SOD 的二级、三级结构预测
利用在线网站SOMPA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL (https://swissmodel.expasy.org/)分别对碎米荠SOD 蛋白序列进行二级、三级结构预测。
2 结果和分析
2.1 碎米荠SOD 家族成员
通过HMMER3.0 中的Hmmsearch 程序对碎米荠氨基酸序列进行搜索,同时利用NCBI-CDD 和SMART 进行蛋白结构域鉴定,剔除了不含保守结构域的氨基酸序列,并手动去除重复的氨基酸序列和不完整的氨基酸序列,最终鉴定出10 个碎米荠SOD基因家族成员,不均匀地分布在7 条染色体上,其中在1、4 和6 号染色体上各有2 个,而3、5、7和8 号染色体上各有1 个(图1)。

图1 碎米荠SOD 基因的染色体分布Fig. 1 Chromosome location of ChSOD genes
对碎米荠SOD 家族成员进行氨基酸序列和结构分析表明(表2),有4 个ChSOD(CARHR008750、CARHR121080、CARHR085500 和CARHR256990)分布在染色体正义链上,其余6 个分布在反义链上;氨基酸序列长度为57 (CARHR120080)~324 (CARH R012800);蛋白质分子量为6 419.41~34 659.01 kDa;等电点在4.92~9.60,且酸性蛋白较多。

表2 碎米荠SOD 基因及其编码蛋白信息Table 2 ChSOD genes and information of their encoding proteins
2.2 系统发育分析
通过Clustal W 对碎米荠10 个SOD 的氨基酸序列进行比对,结果表明(图2),SOD 的氨基酸序列间同源性较高,且主要集中在C 端,该区域可能是SOD 蛋白行使功能的关键区域。
用MEGA 7.0 对碎米荠、拟南芥和水稻SOD 家族成员的系统进化关系进行了比较,并构建了系统发育进化树。结果表明(图3),相较于水稻,碎米荠与拟南芥的SOD 蛋白质具有相似的结构而聚在一起,说明碎米荠与拟南芥同源性较高,可通过分析拟南芥相应同源序列来推测碎米荠基因的功能;此外,进化树还表明,Cu/Zn-SOD 起源于同一分支, 而Mn-SOD、Fe-SOD 起源于另一分支,表明碎米荠Mn-SOD 和Fe-SOD 也可能起源于同一祖先。
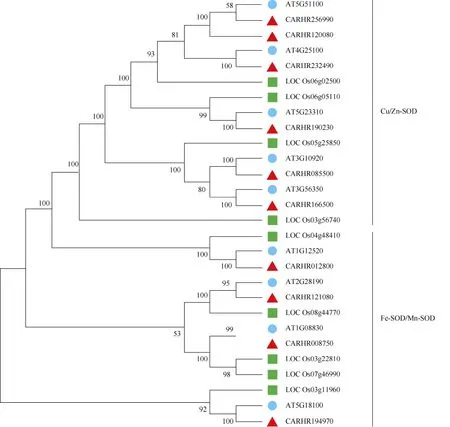
图3 碎米荠(▲)、拟南芥(●)和水稻(■)中SOD 蛋白的系统进化树Fig. 3 Phylogenetic tree of SOD in Cardamine hirsuta (▲), Arabidopsis thaliana (●) and Oryza sativa (■)
2.3 SOD 基因结构和基序组成
基因结构分析表明,ChSODs含有2~9个外显子,其中CARHR256990 含有9 个外显子,而CARHR 120080 仅有2 个外显子(图4)。而对ChSOD 进行保守基序分析表明,同一亚族内的SOD 保守基序的种类与数量大体相同,而不同亚族内的SOD 保守基序的种类和数量差异较大,Motif 3、Motif 5 仅出现在Fe-SOD/Mn-SOD (CARHR012800、CARHR194970、CARHR008750 和CARHR121080)分支中,而其余8种Motif 只存在于Cu/Zn-SOD (CARHR256990、CAR HR120080、CARHR190230、CARHR232490、CARHR 085500 和CARHR166500)分支中。

图4 碎米荠SOD 家族成员的系统发育关系(A)、基序(B)和基因结构(C)Fig. 4 Phylogenetic tree (A), motiff (B) and gene structure (C) of ChSOD members
2.4 ChSODs 启动子顺式作用元件分析
为了进一步研究ChSODs 在非生物胁迫响应中的潜在机制,提取ChSODs 起始位点上游1.5 kb 序列,提交到Plant CAR 检测顺式作用元件,包括ABA响应元件、干旱诱导响应元件(MBS)、低温响应元件(LTR)、防御和应激反应元件(TC-rich)和创伤响应元件(WUN-motif)。从图5 可见,ChSODs 含有2~11个顺式作用元件,其中CARHR008750、CARHR01 2800 和CARHR194970 仅有2 个顺式作用元件,而CARHR166500 有11 个顺式作用元件。此外,有6个ChSODs 基因具有ABA 响应元件,5 个基因具有LTR 响应元件,5 个基因具有TC-rich 响应元件,4个基因具有WUN-motif 响应元件和4 个基因具有MBS 响应元件。因此,推测在响应非生物胁迫时,ChSODs 对ABA 和低温胁迫响应更敏感[20]。
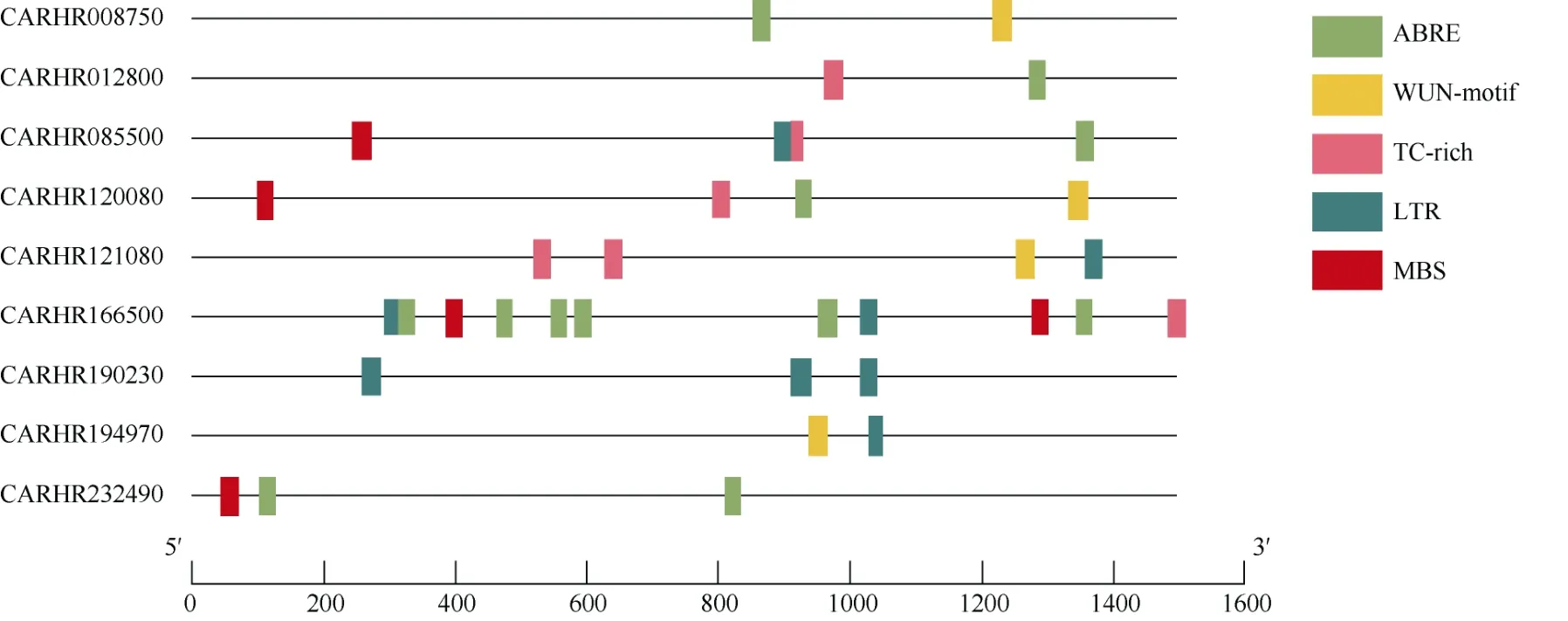
图5 预测ChSOD 启动子中的顺式元件。ABRE: ABA; LTR: 低温; MBS: 干旱; TC-rich: 应激反应; WUN-motif: 创伤。Fig. 5 Predicted cis-elements in ChSOD promoters. ABRE: ABA; LTR: Low temperature; MBS: Drought; TC-rich: Stress; Wun-motif: Trauma.
2.5 ChSODs 表达分析
基因的组织表达与功能密切相关,从图6 可见,ChSODs 在碎米荠根、茎和叶中均有表达,以叶中的表达量最高,其次为茎和根。另外,CARHR08 5500 在叶和茎中的表达量最高(分别为根的8 和5倍), 其次为CARHR256690 (分别为根的5 和3 倍)。

图6 ChSODs 在不同组织中的表达。1~10 见表2。n=3; 相同基因柱上不同字母表示差异显著(P<0.05)。Fig. 6 Expression of ChSODs in different tissues. 1-10 see Table 2. n=3; Different letters upon column of the same gene indicate significant difference at 0.05 level.
2.6 ChSOD 蛋白的二级、三级结构预测
利用SOMPA 预测可知,在ChSOD 家族成员的蛋白质二级结构中,α-螺旋、无规则卷曲和延伸链较高,而β-转角较低。其中多数蛋白质的α-螺旋占25.08%~54.55%,无规则卷曲为29.82%~56.36%,延伸链为11.69%~32.89%,而β-转角绝大多数低于10%。因此,预测在ChSOD 蛋白二级结构中,α-螺旋、无规则卷曲起主要作用(表3)。

表3 ChSOD 蛋白二级结构Table 3 Secondary structure of ChSOD
SWISS-MODEL 对ChSOD 家族成员的蛋白三级结构进行预测,ChSOD 蛋白均含有α-螺旋、β-折叠、无规则卷曲等空间构象,但结构具有差异性;另外,各ChSOD 蛋白含有的螺旋-转角-螺旋(HTH)数目存在差异(图7)。

图7 ChSOD 蛋白的三级结构Fig. 7 Tertiary structure of ChSOD
3 结论和讨论
SOD 是植物体内清除氧自由基的关键酶,其活性与植物生长发育和抗逆性等密切相关[3-5]。近年来,随着全基因组分析技术的发展,已对许多植物的SOD 家族成员进行了分析,并证明其参与调控植物的多重生理过程,如玉米(Zea mays)[21]、拟南芥[22]、水稻[23]、油菜(Brassica napus)[24]等。随着基因组学的发展和碎米荠全基因组测序的完成,为解析碎米荠SOD基因家族成员的功能提供了理论和技术支持。
本研究中,通过生物信息学方法共鉴定出了10个碎米荠ChSOD基因,其结构简单,且大多编码亲水性蛋白,表明碎米荠ChSOD基因结构较稳定,基因在进行复制时较难发生可变剪切,功能相对稳定。根据SOD 蛋白活性中心金属辅因子的类型, 可将其分为Mn-SOD、Cu/Zn-SOD 和Fe-SOD,其中,组成型表达的Cu/Zn-SOD 和Fe-SOD 含量较稳定,既参与清除代谢过程中产生的ROS,也参与植物抗逆性形成;Mn-SOD 的表达极易受外界影响,在清除逆境胁迫产生的大量ROS 中发挥着重要作用[25]。研究表明,Cu/Zn-SOD 对植物的多种抗逆性尤为重要,如抗寒、抗旱、耐盐碱等[24,26-27]。碎米荠10 个ChSOD基因中,有6 个荠ChSOD基因鉴定为Cu/Zn-SOD基因,说明碎米荠抗逆性与SOD 密切相关,且Cu/Zn-SOD 可能发挥主导作用。
前人根据SOD 蛋白的结构同源性推测,不同物种的Mn-SOD 和Fe-SOD 蛋白可能起源于同一祖先——光合细菌[28-29]。刘家林等[23]证实了水稻Mn-SOD 和Fe-SOD 可能起源于同一祖先。对碎米荠SOD蛋白进行预测,显示Cu/Zn-SOD 归于一支,而Mn-SOD 和Fe-SOD 归于另一分支,表明在碎米荠中,Mn-SOD 和Fe-SOD 蛋白也可能起源于同一祖先。而不同SOD 家族成员间的理化性质的差异性可能与产生旁系同源基因,形成新的生物学功能,以更好地适应环境[30]。与水稻相比,碎米荠的ChSOD与拟南芥的AtSOD 亲缘关系更近,可能与同属于双子叶植物有关,据此,可通过拟南芥AtSOD功能来推测碎米荠ChSOD基因的功能。基因在组织中的表达量与功能密切相关,ChSOD在叶中的高表达可能与叶片活跃的光合作用有关。CARHR085500和CARHR256690 在碎米荠叶和茎中表达量较高, 这与前人[31]报道Cu/ZnSOD转录产物主要集中于根和茎的结果一致。此外,高等植物的基因表达主要在转录水平上进行调控,且受多种顺式作用元件和反式作用因子的相互调节。对ChSOD启动子顺式作用元件预测表明,碎米荠SOD启动子中含有ABA、干旱、低温、防御、应激和创伤等非生物胁迫响应元件,且含有ABA 和低温响应元件的基因较多,推测ChSOD在响应非生物胁迫时,可能对ABA 和低温胁迫响应更敏感。这有助于了解基因调控模式,对深入了解碎米荠的生长机制及其外界环境的调控模式具有重要意义。
在碎米荠全基因组中,共鉴定出10 个SOD基因,分布在7 条染色体上;ChSOD 蛋白的分子量与氨基酸数目成正比,且多数为酸性蛋白;ChSOD基因含有2~11 个外显子。碎米荠SOD基因包含6 个Cu/Zn-SOD、3 个Fe-SOD和1 个Mn-SOD,可分为2 个亚家族,位于同一亚族的SOD基因具有相似的保守基序和基因结构。碎米荠ChSOD 与拟南芥AtSOD 的同源性较高。qRT-PCR 分析表明,ChSODs在碎米荠根、茎和叶中均有表达,以叶中的表达量最高。CARHR085500 在碎米荠叶和茎中的表达量最高,其次为CARHR256690。在响应非生物胁迫时,ChSODs 对ABA 和低温胁迫响应较敏感。ChSOD蛋白质的二级、三级结构中,以α-螺旋和无规则卷曲比例较高,可能起主导作用,但不同ChSOD 蛋白质的空间构象和螺旋-转角-螺旋(HTH)存在差异。

