抑制线粒体钙单向转运体对大鼠急性胰腺炎氧化应激的作用研究*
覃颖颖,杨慧莹,吴青,谢金莲,蒙诺,雷宇,唐国都
(1.广西医科大学第一附属医院 消化内科,广西 南宁 530021;2.广西医科大学第二附属医院 消化内科,广西 南宁 530007;3.右江民族医学院第一附属医院 心血管内科,广西 百色 533000)
急性胰腺炎(acute pancreatitis, AP)是临床急腹症的常见病因,20%~30%可进展为重症[1],且进展凶险, 预后差[2]。 线粒体钙单向转运体(mitochondrial calcium uniporter, MCU) 是新近鉴定的位于线粒体内膜的特异性钙离子通道,具有对钌红(ruthenium red, RR)敏感、可顺电化学梯度摄入Ca2+等特点[3]。胞内持续的钙离子浓度升高可能会导致严重的细胞事件[4],引起细胞异常的代谢活动,最终导致细胞死亡[5-6]。氧自由基的参与是AP发病机制的重要环节,线粒体钙信号可作为机体氧化信号的调节器[7]。强化抗氧化效应时可以改善AP 的严重程度[8],沉默信息调节因子3(silent information regulator 3, SIRT3)可通过多种途径抑制机体生成活性氧(reactive oxygen species, ROS)[9]。DONG 等[10]研究发现,线粒体腔内的ROS 可以作为MCU 半胱氨酸97 敏感的信号源,促进MCU 高阶低聚物形成,持续激活MCU 通道。本研究旨在探讨抑制MCU、减轻线粒体钙超载对AP 胰腺病理损伤和氧化应激的影响。
1 材料与方法
1.1 实验动物
雄性Sprague-Dawley(SD)大鼠8~12 周龄、体重210~250 g,购于广西医科大学实验动物中心,实验动物生产许可证号:SCXK(桂)2020-003,实验动物使用许可证号:SYXK(桂)2020-0004。大鼠在20~25℃空调房内饲养,通风良好,鼠笼定期清洁,自由进食、饮水。根据不同研究方法分为对照组、AP 组、AP+RR 组、RR 组,每组8 只。本研究经医院医学伦理委员会批准同意(No:2019-KY- 国基-017)。
1.2 主要试剂
雨蛙肽(上海Amquar 公司),Ⅳ型胶原酶、RR(美国Sigma公司),白细胞介素6(Interleukin-6,IL-6)酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)试剂盒(武汉华美生物科技有限公司),丙二醛(Malondialdehyde, MDA)、还原型谷胱甘肽(Glutathione, GSH)检测试剂盒(南京建成生物工程研究所有限公司),DHE 荧光探针(北京普利莱公司),Fluo-4 AM Ca2+(美国Thermo Fisher 公司)、Rhod-2 AM Ca2+荧光探针(美国Invitrogen 公司),βactin、MCU、SIRT3 兔源单克隆抗体、羊抗兔二抗(美国CST 公司),MnSOD 抗体(英国Abcam 公司)。
1.3 主要仪器
红外线扫膜仪(美国Licor 公司),显微镜(日本Olympus 株式会社),多功能酶标仪(美国Thermo Fisher 公司),7600-120 型自动生化分析仪(日本HITACHI 株式会社),高速冷冻离心机(德国Eppendorf 公司)。
1.4 方法
1.4.1AP诱导大鼠禁食12 h,称体重。对照组大鼠注射2.5 mg/kg 生理盐水,AP 组大鼠腹腔注射50 μg/kg 雨蛙肽,每次间隔1 h,注射7 次,复制AP 模型;AP+ RR 干预组大鼠腹腔注射2.5 mg/kg RR,20 min 后腹腔注射50 μ g/kg 雨蛙肽,RR 组大鼠注射等量2.5 mg/kg RR。
1.4.2血清淀粉酶(Amylase, Amy)、脂肪酶(Lipase)活性和IL-6表达量测定最后1 次注射雨蛙肽结束开始计时。模型复制24 h 后于大鼠腹主动脉穿刺取血,4℃静置30 min,3 500 r/min 离心10 min,取适量上清液,送至广西医科大学第一附属医院检验科检测血清Amy、Lipase 活性;采用ELISA 试剂盒检测血清IL-6 表达量,在多功能酶标仪450 nm 处读取吸光度值。
1.4.3胰腺组织病理学评分模型复制24 h 后留取大鼠胰腺组织,在4%多聚甲醛中固定24 h,脱水,石蜡包埋。选取包埋组织4 μm 厚切片,苏木精-伊红(hematoxylin-eosin, HE)染色。显微镜下观察每张样本切片的5 个视野(×200)并评分,并取平均值,最终得分是每个病理参数的总和。胰腺组织病理学评分标准[11]见表1。
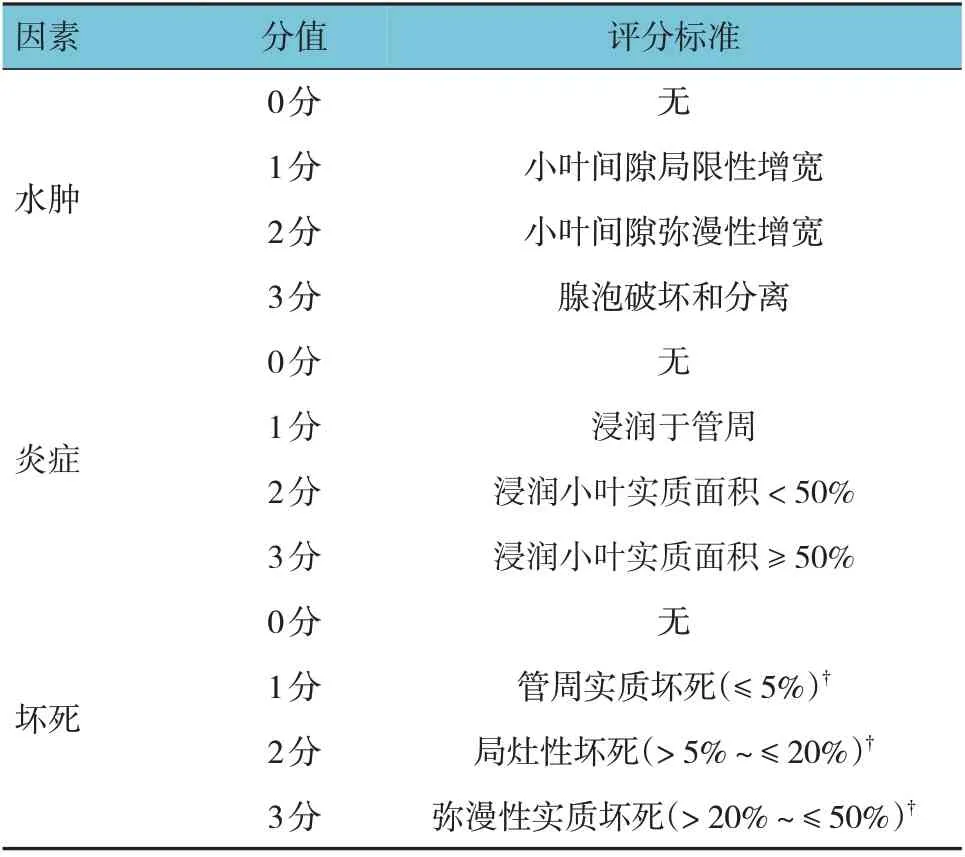
表1 胰腺组织病理学评分标准
1.4.4胰腺腺泡细胞线粒体超微结构观察取2 mm×2 mm×2 mm 主胰管组织,戊二醛中避光固定>2 h,固定、脱水、渗透、包埋、切片、染色,电镜(×2 500、×8 000)下随机拍摄。
1.4.5腺泡细胞的提取及单细胞悬液的制备仔细切取主胰管周围胰腺组织,大小约2 mm×2 mm×2 mm,剪碎,37℃环境下与1 mg/mL Ⅳ型胶原酶孵育15~30 min 后终止消化,用70 μm、40 μm 细胞过滤器过滤,1 000 r/min 离心5 min,杜氏磷酸盐缓冲液(D-PBS)洗2、3 次后重悬。
1.4.6腺泡细胞线粒体内Ca2+、细胞内游离Ca2+、ROS 浓度检测1 mL 腺泡单细胞悬液分别加入5 μmol/L Rhod-2 AM 和5 μmol/L Fluo-4 AM Ca2+探针工作液,按2∶3 体积在37℃黑暗中孵育30 min;1 mL 腺泡单细胞悬液和DHE 荧光探针按1 000∶1体积混匀,37℃避光孵育20 min。用D-PBS洗2、3 次后重悬,吸取500~800 μL 至35 mm×10 mm 细胞培养皿内,倒置荧光显微镜下观察线粒体内Ca2+、细胞内游离Ca2+、ROS 浓度,曝光时间分别为32 ms、195 ms、32 ms。每个实验重复3 次。
1.4.7胰腺组织GSH、MDA 含量的测定托盘天平称取适量胰腺组织,胰腺组织与冰生理盐水按重量(g)与体积(mL)1∶9 混合,冰浴后充分研磨,超声裂解5 s,制成组织匀浆,4 000 r/min离心5 min,取上清液,按GSH、MDA 试剂盒说明书测定。
1.4.8Western blotting 检测胰腺组织MCU、MnSOD、SIRT3 蛋白表达将蛋白样品与5×上样缓冲液(4∶1)混匀,煮沸5~10 min 备用。一抗稀释浓度为1∶1 000,荧光二抗稀释浓度为1∶10 000。转膜条件:150 mA,1 h。每个实验重复3 次。
1.5 统计学方法
数据分析采用SPSS 17.0 和GraphPad Prism 6.0统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠胰腺组织病理评分和血清Amy、Lipase、IL-6水平比较
各组大鼠胰腺HE 评分和血清Amy、Lipase、IL-6 水平比较,经方差分析,差异有统计学意义(P<0.05),AP 组较对照组高(P<0.05),对照组与RR 组比较,差异无统计学意义(P>0.05),AP+RR干预组与AP 组比较,差异无统计学意义(P>0.05)。血清Amy、Lipase、IL-6 水平和组织学变化表明AP 模型复制成功。见图1 和表2。
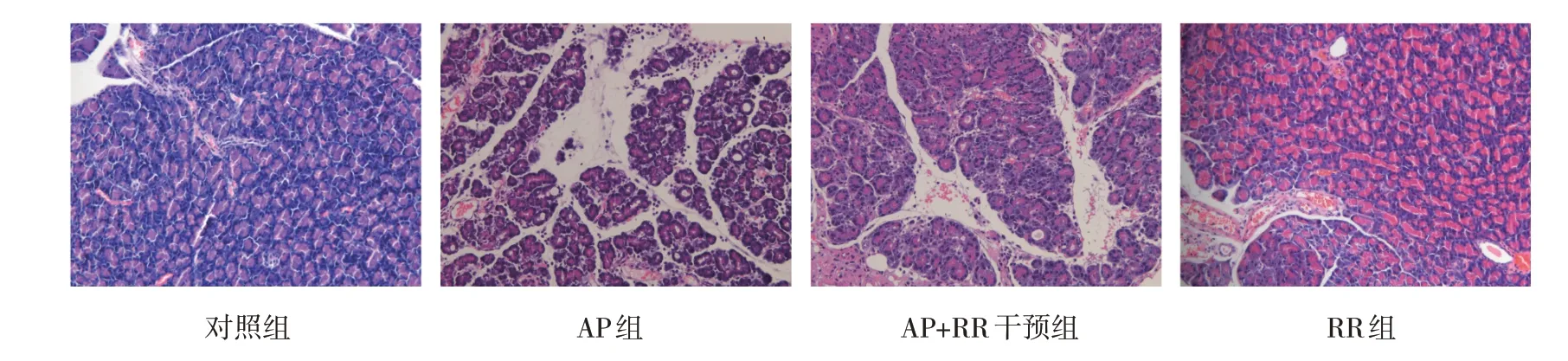
图1 各组大鼠胰腺组织HE染色情况 (×200)
表2 各组大鼠胰腺组织病理评分和血清Amy、Lipase、IL-6比较 (n=8,±s)
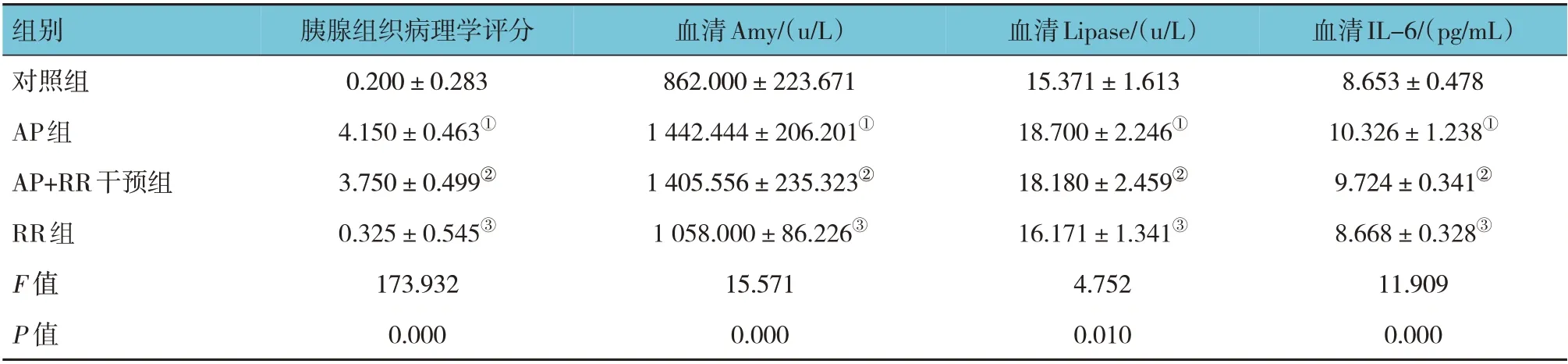
表2 各组大鼠胰腺组织病理评分和血清Amy、Lipase、IL-6比较 (n=8,±s)
注:①与对照组比较,P <0.05;②与AP组比较,P >0.05;③与对照组比较,P >0.05。
组别对照组AP组AP+RR干预组RR组F 值P 值血清IL-6/(pg/mL)8.653±0.478 10.326±1.238①9.724±0.341②8.668±0.328③11.909 0.000胰腺组织病理学评分0.200±0.283 4.150±0.463①3.750±0.499②0.325±0.545③173.932 0.000血清Amy/(u/L)862.000±223.671 1 442.444±206.201①1 405.556±235.323②1 058.000±86.226③15.571 0.000血清Lipase/(u/L)15.371±1.613 18.700±2.246①18.180±2.459②16.171±1.341③4.752 0.010
2.2 各组大鼠胰腺腺泡细胞超微结构
对照组、RR 组腺泡细胞整体结构尚可。AP 组腺泡细胞中度水肿,胞内局部电子密度减低,部分细胞器空泡变。细胞核呈不规则形,局部凹陷严重,异染色质边集,提示细胞凋亡,核仁较大;线粒体中度肿胀、基质变淡、嵴断裂、减少,少量严重者膜破损、基质外溢。AP+RR 组上述变化较AP 组减轻,腺泡细胞轻微水肿,细胞核偶见异染色质边集,核膜完整;线粒体轻微肿胀,形状、大小尚可,外膜模糊,嵴存在;余细胞器结构尚可。见图2。
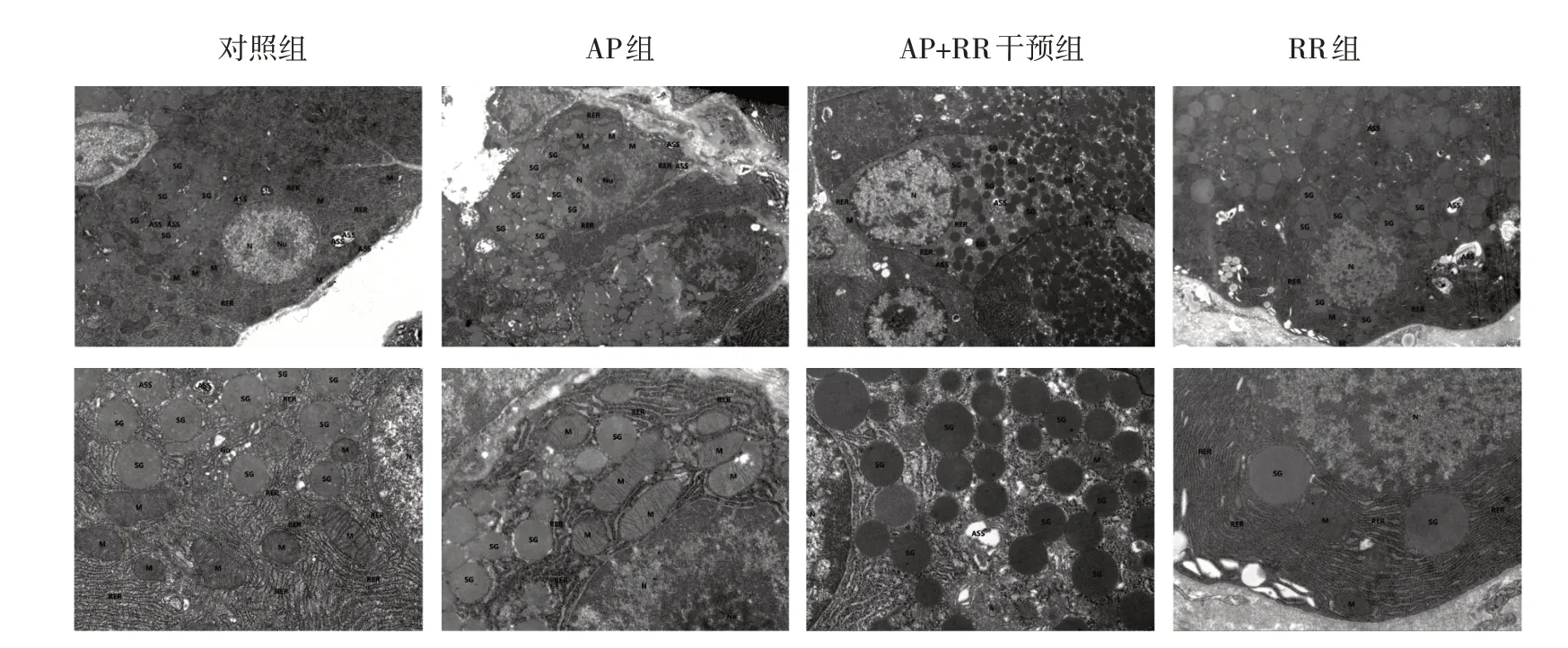
图2 各组大鼠腺泡细胞超微结构的变化 (×8000)
2.3 各组大鼠MCU相对表达量,线粒体内Ca2+、细胞内游离Ca2+浓度比较
各组大鼠MCU 相对表达量,线粒体内Ca2+、细胞内游离Ca2+浓度比较,经方差分析,差异有统计学意义(P<0.05),AP 组高于对照组、RR 组(P<0.05),AP+RR 干预组低于AP 组(P<0.05)。见图3~5 和表3。
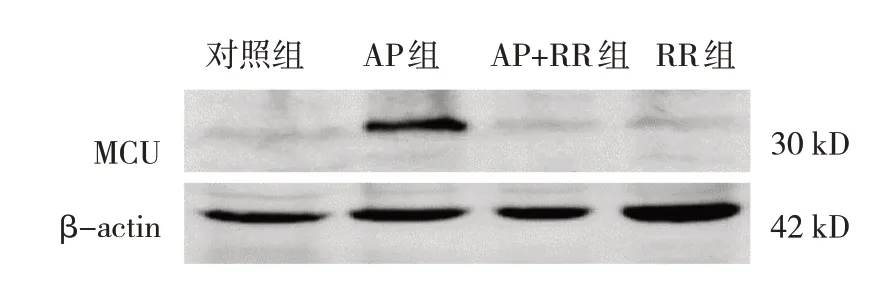
图3 各组大鼠胰腺组织MCU蛋白的表达
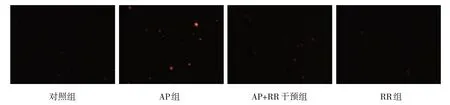
图4 各组大鼠胰腺腺泡细胞线粒体内Ca2+荧光强度变化 (×200)
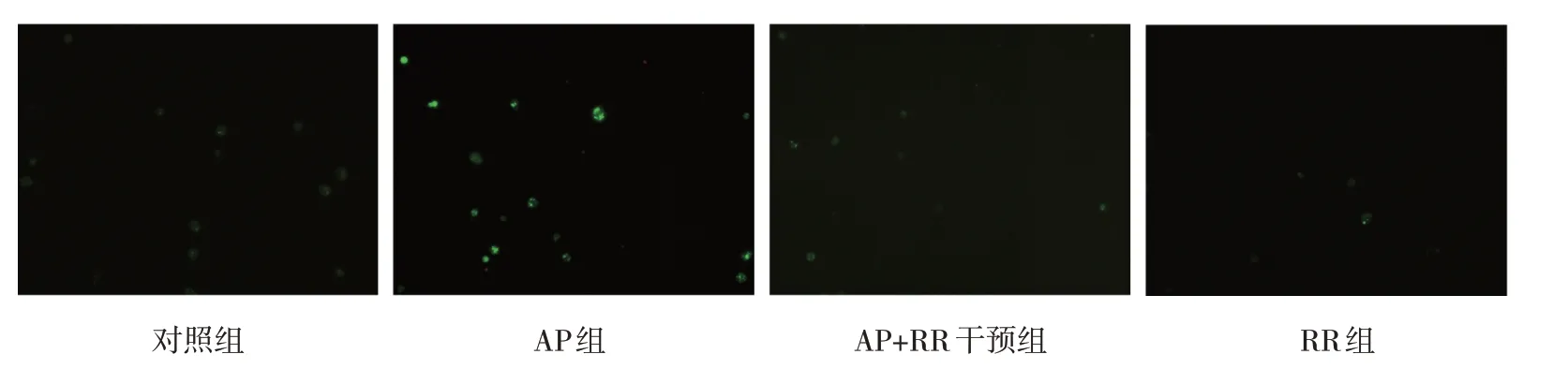
图5 各组大鼠腺泡细胞内游离Ca2+荧光强度变化 (×200)
表3 各组大鼠MCU相对表达量,线粒体内Ca2+、胞内游离Ca2+浓度比较 (n=8,±s)
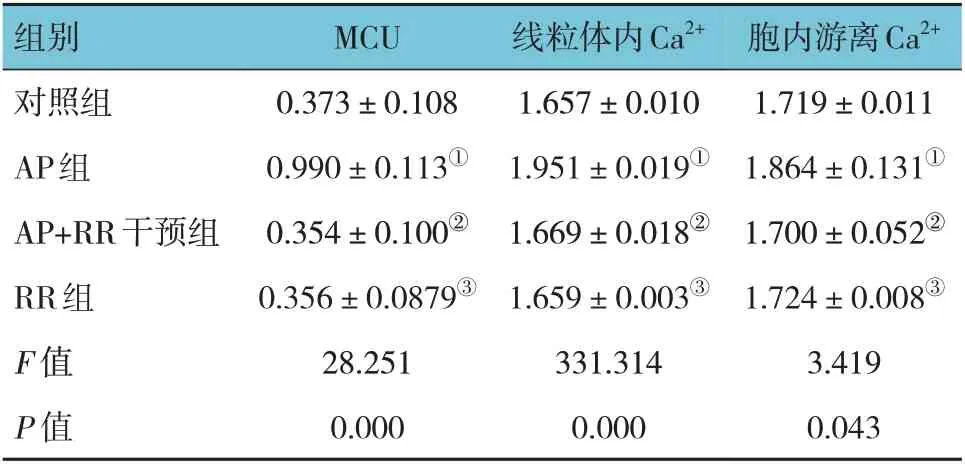
表3 各组大鼠MCU相对表达量,线粒体内Ca2+、胞内游离Ca2+浓度比较 (n=8,±s)
注:①与对照组比较,P <0.05;②与AP 组比较,P <0.05;③与对照组比较,P >0.05。
胞内游离Ca2+1.719±0.011 1.864±0.131①1.700±0.052②1.724±0.008③3.419 0.043组别对照组AP组AP+RR干预组RR组F 值P 值MCU 0.373±0.108 0.990±0.113①0.354±0.100②0.356±0.0879③28.251 0.000线粒体内Ca2+1.657±0.010 1.951±0.019①1.669±0.018②1.659±0.003③331.314 0.000
2.4 各组大鼠胰腺组织MnSOD、SIRT3 表达量,GSH、MDA含量和ROS荧光强度比较
各组大鼠胰腺组织MnSOD、SIRT3 表达量,GSH、MDA 含量和ROS 荧光强度比较,经方差分析,差异有统计学意义(P<0.05),AP 组MnSOD、SIRT3、GSH 低于对照组(P<0.05),ROS、MDA 高于对照组(P<0.05),AP+RR 干预组ROS、MDA 低于AP 组(P<0.05),MnSOD、SIRT3、GSH 高于AP 组(P<0.05)。见表4 和图6~7。
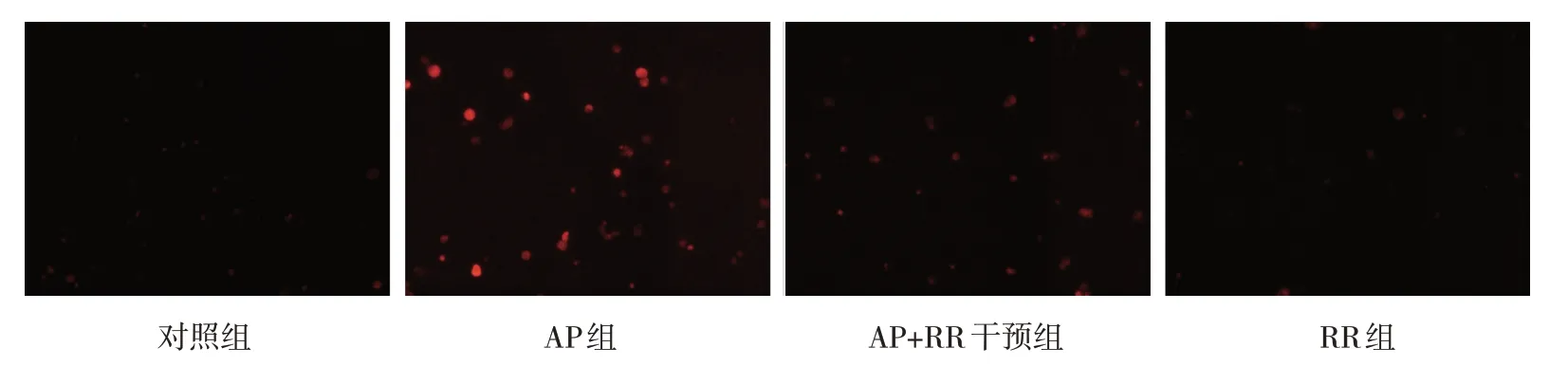
图6 各组大鼠腺泡细胞ROS荧光强度变化 (×200)
表4 各组大鼠胰腺组织MnSOD、SIRT3表达量,GSH、MDA含量和ROS荧光强度比较 (n=8,±s)
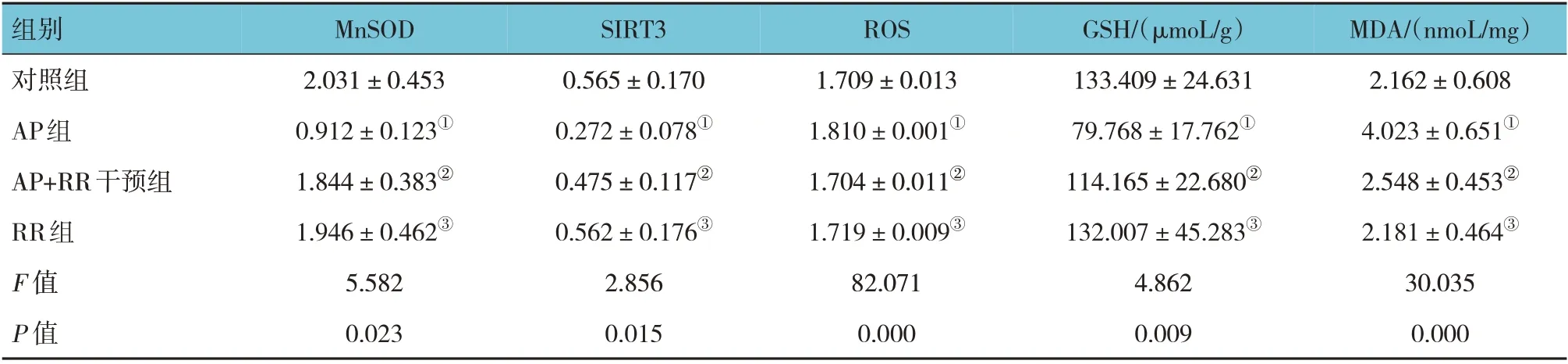
表4 各组大鼠胰腺组织MnSOD、SIRT3表达量,GSH、MDA含量和ROS荧光强度比较 (n=8,±s)
注:①与对照组比较,P <0.05;②与AP组比较,P <0.05;③与对照组比较,P >0.05。
组别对照组AP组AP+RR干预组RR组F 值P 值MDA/(nmoL/mg)2.162±0.608 4.023±0.651①2.548±0.453②2.181±0.464③30.035 0.000 MnSOD 2.031±0.453 0.912±0.123①1.844±0.383②1.946±0.462③5.582 0.023 SIRT3 0.565±0.170 0.272±0.078①0.475±0.117②0.562±0.176③2.856 0.015 ROS 1.709±0.013 1.810±0.001①1.704±0.011②1.719±0.009③82.071 0.000 GSH/(μmoL/g)133.409±24.631 79.768±17.762①114.165±22.680②132.007±45.283③4.862 0.009
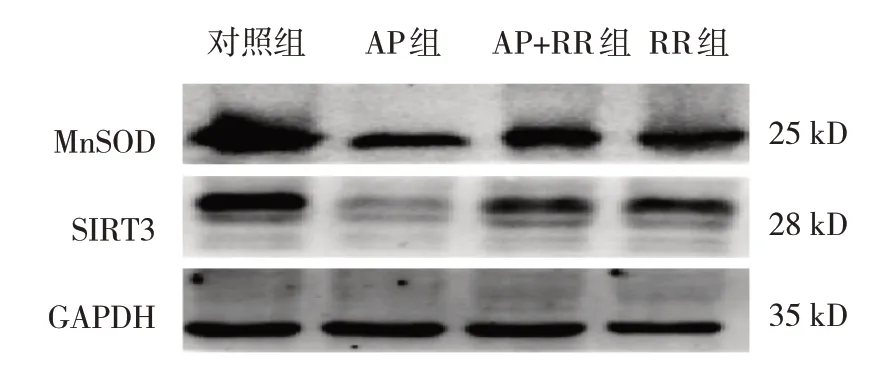
图7 各组大鼠胰腺组织MnSOD、SIRT3蛋白的表达
3 讨论
MCU 参与了多项生物学作用,其中在神经系统、心血管系统和肿瘤性疾病研究较多[12-15]。MCU通过Calpain/OPA-1 等通路,影响线粒体通透性转换及稳态和线粒体分裂/融合的平衡,促进细胞凋亡,参与小鼠模型心肌缺血再灌注损伤和创伤性脑损伤[16-18];MCU 上调线粒体Ca2+摄取,通过抑制NAD+/SIRT3/SOD2 通路和ROS 激活的c-jun 氨基末端激酶途径,促进基质金属蛋白酶-2 的活性[19]。激活ROS/NF-κB 信号,抑制转录因子A-线粒体磷酸化促进线粒体的生物发生[20],促进肿瘤细胞的转移和体内外生长。线粒体是经MCU 运输的钙离子的接收器,线粒体钙离子信号异常会导致线粒体形态完整性发生变化。AP 起病过程中,腺泡细胞钙离子内流和氧化应激反应增强,线粒体形态以及结构的异常。而应用MCU 的抑制剂RR 后,可观察到腺泡细胞超微结构损害减轻,钙内流减弱,抗氧化效应增强。这为AP 钙超载、线粒体损伤、氧化应激提供了生化指标和形态学证据。
Western blotting 和荧光探针结果表明,在雨蛙肽诱导的AP 大鼠中,MCU 介导的氧化应激损伤导致氧化指标ROS 和MDA 水平上升,氧化保护因子MnSOD、GSH 水平下降。有趣的是,SIRT3 在MCU 介导的氧化应激损伤中也呈低表达,而当MCU 的作用被RR 抑制后,氧化应激水平下降,SIRT3 的蛋白表达水平上升,这提示SIRT3 可能是AP 氧化应激损伤的保护因素,MCU 的激活可能抑制了SIRT3 介导的相关通路,诱发氧化应激。MCU 的活化可以抑制肝癌细胞中的NAD+/SIRT3/SOD2 通路,促进肝癌细胞产生ROS,增强肝癌细胞的体外侵袭和迁移能力[17],表明SIRT3 的活化可能抑制MCU 介导的ROS 水平,从而抑制氧化应激的发生、发展,与本研究结果相符。SIRT3 可能是治疗AP 氧化应激损伤的关键靶点。
不幸的是,抑制MCU 无法改善AP 的病理严重程度。这一结果与CHVANOV 等[21]结果是一致的。研究表明,线粒体钙超载并不是AP 诱导剂引起的唯一损伤效应,其可能仅参与腺泡细胞损伤和AP 启动的部分过程。即使是在MCU/CYD-D双基因敲除小鼠中,MCU基因完全缺失,实验动物的脑线粒体仍能摄取Ca2+[17]。DIA 等[22]发现,16 周的高脂肪高蔗糖(high-fat high-sucrose diet, HFHSD)喂养的小鼠出现胰岛素抵抗、糖尿病心肌病,在HFHSD 心肌细胞中观察到IP3R/Grp75/VDAC 钙通道复合体减少,IP3 刺激钙向线粒体的转运减少,但是MCU 及其调节亚基MICU1 并未参与到线粒体钙离子紊乱这一过程中,HFHSD 心肌细胞线粒体钙摄取减少主要是由于网状-线粒体功能性钙耦联减少所致。本研究发现抑制MCU 可能通过SIRT3/MnSOD 通路来抑制早期胰腺炎的氧化应激反应,但同样也显示了RR 并不能显著改善胰腺炎的病理严重程度。MCU 在AP 的发生、发展过程中的作用可能属于“微效”蛋白。然而在临床中,即使是轻症胰腺炎患者的恢复时间也需要1 周以上,AP 的临床治疗过程则更加漫长。有研究指出,在内皮细胞功能障碍中,高糖诱导的MCU相关的钙超载、凋亡和ROS 损伤的表现呈剂量和时间依赖性[23],RR 在AP 的治疗后期仍有巨大的潜在价值。

