木瓜苷对AA大鼠抗炎干预及细胞因子表达影响
周炜津 杨提昆 王亿童 刘江涛 潘晓阳 赵雨鑫 王慧




【摘要】 目的:研究木瓜苷(glucosides of chaenomeles speciosa,GCS)对佐剂型关节炎(adjuvant arthritis,AA)大鼠的抗炎效果及对细胞因子表达的影响。方法:将40只雄性SD大鼠随机分为正常组(8只)和造模组(32只),造模组建立AA大鼠模型。将造模成功的AA大鼠随机分为模型组、GCS低、中、高剂量组,每组8只。在实验第14天,对GCS低、中、高剂量组(30、90、120 mg/kg)AA大鼠连续灌胃给药21 d。测定大鼠关节肿胀程度、关节炎炎症评分、脾脏分数和胸腺分数,HE染色观察各组大鼠关节滑膜组织病理变化情况;采用酶联免疫吸附测定(ELISA)检測血清白细胞介素-1(IL-1)、白细胞介素-10(IL-10)、前列腺素E2(PGE2)及肿瘤坏死因子-α(TNF-α)。结果:与正常组相比,在实验第14天,模型组AA大鼠关节炎炎症评分显著升高(P<0.05);在实验第35天,模型组AA大鼠关节肿胀程度明显,可见一定程度畸形,脾脏分数、胸腺分数、血清IL-1、PGE2、TNF-α水平均显著升高,IL-10水平显著降低(P<0.05)。与模型组相比,在实验第35天,GCS各治疗组AA大鼠关节肿胀程度均有不同程度的降低,关节炎炎症评分、胸腺分数、脾脏分数、血清IL-1、PGE2、TNF-α水平均显著降低,IL-10水平均显著升高(P<0.05);GCS中、高剂量组AA大鼠关节滑膜组织可观察到滑膜组织增生、大量炎性细胞浸润等炎症病理变化均有所改善。结论:GCS具有一定的抗炎效果,可以有效地治疗佐剂型关节炎大鼠所出现的临床症状,减轻大鼠关节肿胀和关节炎的炎症程度。该机制可能是调节促炎-抗炎因子平衡状态,改善机体内细胞因子的紊乱状态,减慢炎症的进展。
【关键词】 木瓜苷 AA大鼠 IL-1 TNF-α PGE2
Effects of Glucosides of Chaenomeles Speciosa on Anti-inflammatory Intervention and Cytokine Expression in AA Rats/ZHOU Weijin, YANG Tikun, WANG Yitong, LIU Jiangtao, PAN Xiaoyang, ZHAO Yuxin, WANG Hui. //Medical Innovation of China, 2022, 19(16): 034-039
[Abstract] Objective: To investigate the glucosides of chaenomeles speciosa (GCS) on anti-inflammatory effect and cytokine expression in adjuvant arthritis (AA) rats. Method: A total of 40 male SD rats were randomly divided into normal group (n=8) and model group (n=32), AA rat model was established in model group. AA rats with successful modeling were randomly divided into model group and GCS low, medium and high-dose groups, 8 rats in each group. On the 14th day of experiment, AA rats in GCS low-dose, medium-dose and high-dose groups (30, 90 and 120 mg/kg) were intragastric for 21 d. The degree of joint swelling, arthritis inflammation score, spleen score and thymus score of rats were determined, HE staining was used to observe the histopathological changes of synovium in each group; the serum interleukin-1 (IL-1), interleukin-10 (IL-10), rostaglandin E2 (PGE2) and tumor necrosis factor-α (TNF-α) were determined by enzyme-linked immunosorbent assay (ELISA). Result: Compared with the normal group, the arthritis score of AA rats in the model group increased significantly on the 14th day of the experiment (P<0.05). On the 35th day of the experiment, the joint swelling degree of AA rats in the model group was obvious, and a certain degree of deformity was observed, including spleen fraction, thymus fraction and serum IL-1, PGE2, and TNF-α levels were significantly increased, and the IL-10 level was significantly decreased (P<0.05). Compared with the model group, on the 35th day of the experiment, the degree of joint swelling of AA rats in each treatment group of GCS decreased in varying degrees, including arthritis score, spleen fraction, thymus fraction and serum IL-1, PGE2, and TNF-α levels were significantly decreased, and the IL-10 levels were significantly increased (P<0.05). The synovial tissue of AA rats in the medium and high dose groups of GCS could observe that the inflammatory pathological changes such as synovial tissue proliferation and a large number of inflammatory cell infiltration were improved. Conclusion: GCS has a certain anti-inflammatory effect, and it can effectively treat the clinical symptoms of adjuvant arthritis rats, reduce joint swelling and inflammation degree of arthritis. This mechanism may be to regulate the balance state of pro-inflammatory and anti-inflammatory regulatory network, improve the disorder of cytokines in body, and slow down the progress of inflammation.
[Key words] Glucosides of chaenomeles speciosa AA rats IL-1 TNF-α PGE2
First-author’s address: Qiqihar Medical College, Qiqihar 161006, China
doi:10.3969/j.issn.1674-4985.2022.16.008
类风湿关节炎(rheumatoid arthritis,RA)是一种病因未明的慢性、全身性自身免疫性疾病,其临床表现以侵蚀性、对称性多关节炎为主[1]。病理变化为关节滑膜组织的慢性炎症、血管翳形成,关节软骨及其组织被逐渐损伤,最终导致关节畸形和功能丧失[2]。流行病学资料显示,RA可发生于任何年龄,女性患者2~3倍于男性[3],在我国拥有较高的发病率和致残率,发病率为0.32%~0.36%[4]。近年来,已有临床资料显示中医药对RA具有一定的疗效,同时又可以有效地减轻西药的毒副作用,具有高效性、低毒性、多途径等特点[5],适宜长期服用。木瓜为蔷薇科植物贴梗海棠Chaenomeles speciosa (sweet) Nakai的干燥近成熟果实,具有舒筋活络、祛湿除痹的功效[6]。目前,已有实验研究表明木瓜提取物--木瓜苷对RA的治疗效果较为显著[7-8]。本实验以佐剂型关节炎(adjuvant arthritis,AA)大鼠模型为实验对象,通过灌胃木瓜苷给药治疗,观察不同剂量的木瓜苷干预AA大鼠后,炎性细胞因子的变化情况,旨在进一步探究木瓜苷对AA大鼠的治疗效果,同时为木瓜苷的药用价值和RA疾病的治疗提供更广泛的临床依据。现报道如下。
1 材料与方法
1.1 动物 SD大鼠,雄性,体重(270±25)g,由辽宁长生生物技术股份有限公司提供(普通级),实验动物许可证:SCXK(辽)2020-0001。饲养于齐齐哈尔医学院实验动物中心。动物饲养于普通的鼠笼中,每笼8只,自由进食,饮自来水,喂标准的颗粒饲料,每天更换垫料,保持室内温度16~20 ℃,相对湿度55%,自然光照,常规饲养观察一周后使用。
1.2 药物及试剂 木瓜苷(glucosides of chaenomeles speciosa,GCS)为粉末状药物,由宣木瓜经乙醇加热浸泡,回流提取,冷却滤过,再次回流提取滤液,由齐齐哈尔医学院药学院临床药理研究所自制提供。完全费氏佐剂(生产厂家:碧云天生物科技有限公司,批号:072220201030,规格:50 mL);白介素-1(IL-1)、白介素-10(IL-10)、前列腺素E2(PGE2)及肿瘤坏死因子-α(TNF-α)采用酶联免疫吸附检测(ELISA)试剂盒(生产厂家:合肥莱尔生物科技有限公司,批号:LE-B0372,LE-B0415,LE-B0748,LE-B0126,规格:96T)检测。
1.3 仪器 HH-2数显恒温水浴锅购自金坛区白塔金昌实验仪器厂;移液枪购自爱来宝(济南)医疗科技有限公司;H4-20KR台式高速冷冻离心机购自苏州威尔实验用品有限公司;JD-SY96A酶标仪购自山东竞道光电科技有限公司;ES500-2B电子天平购自河南爱博特科技发展有限公司。
1.4 方法
1.4.1 AA大鼠模型制备 将40只SD雄性大鼠随机分为正常组(8只)和造模组(32只)。造模组建立AA大鼠模型,造模方法参考文献[9]中的方法,分别在大鼠的右后足足跖皮内注射含卡介苗的完全费氏佐剂(Complete Freund’s adjuvant,CFA)0.1 mL。正常组大鼠在相同部位注射生理盐水0.1 mL,参考文献[10],采用0~4级评分法对大鼠四肢的病变程度进行评分并累计积分,每只大鼠的最高炎症评分为16分,当炎症评分大于2分时,即为造模成功。0~4级评分法:0分,关节正常无红肿;1分,皮肤或脚趾关节轻度红肿;2分,皮肤和脚趾关节中度红肿;3分,跖关节至脚趾重度红肿,但还可以弯曲和行走;4分,踝或腕关节严重红肿,不能弯曲和行走,即发生残疾。
1.4.2 动物分组及给药方案 在实验第14天,将造模成功的32只AA大鼠按照随机分配法分为4组,分别为模型组和GCS低、中、高剂量组,每组8只。GCS低、中、高剂量组分别灌注胃木瓜苷30、90、120 mg/kg,正常组及模型组灌胃等体积的生理盐水,连续给药21 d。
1.5 观察指标
1.5.1 大鼠关节肿胀程度及关节炎炎症评分 从实验开始后,每7天对大鼠四肢进行一次观察,记录关节肿胀程度并进行关节炎炎症评分,评分方法参考文献[10-11]。
1.5.2 大鼠体重测定和采集标本 从实验开始后,每7天对大鼠进行一次体重测定。末次灌胃给药24 h后,对AA大鼠进行取材,用10%水合氯醛腹腔注射进行麻醉,取出脾脏、胸腺和关节滑膜组织。
1.5.3 胸腺分数和脾脏分数的测定 在实验第35天,分别对模型组、GCS低、中、高剂量组AA大鼠胸腺、脾脏进行称量测重。分别称量取出的脾脏和胸腺,计算其相对应的脾脏分数和胸腺分数。胸腺分数=大鼠的胸腺质量/大鼠的体重×100%;脾脏分数=大鼠的脾脏质量/大鼠的体重×100%。
1.5.4 关节滑膜组织的病理学改变 在实验第35天,对正常组、模型组、GCS低、中、高剂量组AA大鼠关节组织进行病理组织形态学观察。将取出的关节滑膜组织用4%甲醛固定,进行脱钙处理后纵向切开,石蜡包埋,蜡块定型后制作切片,随后按照苏木精-伊红(HE)染色方法操作,显微镜下观察组织学病理变化。
1.5.5 ELISA檢测血清中细胞因子变化 在实验第35天,分别对模型组、GCS低、中、高剂量组AA大鼠血清中IL-1、PGE2、TNF-α、IL-10进行测定。腹主动脉取血后,将血液3 000 r/min离心10 min,迅速小心地分离血清和红细胞,静置后取出血清。按照试剂盒的操作步骤,检测血清中IL-1、PGE2、TNF-α及IL-10的含量,用酶标仪在450 nm波长处测量吸光度值(OD值)。
1.6 统计学处理 采用SPSS 22.0软件对所得数据进行统计分析,计量资料用(x±s)表示,两组间比较采用独立样本t检验,多组间比较采用方差分析;计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
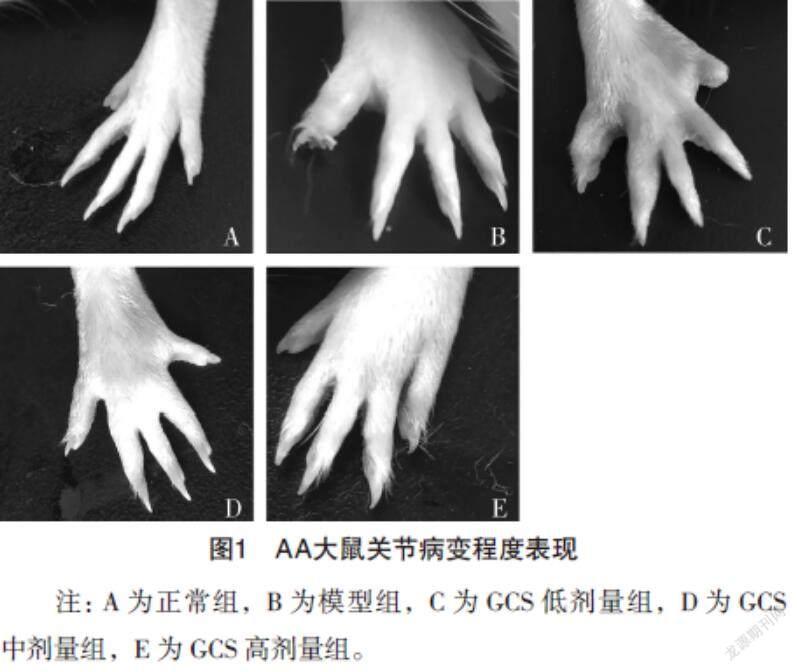
2.1 木瓜苷对AA大鼠关节肿胀程度和关节炎炎症评分的影响 实验第14、21、28、35天,五组关节炎炎症评分比较,差异均有统计学意义(P<0.05);在实验第14天,与正常组相比,模型组和GCS低、中、高剂量组AA大鼠关节炎炎症评分显著增加(P<0.05);在实验第21、28、35天,与模型组相比,GCS低、中、高剂量组AA大鼠给予不同浓度GCS治疗后,关节炎炎症评分显著降低(P<0.05)。见表1。在实验第35天,对各组AA大鼠的关节肿胀程度进行观察:与正常组相比,模型组AA大鼠关节肿胀程度明显,末端小关节处可见一定程度畸形;与模型组相比,GCS低、中、高剂量组AA大鼠关节肿胀程度均有不同程度的降低。见图1。
2.2 木瓜苷对脾脏分数和胸腺分数的影响 五组胸腺分数和脾脏分数比较,差异均有统计学意义(P<0.05);与正常组相比,模型组AA大鼠免疫器官胸腺和脾脏明显肿大,脾脏分数和胸腺分数显著升高(P<0.05);与模型组相比,GCS低、中、高剂量组AA大鼠胸腺分数和脾脏分数均有不同程度降低(P<0.05)。见表2。
2.3 木瓜苷对AA大鼠血清炎症因子水平的影响 五组血清各炎症因子比较,差异均有统计学意义(P<0.05);与正常组相比,模型组血清IL-1、PGE2和TNF-α水平显著升高,IL-10水平显著降低(P<0.05);与模型组相比,GCS低、中、高剂量组血清中IL-1、PGE2和TNF-α均显著降低,IL-10水平均显著升高(P<0.05)。见表3。
2.4 木瓜苷对AA大鼠关节滑膜组织的病理学改变 正常组大鼠滑膜组织未见增生,未见血管翳形成,软骨及其组织未发现损伤。模型组大鼠关节滑膜组织可见增生,伴有大量炎性细胞浸润,可见血管翳的形成,可损伤软骨及其组织。与模型组相比,GCS中、高剂量组可以显著改善出现的病理变化,抑制滑膜组织增生,减轻炎性细胞浸润,抑制血管翳的形成,减轻对软骨及其组织的损伤。见图2。
3 讨论
RA大多为慢性起病,以对称性指、腕、足等多关节肿痛为首发表现,常累及关节外的其他器官及血清类风湿性因子呈阳性,可导致关节畸形及功能丧失。
TNF-α主要由活化的单核-巨噬细胞产生,是引发炎症和关节破坏的主要细胞因子之一,在TNF转基因小鼠模型中TNF的系统性过度表达似乎足以引发慢性滑膜炎和软骨破坏,并在诱导细胞凋亡和其他过程中发挥重要作用[11-12]。IL-1主要由活化的单核-巨噬细胞产生,可以协同刺激APC和T细胞活化,促进B细胞增殖和分泌抗体,对关节软组织呈持续进行性损伤,这与RA的产生密切相关[13]。IL-10是一种多细胞源、多功能的细胞因子,作为抗炎因子可拮抗炎性介质,通过控制炎症反应而避免组织损伤,是公认的炎症与免疫抑制因子。PGE2是一种重要的细胞炎症因子,具有强烈的致炎致痛作用,是二十碳不饱和脂肪酸花生四烯酸在环氧化酶-2(COX-2)的环氧化活性及各种前列腺素合成酶的作用下代谢生成具有生物活性的前列腺素,是体内合成最广泛的前列腺素。PGE2的合成与COX-2密切相关,已有研究表明,在炎症反应过程中,COX-2的含量明显增高,促进PGE2的合成,进一步诱导炎性因子向炎症部位聚集趋化,同时增大毛细血管的通透性,促进炎性渗出,加快局部的炎症反应进程[14-16]。
本实验结果显示,在实验第14天,与正常组相比,模型组、GCS低、中、高剂量组AA大鼠关节炎炎症评分显著升高(P<0.05)。在实验第21、28、35天,与模型组相比,GCS低、中、高剂量组AA大鼠给予不同浓度GCS治疗后,关节炎炎症评分显著降低(P<0.05)。在实验第35天,与正常组相比,模型组AA大鼠关节肿胀程度明显,可见一定程度畸形,脾脏分数和胸腺分数显著升高(P<0.05);血清中IL-1、PGE2、TNF-α水平显著升高(P<0.05),IL-10水平显著降低(P<0.05);模型组AA大鼠关节滑膜组织在病理组织形态学下可观察到关节滑膜组织增生、大量炎性细胞浸润、血管翳的形成、软骨及其组织损伤等病理性变化,与文献[17]报道较为一致。在实验第35天,与模型组相比,GCS低、中、高剂量组AA大鼠关节肿胀程度均有不同程度的降低,胸腺分数和脾脏分数均有不同程度降低(P<0.05),血清中IL-1、PGE2、TNF-α显著降低,IL-10水平显著升高(P<0.05)。GCS中、高剂量组AA大鼠关节滑膜组织在病理组织形态学下可观察到炎性细胞浸润、滑膜组织增生、血管翳形成、关节软骨破坏等炎症病理变化均有所改善。木瓜苷的抗炎作用可能与抑制多种细胞中炎性介质的分泌有关,其中PGE2的含量变化最为显著,笔者做出推测:木瓜苷可能通过降低COX-2表达的下调节来减少PGE2的催化合成,抑制COX-2和其他炎症信号通路形成反馈循环,减轻关节炎炎症级联反应,以延缓减轻疾病的进展和发展。
滑膜组织增生主要是由于细胞增殖与细胞凋亡不平衡所导致的。大量促炎细胞因子被诱导产生,滑膜成纤维细胞中的MAP激酶被激活后,表现为逐级磷酸化,参与到细胞增殖与凋亡的过程中[18]。另一方面,已有研究表明,促炎细胞因子IL-1能抑制抗Fas抗体诱导的凋亡,因此,在炎症状态下由于滑膜细胞通过Fas/FasL通路发生凋亡,但这种凋亡过程可被促炎细胞因子抑制,最终引起滑膜细胞增生、关节破坏等病理变化[19]。
血管翳是RA病变过程中的特征性病理变化,是引起关节病变、软骨破坏的主要病因及病理基础。已有研究表明,當机体处于炎症状态时,巨噬细胞、淋巴细胞可分泌大量的TNF-α、IL-1,血管翳的形成主要受IL-1浓度的影响,当IL-1达到一定的浓度时,大量滑膜细胞聚集在关节软骨表面,促进血管翳的形成[20]。而TNF-α则可以诱导成纤维样滑膜细胞的增殖,促进血管翳的形成。TNF-α和IL-1能刺激滑膜细胞合成并分泌PGE2,这些促炎细胞因子可以上调胶原酶和基质金属蛋白酶的表达水平,导致软骨及其组织发生损伤[21]。
本次实验模型组AA大鼠镜下观察到的滑膜组织增生,大量炎性细胞浸润,形成血管翳等病理变化与RA镜下病理变化一致。经治疗后,GCS中、高剂量组AA大鼠镜下可见滑膜组织增生被抑制,炎性细胞浸润程度减轻,血管翳的形成被抑制,软骨及其组织的损伤减轻等病理变化,根据以往对AA大鼠的研究[22-23],同时结合本次实验的血清细胞因子研究结果,笔者做出推测其改变可能由于:GCS通过抑制滑膜炎时滑膜细胞释放促炎因子PGE2,降低毛细血管的通透性,减少炎性渗出,减轻炎症反应和软骨损伤;通过抑制促炎细胞因子TNF-α、IL-1的分泌,抑制滑膜组织增生和血管翳的形成。
综上所述,当机体有炎症反应等异常情况时,机体内促炎细胞因子(TNF-α、IL-1、PGE2等)和抗炎细胞因子(IL-4、IL-10等)之间的平衡状态被打破,促炎细胞因子被迅速诱导产生,大量促炎因子的产生使机体促炎-抗炎复杂有序的细胞因子平衡调节状态发生紊乱,进一步诱导局部及全身炎症反应,加快、加重对机体和组织的损伤。GCS可有效减轻模型组AA大鼠出现的炎症反应,其抗炎机制可能是通过降低IL-1、PGE2及TNF-α促炎因子含量,增加IL-10抗炎因子含量,从而改善机体内细胞因子的紊乱状态,恢复促炎-抗炎因子的平衡状态。因此,GCS是一种有待挖掘的抗RA药物,根据其消炎抗风湿的药理作用,有可能成为治疗类风湿关节炎的新型药物,需要进一步深入研究。
参考文献
[1]田杰祥,陶永明,王钢,等.中医药治疗类风湿关节炎滑膜炎的机理研究进展[J].中医药学报,2019,47(3):122-124.
[2]孙标,邓翠翠,王加,等.黄芩苷对大鼠类风湿性关节炎软骨损伤的影响[J].广州中医药大学学报,2021,38(7):1440-1446.
[3] JIN S Y,LI M T,FANG Y F,et al.Chinese Registry of rheumatoid arthritis(CREDIT):Ⅱ.prevalence and risk factors of major comorbidities in Chinese patients with rheumatoid arthritis[J].Arthritis Research & Therapy,2017,19(1)251-258:
[4] CONN D L,TILIAKOS A,BAO G,et al.Correction to:Effect of daily low dose prednisone, divided or single daily dose,in the treatment of African Americans with early rheumatoid arthritis[J].Springer London,2018,37(2):355-365.
[5]李蓉,寧乔怡,姚血明,等.中医药对类风湿关节炎滑膜细胞凋亡和增殖作用的研究进展[J].辽宁中医杂志,2017,44(4):868-870.
[6]国家药典委员会.中国人民共和国药典:一部[S].北京:中国医药科技出版社,2020:62-63.
[7]抗晶晶.木瓜苷抗炎作用研究进展[J].中国野生植物资源,2016,35(4):57-59,75.
[8]代琪,佘颖祺,叶俏波,等.中药木瓜和木瓜籽的化学成分及药理作用研究进展[J].亚太传统医药,2021,17(8):219-223.
[9]刘琪,张巧琳,陈晓芸,等.性别差异对大鼠佐剂性关节炎模型的影响[J].中国药理学通报,2020,36(9):1328-1332.
[10]余纳,蔡小燕,林小军,等.蒽贝素对大鼠胶原诱导性关节炎炎症评分及炎症细胞因子的影响[J].南昌大学学报(医学版),2016,56(4):19-22,64,107.
[11]高柳冰,杨荣志,高艳华,等.RA患者血清中TNF-α、IL-6、miR-155、PA及TGF-β1水平及临床意义[J].热带医学杂志,2020,20(12):1585-1588,1599.
[12]任云丽,张小丽.血清炎症因子在类风湿关节炎进展中的价值[J].中国老年学杂志,2021,41(19):4302-4305.
[13]武晔,王晓磊,姜淑华,等.银苓消肿丸对湿热痹阻型类风湿关节炎患者血清IL-1、IL-6、BlyS表达的影响[J].风湿病与关节炎,2017,6(6):21-24.
[14]朱洁宜,吴鑫宇,潘军英,等.乌腺金丝桃对佐剂性关节炎模型大鼠血清中IL-17、PGE2、MMP-9、IFN-γ含量的影响[J].中医药信息,2017,34(5):13-15.
[15]付聪敏,王敏,徐松涛,等.槐果碱的镇痛、抗炎作用及其对COX-2/PGE2信号通路的影响[J].中国药房,2019,30(13):1775-1780.
[16]蔡树焓.花椒新伤油剂对大鼠急性软组织损伤PGE2含量及COX-2、mPGES-1 mRNA基因表达的影响[D].成都:成都体育学院,2021.
[17]顾正位,冯帅,蒋海强,等.木瓜醇提物对大鼠类风湿性关节炎模型关节炎症及滑膜细胞凋亡的影响[J].中国实验方剂学杂志,2020,26(18):45-50.
[18]文建庭,刘健,王馨,等.新风胶囊通过调控lncRNA MAPKAPK5-AS1对类风湿关节炎滑膜成纤维细胞凋亡与炎症的影响[J/OL].中国中药杂志,2021,46(24):6542-6548.
[19] WANG X H,DAI C,WANG J,et al.Therapeutic effect of neohesperidin on TNF-α-stimulated human rheumatoid arthritis fibroblast-like synoviocytes[J].Chinese Journal of Natural Medicines,2021,19(10):741-749.
[20]孙标,邓翠翠,王加,等.黄芩苷对大鼠类风湿性关节炎软骨损伤的影响[J].广州中医药大学学报,2021,38(7):1440-1446.
[21]单兆亚,王波.右美托咪定调控急性痛风性关节炎模型大鼠血清炎性因子水平及滑膜功能效果研究[J].陕西医学杂志,2021,50(9):1052-1055.
[22]王海燕,覃慧林,张永峰,等.木瓜三萜对佐剂性关节炎大鼠关节滑膜组织中Akt、NF-κB和促炎因子的表达影响[J].中国实验方剂学杂志,2017,23(5):141-146.
[23]韩宇飞,高明利,刘东武.类风湿性关节炎的发病机制研究进展综述[J].中国卫生标准管理,2021,12(1):162-165.
(收稿日期:2021-12-02) (本文编辑:程旭然)

