PCV2感染对猪淋巴细胞NF-κB信号通路及炎性细胞因子表达的动态影响
董 林,王艳萍,唐 娜,徐倩倩,苗立中,王金良,沈志强* (.山东省滨州畜牧兽医研究院,山东 滨州 256600;2.山东绿都生物科技有限公司,山东 滨州 256600)
猪圆环病毒2型(porcine circovirus 2,PCV2)是已知最小的单股DNA病毒,病毒结构为闭合环状,无囊膜,是断奶仔猪多系统衰歇综合征(post weaning multi-systemic syndrone,PMWS)的主要病原[1]。PCV2主要浸染免疫系统,损伤免疫细胞,导致机体免疫抑制的发生,感染仔猪的淋巴结、脾脏、扁桃体、胸腺等免疫器官呈现淋巴细胞的缺失、减少和单核巨噬细胞的浸润为主要特征的病理变化[2]。现阶段对相关因子分泌的相互影响和动态变化规律研究鲜见报道,特别是调控细胞因子分泌的细胞间信号通路还未有明确报道[3]。
核因子κB(nuclear factor κB,NF-κB)是一类参与促进多种基因转录的多向性核转录因子,属于Rel蛋白家族,主要包括P50、P52、c-Rel、RelA(P65)、RelB共5个家族成员,广泛存在于真核细胞中,是体内介导炎症反应的重要通路[4]。NF-κB含有300个氨基酸组成的Rel同源结构域(Rel homology domain,RHD),RHD通过其DNA结合区、二聚体化区域及核定位序列与含有κB序列的DNA结合,与同源或异源亚单位形成二聚体或者与IκB抑制蛋白相互作用调节核定位[5]。当细胞受到刺激时,可诱导IκB磷酸化启动降解途径,使得NF-κB易位进入细胞核内与DNA结合,实现转录调节[6-7]。
本试验选取PCV2感染的体外培养仔猪淋巴细胞,研究PCV2作用时间与NF-κB激活途径和炎症细胞因子表达之间关系,探索NF-κB的激活机制及其对细胞因子的影响,以期为PCV2感染防制提供理论支撑。
1 材料与方法
1.1 病毒PCV2 LVDU株(含病毒105.5TCID50/mL),由山东绿都生物科技有限公司提供。
1.2 实验动物28日龄PCV2抗原、抗体双阴性健康易感仔猪10头,由山东滨州禾川林丰畜牧科技有限公司养殖场提供。
1.3 主要试剂与仪器RRPMI-1640培养基(R8758-500,Gibco公司);小牛血清(20200145,天津康源生物);核蛋白提取试剂盒、BCA蛋白检测试剂盒购自北京天根生物;NF-κB EMSA试剂盒,化学发光液为美国Millpore公司产品;兔抗NF-κB/P65单克隆抗体、鼠抗猪p-IκBα单克隆抗体购自美国Cell Signaling Technology公司;TRITC-羊抗兔酶标抗体购自中杉金桥有限公司。恒温恒湿CO2培养箱(Heracell 150i,Thermo公司);高速冷冻离心机(ST16R,Thermo公司);蛋白电泳仪为(Mini-Protean Tetra,BioRad公司);化学发光成像系统(Fusion Solo,法国Vilber公司);激光共聚焦显微镜(A1si+A1Rsi+,日本Nikon公司)。
1.4 体外脾淋巴细胞培养及PCV2接毒10头经检测PCV2抗原、抗体双阴性的28日龄仔猪,无菌采集、分离脾脏细胞。用RPMI-1640培养液重悬细胞并计数,调整单层细胞浓度到6×106个/mL,在容积为250 mL细胞培养瓶中加入25 mL 制备的细胞悬液,分为对照组和PCV2感染组。感染组每毫升细胞悬液加PCV2病毒悬液200 μL;对照组加等量培养液。放入CO2培养箱中于37℃条件下培养,培养0,6,12,24,48 h收取悬浮的淋巴细胞和上清液,每个时间点各取淋巴细胞2 mL用于激光共聚焦检测,其余液氮速冻后置-70℃ 保存备用。细胞上清液用ELISA试剂盒检测分泌的细胞因子IL-1β、TNF-α、IL-6、IL-10、IL-17和TGF-β1的含量。
1.5 激光共聚焦检测NF-κB核移位取不同时间培养的细胞,用0.01 mol/L PBS(pH7.2)洗涤3次后重悬,取100 μL加入经对聚赖氨酸处理凹玻片上,室温静置15 min,浸入4%的多聚甲醛固定10 min,用0.5%TritonX-10+PBS室温通透;再用PBS洗5次,5%小牛血清封闭30 min,加入NF-κB/P65一抗37℃孵育45 min;洗涤后加入荧光二抗37℃孵育30 min,洗涤后加入核染液Hoechst,室温孵育5 min,洗涤5次后加入淬火液,于激光共聚焦显微镜观察结果(波长560 nm)。
1.6 Western blot检测NF-κB/P65、p-IκB蛋白分别提取体外培养仔猪淋巴细胞核蛋白和胞质蛋白,操作按Pierce核蛋白提取试剂盒操作说明书进行。提取蛋白用BCA法测定蛋白浓度,置于-70℃冰箱保存备用。
1.7 NF-κB与核蛋白中DNA结合活性检测依据EMSA试剂盒说明书进行操作,提取核蛋白进行非变性SDS-PAGE电泳,转移NC膜上,紫外灯下交联10 min,化学发光法检测生物素标记的DNA,LNS-4000成像系统进行测量和分析。
1.8 ELISA检测细胞培养液中细胞因子分泌蛋白含量取不同时间细胞上清液,进行IL-1β、TNF-α、IL-6、IL-10、IL-17和TGF-β1含量检测。具体操作按照对应ELSIA试剂盒说明书进行。制作标准曲线,样品检测后于450 nm酶标仪读取D值,依据标准曲线,计算得出各D值对应的样品蛋白含量。

2 结果
2.1 PCV2对体外培养淋巴细胞NF-κB/P65蛋白核移位的影响激光共聚焦显微镜观测结果(图1)显示,PCV2感染后6 h可观测到明显的核内NF-κB/P65蛋白存在,淋巴细胞中随着PCV2感染时间的增加,NF-κB/P65入核易位呈现不断增强的趋势。对照组仅在24 h才能观测到部分淋巴细胞核内出现少量NF-κB/P65蛋白存在。

A.PCV2接种后0 h; B.PCV2接种后6 h;C.PCV2接种后12 h;D.PCV2接种后24 h;E.PCV2接种后48 h。细胞核染色呈蓝色,胞质NF-κB/P65蛋白染色呈红色,易位核内染色合成呈粉红色图1 PCV2感染对体外培养淋巴细胞NF-κB核易位影响
Western blot检测结果如图2,随着PCV2作用体外培养仔猪淋巴细胞时间的延长,细胞核中NF-κB/P65蛋白含量呈现逐渐增多, PCV2作用6 h试验组细胞核中NF-κB/P65含量显著高于对照组(P<0.05),随着作用时间增加,试验组和对照组细胞核内NF-κB/P65均呈现增强趋势,在随后观测时间段内,试验组细胞核内NF-κB/P65含量均显著高于对照组,其中24和48 h极显著高于对照组(P<0.01)。说明PCV2感染,可导致体外培养淋巴细胞中NF-κB/P65发生核易位,并呈现明显的“时间-效应”累增关系。

A.Western blot检测p-IκBα含量结果;B.p-IκBα蛋白相对表达量。**.与对照组差异极显著(P<0.01);*.与对照组差异显著(P<0.05)。下同图2 PCV2感染对体外培养淋巴细胞核内NF-κB/P65蛋白表达影响(n=10)
2.2 PCV2对细胞核中NF-κB与DNA结合率的影响PCV2对体外培养淋巴细胞核蛋白NF-κB与DNA结合率的EMSA法检测结果见图3。体外培养淋巴细胞在PCV2感染条件下,随着作用时间的增加,NF-κB与DNA结合率呈现逐渐升高趋势,12 h 开始PCV2攻毒组结合率显著高于对照组(P<0.05),其中24和48 h极显著高于对照组(P<0.01),说明PCV2能促进易位的NF-κB与DNA结合,且呈现“时间累积效应”。

A.NF-κB与DNA结合EMSA检测结果(D.NF-κB与DNA结合带;F.无结合带);B.DNA结合活性结果图3 PCV2感染对体外培养仔猪淋巴细胞核中NF-κB与DNA结合率的影响(n=10)
2.3 PCV2对体外培养仔猪淋巴细胞质中p-IκBα蛋白含量的影响Western blot对体外培养仔猪淋巴细胞中p-IκBα含量进行检测,结果见图4。随着PCV2感染作用时间的增加,淋巴细胞质中p-IκBα蛋白呈现稳定增加,从培养6 h开始,淋巴细胞质中p-IκBα含量明显高于对照组,24 h开始极显著高于对照组,显示PCV2具有明显的促进胞质内κB磷酸化的作用。

A.Western blot检测p-IκBα含量结果;B.p-IκBα蛋白相对表达量图4 PCV2感染对体外培养仔猪淋巴细胞质中p-IκBα蛋白含量的影响(n=10)
2.4 细胞培养上清中分泌细胞因子含量检测
2.4.1细胞培养上清中分泌型IL-1β和IL-6含量检测 细胞培养上清中IL-1β和IL-6检测结果分别见图5~6。相对于对照组,PCV2感染组IL-1β在24和48 h含量均高有所升高,但与对照组差异不显著(P>0.05)。相对于对照组,PCV2感染组IL-6在24 h时增加明显,48 h感染组 IL-6含量显著高于对照组(P<0.05)。

图5 细胞培养上清中IL-1β含量检测结果

图6 细胞培养上清中IL-6含量检测结果
2.4.2细胞培养上清中分泌型IL-17和TNF-α含量检测 上清中IL-17和TNF-α含量结果见图7~8。PCV2攻毒后6 h,攻毒组细胞上清中IL-17含量明显升高,12和24 h极显著促进IL-17分泌(P<0.01),48 h时还明显高于对照组IL-17含量(P<0.05),结果显示PCV2攻毒随着时间延长可明显升高体外培养淋巴细胞分泌IL-17水平。PCV2攻毒后6 h,攻毒组TNF-α含量显著升高(P<0.05),12 h降至对照组水平,随后急剧增加,24 h达到峰值,48 h有所降低,但还极显著高于对照组(P<0.01)。

图7 细胞培养上清中IL-17含量检测结果

图8 细胞培养上清中TNF-α含量检测结果
2.4.3细胞培养上清中分泌型IL-10和TGF-β1含量检测 IL-10含量检测结果见图9,PCV2攻毒后,体外培养淋巴细胞从6 h开始分泌IL-10水平明显升高,且在随后的12,24和48 h均高于对照组水平,其中12 h达到峰值,显著高于对照组(P<0.05)。TGF-β1含量变化见图10,其变化趋势呈现先降低后升高的特征,6 h明显低于对照组,两者差异显著(P<0.05),12 h还明显低于对照组,24 h开始升高,48 h急剧增加,极显著高于对照组(P<0.01)。

图9 细胞培养上清中IL-10含量检测结果
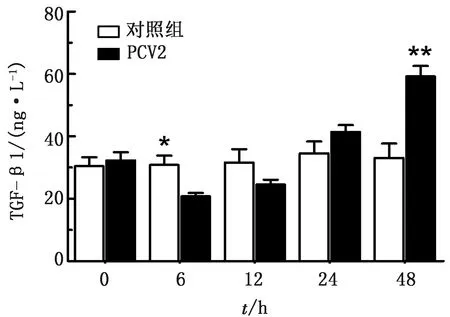
图10 细胞培养上清中TGF-β1含量检测结果
3 讨论
NF-κB作为重要的核转录调控基元,在炎性细胞因子激活与表达过程中起着重要的调控作用,并调节炎症反应最终进程。研究证实NF-κB信号活化与多种炎性细胞因子(IL-10、IL-6、TGF-β1和TNF-α)之间存在密切关联[8-10]。本研究发现,随着PCV2感染时间延长,NF-κB/P65的核易位强度不断增强,核内NF-κB/P65蛋白含量不断增强,呈现明显“时间-效应”关系。随着核内NF-κB/P65蛋白含量的增加,NF-κB与DNA的结合效率呈现明显增强。本试验证实,PCV2感染可导致体外培养淋巴细胞中NF-κB信号激活,表现明显的核易位转移和DNA结合活性增强,为调控下游相关基因的转录与表达提供条件,这一结果与吕春子等[11]的研究一致。WEI等[12]研究发现,NF-κB信号途径可以被PCV2有效激活,导致细胞核内P65蛋白含量和NF-κB与DNA结合活性增加,有利于病毒在细胞中的复制。PCV2能有效激活淋巴细胞中的NF-κB信号,易位至细胞核内与DNA调控元件结合,可有效调控细胞因子及其受体的表达,该途径可能是PCV2导致免疫抑制发生的重要途径[13]。
NF-κB激活通路存在“经典途径”和“旁路途径”2条不同途径[14]。“经典途径”通过促发胞质中IκB的磷酸化降解导致信号激活,调控基因的转录与表达,该途径主要参与机体调控炎性细胞因子、细胞凋亡等相关基因。本试验结果表明,在PCV2作用下,体外培养仔猪淋巴细胞胞质中p-IκB蛋白从6 h开始显著高于对照组(P<0.05),至24 h 极显著高于对照组(P<0.01),这种现象基本与NF-κB/P65蛋白入核和DNA结合活性同步,进一步证实PCV2是通过经典途径实现。
本试验结果表明,炎性因子IL-1β和IL-6在PCV2感染后含量变化不明显,仅IL-6在48 h显著高于对照组(P<0.05),这与陈耿等[15]的研究结果相一致。本试验结果显示,TNF-α和IL-17在PCV2作用 6 h开始明显升高,在24 h达到峰值,其中TNF-α表现出在12 h明显降低,这一结果与相关学者研究不一致,这可能与TNF-α和IL-17同时具有正调节免疫活性和产生炎症损伤的特点有关,早期的含量增加主要表现免疫调节,后期含量升高可能导致免疫损伤[16]。本试验中PCV2感染12 h出现IL-10明显的含量增加,提示PCV2可导致细胞免疫抑制,这与相关研究结果一致。在PCV2感染6,12 h时TGF-β1出现明显降低,这可能是感染PCV2后机体免疫反应增强,随后开始升高,48 h显著高于对照组,可能与机体免疫抑制发生存在一定关联。细胞因子含量检测进一步证实PCV2可以激活NF-κB信号通路,并导致炎性细胞因子表达出现相应变化。
综上,本研究从NF-κB的核易位、核蛋白NF-κB/P65含量变化,NF-κB与核内DNA结合效率以及炎性细胞因子分泌表达等4个方面评价了NF-κB细胞信号通路激活的主要特征,定量检测PCV2对体外培养仔猪淋巴细胞NF-κB信号通路激活及其对炎性细胞因子表达活性的影响,为PCV2感染、致病机理和免疫应答研究奠定了一定基础。

