电针对膝骨关节炎大鼠脊髓背角CB2R、p-P38和p-ERK表达的影响
李杨乐,杨锋,樊静杰,郑晓慧,朱芮,郑洁,3
1.陕西中医药大学针灸推拿学院,陕西 咸阳 712046;2.陕西中医药大学第一临床医学院,陕西 咸阳 712046;3.陕西省针药结合重点实验室,陕西 咸阳 712046
骨性关节炎(osteoarthritis,OA)是始于关节软骨退变,并逐渐累及滑膜、软骨下骨、肌腱及韧带等关节周围多种组织的复杂性退行性关节疾病,我国尤以膝骨关节炎(knee osteoarthritis,KOA)高发。OA患病率与年龄呈正相关,我国60岁以上人群OA患病率为50%,75岁以上人群患病率高达80%。疼痛是OA的首要症状,随着病情发展,出现长期持续性慢性疼痛,也是引起患者关节功能障碍及生活质量下降的重要因素。OA长期持续性疼痛并非关节局部损害引起的单纯感受伤害性疼痛,还包括神经病理性疼痛。脊髓背角是痛觉信息传递与调控的第一站,脊髓水平的中枢敏化是感受伤害性疼痛发展为神经病理性疼痛的重要环节。研究发现,KOA慢性疼痛大鼠脊髓背角痛觉反射通路异常活跃,大鼠患侧足底皮肤对机械刺激表现出较强的脊髓反应,这一过程可能与MAPK 信号通路活化密切相关。大麻素受体2(CB2R)是内源性大麻素系统的重要组成部分,脊髓CB2R激活后可通过抑制MAPK信号通路发挥抑制神经病理性疼痛作用。电针可缓解KOA慢性疼痛及综合症状,提高患者生活质量。本实验以谷氨酸钠碘乙酸(MIA)诱导KOA慢性疼痛大鼠模型,观察电针“阳陵泉”“内膝眼”对大鼠痛性行为学、脊髓背角CB2R、p-P38和p-ERK表达的影响,从脊髓水平揭示电针治疗KOA慢性疼痛的作用机制。
1 材料与方法
1.1 动物与分组
SPF级雌性SD大鼠48只,体质量220~260 g,成都达硕实验动物有限公司提供,动物生产许可证号SCXK(川)2020-030。饲养于陕西中医药大学动物实验中心,温度24~26 ℃,湿度50%~60%,12 h光/暗循环,自由摄食饮水。实验过程严格遵守科技部颁布的《关于善待实验动物的指导性意见》。
1.2 主要试剂与仪器
谷氨酸钠碘乙酸(MIA,货号S30680,上海源叶生物科技有限公司),CB2R阻断剂AM630(货号HY-15421,上海碧云天生物技术有限公司),CB2R一抗(货号PA1-746A,美国Invitrogen公司),p-ERK一抗(货号ab0011,英国Abcam公司),p-P38一抗(货号9216S,美国CST公司),NeuN一抗(货号A0951,美国Abclonal公司),FITC标记羊抗小鼠IgG、Cy3标记羊抗兔IgG(货号分别为BA1101、BA1032,武汉博士德)。病理切片机(型号RM2016,德国Leica公司),荧光显微镜(型号BX53,日本Olympus公司),Von Frey 测痛仪(型号IITC 2391,美国生命科学仪器公司),双足平衡测痛仪(型号IITC390,美国生命科学仪器公司),小动物吸入麻醉机(型号ABM,上海玉研科学仪器有限公司),华佗牌电针仪(型号SDZ-II,苏州医疗用品厂有限公司),华佗牌一次性针灸针(0.18 mm×13 mm,吴江市云龙医疗器械有限公司)。
1.3 分组与造模
48只大鼠适应性饲养1周后随机分为空白组、盐水组、模型组、电针组、CB2R阻断组、CB2R阻断+电针组,每组8只。除空白组和盐水组外,其余各组采用膝关节腔注射MIA 法制备KOA 慢性疼痛大鼠模型。用无菌生理盐水将MIA配制成浓度为80 mg/mL溶液,置于-20 ℃避光保存。用小动物吸入麻醉机对大鼠进行异氟烷吸入麻醉,剔除大鼠左后肢毛发,局部常规消毒后,用微量注射器向大鼠膝关节腔注射50 μL MIA,注射完毕后屈伸膝关节10次,使MIA均匀分布于关节腔内,盐水组向膝关节腔注射50 μL无菌生理盐水。空白组不予处理。
1.4 干预
注射后第15日,对电针组和CB2R阻断+电针组大鼠“阳陵泉”“内膝眼”行电针干预,参照《实验针灸学》和《腧穴名称与定位》进行定位,取穴均为左侧(造模侧)。使用0.18 mm×13 mm一次性针灸针于“阳陵泉”“内膝眼”直刺3~5 mm,常规提插捻转后,分别接电针正、负极,疏密波2/100 Hz,强度1~2 mA,以大鼠局部肌肉轻微抖动、安静不挣扎为度,每次15 min,1次/d,5次为1个疗程,共2个疗程(10次),每个疗程结束后间歇1 d,进行痛性行为学测定,再进行下一疗程的治疗。CB2R阻断+电针组先按2 mg/kg腹腔注射AM630(1.6 μg/μL),10 min后再进行电针干预,干预方式同电针组。CB2R阻断组仅予2 mg/kgAM630腹腔注射。空白组、盐水组、模型组和CB2R阻断组不予干预。
1.5 痛性行为学测定
分别于MIA注射前1 d,注射后7、14 d,以及电针干预1个疗程后(20 d)、2个疗程后(26 d)进行大鼠痛性行为学测定,包括机械痛超敏测定和后肢负重能力测定。机械痛超敏测定:安静环境中,室温(24±2)℃,将大鼠置于底为不锈钢网格、笼体为有机塑料的足底测试平台,待大鼠适应20 min后,使用直径为0.8 mm的电子测试探头垂直刺激大鼠左后足底中心区域,刺激力度均匀且逐渐增大,直至大鼠出现缩爪躲避反应,记录电子屏读数,即为大鼠左侧机械痛缩足阈,每只大鼠间隔10 min测1次,连续测量3次,取平均值作为最终结果。后肢负重能力测定:安静环境中,室温(24±2)℃,将大鼠置于特制的有机玻璃格子内,前肢趴在格子斜面上,后肢分别放在2个独立的重量测试传感器上,待大鼠安静后,采用后肢平衡测痛仪测定后肢负重能力,记录左、右后肢负重值。每只大鼠连续测量3次,取平均值进行计算,以左后肢负重值÷右后肢负重值×100%表示大鼠左后肢负重能力。
1.6 取材
最后一次行为学测定结束后,大鼠禁食24 h,以10%水合氯醛腹腔注射麻醉,开胸,暴露心脏,将钝性注射针头经左心室插入升主动脉根部,同时剪开右心耳,经注射针头快速滴入预冷的生理盐水进行灌注,待大鼠肺完全变白后,用4%多聚甲醛灌注固定,取L~L左侧脊髓组织,置于4%多聚甲醛中固定24 h,梯度乙醇脱水,石蜡包埋,切片(5 μm)、制片,用于免疫荧光检测。
1.7 免疫荧光单标法检测
石蜡切片脱蜡,水化,枸橼酸缓冲液热修复法抗原修复15 min,血清室温封闭30 min,滴加CB2R一抗(1∶200),4 ℃孵育过夜,滴加FITC标记羊抗小鼠IgG(1∶100),37 ℃避光孵育1 h,滴加DAPI 避光孵育5 min染细胞核,PBS冲洗后加抗荧光淬灭剂封片。荧光显微镜下采集图像,每张切片随机选取3~5个视野,Image J软件计算CB2R平均光密度。
1.8 免疫荧光双标法检测
石蜡切片脱蜡、水化、抗原修复、血清封闭(方法同前)后,滴加NeuN 一抗(1∶50),4 ℃孵育过夜,滴加Cy3标记羊抗兔IgG(1∶100),37 ℃避光孵育1 h。滴加CB2R、p-P38、p-ERK 一抗(均为1∶200),4 ℃孵育过夜,滴加FITC标记羊抗小鼠IgG(1∶100),37 ℃避光孵育1 h,滴加DAPI避光孵育5 min,PBS冲洗后加抗荧光淬灭剂封片。荧光显微镜下采集图像,每张切片随机选取3~5 个视野,以CB2R/NeuN、p-P38/NeuN、p-ERK/NeuN双染阳性细胞数分别表示CB2R、p-P38和p-ERK在脊髓背角神经元的定位表达。
1.9 统计学方法

2 结果
2.1 电针对模型大鼠痛性行为学的影响
MIA注射后,大鼠左侧机械痛缩足阈及左后肢负重能力持续下降,14 d后维持在较低水平,与空白组比较,差异有统计学意义(<0.05,<0.01);电针干预后(20 d、26 d),与模型组比较,电针组、CB2R阻断+电针组大鼠左侧机械痛缩足阈及左后肢负重能力明显升高,差异有统计学意义(<0.05,<0.01),且电针组明显优于CB2R 阻断+电针组(<0.05,<0.01)。见图1。
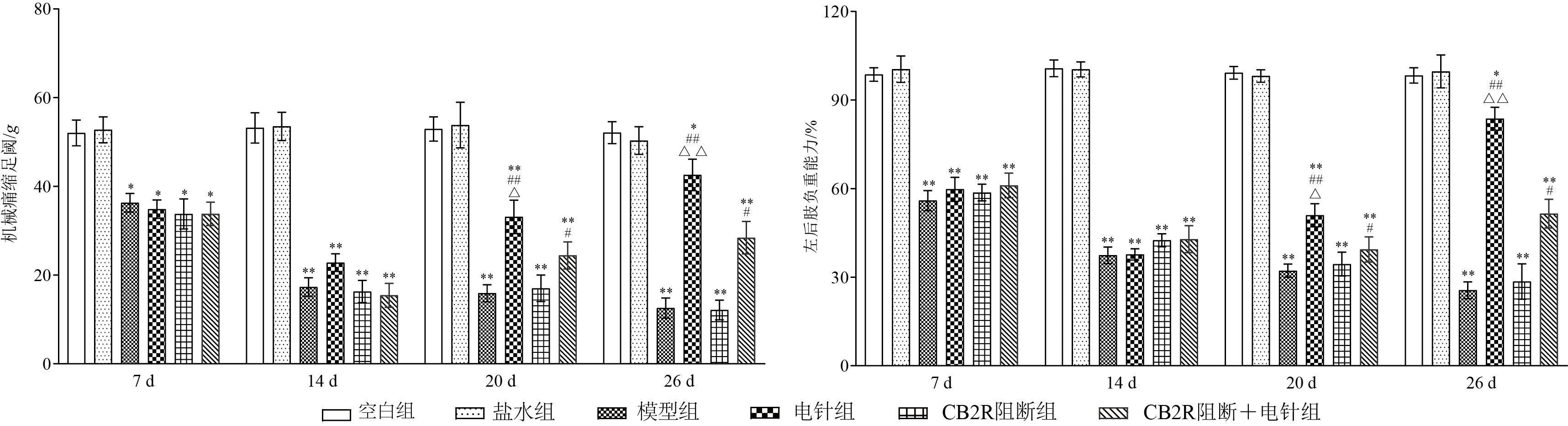
图1 各组大鼠不同时点左侧机械痛缩足阈和左后肢负重能力比较(,每组8只)
2.2 电针对模型大鼠左侧脊髓背角CB2R表达的影响
与空白组比较,模型组大鼠左侧脊髓背角CB2R表达升高,差异有统计学意义(<0.05);与模型组比较,电针组大鼠左侧脊髓背角CB2R表达升高,差异有统计学意义(<0.01)。见图2、图3。

图2 各组大鼠左侧脊髓背角CB2R阳性表达(免疫荧光染色,×400)

图3 各组大鼠左侧脊髓背角CB2R表达比较(,每组4只)
2.3 电针对模型大鼠左侧脊髓背角神经元CB2R、p-P38、p-ERK表达的影响
与空白组比较,模型组大鼠左侧脊髓背角CB2R/NeuN、p-P38/NeuN、p-ERK/NeuN双染阳性细胞数显著增加,差异有统计学意义(<0.05,<0.01);与模型组比较,电针组大鼠左侧脊髓背角CB2R/NeuN双染阳性细胞数显著增加,差异有统计学意义(<0.01),电针组和CB2R阻断+电针组大鼠左侧脊髓背角p-P38/NeuN 和p-ERK/NeuN 双染阳性细胞数显著减少,差异有统计学意义(<0.01,<0.05)。见图4~图7。

图4 各组大鼠左侧脊髓背角CB2R/NeuN、p-P38/NeuN、p-ERK/NeuN阳性表达比较(,每组4只)

图5 各组大鼠左侧脊髓背角CB2R/NeuN阳性表达(免疫荧光染色)

图6 各组大鼠左侧脊髓背角p-P38/NeuN阳性表达比较(免疫荧光染色)
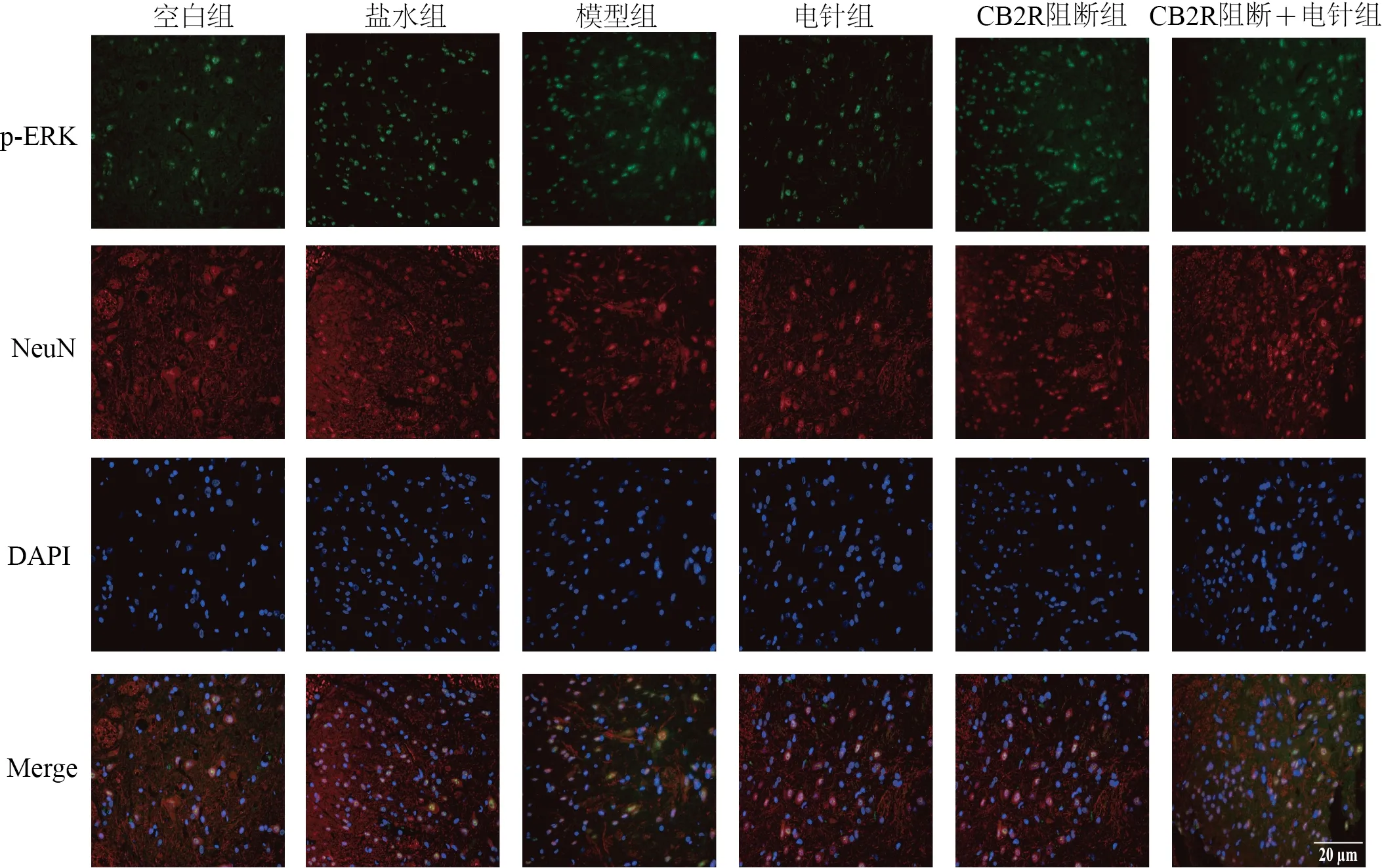
图7 各组大鼠左侧脊髓背角p-ERK/NeuN阳性表达(免疫荧光染色)
3 讨论
KOA属中医学“痹证”范畴,现代医家多称其为“膝痹”。因发病机制不明,目前尚缺乏能够控制关节退变的有效措施,治疗集中在改善症状方面。电针可有效缓解KOA患者疼痛症状,改善关节功能。多选取膝关节局部穴位以疏通经气,如阳陵泉、内膝眼、犊鼻、血海、足三里、阴陵泉、鹤顶、梁丘、阿是穴等。
KOA初期主要表现为急性疼痛,以关节局部病理变化及伤害性感受器外周敏化为主。随着病情发展,病变关节炎性刺激不断传入,脊髓背角感觉神经元处于超敏状态,导致来自关节局部或远离关节部位的正常刺激也可引发剧烈疼痛,这一过程称为脊髓中枢敏化,是KOA慢性疼痛形成的重要神经学基础。KOA慢性疼痛患者多表现出脊髓中枢敏化的特征,其疼痛范围往往超出关节区域,且关节及整个下肢的压痛阈显著下降。MIA关节腔注射是复制啮齿类动物KOA慢性疼痛模型的经典方法,注射14 d后可出现神经病理性疼痛性质的痛性行为。本研究结果显示,MIA诱导后,模型大鼠左侧机械痛缩足阈和后肢负重能力明显降低,电针组大鼠左侧机械痛缩足阈及后肢负重能力明显升高,提示电针可抑制大鼠痛性行为。
研究发现,内源性大麻素系统在KOA大鼠脊髓痛觉通路敏化中呈现出适应性变化,表现为脊髓内源性大麻素含量显著升高,并通过作用于CB2R发挥疼痛抑制作用,CB2R高表达的转基因KOA小鼠痛性行为明显减少,表明CB2R活化对脊髓痛觉通路敏化具有抑制作用。MAPK家族的P38和ERK在神经病理性疼痛过程中具有调控作用,MIA诱导的KOA大鼠痛性行为与大鼠脊髓p-P38和p-ERK高表达密切相关。本实验中,模型组大鼠左侧脊髓背角CB2R表达呈适应性上调,电针可上调模型大鼠左侧脊髓背角CB2R表达及CB2R在脊髓背角感觉神经元表达,同时下调p-P38和p-ERK在脊髓背角感觉神经元的表达。阻断CB2R后,电针对模型大鼠痛性行为及脊髓背角感觉神经元p-P38和p-ERK表达仍有抑制作用,且与电针组比较差异有统计学意义(<0.05,<0.01),表明电针可能通过激活CB2R抑制p-P38和p-ERK表达。
综上,电针“阳陵泉”“内膝眼”可抑制KOA大鼠痛性行为,减轻脊髓中枢敏化,其作用机制与激活脊髓背角CB2R、抑制P38/ERK活化有关。

