鞘内注射白藜芦醇对骨癌痛模型大鼠痛觉及OPG/RANK/RANK-L信号通路的影响
周芳 林涛 代月娥 周勤 蒋蓉


关键词骨癌痛;白藜芦醇;OPG/RANK/RANK-L信号通路;镇痛
骨癌痛为乳腺癌、前列腺癌、肺癌等大部分晚期癌症患者的常见症状之一,极大地降低了患者的生活质量[1]。骨癌痛主要表现为痛觉过敏和触诱发痛,其中,痛觉过敏是指患者对于刺激性疼痛的敏感程度增强,触诱发痛是指非痛刺激(比如压迫或者冷刺激)引发的疼痛。目前,临床上针对骨癌痛的治疗方式主要有手术、放疗、化疗及药物治疗(阿片类镇痛药物和双膦酸盐类药物),药物治疗是镇痛的主要方式;然而由于骨癌痛并非单一的炎性疼痛,且长期使用阿片类药物具有较大的副作用,使得常规药物治疗难以达到理想的治疗效果[2]。因此,寻找新的治疗骨癌痛的药物十分必要。
白藜芦醇是一种天然多酚类化合物,具有抗肿瘤、抗炎等药理作用,且副作用小,耐受性良好[3]。研究表明,胶质细胞功能异常可以促进骨癌痛的中枢敏化[4],而鞘内注射白藜芦醇可以有效抑制胶质细胞活化从而缓解骨癌痛[5]。另有研究表明,白藜芦醇还可通过降低脊髓背角钙调蛋白依赖性蛋白激酶Ⅱ(calmodulin dependentprotein kinase Ⅱ,CaMKⅡ)的活化来抑制骨癌痛发生时的痛觉过敏[6]。然而,引发骨癌痛的机制除了神经元活化、胶质细胞功能异常,还有骨组织的破损[7]。骨转移过程中,成骨细胞/破骨细胞的动态失衡导致了骨组织的破损,从而引发疼痛[8]。相关研究发现,成骨细胞分泌的一系列炎症因子可增加破骨细胞的活性,进一步加剧骨癌痛[9]。骨保护素(osteoprotegerin,OPG)/核因子κB受体激活因子(receptor activator of NF-κ B,RANK)/RANK 配体(RANK-L)信号通路参与调节成骨细胞/破骨细胞的动态平衡和骨癌痛的发生发展[10-11],但是,白藜芦醇是否可通过这一信号通路来发挥抗骨癌痛的作用尚未明确。
基于此,本研究采用右后肢胫骨注射乳腺癌Walker256 细胞悬液的方法建立骨癌痛大鼠模型,并以鞘内注射的方式进行给药,从而研究白藜芦醇对骨癌痛模型大鼠痛觉、OPG/RANK/RANK-L 信号通路及炎症因子水平的影响,以期为骨癌痛新药开发提供参考。
1 材料
1.1 主要儀器
本研究所用仪器主要有37370 型足底热刺痛仪、NC12775 型VonFrey 纤维丝(上海玉研科学仪器有限公司),311 型二氧化碳培养箱、iBrightTM CL750 型成像仪(美国Thermo Fisher Scientific 公司),Mini-PROTEAN®Tetra 型垂直电泳槽(美国Bio-Rad 公司),Spectramax M5型多功能酶标仪(美国Molecular Devices公司)。
1.2 主要药品与试剂
白藜芦醇购自美国Sigma公司(批号R5010);RPMI-1640 培养基、胎牛血清(FBS)均购自美国Thermo FisherScientific 公司(批号分别为A1049101、10099);兔抗RANK-L 多克隆抗体购自美国Proteintech 公司(批号23408-1-AP);兔抗RANK多克隆抗体、兔抗OPG多克隆抗体、辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(二抗)、化学发光试剂盒均购自美国Bio-Rad 公司(批号分别为ab200369、ab183910、1706515、1705061);兔抗GAPDH多克隆抗体购自美国Merck公司(批号G9545);磷酸盐缓冲液(PBS)、胰酶均购自北京索莱宝科技有限公司(批号分别为P1020、T1300);蛋白提取试剂盒、BCA蛋白浓度测定试剂盒、蛋白上样缓冲液(5×)、大鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒、大鼠白细胞介素6(interleukin-6,IL-6)ELISA 试剂盒、大鼠IL-1β ELISA 试剂盒、大鼠趋化因子配体2(chemokine ligand 2,CCL2)ELISA试剂盒均购自上海碧云天生物技术有限公司(批号分别为P0033、P0012、P0286、PT516、PI328、PI303、PC128);其余试剂为实验室常用规格,水为纯净水。
1.3 细胞
大鼠乳腺癌Walker256 细胞(编号ZQ0544)购自上海中乔新舟生物科技有限公司。
1.4 动物
本实验所用SD 雄性大鼠共40 只,体质量200~220 g,6~8 周龄,均购自北京维通利华实验动物技术有限公司,动物生产许可证号为SCXK(京)2019-0011。所有大鼠随机分笼饲养,提供充足的食物、饮用水并进行12 h/12 h 的昼夜光照循环,饲养环境保证通风、温度适宜(20~23 ℃)。动物适应环境2 周后,进行后续实验。
2 方法
2.1 细胞培养
将Walker256 细胞培养于含有10%FBS 的RPMI-1640 培养基中,置于5%CO2、37 ℃恒温培养箱中培养。当细胞密度达80%时,进行传代培养。取对数生长期的细胞,用PBS清洗1 遍后,用0.25%胰酶消化1 min,制成单细胞悬液,并用细胞冻存液调整细胞密度为2×107个/mL,用液氮冻存备用。
2.2 鞘内置管处理
大鼠腹腔注射3%戊巴比妥钠(30 mg/kg)进行麻醉,根据文献[12]方法操作:使大鼠俯卧于手术布上,以脊髓L6~S1 棘突间隙为中心用碘伏消毒,依次切开皮肤、浅筋膜,分离肌肉暴露出大鼠脊髓L6 的硬脊膜,将PE-10 导管缓慢推入至脊髓L6(插入深度为3 cm),再缝合固定近端导管。术后大鼠分笼饲养,并给予足够的食物和水。取无运动障碍且髓鞘注射2%利多卡因20 mL后30 s 内出现双下肢麻痹的大鼠用于实验。
2.3 造模、分组与给药
参考文献[13]方法,建立骨癌痛大鼠模型。将鞘内置管5 d 后且可用于实验的大鼠,分为假手术组、模型组和白藜芦醇低、中、高剂量组(0.25、1、2 mg/kg,以二甲基亚砜溶解),每组8 只。除假手术组外,其余各组大鼠腹腔注射3%戊巴比妥钠(30 mg/kg)进行麻醉,使大鼠仰卧于手术台上,固定右后肢,进行脱毛、碘伏消毒;在大鼠右后肢膝关节处向下切开约0.5 cm,钝性分离肌肉,暴露胫骨;用1 mL针头在胫骨远端钻孔,并注入Walker256细胞悬液20 μL(注射完停留1~2 min),再用医用胶水迅速封闭针孔,然后逐层缝合。假手术组大鼠暴露胫骨钻孔后,注射等体积生理盐水。术后12 d,所有造模大鼠的机械缩足反射阈值和热缩足反射潜伏期较假手术组大鼠均显著降低,表明造模成功。造模成功后,白藜芦醇各剂量组大鼠分别鞘内注射相应药物,假手术组和模型组大鼠鞘内均注射等体积二甲基亚砜,鞘内注射量为10 μL,每天1次,连续5 d。
2.4 机械缩足反射阈值的检测
检测造模前、造模后(即术后12 d)和给药后第3、5天各组大鼠的机械缩足反射阈值变化。将大鼠置于底部为金属网格、四周为透明玻璃的盒子中。待大鼠适应后,用不同弯折力的VonFrey 纤维丝刺激大鼠右后足足底,每次刺激5 s,间隔15 s。当大鼠出现缩足、抬足、舔足等行为时,记录此时VonFrey 纤维丝对应的折力值(g),即机械缩足反射阈值。整个实验过程由同一名实验员进行触痛刺激,以保持刺激强度一致。每只大鼠重复测量3 次,取平均值。
2.5 热缩足反射潜伏期的检测
检测造模前、造模后(即术后12 d)和给药后第3、5天各组大鼠的热缩足反射潜伏期。同样将大鼠置于底部为金属网格,四周为透明玻璃的盒子中。待大鼠适应后,用热刺痛仪刺激大鼠右后足足底。当大鼠出现抬足时,记录此时热刺痛仪对应的数值,即热缩足反射潜伏期。整个实验过程由同一名实验员进行热刺激,以保持刺激强度一致。每只大鼠重复测定3 次(每隔5 min测量1 次),取平均值。
2.6 血清中炎症因子水平的检测
采用ELISA法進行检测。末次给药后,采集各组大鼠的外周血,置于1.5 mL离心管中,室温静置2 h 后,以2 000 r/min 离心10 min,收集血清(上清液)于离心管中。按照ELISA 试剂盒说明书方法分别检测血清中炎症因子TNF-α、IL-6、IL-1β、CCL2 的水平。
2.7 大鼠胫骨中RANK、RANK-L、OPG蛋白表达水平的检测
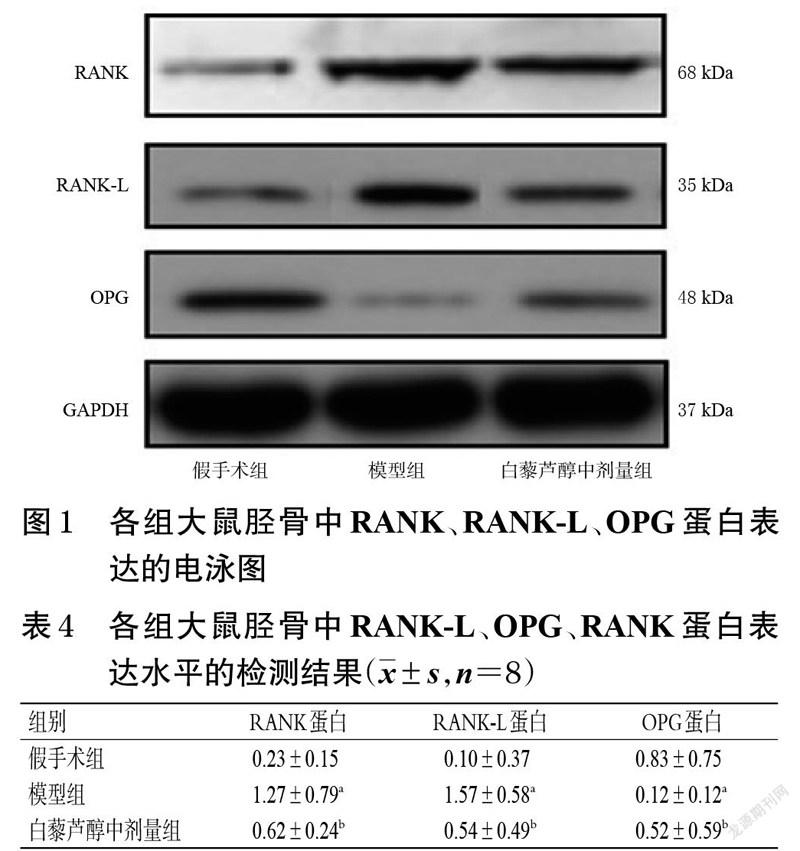
采用Western blot法进行检测。末次给药取血后,假手术组、模型组和白藜芦醇中剂量组大鼠腹腔注射戊巴比妥钠(300 mg/kg)处死后,迅速取出大鼠的胫骨,置于预冷的生理盐水中充分浸泡,然后用水清洗3~5 遍。将胫骨组织剪碎,用液氮研磨成粉末。每100 mg骨组织粉末用300 μL RIPA 裂解液混合匀浆,冰浴30 min 后,于4 ℃条件下以12 000 r/min 离心15 min,收集上清液,即为骨组织蛋白。用BCA 试剂盒测量骨组织蛋白的浓度。将骨组织蛋白样品用loading buffer(5×)稀释,然后煮沸灭活。待灭活蛋白冷却至室温,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,然后转膜并用5%脱脂奶粉封闭90 min,加入RANK、RANK-L、OPG一抗(稀释度均为1 ∶1 000)和GAPDH一抗(稀释浓度为1 ∶10 000)孵育过夜;以TBST 漂洗5 min×3 次后,加入二抗(稀释度为1 ∶10 000)室温孵育90 min。采用化学发光试剂盒显色,并用凝胶成像仪成像,采用Quantity-one 软件分析蛋白灰度值,以目的蛋白与内参蛋白的灰度值比值表示目的蛋白的表达水平。
2.8 统计学方法
采用SPSS 20.0 软件进行统计分析,数据用x±s 表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
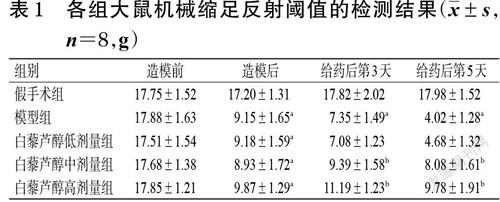
3.1 大鼠机械缩足反射阈值的检测结果
造模前各组大鼠机械缩足反射阈值差异无统计学意义(P>0.05)。造模后,与假手术组相比,模型组和白藜芦醇各剂量组大鼠机械缩足反射阈值均显著降低(P<0.05)。给药后第3、5 天,与假手术组相比,模型组大鼠机械缩足反射阈值均显著降低(P<0.05);与模型组相比,白藜芦醇低剂量组大鼠机械缩足反射阈值差异无统计学意义(P>0.05),而白藜芦醇中、高剂量组大鼠机械缩足反射阈值均显著升高(P<0.05),且呈剂量依赖趋势。结果见表1。
3.2 大鼠热缩足反射潜伏期的检测结果
造模前各组大鼠热缩足反射潜伏期差异无统计学意义(P>0.05)。造模后,与假手术组相比,模型组和白藜芦醇各剂量组大鼠热缩足反射潜伏期均显著降低(P<0.05)。给药后第3、5 天,与假手术组相比,模型组大鼠热缩足反射潜伏期均显著降低(P<0.05);与模型组相比,白藜芦醇低剂量组大鼠热缩足反射潜伏期差异无统计学意义(P>0.05),而白藜芦醇中、高剂量组大鼠热缩足反射潜伏期均显著升高(P<0.05),且呈剂量依赖趋势。结果见表2。
3.3 大鼠血清中炎症因子TNF-α、IL-6、IL-1β、CCL2 的水平的检测结果
与假手术组相比,模型组大鼠血清中TNF-α、IL-6、IL-1β、CCL2 表达水平均显著升高(P<0.05)。与模型组相比,白藜芦醇低剂量组大鼠血清中IL-6 水平显著降低(P<0.05),TNF-α、IL-1β和CCL2 水平差异无统计学意义(P>0.05);白藜芦醇中、高剂量组大鼠血清中TNF-α、IL-6、IL-1β、CCL2 水平均显著降低(P<0.05)。结果见表3。
3.4 大鼠胫骨中RANK、RANK-L、OPG蛋白表达水平的检测结果
与假手术组相比,模型组大鼠胫骨中RANK、RANK-L蛋白表达水平显著升高,OPG蛋白表达水平显著降低(P<0.05)。与模型组相比,白藜芦醇中剂量组大鼠胫骨中RANK、RANK-L 蛋白表达水平均显著降低,OPG 蛋白表达水平显著升高(P<0.05)。结果见图1、表4。
4 讨论
骨癌由多种癌症的原发性或继发性骨转移诱发,约90%的乳腺癌和前列腺癌患者会发生骨转移[14]。骨癌发生发展过程中会引起剧烈且持续的疼痛,增加患者死亡率,因此,深入了解骨癌痛的分子机制可为骨癌痛药物及新作用靶点的开发提供依据。本研究选用大鼠乳腺癌Walker256 细胞制备骨癌痛大鼠模型,结果发现,与假手术组相比,模型组大鼠机械缩足反射阈值和热缩足反射潜伏期均显著降低,提示骨癌痛模型大鼠出现机械痛敏反应和神经病理性疼痛,表明造模成功。进一步鞘内注射白藜芦醇发现,大鼠机械缩足反射阈值和热缩足反射潜伏期均有所升高。这表明白藜芦醇可以改善大鼠骨癌痛。
研究发现,骨肿瘤细胞和相关免疫细胞可释放大量炎症因子,如CXCL 家族趋化因子、IL-6、TNF-α和转化生长因子β(transforming growth factor beta,TGF-β)等,这些炎症因子可通过致敏外周伤害性感受器或作用于成骨细胞、破骨细胞、神经纤维上的效应器,从而导致骨癌痛的产生[15-16]。研究发现,TNF-α和IL-1β是导致骨癌痛的主要促炎因子,可以激活胶质细胞,诱导胶质细胞分泌CCL2,进一步加剧炎症疼痛[17]。在骨癌痛等慢性疼痛中,机体TNF-α和IL-1β水平升高[18];TNF-α与TNF受体结合[包括TNF-α受体1(TNFR1)和TNF-α受体2(TNFR2)]可导致神经元的敏化[19];IL-1β可以直接增加神经元突触间兴奋传播,导致机械痛敏反应[20]。本研究发现,模型组大鼠血清中炎症因子TNF-α、IL-1β、IL-6 和CCL2 的水平均显著升高,而经白藜芦醇干预后,大鼠上述炎症因子水平均降低。这表明白藜芦醇可以改善大鼠骨癌痛引起的炎症反应。
在炎症条件下,OPG/RANK/RANK-L 信号通路调节的破骨细胞分化会受到影响,从而影响破骨细胞与成骨细胞的动态平衡[21]。RANK-L 与其受体RANK 结合后可促进破骨细胞的成熟和分化;而OPG是破骨细胞抑制因子,可通过调节TNF-α、TGF-β、糖皮质激素等的激活,竞争性地抑制RANK与RANKL的结合,从而抑制破骨细胞分化,并促进其凋亡[22]。骨肿瘤中,成骨细胞与破骨细胞的平衡被打破,破骨细胞的增殖及活化可以分泌溶解酶,引发进行性的溶骨活动,降解骨基质,从而引发剧烈疼痛[23-24]。一项临床研究发现,49 例骨转移瘤患者外周血中RANK-L 水平远高于未发生骨转移瘤的肿瘤患者,表明RANK-L 可以作為骨转移瘤的生物标志物[25]。此外,成骨细胞、免疫细胞及肿瘤细胞分泌的炎症因子可以增加破骨细胞的活性,从而下调OPG,上调RANK-L;同时,活化后的破骨细胞又进一步分泌多种生长因子,促进肿瘤细胞增殖[26]。本研究发现,模型组大鼠胫骨中OPG蛋白表达水平显著降低,RANK-L蛋白表达水平显著升高,提示大鼠胫骨出现了骨吸收和骨破损。由于中剂量的白藜芦醇已具有镇痛和缓解炎症的作用,因此,本研究在后续Western blot 实验中仅检测了白藜芦醇中剂量组大鼠胫骨中OPG/RANK/RANK-L 信号通路相关蛋白的表达水平。结果发现,经白藜芦醇干预后,模型大鼠胫骨中RANK、RANK-L 蛋白表达水平均显著降低,OPG蛋白表达水平显著升高。这表明白藜芦醇可通过抑制OPG/RANK/RANK-L 信号通路活性,抑制破骨细胞活化和骨质破损,从而缓解大鼠骨癌痛。
综上所述,鞘内注射白藜芦醇可缓解大鼠骨癌痛引起的炎症反应,其作用机制可能与抑制OPG/RANK/RANK-L信号通路活性有关。

