浓酱兼香型白酒发酵酒醅微生物群落及理化指标对正丙醇产出的影响
范培文,刘蒲临,张明春,缪礼鸿*,陈家晖,邓 灿,汪彩莉,王奇盛
(1.武汉轻工大学 生命科学与技术学院,湖北 武汉 430023;2.湖北白云边酒业股份有限公司,湖北 松滋 434200)
浓酱兼香型白酒是在我国传统酱香型白酒和浓香型白酒的基础上发展而来[1-2]。它吸取了酱香型白酒的高温制曲、高温堆积以及浓香型白酒的泥窖发酵等工艺特点,形成了浓酱兼香型白酒独特的生产工艺[3-4]。
高级醇是白酒自然发酵过程中生成的重要副产物,能够衬托酒体酯类香气[5]。除异戊醇呈微甜外,大多数高级醇(如异丁醇、正丙醇、正丁醇)都呈苦味,含量过高会导致酒体苦涩,使人上头易醉,但是含量太低会导致酒体口味淡薄[6]。高级醇含量是白酒卫生标准严格控制的一项指标,白酒中的总高级醇含量应控制在0.2~1.0 g/mL[7]。在白酒发酵过程中,理化因素对微生物群落的组成有显著影响,从而影响高级醇的产出。ZHANG H X等[8]研究发现,初始温度越高,乳酸菌的数量增加越快,高温使总酸含量增加,总酯含量降低,从而影响高级醇总量。JIANG J等[9]研究发现,在白酒发酵过程中,水分和氮源含量等理化因子对微生物群落及其代谢有很大影响,通过响应面法对发酵工艺优化后,高级醇总含量由328.80 mg/L显著降低至114.88 mg/L。
正丙醇在白酒中的含量已成为一个限制性指标,因此对正丙醇的产出机理进行研究具有重大意义[10]。国内外学者针对正丙醇产生的机理,从细菌、真菌等菌种角度展开了研究。田源等[11]通过对浓香型白酒窖内发酵过程酒醅中微生物的宏转录组进行分析,解析与正丙醇合成相关的微生物和代谢,发现了3条可能的酒醅微生物合成正丙醇的途径。真菌主要通过2-甲基苹果酸代谢途径和苏氨酸代谢途径合成正丙醇,细菌则主要通过丙酸代谢途径合成并参与苏氨酸代谢途径。正丙醇是白酒中高级醇重要的组成部分之一[12],因此通过减少杂醇油的产出来达到降低正丙醇的目的。杨生智等[13]从杂醇油生产机理入手,通过添加氮源,可降低酒中19%杂醇油含量。孙金旭等[14]研究发现,随着大曲添加量升高,酱香型白酒杂醇油降低。王立钊等[15]的研究结果表明,白酒酿造过程中,发酵力、糖化力和蛋白分解能力对杂醇油的产出也有影响。柏永昊等[16]研究表明,芽孢杆菌虽然能增加白酒发酵过程中正丙醇的含量,但不是正丙醇产生的主要因子。JANSSEN P H等[17]研究表明,一株厌氧羧菌(Clostridiumsp.)能够发酵苏氨酸产生丙酸和正丙醇,证明正丙醇是苏氨酸发酵的末端产物。
本研究以某酒厂浓酱兼香型白酒二轮次出池酒醅为样品,筛选的正丙醇含量高、中、低酒醅样品,对其进行理化指标分析,并采用高通量测序技术分析其微生物群落结构,并基于冗余分析(redundancy analysis,RDA)探讨正丙醇含量与微生物、理化因子之间的关系。以期降低酒醅中正丙醇含量,为人工调控和降低白酒的正丙醇含量提供新途径。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
高温大曲、高粱:湖北省某著名浓酱兼香型酒厂;24份酒醅样品(N41610、N41609、N41911、N41912、N40623、N40624、N30211、N30212、N30621、N30630、N40217、N40218、N30930、N22130、N41328、N21329、N21627、N11304、N20230、N11904、N42122、N11203、N12327、N20530):湖北省某著名酒厂浓酱兼香型白酒二轮出池酒醅。
1.1.2 试剂
溶菌酶(酶活2 000 U/g):山东蕙华生物科技有限公司;裂解酶(酶活120 U/g):康迪恩生物有限公司;叔戊醇、乙醇、正丙醇、乙酸乙酯标准品(纯度≥99%)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA):国药集团化学试剂有限公司;DL 2 000脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker:宝生物工程(大连)有限公司;聚合酶链式反应(polymerase chain reaction,PCR)引物、Ezup柱式细菌基因组脱氧核糖核酸DNA抽提试剂盒:生工生物工程(上海)股份有限公司。
1.2 仪器与设备
ZHJH-C1115B超净工作台、ZXDP-A2160恒温培养箱、ZHWY-2102振荡培养箱:上海智城科技有限公司;7890A气相色谱(gas chromatography,GC)仪、CP97723A色谱柱(50 m×0.25 mm×0.25 μm):美国安捷伦公司;WH-3微型旋涡混合仪:上海沪西分析仪器厂有限公司;T100 Thermal Cycler PCR仪:美国BIO-RAD公司;SYDR/1305凝胶成像仪:美国Syngene公司;DYY-6C电泳仪:北京六一仪器厂。
1.3 实验方法
1.3.1 正丙醇的测定[18]
标准品的配制:精密量取恒温至20 ℃的正丙醇4 mL、5 mL、6 mL,分别置于100 mL量瓶中,分别精密加入恒温至20 ℃的叔戊醇(内标物质)1 mL,用水稀释至刻度,摇匀,精密量取上述各溶液1 mL,分别置于100 mL量瓶中,用水稀释至刻度,摇匀,作为对照品溶液。
样品预处理:将二轮原酒出池酒醅样品于蒸馏瓶中蒸馏,收集馏出液,并用0.45 μm水系滤膜进行过膜处理,取10mL过膜馏出液,加200μL叔戊醇(质量浓度324.710 mg/L)作内标物,混合均匀。
色谱条件:检测器为氢火焰离子化检测器(flame ionization detector,FID);CP97723A色谱柱(50 m×0.25 mm×0.25 μm);进样量1 μL;分流比为20∶1;载气为高纯氮气(N2);氢气(H2)流速为30 mL/min,空气流速为400 mL/min,N2流速为5 mL/min,程序升温:初始温度60 ℃,维持5 min,再以10 ℃/min升温至160 ℃,维持5 min。检测器温度200 ℃,进样口温度220 ℃,总运行时间20 min。
定性定量方法:采用保留时间定性,内标法定量[19-20]。
1.3.2 理化指标的测定
水分含量的测定[21]:准确称取样品10.0 g,在恒温130 ℃条件下将酒醅试样加热45 min,干燥前后试样质量差,即为水分含量;pH的测定:采用pH计[22];总酸的测定:采用酸碱滴定法[23];氨基酸态氮的测定:采用奈氏试剂比色法[24];还原糖的测定[25]:采用3,5-二硝基水杨酸法。
1.3.3 高通量测序
DNA提取:将50 g酒醅样品与100 mL提取缓冲液(40 mmol/L EDTA,50 mmol/L Tris-HCl,pH 8.0)充分混匀。在37 ℃的条件下用溶菌酶(1 mg/mL)和裂解酶(2 mg/mL)处理1 h,然后用LEE H W等[26]所描述的方法对DNA进行提取。
PCR扩增:以DNA为模板,对真菌和细菌进行PCR扩增,细菌扩增16S rRNA基因V3-V4区,采用16S rRNA的通用引物341F(5'-CCTAYGGGRBGCASCAG-3')与806R(5'-GGACTACNNGGGTATCTAAT-3')。真菌ITS内转录间隔区(internal transcribed spacer,ITS)1区,采用引物1737F(5'-GGAAGTAAAAGTCGTAACAAGG-3')与2043R(5'-GCTGCGTTCTTCATCGATGC-3')。PCR扩增体系(50 μL):2(PowerTaqMaserMix 25 μL,DNA模板1 μL,引物各1 μL,三蒸水22 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性50 s,54 ℃退火50 s,72 ℃延伸90 s,30个循环;72 ℃再延伸10 min。扩增完成后,委托美吉生物公司使用Illumina Miseq平台进行高通量测序。
1.3.4 高通量数据分析
将测序完毕的原始序列使用QIIME 2软件[27]进行质控、过滤、去嵌合体得到有效序列。将有效序列中97%相似度进行操作分类单元(operational taxonomic units,OTU)聚类。通过美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库获得微生物信息,确定产目标物质潜在的微生物种属。
1.3.5 数据分析
为了建立微生物群落与正丙醇之间的关系,分别以酒醅样品的细菌和真菌的相对丰度以及酒醅样品的理化指标作为数据,正丙醇作为变量进行冗余分析(RDA),使用CANOCO 5.0软件[28]进行。实验重复3次,通过SPSS Statistics 22.0对数据进行显著性分析,结果为“平均值±标准偏差”。P<0.05表示差异显著。
2 结果与分析
2.1 酒醅理化指标的分析结果
对24份酒醅样品的正丙醇含量进行测定,结果表明,所有酒醅样品的正丙醇含量范围在1 103~2 463.04 mg/kg之间,从中选出3份酒醅样品,分别为正丙醇含量最高的样品N41328(2 463.04 mg/kg)、正丙醇含量中等的样品N40217(1 697 mg/kg)、正丙醇含量最低的样品N30930(1 103 mg/kg),其理化指标分析结果见表1。

表1 酒醅样品的理化指标检测结果Table 1 Determination results of physicochemical indexes of fermented grains samples
由表1可知,3份酒醅样品pH值差异不显著(P>0.05);总酸含量差异显著(P<0.05),样品N30930的总酸含量最高,为8.28g/kg,比总酸含量最低的酒醅样品N40217高3.51g/kg;水分含量差异极显著(P<0.01),正丙醇含量高的酒醅样品N41328水分含量最低(42.8%),比正丙醇含量最低的酒醅样品N30930低4.8%;酒醅样品N41328还原糖含量最高,达42.5g/kg,比酒醅样品N30930高13.9g/kg;酒醅样品N41328的氨基酸态氮含量比酒醅样品N30930低0.19 g/kg,氨基酸态氮含量N41328和N40217之间差异并不显著(P<0.05),但N30930与其他两份样品酒醅差异显著(P<0.05)。表明不同正丙醇产量酒醅的水分、总酸、还原糖存在显著差异(P<0.05)。
2.2 酒醅微生物多样性分析
2.2.1 Alpha多样性分析
Chao1指数是用Chao1算法估计微生物群落中含OTU数目的指数,Chao1指数越大,表明群落的丰富度越高[29]。Shannon指数是用来估算样品中微生物群落的多样性,Shannon指数值越高,表明群落的多样性越高[30]。Coverage指数表示了样本的覆盖率,其指数越高,代表样本测序的结果反映微生物群落越完整[31]。酒醅样品中细菌、真菌菌群Alpha多样性分析结果见表2。

表2 酒醅样品中细菌及真菌菌群Alpha多样性分析结果Table 2 Alpha diversity analysis results of bacterial and fungal flora in fermented grains samples
由表2可知,所有样本的覆盖率均>0.999,说明测序结果能够完整反映各样品酒醅细菌群落组成的信息。三个酒醅样品细菌的Chao1指数在46.85~107.23之间,Shannon指数在0.93~1.76之间。三个酒醅样品的群落丰富度和多样性存在较大差异。样品N41328的群落丰富度以及群落多样性是3个样品酒醅中最高的,Chao1指数为107.23,Shannon指数为1.76。
3个样品的覆盖率均在0.999以上,证明此结果可以完整的体现出酒醅的真菌群落情况。三个酒醅样品真菌的Chao1指数在51.00~91.50之间,Shannon指数在1.49~1.92之间。其中,样品N41328的真菌菌群丰富度是三个酒醅样品中最高的,Chao1指数为91.50。N40217的真菌群落多样性最高,Shannon指数达1.92。
2.2.2 酒醅微生物群落结构分析
将平均相对丰度>1.00%的菌门或属定义为优势门或属,将不能鉴定到属水平的序列归并为“unclassified”,将其他<1.00%的属求和后归并为“others”。基于属水平的二轮出池酒醅样品中细菌菌群组成见图1。
由图1可知,3个样品中共检出3个细菌属,分别为乳杆菌属(Lactobacillus)、克罗彭斯特菌属(Kroppenstedtia)和枝芽孢杆菌属(Virgibacillus)。N41328的主要细菌属为乳杆菌属(相对丰度93.95%)、克罗彭斯特菌属(相对丰度2.53%)和枝芽孢杆菌属(相对丰度1.60%)。N40217的主要细菌属为乳杆菌属(相对丰度98.81%)。N30930的主要细菌属为乳杆菌属(相对丰度99.37%)。其中,乳杆菌属是3份样品中的共有优势细菌属。酒醅样品N41328和和N30930的乳杆菌属相对丰度差异较明显,样品N41328的乳杆菌属的相对丰度比样品N30930低5.42%,样品N41328的克罗彭斯特菌属比样品N30930高2.27%,样品N30930未检出枝芽孢杆菌属。酒醅样品N41328的克罗彭斯特菌属(Kroppenstedtia)和枝芽孢杆菌属(Virgibacillus)的相对丰度比样品N40217分别高1.71%、1.55%。由以上结果可知,3个酒醅样品的细菌群落组成差异明显,对后续相关性分析提供了良好的分析基础。

图1 基于属水平的酒醅样品的细菌菌群组成Fig.1 Composition of bacterial flora of fermented grains samples based on genus level
由图2可知,在3个酒醅样品中共鉴定出13个真菌属。与细菌群落相比,真菌群落在整个发酵过程中的群落组成更为复杂。其中,酒醅样品N41328的主要真菌属为曲霉属(Aspergillus)(相对丰度21.63%)、伊萨酵母属(Issatchenkia)(相对丰度11.11%)和毛孢子菌属(Trichosporon)(相对丰度52.55%)等。在酒醅样品N40217中,主要真菌属为曲霉属(Aspergillus)(相对丰度22.72%)、伊萨酵母属(Issatchenkia)(相对丰度41.27%)、毛孢子菌属(Trichosporon)(相对丰度9.84%)以及毕赤酵母属(Pichia)(相对丰度14.50%)等。在酒醅样品N30930中,主要真菌属为曲霉属(Aspergillus)(相对丰度49.48%)、伊萨酵母属(Issatchenkia)(相对丰度15.86%)和嗜热子囊菌属(Thermoascus)(相对丰度17.36%)等。其中,曲霉属和伊萨酵母属是3种样品中的共有优势真菌属。毕赤酵母属在酒醅样品N40217中相对丰度较高;嗜热子囊菌属在酒醅样品N30930中相对丰度较高;在酒醅样品N41328中,毛孢子菌属(Trichosporon)相对丰度较高(52.55%),比样品N40217高42.71%,在酒醅样品N30930中已检测不到毛孢子菌属(Trichosporon)。与细菌群落相比,真菌群落的差异更为明显。
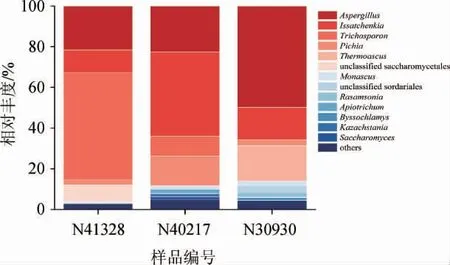
图2 基于属水平的酒醅样品的真菌菌群组成Fig.2 Composition of fungal flora of fermented grains samples based on genus level
2.3 正丙醇与微生物及理化因子的相关性分析
正丙醇与真菌、细菌、理化因子的冗余分析结果见图3。用物种样品数据及理化因子(还原糖、水分、总酸、pH值以及氨基酸态氮)对正丙醇含量做消除趋势对应分析(detrended correspondence analysis,DCA)分析,第一轴的长度<3.0,所以采用RDA进行分析。正丙醇用红色箭头表示,与真菌(a)、细菌(b)及理化因子(c)用蓝色箭头表示,双色箭头所呈夹角表示相关性,锐角为正相关,直角为不相关,钝角为负相关。箭头与原点的连线长度代表着正丙醇与细菌、真菌以及理化指标相关程度的大小,连线越长,说明相关性越大,反之越小[32]。由图3a可知,正丙醇含量97.7%的变化由真菌群落解释。毛孢子菌属(Trichosporon)与正丙醇夹角为锐角,呈正相关,曲霉属(Aspergillus)、伊萨酵母属(Issatchenkia)、嗜热子囊菌属(Thermoascus)、毕赤酵母属与正丙醇夹角为钝角,呈负相关。由图3b可知,乳杆菌属(Lactobacillus)与正丙醇的夹角为钝角,呈负相关,克罗彭斯特菌属(Kroppenstedtia)以及枝芽孢杆菌属(Virgibacillus)与正丙醇的夹角为锐角,呈正相关。由图3c可知,还原糖与正丙醇呈正相关,氨基酸态氮、总酸以及水分与正丙醇的夹角为钝角,呈负相关。

图3 正丙醇与真菌(a)、细菌(b)及理化因子(c)的冗余分析结果Fig.3 Redundancy analysis results of n-propanol with fungi (a),bacteria (b) and physicochemical factors (c)
2.4 讨论
正丙醇是白酒发酵过程中产生的主要高级醇之一。分析中国白酒发酵过程中理化因子以及微生物因素对正丙醇产出的影响,将有助于有效调控正丙醇的产生量。张春林等[33]分析了酱香型白酒二轮次堆积发酵过程中堆积酒醅微生物群落结构及演替规律,其报道的真菌优势属分别为曲霉属、毛孢子菌属和毕赤酵母属,优势细菌属分别为乳杆菌属、枝芽孢杆菌属和克罗彭斯特菌属,与本研究结果相似。卢建军等[34]研究结果表明,乳酸杆菌是白酒酿造中产正丙醇的重要微生物来源之一,其中,面包乳杆菌(Lactobacillus panis)代谢生成正丙醇的能力相对较强。曲冠颐等[35]通过接种库德里阿兹氏毕赤酵母(Pichia kudriavzevii)与短乳杆菌(Lactobacillus brevis)对高级醇的产量进行调控,结果表明菌剂的添加可以有效调控醇类物质的产出,显著降低高级醇的产量。
3 结论
本研究通过对某白酒厂正丙醇含量高、中、低三种不同酒醅样品的理化指标和微生物群落结构进行分析,结果表明,不同正丙醇产量的酒醅中水分、总酸、还原糖以及氨基酸态氮的含量差异显著(P<0.05)。正丙醇含量高的酒醅水分和氨基酸态氮的含量均较低,还原糖含量较高;酒醅中共有优势细菌属均为乳杆菌属(Lactobacillus)等,共有优势真菌属均包括曲霉属(Aspergillus)、伊萨酵母属(Issatchenkia)。RDA结果表明,酒醅的水分、氨基酸态氮、总酸、乳杆菌属、曲霉属、伊萨酵母属、嗜热子囊菌属(Thermoascus)、毕赤酵母属(Pichia)与正丙醇含量呈负相关,还原糖、毛孢子菌属(Trichosporon)、枝芽孢杆菌属(Virgibacillus)、克罗彭斯特菌属(Kroppenstedtia)与正丙醇的产量呈正相关。本研究为有效地控制正丙醇的产量,控制白酒发酵过程中的风味代谢,提高白酒质量提供了一种有效的策略。相比于实验室模拟发酵,传统白酒酿造工厂发酵过程中的微生物种类和影响因子更为复杂,今后还需深入研究白酒发酵中高级醇的产生机制,为进一步人工定向调控和降低正丙醇等高级醇含量奠定理论基础。

