基于非洲猪瘟病毒截短p72蛋白的间接ELISA抗体检测方法的建立
张文燕,王亚文,袁 晨,冯亚文,滕召剑,商佳亮,逯纪成,宋勤叶
(1.河北农业大学动物医学院,河北省兽医生物技术创新中心,保定 071000;2.河北省兽药监察所,石家庄 050051;3.保定市动物疫病预防控制中心,保定 071001)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(ASFV)引起猪的一种急性、热性、高度接触性传染病,病死率高达100%,以体温升高、全身各组织和器官广泛性出血、脾脏异常肿大为主要特征[1-2]。世界动物卫生组织(OIE)将该病列为法定报告动物疫病之一,中国将其列为一类动物传染病。2018年8月3日,中国确诊首例ASF,随后该病在中国各个地区暴发和流行,给生猪养殖业造成了极大的经济损失[3-4]。2021年国内猪场出现基因突变或缺失的低毒力毒株[5-6]。该突变毒株感染猪的潜伏期和病程延长,感染猪排毒不规律,且排毒时间延长,致使ASF的防控难度加大。由于目前尚无预防和治疗ASF的有效疫苗和药物,故应用特异、敏感的病原和血清学检测技术,准确检测、排查和清除感染猪是控制本病的重要措施之一[4]。
ASFV是目前已知的唯一DNA虫媒病毒,也是非洲猪瘟病毒科(Asfarviridae)非洲猪瘟病毒属(Asfivirus)的唯一成员。目前,已知的不同毒力的ASFV毒株分为8个血清群、24种基因型[7]。24种基因型在非洲均有流行,中国流行的主要为基因Ⅱ型,与格鲁吉亚毒株为同一个分支。2021年在河南和山东有流行基因Ⅰ型的报道[8]。ASFV基因组长170~193 kb,包含151~167个开放阅读框(ORFs),编码150~200种蛋白质(68个结构蛋白和100多个非结构蛋白)[9-10]。这些蛋白与病毒的复制、结构形态、入侵感染及诱导宿主抗感染免疫等有关。p72是ASFV二十面体的主要组成部分,对病毒衣壳的形成起着重要作用。该蛋白由B646L基因编码,大小为73.2 ku,在病毒感染晚期表达,能诱导机体产生高效价的特异性抗体,并且在不同分离株之间高度保守,故p72是ASFV感染检测与诊断的重要靶标[10-11]。ELISA是OIE推荐的ASF临床血清学检测技术,国内虽然有基于p72蛋白的ELISA抗体检测技术的研究报告[12-14],但目前尚缺乏理想的ASFV抗体检测试剂盒。故本研究以p72为靶标,建立了ELISA抗体检测方法,旨在为ASF的血清学检测与临床诊断提供重要技术支持。
1 材料与方法
1.1 菌株
大肠杆菌Rosetta(DE3)感受态细胞,由河北农业大学传染病实验室保存。pET28a-p72s表达菌种[12],由河北农业大学传染病实验室构建与保存。
1.2 材料和主要试剂
ASFV抗体标准阳性、阴性猪血清以及临床采集的无疾病症状的猪的血清样本,由保定市动物疫病预防控制中心提供;HRP-羊抗猪IgG购自北京索莱宝生物技术有限公司;ASFV多抗原(p32、p62和p72)间接ELISA试剂盒购自IDVET公司;猪伪狂犬病病毒(PRV)、猪瘟病毒(CSFV)和猪繁殖与呼吸综合征病毒(PRRSV)抗血清均购自IDEXX公司;猪圆环病毒2型(PCV2)抗血清由河北农业大学传染病实验室制备与保存。
1.3 重组p72s的制备
复苏pET28a-p72s表达菌种,按照 1∶100的比例接种到新鲜Kana+/LB液体培养基中,37 ℃下振摇培养至对数期(D600 nm值达到约0.6~0.8)时,加入终浓度为0.5 mmol/L的IPTG,26 ℃诱导培养5 h;8 000 r/min离心7 min收集菌体沉淀,于4 ℃超声裂解菌体35 min(超声2 s、间歇2 s、振幅30%);10 000 r/min离心15 min后,分别取上清液和沉淀进行SDS-PAGE(分离胶浓度为12%,下同),检测蛋白的表达情况。进而用Ni-Agarose His标签蛋白纯化试剂盒纯化p72s蛋白,经SDS-PAGE检测蛋白的纯化结果。同时对蛋白进行Western blotting鉴定,即取p72s蛋白进行SDS-PAGE,然后将蛋白转印到醋酸纤维膜上;将膜置入5%脱脂奶粉的封闭液中,于4 ℃下孵育过夜;洗膜,加入1∶200倍稀释的标准ASFV抗血清,室温孵育2 h,同时设立标准ASFV阴性血清对照;洗膜,加入1∶4 000稀释的HRP-羊抗猪IgG,室温孵育1.5 h;洗膜,将膜置于DAB显色液中显色至条带清晰。
1.4 ELISA方法的建立
1.4.1 抗原包被浓度与待检血清稀释倍数的确定 采用方阵滴定法同时确定抗原包被浓度和待检血清稀释倍数。即将重组p72s稀释为0.5、1.0、2.0、4.0 μg/mL,100 μL/孔加入酶标板,每个浓度重复2孔;将酶标板置37 ℃孵育1 h,4 ℃过夜;次日弃去包被液,用PBST(含0.05% Tween-20的0.01 moL/L PBS,pH 7.4)洗涤3次,3 min/次;加入封闭液(含5%犊牛血清的PBST)于37 ℃封闭1 h;分别将1∶50~1∶1 600倍比稀释的阳性、阴性血清加入到不同浓度抗原包被的相应孔内,组成方阵,每孔100 μL,于37 ℃条件下反应1 h;洗板3次(洗涤方法同前),每孔加入100 μL HRP-羊抗猪 IgG(1∶2 500稀释),于37 ℃反应45 min;洗板,加入底物(TMB)显色液,100 μL/孔,室温避光显色15 min;每孔加入50 μL 2 mol/L H2SO4终止反应。在酶标检测仪上测定样本D450 nm值,并计算阳性血清(P)与阴性血清(N)D450 nm值的比值(P/N值),以确定抗原最佳包被浓度和待检血清的最佳稀释倍数。
1.4.2 封闭液与酶标抗体工作浓度的确定 将4种封闭液(含5%犊牛血清、5%脱脂奶粉、1%明胶和2%BSA的PBST)分别与1∶500、1∶1 000、1∶2 500、1∶5 000倍比稀释的HRP-羊抗猪IgG组成方阵,进行ELISA,每个组合重复2孔。操作过程同1.4.1。根据P/N值的大小,确立最佳封闭液和酶标抗体的最佳稀释倍数。
1.4.3 反应条件的确定 通过单一变量法优化ELISA的反应条件,即将一定浓度的重组p72s加入到酶标板的相应孔内后,分别于37 ℃孵育2 h后4 ℃过夜、37 ℃孵育1 h后4 ℃过夜及4 ℃过夜等条件下包被抗原,然后按照1.4.1所述的操作过程进行ELISA,根据P/N值确定最佳抗原包被条件。随后依次对封闭条件(分别于37 ℃和室温条件下封闭1和2 h)、待检血清反应条件(37 ℃或室温下反应30或60 min)、酶标抗体反应条件(37 ℃或室温下反应30、45或60 min)及显色条件(室温避光显色10、15、20、25和30 min)进行优化,确定ELISA的最佳反应条件。每个反应条件均重复1次。
1.4.4 阴阳性临界值的确定 通过ELISA检测ASFV抗体标准阳性血清和阴性血清各100份,每份血清重复1孔。用GraphPad Prism5.0软件绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算判定特异抗体阴、阳性临界值,并应用SPSS 26.0数据统计分析软件对100份阴性血清D450 nm值进行正态分布分析,评价阴阳性临界值划分的准确性。
1.4.5 特异性试验 以建立的ELISA检测PRV-gE、PRV-gB、PCV2、CSFV、PRRSV抗体阳性血清,同时设立ASFV阳性对照与阴性对照,每份血清重复2孔。检验其他病毒抗体血清与p72s的交叉反应情况,评价建立方法的特异性。
1.4.6 敏感性检测 分别用建立的ELISA和商品试剂盒检测5份(1#~5#)1∶100~1∶12 800倍比稀释的ASFV抗体标准阳性血清(每个稀释度重复2孔),分析建立方法与试剂盒检测的血清抗体效价。同时用分光光度计(NanoDrop2000)测定所建立的ELISA方法和试剂盒可检测的血清中的最低蛋白含量。根据上述结果综合评价建立方法的检测灵敏度。
1.4.7 重复性试验 用同一批次或3个批次的p72s蛋白包被酶标板,检测9份临床血清样品,根据检测结果,分别计算ELISA的变异系数,评价ELISA的批内与批间重复性。
1.5 初步应用、符合率检验及Western blotting验证
同时用建立的方法和试剂盒检测124份血清样本,比较两者检测结果的符合率。随机选择p72s-ELISA与试剂盒检测均为阳性的血清5份,试剂盒检测为阴性而p72s-ELISA检测为阳性的血清5份,以及p72s-ELISA与试剂盒检测均为阴性的血清5份,进一步用Western blotting验证。Western blotting的主要步骤:将SDS-PAGE后的p72s蛋白转印到PVDF膜上,于4 ℃下封闭过夜;洗膜,加入待检猪血清(1∶100稀释),室温孵育2 h;洗膜,加入HRP-羊抗猪IgG(1∶4 000稀释),室温孵育1.5 h;洗膜,将膜置于DAB显色液中于暗处显色,观察结果。
2 结 果
2.1 重组p72s蛋白的制备
收集IPTG诱导5 h后的pET28a-p72s表达菌,超声波裂解后进行SDS-PAGE检测,可见以包涵体形式表达的目的蛋白条带,蛋白分子质量约42 ku(图1A),与预期大小相符。蛋白经镍柱纯化后,电泳无肉眼可见杂蛋白(图1B)。Western blotting鉴定结果显示,重组p72s蛋白能够与标准ASFV抗血清反应,在42 ku处显示目的条带,而与ASFV抗体阴性血清不发生反应(图1C)。
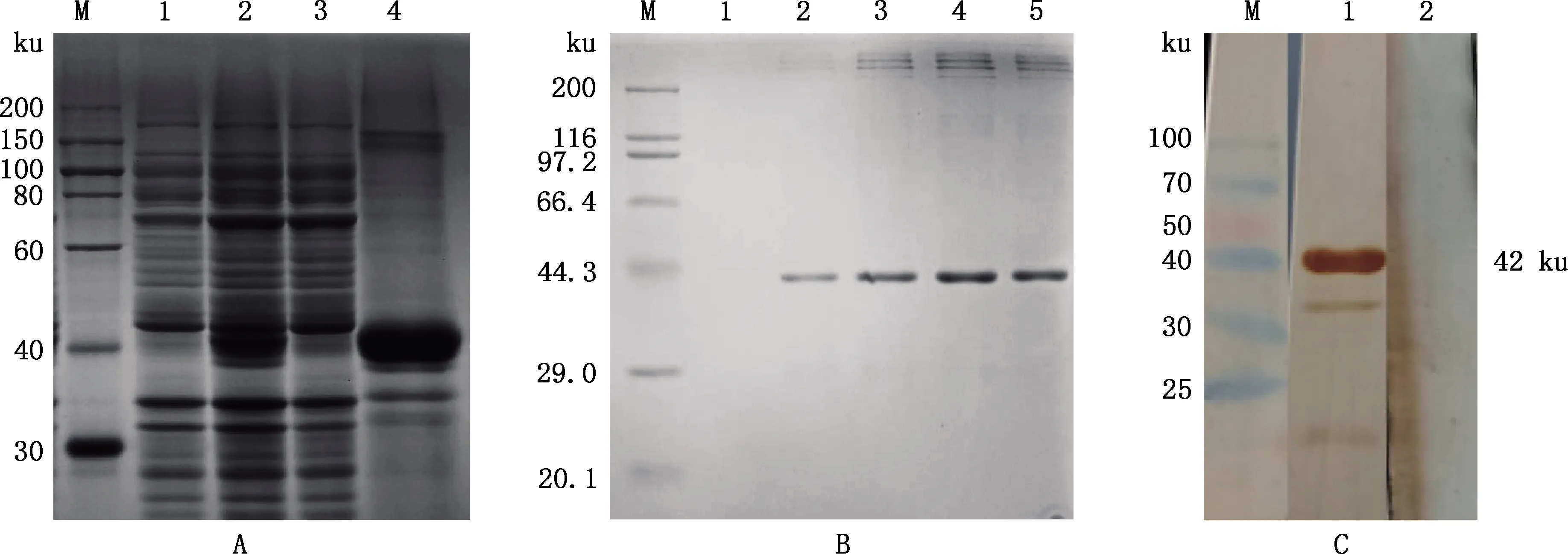
A,重组p72s的表达及其表达形式:M,蛋白质分子质量标准;1、2,分别为细菌诱导前与诱导后的产物;3、4,分别为菌体裂解后的上清液与沉淀。B,重组p72s的纯化:M,蛋白质分子质量标准;1,蛋白洗脱液;2~5,纯化蛋白样品。C,重组p72s的Western blotting鉴定:M,蛋白质分子质量标准;1,重组p72s与ASFV阳性血清反应;2,重组p72s与ASFV阴性血清反应
2.2 最佳抗原包被浓度和待检血清的稀释倍数
当重组p72s以0.5~4.0 μg/mL包被、待检血清1∶50~1∶100稀释时,阳性血清的D450 nm值在1.108~2.612之间,阴性血清的D450 nm值在0.166~0.366之间,此时的P/N值为5.363~8.448,高于其他组合的P/N值(表1)。但当血清1∶100稀释,蛋白包被浓度为4.0 μg/mL时,阴性血清的D450 nm值高于0.5 μg/mL包被时的D450 nm值,故本试验确定ELISA的最适抗原包被浓度为0.5 μg/mL,待检血清的稀释度为1∶100。
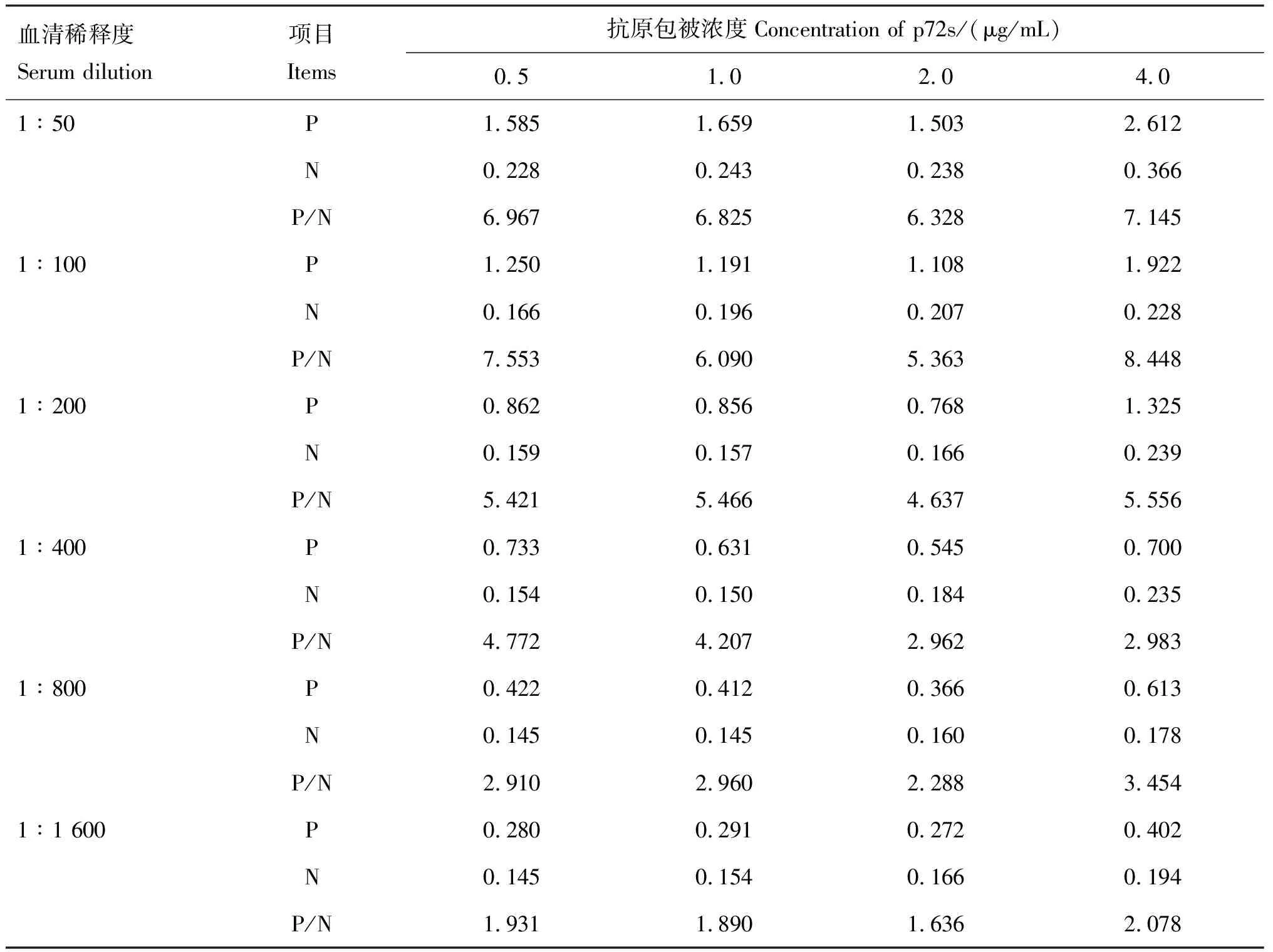
表1 最适抗原包被浓度和血清稀释度的确定(D450 nm值)
2.3 最佳封闭液和酶标抗体的稀释倍数
由表2可知,以1%明胶和2%BSA作为封闭液时,阴性血清的D450 nm值在0.188~1.242之间,特异性不好,故首先排除这两种封闭液。比较5%犊牛血清和5%脱脂奶粉作为封闭液时的P/N值时发现,后者的P/N值明显高于前者,且用5%脱脂奶粉作为封闭液、酶标抗体作1∶5 000稀释时,阴性血清的D450 nm值最低,且P/N值(15.019)较高。故确定ELISA的封闭液为5%脱脂奶粉,酶标抗体稀释度为1∶5 000。
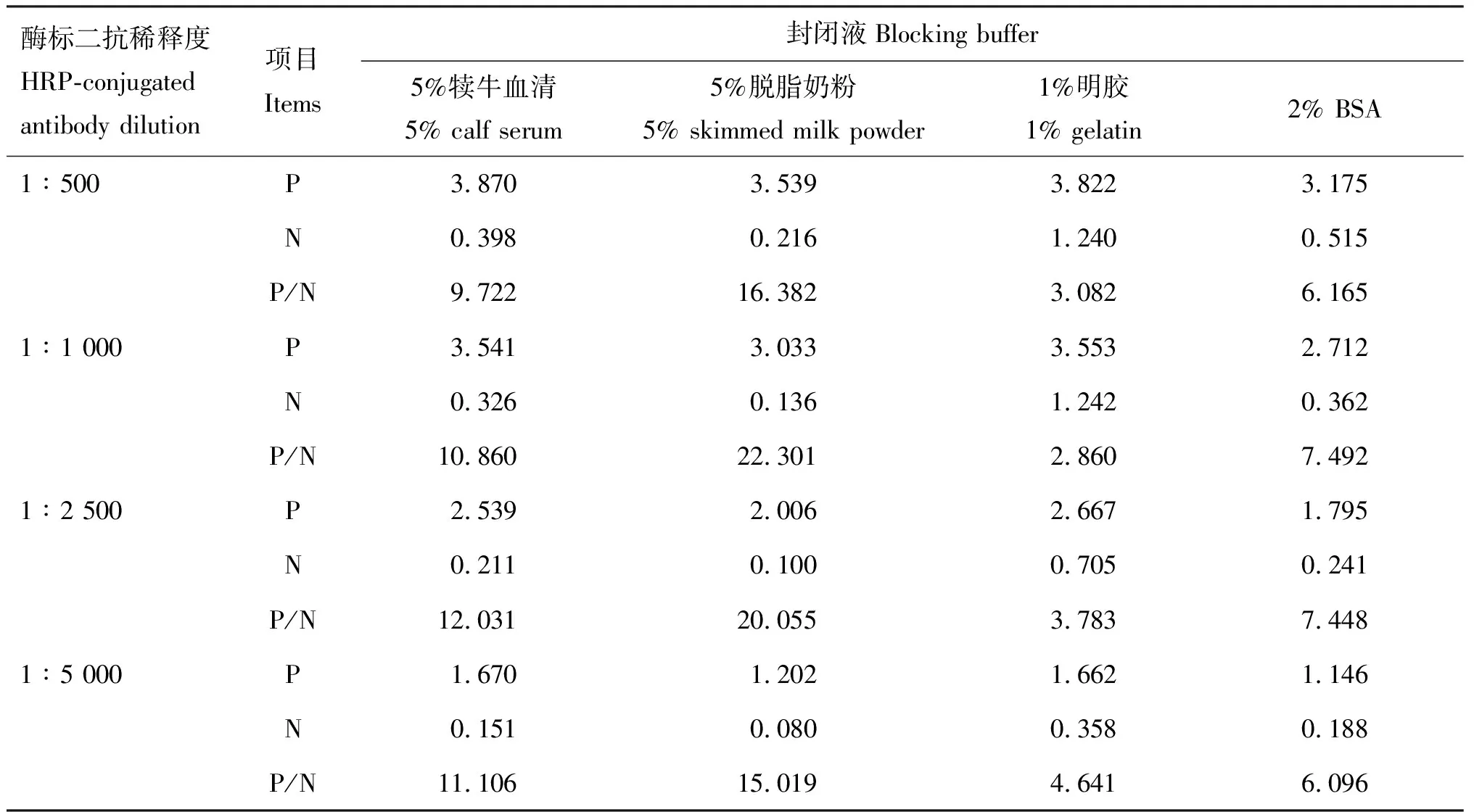
表2 最佳封闭液和酶标抗体稀释度的确定(D450 nm值)
2.4 最佳反应条件
通过比较不同反应条件下的P/N值,发现当抗原包被酶标板后于37 ℃孵育1 h,再于4 ℃吸附过夜,加入封闭液于37 ℃封闭1 h或者于室温下封闭2 h,抗原与待检血清在37 ℃反应60 min,待检血清与酶标抗体在37 ℃反应45 min,底物于室温避光显色20 min时,ELISA的P/N值最大,分别为22.523、16.232或16.788、12.297、9.916和17.413,故确定上述条件为所建立的ELISA(p72s-ELISA)方法的最佳反应条件。
2.5 阴阳性临界值测定结果
应用ROC曲线分析p72s-ELISA检测的100份抗ASFV标准阳性和100份标准阴性血清的D450 nm值,结果显示曲线下面积(AUC)为0.999(95%CI=0.9954~1.0000),以0.365为临界值,约登指数(0.99)最大,灵敏度为0.99(95%CI=0.9455~0.9997),特异性为1(95%CI=0.9638~1.0000),故当D450 nm值≥0.365时,判定为阳性;当D450 nm值<0.365时,判定为阴性(图2A)。进一步对上述100份阴性血清的D450 nm值进行的正态分布分析,结果显示p72s-ELISA偏度系数为0.156,峰度系数—0.487,均<1,单样本K-S检验结果显示P=0.200(图2B)。表明p72s-ELISA的检测结果服从正态分布。
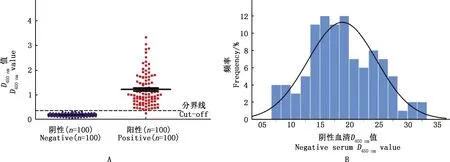
A,临界值;B,正态分布分析
2.6 特异性试验结果
用p72s-ELISA方法检测PRV-gE、PRV-gB、PCV2、CSFV和PRRSV抗血清时,D450 nm值均低于临界值(0.365)(图3),表明p72s-ELISA方法具有良好的特异性。
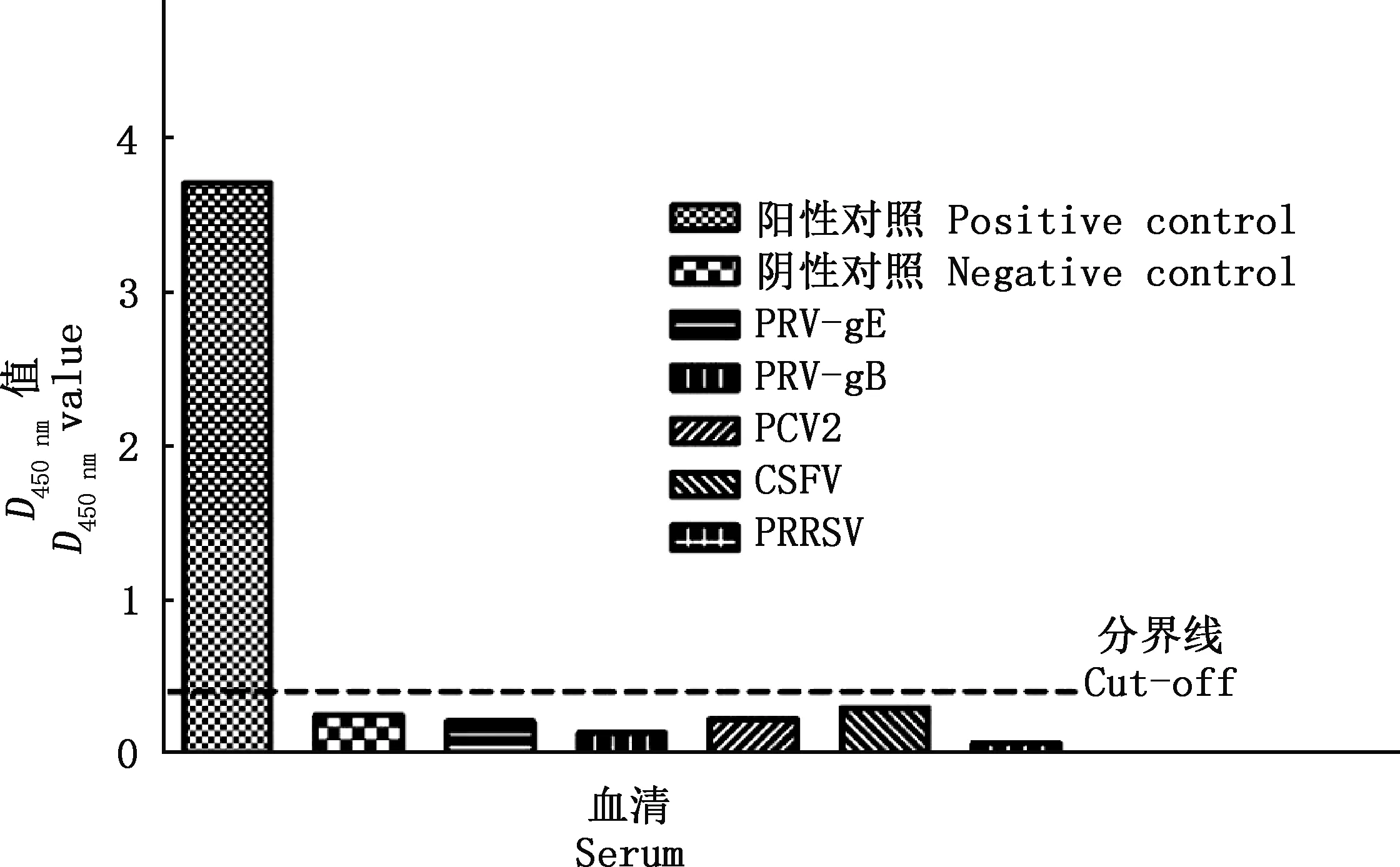
图3 p72s-ELISA的特异性检测
2.7 敏感性检测结果
用p72s-ELISA和商品试剂盒同时检测5份ASFV抗体标准阳性血清,结果p72s-ELISA检测的血清抗体效价分别为1∶800、1∶1 600、1∶800、1∶800和1∶800,试剂盒检测的抗体效价分别为:1∶200、1∶200、阴性、1∶800和1∶800(图4)。p72s-ELISA和试剂盒可检测到相应血清的总蛋白含量分别在0.091~0.153和0.110~0.554 mg/mL之间。上述结果表明,建立的p72s-ELISA方法具有很高的敏感性。
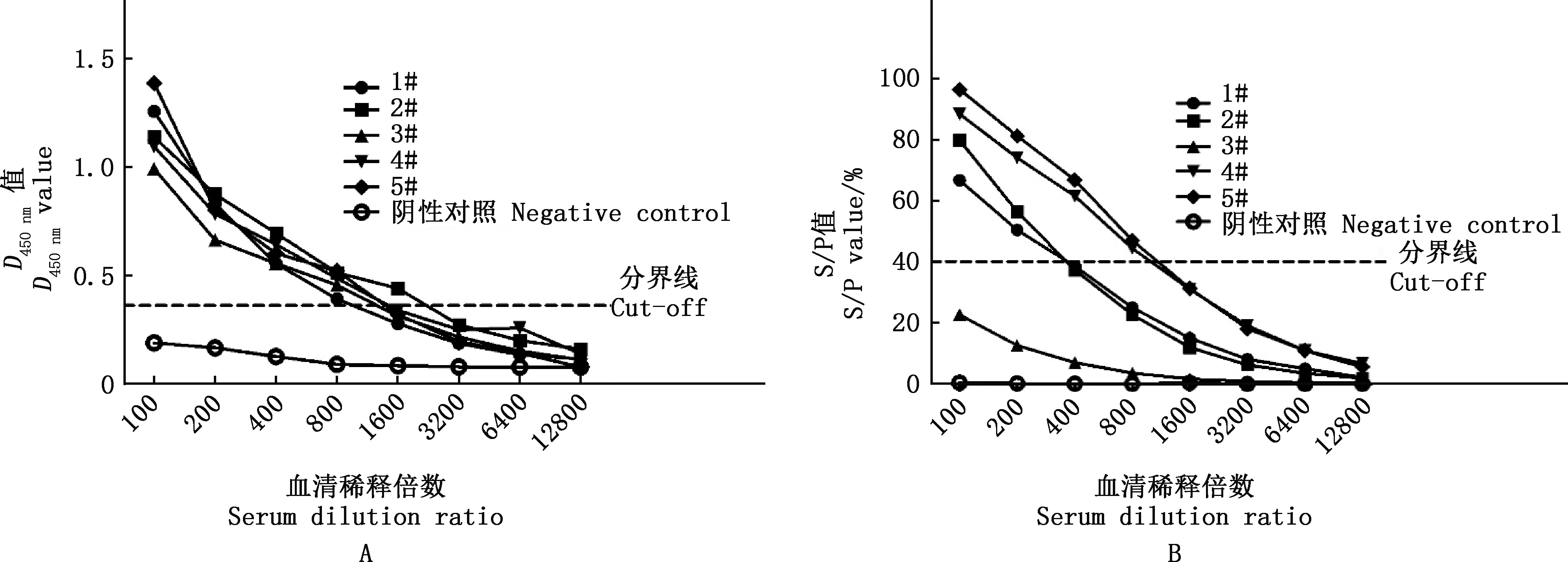
图4 p72s-ELISA(A)与商品试剂盒(B)的敏感性比较
2.8 重复性试验结果
分别用同一批次和不同批次的p72s-ELISA检测9份血清,结果如表3与表4所示,批内重复性试验的变异系数(CV)为0.736%~9.158%,批间重复性试验的变异系数为2.944%~8.205%,均低于10%。该结果表明,建立的ELISA方法均具有良好的重复性。
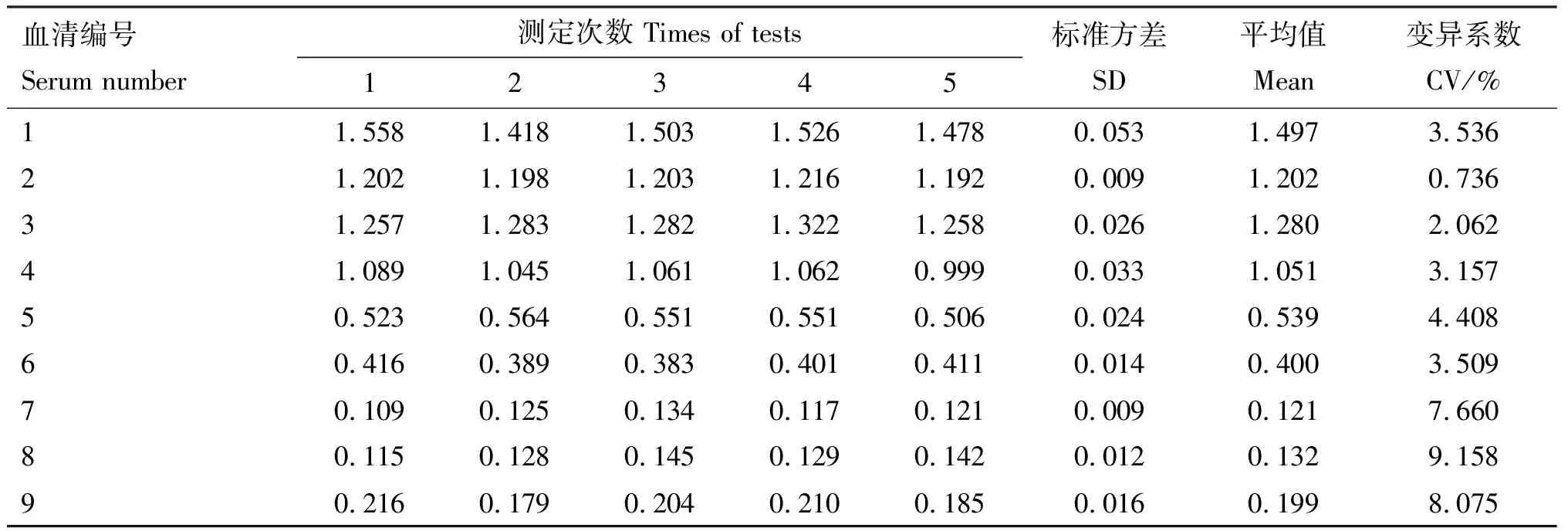
表3 p72s-ELISA批内重复性试验结果(D450 nm值)
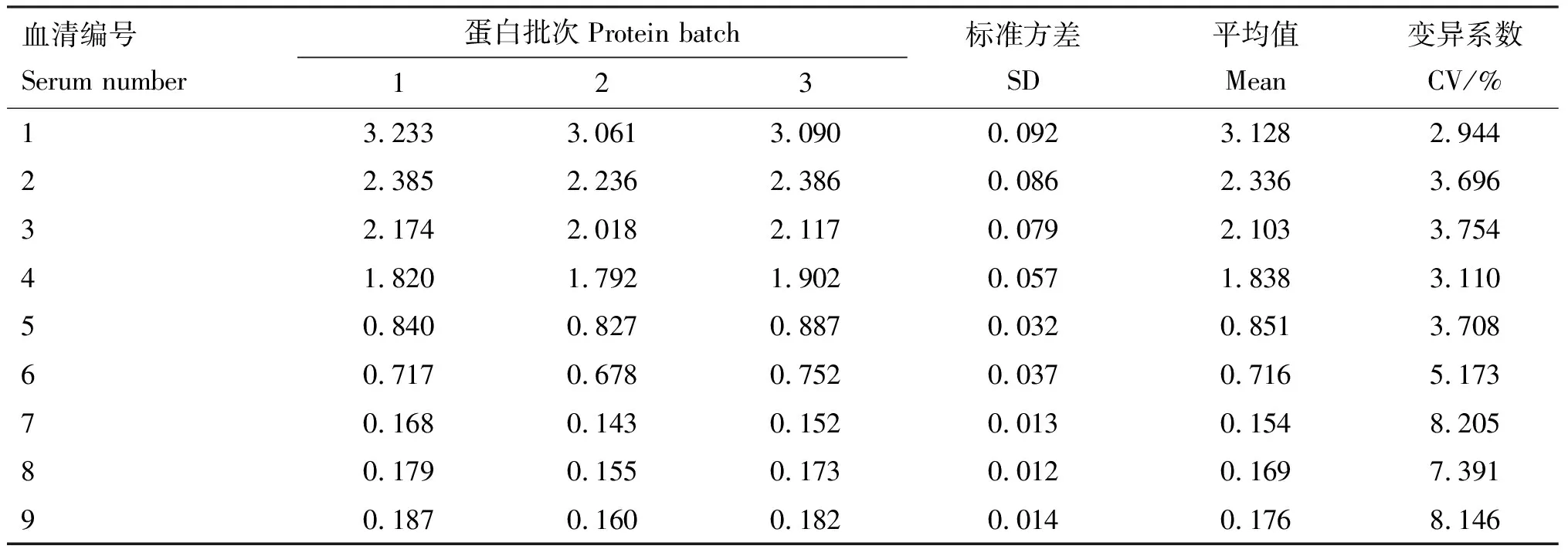
表4 p72s-ELISA批间重复性试验结果(D450 nm值)
2.9 初步临床应用、符合率及验证
分别用建立的p72s-ELISA和商品试剂盒检测124份血清样本,结果如表5所示,p72s-ELISA和商品试剂盒的ASF抗体阳性检出率分别为75.81%(94/124)和32.26%(40/124),ASF抗体阴性检出率分别为24.19%(30/124)和67.74%(84/124)。p72s-ELISA与商品试剂盒的阳性符合率为100%,阴性符合率为35.71%,总符合率均为56.45%。进一步用Western blotting对p72s-ELISA与试剂盒检测结果相符和不符的15份血清进行验证,结果显示,p72s-ELISA与试剂盒检测结果同为阳性、试剂盒检测为阴性而ELISA检测为阳性的血清,Western blotting检测均出现目的条带;试剂盒和ELISA检测均为阴性的血清无目的条带出现(图5)。上述结果表明,p72s-ELISA的检测结果与Western blotting检测结果完全一致,其ASFV抗体阳性检出率高于商品试剂盒。
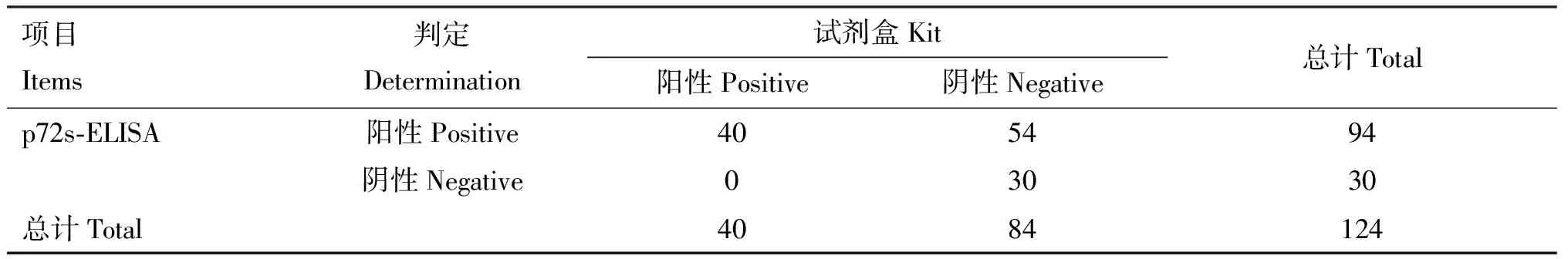
表5 p72s-ELISA与ELISA试剂盒的符合率

M,蛋白质分子质量标准;1~5,p72s-ELISA与试剂盒检测均为抗体阳性的血清;6~10,p72s-ELISA检测抗体阳性、试剂盒检测为抗体阴性的血清;11~15,p72s-ELISA与试剂盒检测均为阴性的血清;16,阳性对照;17,阴性对照
3 讨 论
ASF在全球的流行区域不断增加,快速检测和及时确诊感染猪或发病猪是有效控制该病的主要措施。已知随着ASFV毒株的毒力、感染途径、感染剂量及宿主的抵抗力不同,ASF的临床经过表现为最急性、急性、亚急性和慢性型等多种形式,致使该病的临床症状与病理变化复杂多样[1-2],尤其是ASFV变异减毒株在中国猪场的出现,增加了非洲猪瘟流行的隐蔽性,同时给该病的临床诊断和防控带来了新的挑战[5-6]。应用PCR检测唾液和血液样本中的病毒核酸是筛查ASFV感染猪的重要手段[1-2],但由于ASFV慢性和亚临床感染猪的排毒没有规律,仅仅依靠PCR检测,常出现漏检现象,故需要结合抗体检测结果,以保证筛检的准确性[1-2]。鉴于此,不断改进和完善诊断与监测手段对于ASF的有效防控至关重要。
ELISA是广泛用于快速检测特异性抗体的常用检测技术,其不仅敏感性和特异性高,而且适于样本的批量检测和商品化。用于ELISA的检测抗原可以是完整的病原微生物,也可以是来自病原微生物或体外表达的蛋白。由于ASF是中国规定的一类动物疫病,培养和纯化ASFV需要生物安全防护3级(P3)实验室,培养与纯化病毒成本高,并且在操作过程中存在散毒的安全隐患,而应用原核或真核表达系统表达的蛋白作为检测抗原,具有特异、敏感、成本低、安全等优势。因此,现在常通过体外表达手段,制备目标蛋白作为ELISA用抗原[13-16]。相对于真核表达系统,原核表达系统操作简单、成本低,所以本试验采用原核表达系统来表达p72s蛋白。
ELISA结果的临界值确定直接关系到检测结果的准确性,临界值过高或过低会导致检测结果出现假阴性或假阳性。为了保证建立方法结果判定的客观性,本研究采用ROC曲线分析方法确定阴阳性临界值,同时对已知阴性样本进行正态分布分析。已知进行ROC曲线分析时,常用约登指数来评判方法的准确性,约登指数越大说明所建立方法的灵敏度越高、特异性越强[17-18]。本试验中约登指数的最大值为0.99,AUC为0.999,并且样本检测结果服从正态分布,说明所建立方法同时具有很高的灵敏度、特异性与客观性。建立的p72s-ELISA方法与常见的CSFV、PRRSV、PRV等病毒无交叉反应,批内与批间重复试验的变异系数均低于10%,说明所建立的方法的特异性高、重复性好,这些特征与文献[13-15]报道的相似。但本研究不仅与商品试剂盒进行了比较,发现建立方法的敏感性和对血清样本的阳性检出率更高,而且为了确保检测结果的准确性,还应用Western blotting对ELISA的结果进行验证,其结果与ELISA的检测结果完全一致,说明建立的ELISA方法具有更高的检测敏感性与准确性。
4 结 论
本研究建立了基于ASFV截短p72蛋白的间接ELISA抗体检测方法,该方法的抗原最佳包被浓度为0.5 μg/mL,待检血清的稀释度为1∶100;与PRV、PCV2、CSFV和PRRSV等病毒抗血清均无交叉反应;能检测到ASFV抗血清中的总蛋白量为0.091~0.153 mg/mL,具有良好批内与批间重复性;对血清样本的阳性检出率高于商品试剂盒。建立的间接ELISA方法可以为ASF的血清学调查、临床诊断及其综合防控提供重要技术支撑,具有显著的应用开发潜力。

