银黑狐MC1R基因核心启动子区的鉴定
刘华云,张 磊,徐桂利,张天浩,谢遇春,段玲欣,刘铮铸,巩元芳
(河北科技师范学院动物科技学院,河北省特色动物种质资源挖掘与创新重点实验室,秦皇岛066004)
狐狸是中国重要的毛皮动物,分狐属和北极狐属2个属,银黑狐是狐属狐中的一个种[1]。狐狸毛色不仅是识别狐种的重要表型性状,也是衡量其毛皮质量的重要经济性状。黑色素是哺乳动物毛色形成的重要物质基础,分为真黑色素和褐黑色素,真黑色素使毛色呈黑色,褐黑色素使毛色呈黄色或红色,真黑色素和褐黑色素的分布决定哺乳动物毛色的深浅。黑色素的合成是一个复杂的调控网络,受多个基因的调控[2]。黑素皮质激素受体1(melanocortin 1 receptor,MC1R)基因是参与黑色素合成的重要功能基因,该基因编码区只有1个外显子,通过调节cAMP通路促进黑色素表达中真黑色素的合成[3]。
研究表明,MC1R基因主要存在于哺乳动物毛囊和皮肤的黑色素细胞中,与皮肤或被毛色素的沉积紧密相关[4-5]。刘玲玲等[6]利用全基因组关联分析发现MC1R基因与马毛色性状有关。王晓薇等[7]研究发现,MC1R基因在黑斑滩羊皮肤组织中表达量极显著高于纯白滩羊、显著高于褐斑滩羊,说明MC1R基因的高表达有利于真黑色素的形成,进而促进细胞中黑色素含量的增加。南瑞鹏等[8]研究发现,MC1R基因在羊驼毛囊干细胞中高效表达,间接促进小眼畸形相关转录因子(microphthalmia-associated transcription factor,MITF)和酪氨酸酶(tyrosinase,TYR)基因的表达,说明羊驼毛色形成受多个基因的调控。因此,MC1R基因在动物毛色合成过程中有着重要的调控作用,其通过促进真黑色素的合成继而影响动物深毛色的形成。
基因在真核生物中的表达是一个复杂的过程,依赖于多层次的调控,其中转录水平的调控是影响真核生物基因表达的重要一步。启动子是基因的一个组成部分,控制基因表达(转录)的起始时间和表达程度,通过对启动子区的研究有助于了解基因的结构、功能及表达调控机制[9-11]。目前,MC1R基因启动子区在人、小鼠中研究较为成熟[12],但在狐狸中鲜有报道。鉴于此,本研究利用PCR扩增、生物信息学预测及双荧光素酶报告基因检测等技术对银黑狐MC1R基因核心启动子区进行了鉴定与分析,以期为深入研究该基因对狐狸毛色的调控机制提供参考。
1 材料与方法
1.1 材料
1.1.1 试验动物 银黑狐来自秦皇岛市昌黎金岛育种场,随机选取1只健康成年银黑狐,剪去背部被毛,用取肤器采集背部皮肤组织样品并立即放入液氮中,后转入―80 ℃保存备用。
1.1.2 主要试剂 大肠杆菌DH5α感受态细胞、pMD19-T载体、T4 DNA连接酶、限制性内切酶SacⅠ和Hind Ⅲ均购自TaKaRa公司;pGL3-Basic表达载体、pRL-TK载体和双荧光酶检测试剂盒Dual-Luciferase®Reporter Assay System均购自Promega公司;皮肤黑色素瘤细胞株(B16细胞)购自北京协和细胞资源中心;DMEM培养基(高糖型)购自HyClone公司;胎牛血清购自Gibco公司。
1.2 基因组DNA提取
参照Sambrook等[11]方法从银黑狐皮肤组织样中提取基因组DNA,TE溶解,―20 ℃保存备用。
1.3 银黑狐MC1R基因5′-UTR区序列获取
1.3.1 引物设计及合成 根据GenBank中犬MC1R基因5′-UTR区序列(登录号:NM_001014282)和银黑狐MC1R基因编码区序列(登录号:KJ489060),利用Primer Premier 3.0引物设计软件对银黑狐MC1R基因5′-UTR区设计引物,F:5′-GAGCTCTGTTCTCTCAGCCTCCTCAC-3′;R:5′-AAGCTTGAAGTGAGGGGTGGTTGG-3′,预计扩增片段大小为2 781 bp。引物由生工生物工程(上海)股份有限公司合成。
1.3.2 PCR扩增 PCR反应体系50 μL:银黑狐基因组DNA 1 μL,10×PCR Buffer 5 μL,2.5 mmol/L dNTPs 4 μL,上、下游引物各1 μL,Taq酶1 μL,ddH2O 37 μL。PCR反应条件:94 ℃预变性5 min;98 ℃变性10 s,55 ℃退火15 s,68 ℃延伸3 min,共30个循环;72 ℃延伸10 min;4 ℃保存。PCR扩增产物用1.5%琼脂糖凝胶电泳检测,取鉴定正确的扩增产物纯化回收后克隆至pMD19-T载体,连接体系10 μL:载体 1 μL,DNA回收产物 4 μL,Solution Ⅰ 5 μL。离心混匀后,16 ℃过夜连接。连接产物转化大肠杆菌DH5α感受态细胞,37 ℃摇床培养,将菌液PCR鉴定为阳性的样品送生工生物工程(上海)股份有限公司进行测序。
1.4 银黑狐MC1R基因核心启动子区预测分析
利用3个在线生物学软件Neural Network Promoter Prediction(http:∥www.fruitfly.org/seq_tools/promoter.html)、Promoter 2.0(http:∥www.cbs.dtu.dk/services/Promoter/)和TSSW(http:∥www.softberry.com/berry.phtml?topic=tssw&group=programs&subgroup=promoter)依次对银黑狐MC1R基因启动子核心区进行预测。
1.5 银黑狐MC1R基因核心启动子区确定
在软件预测的基础上,利用荧光素酶报告基因检测技术进一步确定银黑狐MC1R基因的核心启动子区。
1.5.1 引物设计及PCR扩增 根据软件预测结果,在起始密码子上游依次截取10个片段(图1),分别设计相应的引物(表1),在上、下游引物的5′-端分别引入SacⅠ、Hind Ⅲ酶切位点及相应的保护碱基以便于克隆。引物均由生工生物工程(上海)股份有限公司合成。缺失片段PCR扩增体系与程序同1.3.2,PCR产物用1.5%琼脂糖凝胶电泳检测。
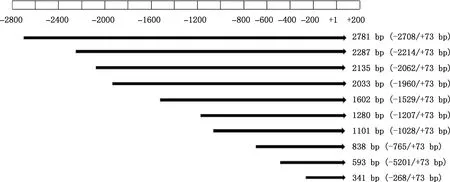
图1 银黑狐MC1R基因启动子缺失片段示意图

表1 银黑狐MC1R基因启动子区缺失片段引物
1.5.2 目的片段克隆及鉴定 PCR产物经琼脂糖凝胶电泳纯化回收后连接至pMD19-T载体上,具体方法同1.3.2,将菌液PCR鉴定为阳性的样品送往华大基因公司进行测序。
1.5.3 重组质粒构建及鉴定 对于不同长度的重组载体pMD19-T和pGL3-Basic,利用SacⅠ和Hind Ⅲ进行双酶切。酶切体系50 μL:质粒 13 μL,Buffer 5 μL,SacⅠ和Hind Ⅲ各3 μL,ddH2O补足体系。37 ℃酶切6 h。酶切产物进行切胶回收并进行双酶切验证,验证后选取相应扩增片段与pGL3-Basic连接,连接体系10 μL:目的片段质粒4 μL,pGL3-Basic 1 μL,Solution Ⅰ 5 μL。16 ℃过夜连接。共构建10个荧光素酶报告基因重组质粒,分别命名为:pGL3-MC1RP0(-2 708/+73 bp)、pGL3-MC1RP1(-2 214/+73 bp)、pGL3-MC1RP2(-2 062/+73 bp)、pGL3-MC1RP3(-1 960/+73 bp)、pGL3-MC1RP4(-1 529/+73 bp)、pGL3-MC1RP5(-1 207/+73 bp)、pGL3-MC1RP6(-1 028/+73 bp)、pGL3-MC1RP7(-765/+73 bp)、pGL3-MC1RP8(-520/+73 bp)和pGL3-MC1RP9(-268/+73 bp)。菌液经PCR扩增及酶切鉴定后,选取阳性重组质粒测序。对阳性菌液提取无内毒素质粒,并检测其浓度和纯度。
1.5.4 细胞培养与重组质粒瞬时转染 取出B16细胞复苏后,接种于含10%胎牛血清的高糖DMEM培养基中,置于37 ℃、5% CO2恒温细胞培养箱中培养,细胞每1~2 d用胰酶消化传代。复苏后的细胞培养3代后用于重组质粒的瞬时转染(瞬转)试验。转染前12~24 h,将生长状态良好的B16细胞接种于24孔板内,每孔接种5×104~10×104个细胞。当细胞汇合度为80%~90%时,按照Xfect Transfection Reagent操作步骤进行相应质粒转染;转染时每孔加入质粒总量为5 μg(pGL3相关重组质粒与内参质粒pRL-TK质量比为100∶1),转染试剂量为15 μL。对照组为pGL3-Basic与pRL-TK共转染,试验组为pGL3相关重组质粒与pRL-TK共转染。每组进行3个复孔的转染,且进行3次以上重复试验。转染48 h后收集细胞,用于双荧光素酶的活性检测。
1.5.5 双荧光素酶活性检测 根据双荧光酶检测试剂盒Dual-Luciferase®Reporter Assay System说明书进行报告基因表达水平的检测,具体方法为:弃掉24孔板中的细胞培养液,用1×PBS洗涤细胞2次;加入150 μL细胞裂解液(1×PLB),轻轻吹打完全细胞;室温放置15 min后,收集细胞裂解产物;取20 μL细胞裂解产物至荧光测定管中,加入100 μL检测试剂(firefly luciferase,LARⅡ),混匀后使用GloMax-MultiJr单管型多功能检测仪检测萤火虫萤光素酶活性;迅速加入100 μL Stop&GLO试剂,测定作为内标的Renilla荧光素酶活性。萤火虫荧光素酶活性/Renilla荧光素酶活性的比值即为荧光素酶的相对活性(relative luciferase activity,RLA)。
1.5.6 统计分析 利用SPSS 22.0统计软件对数据进行单因素方差分析(One-Way ANOVA),数据用平均值±标准差表示,P<0.05代表组间存在统计学差异,具有统计学意义。
2 结 果
2.1 银黑狐MC1R基因5′-UTR区序列获取
以银黑狐基因组DNA为模板进行PCR扩增,扩增产物经1.5%琼脂糖凝胶电泳检测后,有一条长约2 781 bp的清晰条带(图2),与目的片段大小相符。PCR扩增产物克隆到pMD19-T载体后送测序,结果显示,克隆所获目的片段与GenBank中犬MC1R基因5′-UTR区序列(登录号:NM_001014282)相似性达93.97%,表明已成功获得银黑狐MC1R基因2 781 bp(-2 708/+73 bp)的5′-UTR区序列。
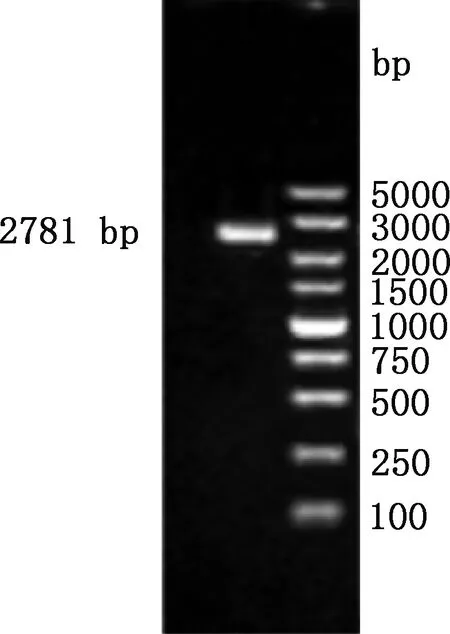
图2 银黑狐MC1R基因5′-UTR区PCR扩增结果
2.2 银黑狐MC1R基因启动子活性区预测分析
通过在线软件对银黑狐MC1R基因5′-UTR区(-2 708/+73 bp)进行预测分析。利用Neural Network Promoter Prediction预测到4个启动子活性区域:-1 964/-1 915 bp(得分0.93)、-1 834/-1 785 bp(得分0.97)、-1 414/-1 365 bp(得分0.82)和-596/-548 bp(得分0.92);利用Promoter 2.0软件预测启动子位置为-1 209 bp(得分0.70)和-309 bp(得分0.71);利用TSSW软件预测启动子位置为-2 323 bp(得分17.88)和-359 bp(得分4.86)。3个软件是基于不同算法对启动子区的预测,提示-596/+73 bp可作为参考的候选核心启动子区域。
2.3 银黑狐MC1R基因启动子缺失序列重组质粒酶切鉴定
以2 781 bp(-2 708/+73 bp)PCR产物为模板进行缺失片段的PCR扩增,所得片段大小分别为2 781、2 287、2 135、2 033、1 602、1 280、1 101、838、593和341 bp(图3),均与预期大小相符。PCR扩增产物纯化回收后分别克隆到pGL3-Basic质粒中,用SacⅠ与Hind Ⅲ双酶切进行重组质粒鉴定,均获得与预期相符的目的片段(图4)。选出阳性重组质粒测序,结果显示,克隆到的不同长度目的片段与所得狐狸MC1R基因序列相似性达99%。说明成功构建了10个包含银黑狐MC1R基因不同长度序列的重组质粒。
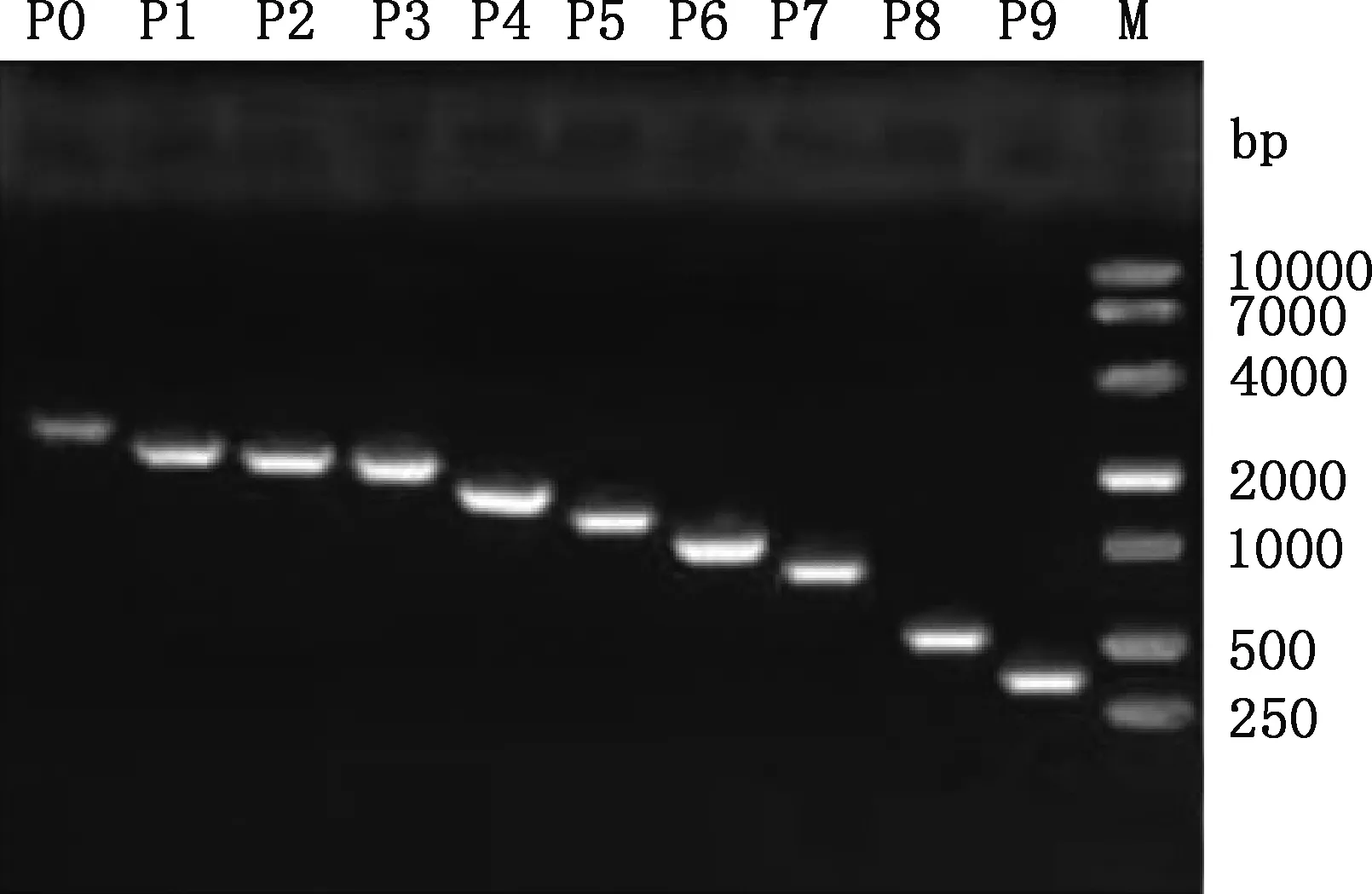
P0~P9,MC1R基因启动子不同缺失片段;M,DM10000 DNA Marker
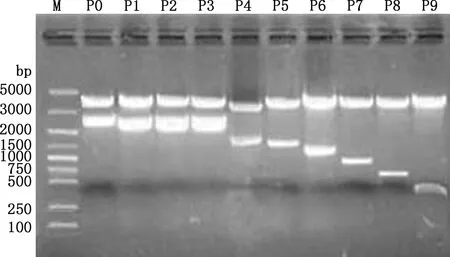
M,DM5000 DNA Marker;P0~P9,不同缺失片段重组质粒的SacⅠ与Hind Ⅲ双酶切产物
2.4 双荧光素酶活性检测
将10个启动子缺失片段的重组质粒、pGL3-Basic质粒分别与phRL-TK质粒瞬时共转染B16细胞48 h后收集细胞,计算RLA,分析各启动子片段的活性,进而确定MC1R基因的启动子位置,结果见图5。由图5可知,9个启动子缺失片段的重组质粒转染后的荧光素酶相对活性均较pGL3-Basic空质粒转染组显著或极显著增加(P<0.05;P<0.01),表明报告基因在B16细胞中具有启动活性,启动子片段可启动荧光素酶的表达。通过比较10个不同长度启动子片段的活性值发现,pGL3-MC1RP8(-520/+73 bp)组的荧光素酶活性值最高,说明银黑狐MC1R基因的核心启动子区存在于pGL3-MC1RP8(-520/+73 bp)区域内。

与pGL3-Basic相比,*,差异显著(P<0.05);**,差异极显著(P<0.01)
3 讨 论
银黑狐是赤狐在自然条件下产生的毛色突变体,被毛黑白相间,有一层雾状的针毛,是裘皮服装的主要饰品。近年来,随着人们生活水平的不断提高以及绿色环保理念的普及,生产天然优质彩色狐皮成为养狐业的终极目标,因此对其毛色调控基因的研究成为热点。目前发现调控狐狸毛色的基因有MC1R、TYRP1、Agouti、TYR、CBD、Extension、SILV、KIT、MITF等,其中MC1R是最早被发现且证实可调控动物毛色的基因之一[13],前人陆续在狐狸[14-16]、水貂[17]、家犬[18-19]、兔[20-22]、马[23]、羊[24-26]、猪[27-29]、牛[30-33]和羊驼[34]等物种中进行了相关研究。基因在真核生物中的表达调控可分为多个水平,其中最主要的就是转录水平调控,而启动子调控也是转录环节的关键,因此针对启动子功能区域开展相关研究对了解基因的表达调控机制具有重要意义[2]。
本研究成功获取了银黑狐MC1R基因5′-UTR区2 781 bp的DNA序列,构建了10个不同缺失长度的启动子荧光素酶表达载体,活性检测表明,10个片段均有一定的启动子活性。研究表明,克隆片段仅含有TSS上游的区域很多情况会导致假阴性结果,若克隆片段包含TSS、ATG及部分编码区会使阳性率大大提高[2]。本研究克隆的10个片段均符合上述要求。利用3种不同算法的在线生物学软件对银黑狐MC1R基因的启动子区进行预测发现,-596/+73 bp可能为该基因的核心启动子区。双荧光素酶活性结果显示,pGL3-MC1RP8(-520/+73 bp)的活性值最高,提示-520/+73 bp为银黑狐MC1R基因的核心启动子区,与软件预测结果相符。
研究发现,在狐狸MC1R基因5′-UTR区的-36/-41、-100/-105、-123/-128、-278/-283和-507/-512 bp区域各存在1个E-box,在-91/-96 bp区域存在1个GC-box,在-451/-457 bp区域存在1个BRE调控元件[16]。E-box和GC-box是上游调控区重要的顺式作用元件,参与促进基因的转录调控。BRE是基因核心启动子区重要的调控元件,是TFIIB的特异性识别元件,而TFIIB基因的一个基本转录起始因子可促进RNA聚合酶正确定位,起“定位因子”的作用[35]。研究中E-box、GC-box及BRE调控元件均位于-520/+73 bp区域内,提示通过双荧光素酶检测技术确定的活性区域(-520/+73 bp)是银黑狐MC1R基因的核心启动子区。研究发现,黑腹田鼠MC1R基因编码区上游500 bp左右为其核心启动子区[36];人MC1R基因最小启动子区域在-517/-282 bp[37],均与本研究结果基本吻合。
真核生物的表达是顺式作用元件和反式作用因子共同作用的结果,此过程复杂而有序。转录水平调控是基因表达的第一步,是转录因子与转录因子结合位点进行特异性结合,参与调控靶基因转录效率的过程[38]。本研究构建的10个缺失报告基因载体中pGL3-MC1RP8(-520/+73 bp)的活性值最高,提示-520/+73 bp区域内含有重要的调控元件,可调控狐狸MC1R基因启动子的活性,本试验结果为深入研究该基因奠定了理论基础,也为其他动物毛色基因的研究提供了参考。下一步应利用点突变、染色质免疫共沉淀、DNA足纹分析和凝胶阻滞分析等技术验证启动子区转录因子的真正功能,进而深入了解狐狸MC1R基因的转录调控机制。
4 结 论
本研究利用PCR扩增、生物学软件预测及双荧光素酶报告基因检测等技术成功确定了银黑狐MC1R基因的核心启动子区(-520/+73 bp)。
——一道江苏高考题的奥秘解读和拓展

