Urantide 对动脉粥样硬化大鼠脾组织中ERK1/2 及P38 表达的影响
胥玉行,李英,谢云鹏,王途,崔海鹏,赵娟*
1.承德医学院病理生理学教研室,河北 承德 067000;2.承德医学院附属医院,河北 承德 067000
动脉粥样硬化(atherosclerosis,AS)是一种以动脉内形成粥样斑块为主要病变的慢性炎性疾病,对人的身体健康造成极大威胁[1~3]。细胞外信号调节激酶1/2(ERK1/2)和P38 丝裂原蛋白激酶(P38 mitogenactivated protein kinase,P38)是 MAPK(mitogenactivated protein kinase)家族控制炎性反应的重要成员,可介导心血管疾病的发生发展[4~6]。尾加压素Ⅱ(urotensinⅡ,UⅡ)及其受体G 蛋白耦连受体14(G protein-coupled receptors 14,GPR14)构成的UⅡ/UT 系统与AS 等疾病有显著的关联性[7,8]。Urantide 正是基于UⅡ衍生而来,目前被认为最有效的UⅡ受体特异性拮抗剂[9]。本课题组前期研究发现Urantide 可通过拮抗UⅡ/UT 相互作用和调控MAPK 信号通路减轻动脉粥样硬化性心肌损伤,并通过抑制ERK1/2、P38 MAPK 信号通路激活而改善AS 病变程度[5,6,10]。脾具有调节血脂代谢、免疫调控、造血等多种生理功能[11]。研究显示AS 模型(ApoE-/-)小鼠出现脾肿大,血清IgG、ANA 和抗dsDNA 抗体滴度显著升高,提示ApoE-/-小鼠免疫功能异常可能对自身脏器造成损伤[12],脾病变与AS 的发展有一定联系。近年来相关研究表明,通过调节脾细胞和分子成分来限制单核细胞依赖的致病活性的新方法或许成为将来防治心血管病的一个可行方向[13,14]。然而,Urantide 是否对AS大鼠的脾具有作用尚未阐述。本实验以AS 大鼠为研究对象,观察其脾组织的形态学变化及ERK1/2、P38 MAPK 信号通路相应蛋白表达的影响,进一步探讨Urantide 与AS 之间的联系。
1 材料与方法
1.1 材料
1.1.1 实验动物及高脂饲料配制 SPF 级雄性Wistar大鼠180 只(北京维通利华实验动物技术有限公司,许可证号:SCXK (京)-2016-0011),体质量180~200 g;高脂饲料配制:0.2%丙硫氧嘧啶,0.5%胆酸钠,3.5%胆固醇,5%白糖,10%猪油,80.8%基础饲料。
1.1.2 主要试剂 Urantide(苏州强耀生物公司);辛伐他汀(simvastatin)(北京诺华制药有限公司);Bradford 蛋白浓度测定试剂盒(索莱宝公司)、RIPA 裂解液、兔抗大鼠ERK1/2、p-ERK1/2、P38、p-P38(Cell Signaling Technology);GAPDH 一抗、HRP 标记山羊抗兔二抗(Bioworlde);超敏ECL 化学发光试剂盒(上海碧云天生物技术有限公司);FITC 荧光二抗、DAPI 染液(北京天根生化科技有限公司)。
1.2 实验方法
1.2.1 大鼠分组及处理 随机分为正常组(n=30)和模型组。实验开始时,模型组给予每只大鼠腹腔注射维生素D3 150 U/kg 连续3 d,并饲以高脂饲料,于第4周,随机选取6 只进行组织形态学观察,验证造模成功后,Urantide(3、7、14 d)组(每组30 只)每日尾静脉注射Urantide 30 μg/kg;阳性药辛伐他汀组(n=30)每日给予辛伐他汀5 μg/kg 灌胃,连续14 d。
1.2.2 胸主动脉、脾形态学观察 用4%多聚甲醛对大鼠胸主动脉、脾组织固定后经过梯度酒精脱水、二甲苯透明、浸蜡、包埋后制作石蜡切片,经二甲苯脱蜡,梯度酒精水化后,常规HE 染色,光镜下观察各组大鼠的病理变化。
1.2.3 免疫荧光染色法测定脾组织中p-ERK1/2、p-P38 表达 取制备好的石蜡切片,由二甲苯脱蜡、梯度酒精水化后,抗原修复,10%山羊血清封闭,兔抗大鼠一抗p-ERK1/2(1:200)、p-P38(1:1600)孵育过夜;洗片,在暗室环境下,滴加FITC 标记二抗(1:1000),孵育1 h,移去二抗,滴加DAPI 染液,孵育45 min,洗片,防荧光淬灭剂封片后在荧光显微镜下观察。每组选6 张切片,每张片选取6 个不同视野拍照。Image-Pro Plus 6.0 软件计算免疫荧光阳性细胞的平均吸光强度值,随后作统计学分析。
1.2.4 Western blot 检测脾ERK1/2、p-ERK1/2、P38、p-P38 蛋白 组织样本的总蛋白由RIPA 裂解液提取,使用Bradford 蛋白浓度测定试剂盒对蛋白质进行定量检测。取45 μg 蛋白于SDS-PAGE 分离后转膜,封闭,GAPDH(1:5000)、ERK1/2(1:1000)、p-ERK1/2(1:2000)、P38(1:1000)、p-P38(1:1000)兔抗大鼠一抗孵育过夜,洗膜,滴加HRP 标记抗兔二抗(1:5000),孵育l h,洗膜,超敏ECL 化学发光试剂盒显影。运用Image J 吸光度值分析软件,测定各目的蛋白条带灰度值并计算蛋白的相对表达水平。
1.3 统计学分析
运用SPSS 21.0 软件分析,计量资料用均数±标准差()表示。多组间参数比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05 为差异具有统计学意义。
2 结果
2.1 大鼠胸主动脉形态学改变
正常组血管内皮边缘整齐,中膜见梭形平滑肌细胞排列均匀整齐,弹力纤维层结构完整,膜边界清楚。模型组胸主动脉内皮损伤,中膜内平滑肌细胞排列紊乱,有结晶,钙化形成,为典型AS 病理形态改变,证实AS 大鼠模型造模成功。经Urantide 治疗的大鼠与模型组大鼠相比,随用药时间增加,胸主动脉粥样斑块逐渐减小(图1)。

图1 大鼠胸主动脉形态(HE 染色) A:正常组B:模型组C:Urantide 组Fig.1 Morphological changes of thoracic aorta in each group (HE staining) A: Control group;B:AS group;C: Urantide group
2.2 大鼠脾组织形态学变化
正常组大鼠脾内红髓、白髓清晰可见,无脂肪变性及细胞坏死,脾细胞结构完整,红髓内可见呈索条状分布的脾索,其间有脾血窦。模型组大鼠脾内有细胞坏死及变形,界限不清,脾索分布不均,脾中央动脉有明显玻璃样变性。经Urantide 治疗的大鼠与模型组大鼠相比,随用药时间增加,脾病变逐渐减轻,用药14 d 的大鼠脾动脉形态接近于阳性药组(图2)。

图2 大鼠脾形态(HE 染色)A:正常组B:模型组C:阳性药物组D:Urantide 3 d 组E:Urantide 7 d 组F:Urantide 14 d 组Fig.2 Morphological changes of spleen of rats in each group (HE staining)A: Control group; B:AS model group; C: Simvastatin group; D: Urantide 3 days group; E: Urantide 7 days group; F: Urantide 14 days group
2.3 大鼠脾免疫荧光p-ERK1/2、p-P38 表达
p-ERK1/2、p-P38 颗粒主要存在于脾血管周围,模型组内阳性颗粒表达水平较正常组均明显升高(P<0.05)。由Urantide 治疗后,脾p-ERK1/2、p-P38 阳性颗粒表达较模型组明显下降(P<0.05),Urantide 14 d组效果最明显(图3,4)。
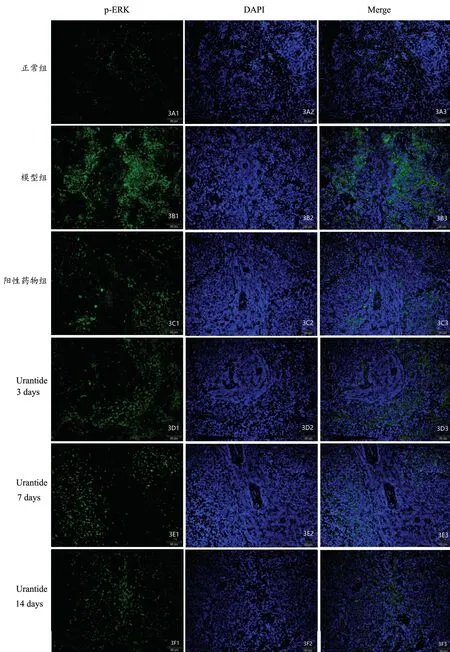
图3 大鼠脾组织内p-ERK 表达水平(标尺=50 μm)A1~F1:脾内 p-ERK 表达水平A2~F2:细胞核DAPI染色 A3~F 3:脾 内p-ERK 与DAPI 共定位A:正常组B:模型组 C:阳性药物组D:Urantide 3 d 组E:Urantide 7 d 组F:Urantide 14 d 组Fig. 3 The expression levels of p-ERK in rat spleen of each group (bar=50μm)A1~F1: p-ERK protein expression level in the spleen;A2~F2: Nuclear DAPI staining; A 3~F3:Colocalization of p-ERK protein and DAPI in the spleen.A: Control group;B: AS group; C:Simvastatin group;D: Urantide 3 days group; E: Urantide 7 days group; F:Urantide 14 days group

图4 大鼠脾组织内p-P38 表达水平(标尺=50 μm)A1~F1:脾内p-P38表达水平A2~F2:细胞核DAPI 染色A3~F3:脾内p-P38与DAPI 共定位A:正常组B:模型组 C:阳性药物组D:Urantide 3 d 组E:Urantide 7 d 组F:Urantide 14 d 组Fig.4 The expression levels of p-P38 in rat spleen of each group (bar=50 μm)A1~F1: p-P38 protein expression level in the spleen;A2~F2: Nuclear DAPI staining; A 3~F3:Colocalization of p-P38 protein and DAPI in the spleen.A: Control group;B: AS group; C:Simvastatin group;D: Urantide 3 days group; E: Urantide 7 days group; F:Urantide 14 days group
2.4 Western blot 检测
同正常组比,模型组脾内p-ERK1/2、p-P38 蛋白表达明显升高(P<0.05);与模型组比,辛伐他汀组中p-ERK1/2 蛋白质表达明显下降(P<0.05),p-P38 蛋白质表达无明显变化(P>0.05);与模型组比,Urantide 各组中p-ERK1/2、p-P38 蛋白表达水平下降(P<0.05),ERK1/2、P38 蛋白质表达无明显变化(P>0.05)(图5)。
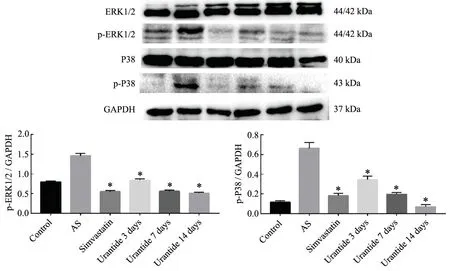
图5 大鼠脾内蛋白表达水平*P<0.05,与AS 组比较Fig.5 The protein expression levels in spleen of rats in each group *P<0.05,compared with AS group
3 讨论
AS 是一种由多种病理变化影响的复杂动脉疾病,其中血管壁的慢性炎性反应有着至关重要的作用[15,16]。而血管内局部炎症反应、泡沫细胞的形成、免疫应答等多种反应过程与单核巨噬细胞系统密切相关。单核巨噬细胞主要存储于脾,是粥样斑块形成的主要细胞[17]。
在高胆固醇条件刺激下,脾能促使造血干细胞和多能祖细胞(HSPCs)分化成为单核细胞和嗜中性粒细胞等细胞,使单核细胞在炎症中的数量显著增加,有研究表明,主动脉中积聚的单核细胞30%左右来自脾[18,19]。此外,当脾外髓质裂解时亦可释放单核细胞进入血液,随血液循环进入发炎的内膜,持续的单核细胞招募促进巨噬细胞积累、增加斑块体积[17~20]。
ERK1/2 和P38 属于MAPK 家族,MAPK 信号通路是由一系列的蛋白激酶及其磷酸化作用构成的级联反应[3,6,10]。由于受不同细胞类型和细胞环境影响,该信号通路可产生促凋亡、促炎、抗增殖、参与缺血/再灌注损伤、脂质代谢等多种生物学效应[5,21~23]。当血管内皮细胞长期处于氧化应激、高血脂等因素刺激下,多种链激酶通过磷酸化途径激活P38 MAPK,而ERK1/2 可由MEK1 和MEK2 介导其磷酸化,之后移位进入细胞核内调控基因表达并参与AS 炎症反应的调节[24~27]。
脾血管内皮细胞受AS 大鼠血脂变化影响,使MAPK 信号通路被激活产生自身免疫反应,导致脾肿大促使脾功能异常改变,释放单核细胞至病变部位,进一步加剧泡沫细胞堆积[11,12,17~20]。有研究显示,脾切除术后的小鼠主动脉根部病变明显更大[28]。此外,脂质代谢受脾的影响,在动物中观察到脾移除后血清胆固醇水平升高[11,29]。由此可知,脾功能异常能加速AS 进展过程。
UⅡ是由11 个氨基酸残基组成的生长抑素样神经环肽,是维持内环境稳态的关键因素之一,UⅡ参与肝硬化、炎症、肾功能衰竭、生殖功能障碍等多种疾病的发展过程[30]。此外,UⅡ也被视作促进AS 发生发展的主因之一[7,8]。
本实验结果表明,经Urantide 治疗的AS 大鼠,脾组织中ERK1/2、P38 MAPK 信号通路相关蛋白表达含量均下降,其中p-ERK1/2,p-P38 表达量显著下降,AS大鼠脾中央动脉内玻璃样病变、胸主动脉内粥样斑块均有一定程度的改善。进一步的免疫荧光实验也证明Urantide 可显著降低AS 大鼠脾中p-ERK1/2、p-P38阳性颗粒表达。提示脾动脉内玻璃样变可能是AS 致脾损伤的主要病变之一,最终导致脾的结构功能改变。脾功能恢复正常水平时,可能使单核细胞的生成减少,泡沫细胞随单核细胞募集数量减少而减少,从而抑制粥样斑块进一步的病理改变。
本课题前期大量研究发现,Urantide 可通过拮抗UⅡ/UT 系统,产生多种不同生物学效应,影响AS 及相关病变进展过程。经Urantide 治疗后,可降低P38 MAPK 信号通路中P38 基因与蛋白的表达水平,改善大鼠AS 病变程度[6,10];通过调控ERK1/2、MAPK、JNK等信号通路的活化水平,减轻AS 大鼠肝脂肪变性[5,31];通过下调OPN 和α-SMA 的表达,改善AS 大鼠心肌纤维化水平[32];通过调节JAK2/STAT3 信号通路,改善AS 相关肾损伤[33,34]。这些研究证明Urantide 通过拮抗UⅡ/UT 系统,调控不同信号通路在AS 大鼠各组织器官发挥抗AS 作用。
综上表明,Urantide 可通过阻断UⅡ/UT 系统进而介导ERK1/2、P38 MAPK 信号通路,从而减轻AS 大鼠的脾动脉玻璃样变的病变程度。然而,Urantide 阻断发挥生物学作用的具体机制还需更深层次的探究。

