基于SEER数据库的T1M1期结直肠癌临床病理特征及预后分析
周华彬,高志光,郑超,张涛,刘玉兰,利民
结直肠癌是全球最常见的恶性肿瘤之一,据2020年全球癌症统计报告,全球约有190万结直肠癌新发病例,约有93.5万人死于结直肠癌,结直肠癌发病率在全部恶性肿瘤中位居第三位,死亡率位居第二位,而在我国,结直肠癌发病率、病死率分别跃居第二位和第五位,其中每年新发病55万,死亡病例28万[1,2]。早期结直肠癌(PT1)定义为癌细胞穿透结直肠黏膜肌层浸润至黏膜下层,但未累及固有肌层[3]。然而,仍有少数T1期结直肠癌患者在初诊时就已经发生了跳跃式的远处转移,其TNM分期为T1N0M1Ⅳ期。部分T1M1期结直肠癌患者临床表现比较隐匿,容易出现漏诊,单纯的内镜黏膜下剥离术或局部切除不能使患者完全获益[4],其生存预后明显差于无远处转移的T1M0期结直肠癌患者,对于T1M1期结直肠癌患者的临床特征及生存预后分析少见文献报道。本研究通过收集美国国家癌症研究所的监测、流行病学和最终结果数据库(National Cancer Institute′s Surveillance,Epidemiology,and End Results data set,SEER)中符合条件的T1M1期结直肠癌患者的临床病例资料,对该类患者的临床病理特征及生存预后分析进行回顾性研究。
1 资料与方法
1.1 一般资料
通过SEER*Stat(版本8.3.9.2)提取2020年发布的SEER数据库[Incidence-SEER Research Plus Data,Nov 2020 Sub(1975~2018)]中登记的结直肠癌患者资料。纳入标准:①诊断时年龄≥18岁;②诊断年份为2010年~2015年;③结直肠癌分期符合第7版AJCC分期T分期为T1期,M分期为M1(M1a、M1b期);④诊断标准为组织病理学确诊。排除标准:①肿瘤部位不明确;②肿瘤分化程度未知;③T、N、M分期不详;④手术、化疗、随访信息不完整或生存期不详;⑤合并其他部位肿瘤。
1.2 研究方法
收集患者的临床病理资料(包括年龄、性别、人种、肿瘤原发部位、组织分化程度、组织学类型、CEA、TNM分期、转移情况、转移部位、手术信息、区域淋巴结清扫情况、放疗信息、化疗信息)以及随访资料。根据年龄将患者分为:青年组(20~49岁),中年组(50~64岁),老年组(≥65岁)。结直肠癌按照原发部位分为左半结肠和右半结肠,左半结肠肿瘤包括结肠脾曲、降结肠、乙状结肠、直肠的肿瘤,右半结肠肿瘤包括阑尾、盲肠、升结肠、结肠肝曲及横结肠的肿瘤。组织学类型主要分为非特殊型腺癌和特殊型腺癌,特殊腺癌包括黏液腺癌、印戒细胞癌等。本研究主要观察终点为肿瘤特异性死亡,末次随访时仍存活或非结直肠癌相关死亡患者的生存时间作为删失数据处理。
1.3 统计学分析
采用SPSS 25.0对纳入的临床数据进行统计描述及统计分析。以Kaplan-Meier绘制生存曲线,生存曲线之间的比较采用Log-Rank检验,将单因素分析中P<0.05的影响因素纳入Cox比例风险回归模型进行多因素分析,P<0.05为差异有统计学意义。
2 结果
2.1 患者的临床病理特征
检索2010~2015年SEER数据库共登记结直肠癌患者30 664例,经筛选本研究共纳入符合T1M1期结直肠癌要求的病例524例,其临床病理特征如表1所示。其中20~49岁患者(85例,16.2%)、50~64岁患者(196例,37.4%)、≥65岁患者(243例,46.4%),男性患者(296例,56.5%),女性(228例,43.5%),肿瘤原发部位左半结肠(335例,63.9%)多于右半结肠(189例,36.1%),组织分化良好的病例有418例(79.8%),组织类型中非特殊型腺癌487例(92.9%),CEA升高有438例(83.8%),N0患者有327例(62.7%),N1、N2患者共197例(37.6%),单发转移268例(51.1%),多发转移者有256例(48.9%),接受手术、区域淋巴结清扫、放疗、化疗的分别有91例(17.4%)、56例(10.7%)、67例(12.8)、394例(75.2%),在远处转移器官中,其中以肝转移最为多见,共428例。

表1 TIMI期结直肠癌患者临床病理特征(n)
2.2 T1M1结直肠癌的生存分析
本研究共纳入524例T1M1期结直肠癌患者,中位随访14个月,结直肠癌特异性死亡443例,中位生存时间12个月。单因素分析结果显示,年龄(χ2=23.162,P<0.001)、性别(χ2=4.306,P=0.038)、原发肿瘤部位(χ2=7.049,P=0.008)、组织分化程度(χ2=12.031,P=0.001)、CEA(χ2=10.425,P=0.001)、转移情况(χ2=26.702,P<0.001)、手术(χ2=67.546,P<0.001)、区域淋巴结清扫(χ2=45.553,P<0.001)、化疗(χ2=94.414,P<0.001)与T1M1期结直肠癌患者肿瘤特异性生存密切相关(P<0.05),而与人种、组织学类型、N分期、有无放疗无关。(见表2、图1)
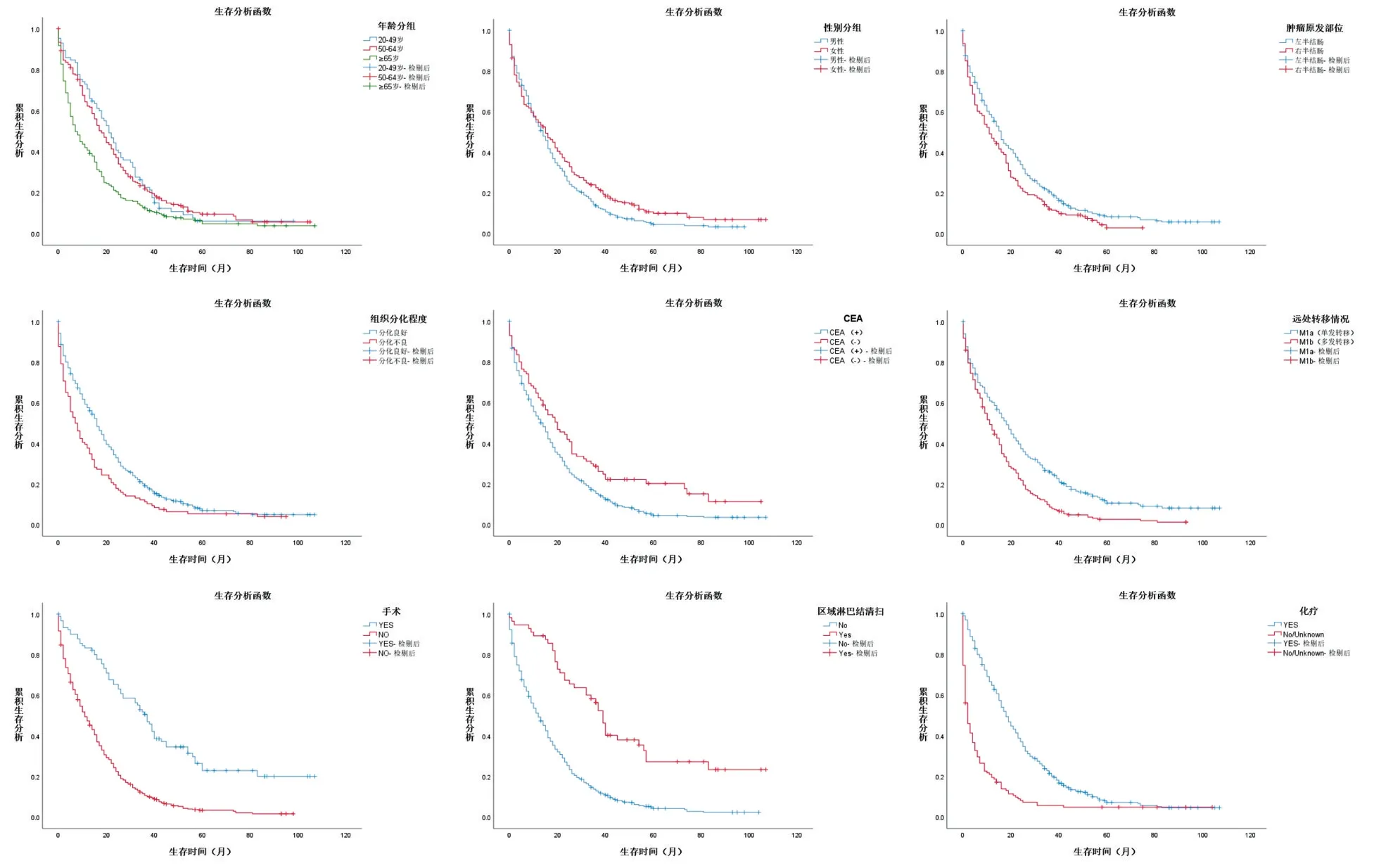
图1 不同临床特点T1M1期结直肠癌的K-M生存曲线

表2 T1M1期结直肠癌单因素分析结果
2.3 T1M1结直肠癌患者预后多因素分析
将单因素分析结果中与T1M1期结直肠癌患者肿瘤特异性生存相关的所有因素(P<0.05)纳入Cox多因素分析,结果显示,年龄、组织分化程度、是否合并多发转移、手术、化疗是预后不良的独立危险因素,其中年龄≥65岁、右半结肠、组织分化程度差、合并多发转移、未接受手术及化疗的T1M1期结直肠癌患者预后更差。(见表3)
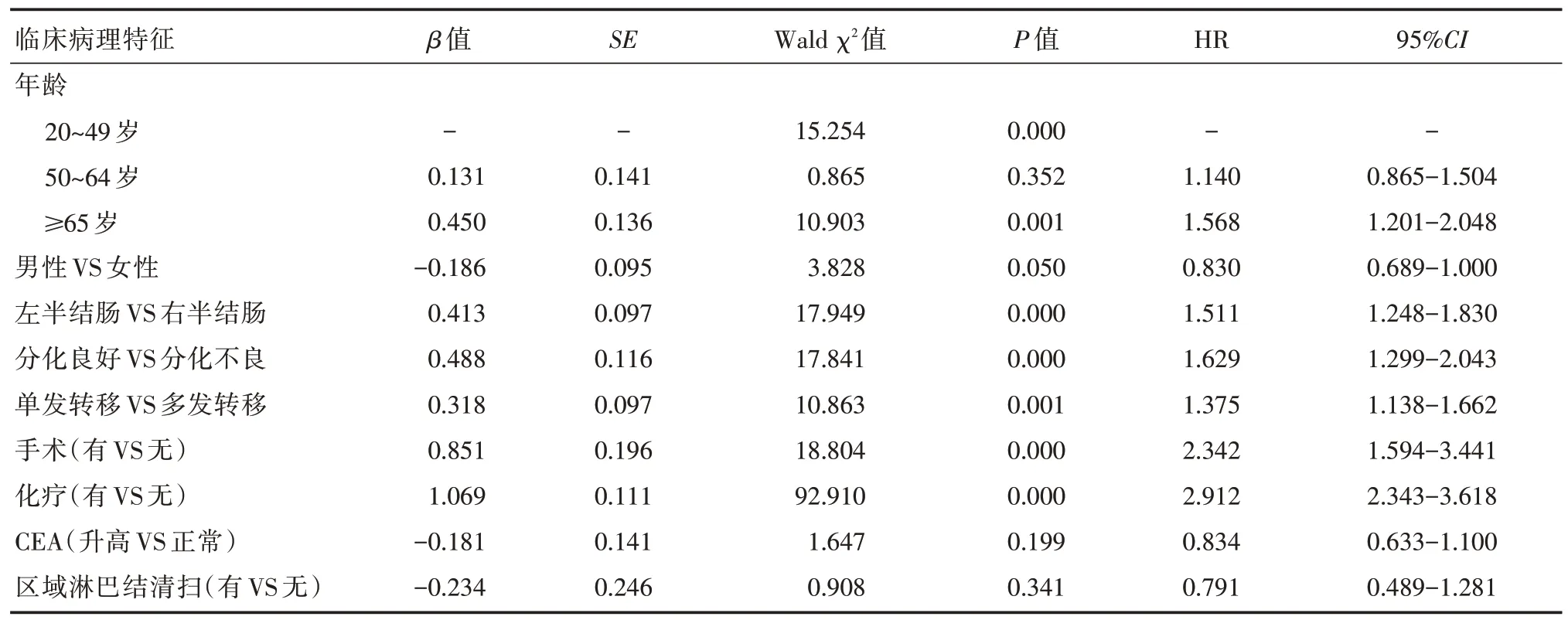
表3 T1M1期结直肠癌预后的COX多因素分析结果
3 讨论
《中国结直肠癌诊疗规范(2020版)》中将早期结直肠癌(PT1)定义为癌细胞穿透结直肠黏膜肌层浸润至黏膜下层,但未累及固有肌层。文献报道[5],T1期结直肠癌淋巴结转移率为8.41%,本研究纳入的T1M1期结直肠癌病例中,无区域淋巴结转移(T1N0期)327例(62.4%),合并有区域淋巴结转移(T1N1~2期)197例(37.6%)。本研究数据表明,T1期结直肠癌仍存在区域淋巴结转移或远处转移的风险,因此,在对T1期结直肠癌患者进行内镜黏膜切除术、内镜黏膜下剥离术或经肛局部切除治疗前,应结合影像学检查排除有无器官转移,避免出现漏诊误诊[6]。另外,本研究也提示对于《中国结直肠癌诊疗规范(2020版)》中早期结直肠癌的定义可能需要进一步验证。
医学影像、肠镜技术以及液体活检的迅速发展,大大提高了结直肠癌的早期诊断率[7],但仍有很多结直肠癌患者首次就诊时就已经发生远处器官转移,远处器官转移是治疗失败的原因,也是导致结直肠癌相关病死率升高的主要原因,其中远处转移主要以肝转移最多见[8],本研究中纳入的524例患者中,肝转移有428例。文献报道[9],早期结直肠癌患者的5年生存率高达90%,晚期患者的5年生存率只有14%,本研究T1M1期结直肠癌患者中位生存时间为12个月,5年生存率约8%(见图2),比文献报道的5年生存率还低,考虑与本研究只纳入T1期排除T2~T4期的病例有关。对于晚期结直肠癌,通过MDT团队对患者病情进行全面评估,接受放疗、化疗及手术等综合治疗,可提高患者的5年生存率[10]。本研究单因素结果显示,未接受手术、放疗或化疗的患者1年、3年、5年生存率都明显低于接受手术、放疗或化疗的患者。本研究Cox多因素分析结果显示年龄是预后不良的独立危险因素,年龄≥65岁的患者有243例,此部分患者预后风险较年轻患者更高(HR=1.568),说明老年患者更容易出现晚期疾病,更不可能进行治愈性手术,术后死亡率更高。因此,对于老年患者在制定创伤较大的治疗方案时可能需要谨慎选择[11]。在本研究结果显示右半结肠是T1M1期结直肠癌不良预后的独立影响因素,右半结肠癌的整体预后要比左半结肠癌差,与之前文献报道一致[12-14]。右半结肠癌预后差的原因可能因为右半结肠癌发病隐匿,临床症状主要表现为贫血、乏力、消瘦等,不容易早期被发现,而左半结肠主要表现血便或大便习惯改变等明显症状,早期诊断率较高。

图2 T1M1期结直肠癌患者5年生存率
本研究存在以下不足:①本研究属于回顾性研究,在数据统计方面可能存在一定的偏倚,②SEER数据库缺乏病理免疫组化、手术方式、化疗方案及剂量、免疫治疗、靶向治疗等信息,这些都是影响T1M1期结直肠癌患者生存预后的重要因素。
综上所述,基于SEER数据库的524例T1M1结直肠癌的患者资料,年龄≥65岁、右半结肠癌、组织分化程度差、合并多器官转移、未接受手术及化疗是T1M1期结直肠癌患者预后不良的独立危险因素。

