miR-26a下调TET抑制人宫颈癌HeLa细胞增殖与侵袭
雷林宸, 谭志琴, 杨春秀, 刘玲燕, 吴鹏
(1.衡阳市妇幼保健院重症医学科,湖南省衡阳市 421001;2.南部战区空军医院妇产科,广东省广州市 510060)
宫颈癌为全世界最常见的女性恶性肿瘤之一,严重危害妇女的身心健康。尽管手术、化疗、放疗、内分泌治疗及靶向治疗等已取得进步,但是对于复发转移性宫颈癌的疗效欠佳[1]。因此,寻找宫颈癌特异性治疗靶点是宫颈癌研究亟待解决的问题,是延长宫颈癌患者生存时间和改善其生活质量的关键。
TET蛋白是生物体内存在的一种双加氧酶,也是DNA去甲基化过程中的一种重要酶。TET蛋白家族包括3个成员TET1、TET2和TET3,TET对基因的转录调控具有激活与抑制双重功能,TET家族成员发生的结构异常或基因突变常与人类造血系统恶性肿瘤的发生关系紧密[2]。过表达TET可促进宫颈癌HeLa细胞转移[3]。但目前TET蛋白在宫颈癌中的作用机制尚不明确。microRNA(miRNA)为一类内源性的非编码小分子RNA,其通过与mRNA 3′-UTR区域的配对,可实现对基因转录水平的负性调控。miR-26a已被发现与宫颈癌的进展过程密切相关[4],在胃癌发生过程中miR-26a能直接靶向调控TET的表达[5]。本研究探讨TET蛋白家族3个成员TET1、TET2和TET3对宫颈癌细胞增殖与侵袭的影响,并探究其调控宫颈癌细胞增殖与侵袭的分子机制。
1 材料和方法
1.1 材料与试剂
人宫颈癌HeLa细胞(中国科学院上海生命科学院生化细胞所),转染试剂Lipofectamine 3000、RNA提取试剂TRIzol、细胞培养基DMEM、细胞培养胎牛血清以及抗生素、miR-26a模拟物及对照(scramble)引物和其内参U6、TET1、TET2、TET3的干扰小RNA(small interfering RNA,siRNA)序列及其对照(control)无关序列(Invitrogen,美国),RNA抽提试剂盒(Applied Biosystems,美国),TaqMan反转录试剂盒、qSYBR-Green-containing PCR试剂盒、双荧光素酶活性检测试剂盒(Qiagen,美国),血细胞计数板(16×25格),Transwell小室和基质胶(BD,美国),紫外可见分光光度计(Thermo,Nanodrop 2000,美国),奥林巴斯正置显微镜OLYMPUS BX51(Olympus公司,UIS2光学成像系统,日本)。突变型TET1、TET2、TET3的3′-非翻译区(3′-UTR)的荧光素酶报告载体(TET1-mut、TET2-mut和TET3-mut)、野生型TET1、TET2、TET3的3′-UTR的荧光素酶报告载体(TET1-wt、TET2-wt和TET3-wt)由GeneCopoeia公司构建。
1.2 细胞培养及分组
人宫颈癌HeLa细胞培养于含10%FBS、100 U/mL青霉素、0.1 g/L链霉素(双抗)的DMEM培养基中,细胞置于37 ℃、含5%CO2的细胞培养箱内孵育。
细胞实验分为si-TET1组、si-TET2组、si-TET3组、si-control组。si-TET1、si-TET2、si-TET3分别转染TET1、TET2、TET3的干扰小RNA序列,si-control组转染其对照无关序列。si-TET1、si-TET2、si-TET3序列分别为5′-GCACGCATGAATTTGGATA-3′、5′-CTGCTTCTGTTCTCAATAA-3′、5′-CCACCTGCGATTGCGTCGAACAAAT-3′,si-control组序列为5′-UUCUCCGAACGUGUCACGU-3′。
1.3 细胞转染
采用0.25%胰蛋白酶消化处于对数生长期的宫颈癌HeLa细胞,并将其吹打成单个细胞,每个六孔板中铺2 mL细胞(共8×103个)置于细胞培养箱中。按照Lipofectamin 3000说明书进行操作,分别转染si-control、si-TET1、si-TET2、si-TET3以及scramble、miR-26a,转染8 h后,更换为常规细胞培养基,48 h后可收集细胞用于后续实验。
1.4 RNA提取及qRT-PCR实验
每六孔板内加100 μL TRIzol裂解液,室温静置5 min,加入140 mL氯仿并震荡20 s后室温放置8 min,以转速15 000 r/min,4 ℃离心20 min,转移上层液体至另一干净EP管内,按1体积的异丙醇、2体积的TRIzol加入上层液体中,将其混匀后室温静置18 min,随后离心移除上清液体。加入500 μL 75%乙醇冲洗离心管底部的沉淀物,以转速12 000 r/min,4 ℃离心15 min,随后移除上清液并将底部沉淀物溶于30 μL无酶水。于紫外可见分光光度计上检测A260/A280比值,检测合格后于-80 ℃冰箱内保存备用。
按照产品说明书进行qRT-PCR实验,提取细胞中RNA后进行反转录,并进行后续的操作。miR-26a的引物序列为F:5′-ATGGCTTCAAGTAATCC-AGGA-3′;R:5′-GTGCAGGGTCCGAGGT-3′,内参U6的引物序列为F:5′-CTCGCTTCGGCAGCACA-3′;R:5′-AACGCTTCACGAATTTGC-GT-3′。miRNA的相对表达量采用公式2-ΔΔCT计算。
1.5 细胞增殖曲线检测细胞增殖能力
将宫颈癌HeLa细胞经0.25%胰酶消化后,将细胞调至5×103个/mL,随后将其接种到24孔板中,每孔500 μL,采用血细胞计数板(16×25格)统计细胞数量(每毫升细胞数=400×每小格细胞数×104×稀释倍数),每24 h计数一次,连续4天,绘制细胞增殖曲线图。
1.6 克隆形成实验
采用0.25%胰蛋白酶消化处于对数生长期的宫颈癌HeLa细胞,吹打成单个细胞,以梯度倍数稀释,每组设置3个平行样。每组细胞均在六孔板中接种,每孔100个细胞,轻轻晃动细胞使其均匀分散。置于37 ℃、5%CO2细胞培养箱中孵育。结晶紫染色,显微镜镜下计数克隆形成的具体数目。
1.7 细胞侵袭实验
在Transwell小室内铺加基质胶,静置6 h待其成膜。取上述细胞稀释液150 μL接种到小室上腔层,下腔层内添加350 μL完全培养基,静置,于培养箱内孵育36 h后结晶紫染色。将上室中内侧细胞用棉签除去,PBS缓冲液清洗3次,倒置小室并晾干,于倒置显微镜下进行细胞计数。
1.8 荧光素酶活性检测
荧光素酶报告基因实验分为TET1-wt、TET2-wt、TET3-wt、TET1-mut、TET2-mut、TET3-mut的miR-26a组、scramble组。分别共转染到宫颈癌HeLa细胞株中,48 h后收集细胞,根据试剂盒说明书操作,验证TET与miR-26a的结合关系。
1.9 统计学方法
2 结 果
2.1 敲低TET对宫颈癌HeLa细胞增殖能力的影响
细胞增殖曲线结果显示,与si-control组比较,si-TET1组、si-TET2组和si-TET3组的宫颈癌HeLa细胞增殖能力均显著降低(P<0.05;图1)。

图1 敲低TET对宫颈癌HeLa细胞增殖能力的影响a为P<0.05,与si-control组比较。
2.2 敲低TET对宫颈癌HeLa细胞克隆形成能力的影响
与si-control组比较,si-TET1组、si-TET2组和si-TET3组细胞克隆形成数量均显著降低(P<0.05;图2)。即外源性敲低TET的表达,可显著降低宫颈癌HeLa细胞克隆形成能力。

图2 敲低TET对宫颈癌HeLa细胞克隆形成能力的影响A为宫颈癌HeLa细胞的克隆染色图片;B为克隆数量柱状图。a为P<0.05,与si-control组比较。
2.3 TET对宫颈癌HeLa细胞侵袭能力的影响
与si-control组比较,si-TET1组、si-TET2组、si-TET3组穿过基质胶的宫颈癌HeLa细胞数量均显著降低(P<0.05;图3)。即外源性敲低TET的表达,可显著降低宫颈癌HeLa细胞的侵袭能力。
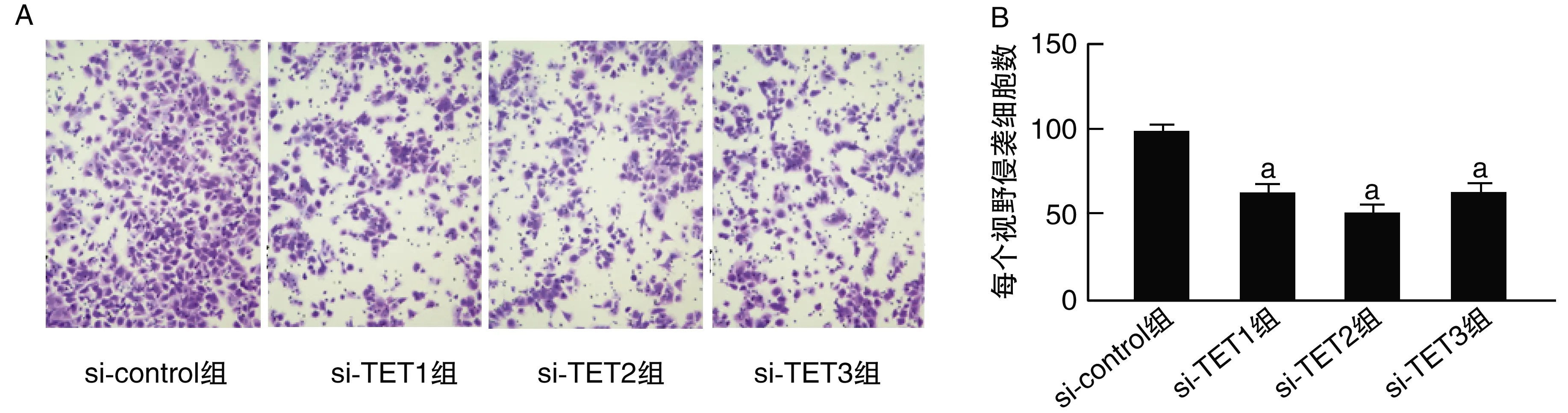
图3 敲低TET对宫颈癌HeLa细胞侵袭能力的影响A为穿过基质胶的宫颈癌HeLa细胞染色图片(0.5%结晶紫染色,200×);B为穿过基质胶的宫颈癌HeLa细胞数量柱状图。a为P<0.05,与si-control组比较。
2.4 miR-26a通过TET抑制宫颈癌HeLa细胞增殖与侵袭
TargetScan在线软件预测结果显示TET1、TET2和TET3均可与miR-26a直接结合(图4A)。与共转染TET1-wt、TET2-wt、TET3-wt的scramble组比较,共转染TET1-wt、TET2-wt、TET3-wt的miR-26a组的细胞荧光素酶活性均显著降低(P<0.05,图4B)。与转染scramble比较,转染miR-26a后,宫颈癌HeLa细胞中TET1、TET2、TET3 mRNA均显著降低(图4C)。

图4 TET与miR-26a之间的结合关系的证实A为TargetScan软件预测TET1、TET2、TET3 mRNA 3′-UTR区域可与miR-26a结合;B为各组荧光素酶活性;C为qRT-PCR检测转染scramble和miR-26a后,宫颈癌HeLa细胞中TET1、TET2、TET3 mRNA相对表达量。a为P<0.05,与scramble组比较。
3 讨 论
宫颈癌由感染某些高风险、致癌类型的人乳头瘤病毒引起。宫颈癌筛查和接种HPV疫苗均可降低其死亡率、防止宫颈癌前体病变的发生,但其低诊断率和复发转移治疗仍是亟待解决的重要问题[6-7]。
TET1、TET2、TET3共同构成TET蛋白家族,三者均具备将5mC转化成5hmC的能力[8]。研究表明TET家族成员可同时激活或抑制基因的转录调控,TET家族成员可通过参与DNA的去甲基化过程而激活对基因的转录调控,但TET1被认为可转录抑制部分基因,该作用可能与羟化酶活性无关[9]。同时TET家族成员介导的DNA去甲基化过程也与多种肿瘤的发生密切相关。研究证实,TET蛋白家族的基因突变或结构异常,常与哺乳动物的造血系统恶性肿瘤密切关联[2],在急性粒细胞白血病患者中TET1可与组蛋白甲基转移酶基因融合[10]。但目前TET蛋白在宫颈癌中的作用机制尚不明确。研究发现,过表达TET可促进宫颈癌细胞转移[3]。本研究中通过干扰TET1、TET2、TET3表达均可显著抑制宫颈癌HeLa细胞的增殖、克隆形成和侵袭,提示TET可能在宫颈癌发生、发展中起着重要的作用。
miR-26a属miR-26家族,miR-26a基因存在两个染色体位点,miR-26a-1位于3号染色体CTDSPL基因内含子,miR-26a-2位于12号染色体CTDSP2内含子,miR-26a与其宿主基因CTDSPL/2共同转录,其转录受共同启动子序列调控[11]。研究显示miR-26a具有显著的抑瘤功能[12-15]。本课题组前期研究证实miR-26a可通过靶向MCL1抑制宫颈细胞增殖与侵袭,诱导宫颈癌细胞凋亡[16];miR-26a在宫颈癌组织和细胞中表达下调,其下调与宫颈癌的临床分期、淋巴结转移、预后等显著相关;此外,miR-26a可通过靶向MTDH抑制乳腺癌的侵袭与转移[17]。
一个miRNAs可调控多个靶基因,同一个靶基因也可以受多个miRNAs调控。mRNA之间可通过miRNAs反应元件达到相互调控的目的,该调控机制即竞争性内源RNA(ceRNA)机制具有相同miRNAs反应元件的mRNAs、假基因、lncRNA等转录物通过竞争性结合同种miRNAs调控其表达水平,从而影响细胞的功能[18]。Kou等[19]发现,HMGA2能调控let-7靶基因TGFBR3的表达,作为ceRNA促进肺癌细胞侵袭及转移。
研究显示,在胃癌的发生发展过程中,miR-26a能直接靶向调控TET1、TET2、TET3的表达[5],因此推测TET可能是作为miR-26a的ceRNA而发挥促进宫颈癌生长与转移作用。本研究中,经靶点预测和qRT-PCR实验证实TET1、TET2、TET3均为miR-26a调控的靶基因,在宫颈癌HeLa细胞中通过荧光素酶报告基因实验证实miR-26a能与TET1、TET2、TET3 mRNA 3′非编码区结合抑制荧光素酶活性。上述结果证实TET1、TET2、TET3均为miR-26a靶基因。因TET蛋白对其下游靶基因具有转录激活或抑制作用[2]。通过siRNA敲低TET1、TET2、TET3的表达均可抑制宫颈癌HeLa细胞增殖、克隆形成及侵袭能力,抑制TET尤其是TET2这种不依赖于编码蛋白发挥抑制宫颈癌HeLa细胞转化的功能,提示TET可能作为ceRNA而发挥功能。研究显示,miR-26a调控的靶基因有MTDH[20]、SMAD1[21]和GSK-3β[22]等,TET1、TET2、TET3很可能作为ceRNA调控这些基因的表达,或通过调控宫颈癌组蛋白甲基化修饰或者通过调控miR-26a其他靶基因参与不同的信号通路,从而实现调控宫颈癌的发生发展。