种子引发对甜高粱角质层蜡质及其抗性的影响
姚露花,綦才,杨建峰,郭彦军
(1. 西南大学农学与生物科技学院,重庆 400716;2. 青岛农业大学草业学院,山东 青岛 266109;3. 西南大学动物科学技术学院,重庆 400716)
全球气候变化引发的自然灾害,如干旱、水涝、高温、冷害等,严重影响着农业生产,全球受影响农田面积高达25%~38%[1]。高温干旱易导致禾谷类作物如玉米(Zea mays)、小麦(Triticum aestivum)、水稻(Oryza sativa)等减产达28%~49%[2]。因此,如何提高大田作物的抗逆性已成为农业生产亟待解决的问题。目前,抗逆品种选育被认为是解决这一问题的关键[3-4]。然而,品种选育周期长,加上品种更新换代较为频繁,依然无法从根本上解决非生物胁迫引发的生产损失。在生产中,主要通过施肥、灌溉、栽培措施等提高作物对自然灾害的抵抗能力[5-7]。其中,种子引发是一种低成本、可高效提高种子发芽活力及幼苗抗性的方法,可改善植物在非生物胁迫下的生长发育[8],在农业生产中使用较为广泛。
聚乙二醇(polyethylene glycol,PEG)引发对作物种子发芽、育苗和产量均有积极影响[9]。PEG 引发因其分子量大不易浸入种子,不会对种子胚胎产生破坏性影响[9]。PEG 引发的高粱(Sorghum bicolor)幼苗表现出较少的脂质过氧化,改善了细胞膜稳定性[10]。激素引发如水杨酸(salicylic acid,SA)可促进干旱条件下水稻种子的离子吸收,从而增加发芽及幼苗生长,同时减少植物的蒸腾水分流失[11]。盐胁迫下,脱落酸(abscisic acid,ABA)引发通过调节离子传输,减少蒸腾水分损失来促进大麦(Hordeum vulgare)叶片的生长[12]。吲哚-3-乙酸(indole-3-acetic acid,IAA)引发可调节小麦中的离子稳态和诱导叶片中的SA 生物合成来响应盐胁迫[13]。总之,渗透引发与激素引发通过不同的作用机制影响种子吸胀过程,因此筛选合适的引发剂,对精准提高作物抗逆性具有重要意义。
角质层蜡质是由初级醇、醛类、脂肪酸和烷烃等化合物组成的有机混合物,覆盖于植物表面形成抗逆屏障,可有效限制植物非气孔水分散失[14]。研究发现,植物表皮蜡质的含量和化学组分会因植物种类、发育阶段和器官部位变化而变化。比如,番茄(Lycopersicon esculentum)叶蜡的主要成分是烷烃和三萜类化合物[15],小麦叶蜡主要成分是伯醇和烷烃[16],高粱叶蜡的主要成分是烷烃和醛类化合物[17]。而蜡质的功能受其组分含量及种类的影响[18-19]。如C29烷与C31烷含量的增加更有利于防止植物过度失水[18]。植被富含C27~C33烷烃其保水能力较富含酮醛类物质更强[20]。拟南芥(Arabidopsis thaliana)突变体试验发现C29烷烃大量缺失,植株失水率显著增加且对干旱更加敏感[21-22]。叶绿素浸提试验显示蜡质组分中烷类物质含量的下降导致植物角质层渗透率上升约4 倍,其失水率明显加快。角质层蜡含量的变化会改变角质层的渗透性,调节角质层蒸腾,提高作物耐旱性[23]。种子引发可影响植物体内代谢活动以响应环境胁迫[24],而蜡质是植物脂质代谢的重要产物,可有效防止外界环境胁迫对植物生长的伤害[14]。因此,本研究认为引发可能通过改变角质层蜡质合成代谢以响应环境胁迫。
为了验证这一假设,本研究选择甜高粱(S. bicolor‘Dochna’)为试验对象,通过设置渗透引发(H2O,PEG)和激素引发处理[SA,ABA,赤霉素(gibberellin,GA)],研究引发是否通过改变角质层蜡质沉积,从而影响表皮渗透性、利于高粱生长。甜高粱是普通高粱的变种,一年生C4草本植物,具有光合效率高、可发酵糖量高、抗逆性强等特征[25-26]。因其生物产量高,富含多种营养成分,已经作为一种优质的饲用作物被广泛推广种植。然而,甜高粱抗逆性受其品种及推广种植环境的影响存在很大差异[3,27]。目前,针对改变高粱角质层蜡质沉积来降低水分散失的研究仅限于高粱苗期[28],对于大田条件下不同生长期的研究未见报道。因此,本研究主要探讨:1)引发对高粱不同生长期蜡质含量及组分含量的影响;2)引发对高粱不同生育期叶片含水量及叶片水分损失率的影响;3)引发对高粱不同生长期叶绿素含量及叶绿素浸提率的影响;4)引发对角质层蜡质的影响是否存在跨年度效果。
1 材料与方法
1.1 试验地点与材料
试验地位于重庆北碚西南大学实验农场(29°48′N,106°24′E),属亚热带季风性湿润气候。该地区的平均温度为17.8 ℃,过去30 年平均降水量为1100 mm。高粱生长试验期(2020 和2021 年)的气温与降水情况如图1所示。试验地土壤为紫色壤土,是中国南方最重要的农业土壤类型之一。土壤pH 值(土壤∶水=1∶5)为7.8,养分含量如全氮、全磷、全钾和总有机碳的含量分别为0.51 g·kg-1、0.38 g·kg-1、43.67 g·kg-1、21.13 g·kg-1;碱解氮、速效磷和速效钾的含量分别为41.94 mg·kg-1、6.81 mg·kg-1和56.67 mg·kg-1。土壤理化性质的测定参考鲍士旦[29]的方法。

图1 高粱种植期间重庆气温与降水情况Fig.1 Temperature and precipitation in Chongqing during planting stage of sorghum
试验材料选择甜高粱品种为品05206,由山西省农业科学院高粱研究所提供。挑选饱满健康的种子约600粒,用3% H2O2消毒5 min 后,用蒸馏水冲洗以去除消毒剂,然后进行种子引发处理。种子引发处理包括水(H2O)引发、聚乙二醇(PEG)引发、水杨酸(SA)引发、脱落酸(ABA)引发和赤霉素(GA)引发。其中,水引发为去离子水引发;PEG 引发液的质量百分数为15%、SA 引发液浓度为150 mg·L-1,ABA 引发液浓度为20 mg·L-1、GA 引发液浓度为5 mg·L-1。每次选择约200 粒大小一致的种子浸泡于100 mL 的各引发溶液中,20 ℃,黑暗条件下处理24 h[30],之后在室温下干燥至种子原始水分重量。同时用未引发种子作为对照(CK)。所有种子均储存于4 ℃冰箱进行下一步试验。
1.2 试验设计
将未引发与引发种子于2020 年5 月在室温条件下催芽12 h,播种于土壤,覆土3 cm。小区面积2 m×4 m,3次重复。株距30 cm,行距40 cm。试验地播前进行常规处理,深翻(深度约25~30 cm)并施加600 kg·hm-2复合肥(N-P2O5-K2O 比例为15-15-15)。播种方式为人工播种,每穴播3~4 粒,3 叶期按设计株距定苗。高粱苗期进行正常浇水管理,拔节期进行中耕除杂防止高粱后期倒伏及杂草对高粱生长产生影响。于2020 年8 月收种后,种子存储于4 ℃低温冰箱,然后于2021 年5 月直接播种。播种方式与田间管理方式同2020 年。不同生育期(苗期、拔节期、抽穗期、成熟期)所有指标均在同一时间取同一位置的叶片测定。
1.3 指标测定
1.3.1蜡质提取 采集高粱同一部位展开叶片,室温条件下加入含1 µg·µL-1内标(十六烷)的氯仿约3 mL,振荡提取30 s,重复3 次。总提取液于40 ℃下氮气吹干,加入吡啶与BSTFA[N,O-Bis(三甲基硅烷基)三氟乙酰胺]衍生剂各20 µL,70 ℃反应45 min,之后用氮吹仪再次吹干。将提取物用0.5 mL 氯仿溶解进行气相色谱和质谱分析[31]。叶片提蜡前,利用WinFOLIA 专业叶片图像分析系统(regent instrument inc,加拿大)和数字化扫描仪(EPSON V750,日本)测定叶片面积[32]。
1.3.2气相色谱、质谱分析(GC-MS) 蜡质含量分析采用福立9790Ⅱ系列气相色谱仪(中国)。气相色谱仪程序:GC 毛细管柱长30 m,直径0.32 mm,液膜厚度0.25 µm;氮气作为载气;进样量为2 μL。柱膜和FID 检测器的温度分别为300 和320 ℃。分流比为3∶1。程序升温方式:初始温度为80 ℃,以每分钟15 ℃的速度升温至260 ℃,并保持10 min,之后以每分钟2 ℃升温至290 ℃,保持1 min,再以每分钟5 ℃的速度升温至320 ℃,并保持10 min。用内标计算植物单位面积的蜡质含量,单位为µg·cm-2。利用气相色谱—质谱联用仪(GCMS-QP2010 Ultra,日本)鉴定蜡质组分,程序升温方式同色谱分析。
1.3.3叶片相对含水量与角质层水分损失率测定 高粱叶片相对含水量(relative water content,RWC)根据Weatherley[33]的方法测定。即采集高粱不同生长期同一部位完全展开的叶片,并立即称量鲜重(fresh weight,FW)。之后将叶片在蒸馏水中浸泡3 h,测定叶片饱和重量(saturated weight,SW),在70 ℃烘箱中干燥24 h 后,并称干重(dry weight,DW)。相对含水量(RWC)计算公式为:RWC=(FW-DW)/(SW-DW)×100%。
角质层水分损失率根据Burkhardt 等[34]的方法测定。将植株放于黑暗条件下适应12 h 以确保气孔关闭。采集叶片样品浸入蒸馏水中1 h 并称重。之后将叶片放入暗室进行连续脱水,每隔15 min 测定其重量,持续150 min,以记录水分损失。最后,将叶片样品在70 ℃下干燥24 h 并称重。失水率计算公式如下:

1.3.4叶绿素含量与叶绿素浸提率测定 叶绿素含量使用SPAD 仪(SPAD 502 Plus,日本)测定,选择不同高粱植株同一叶片同一位置重复测定4 次。叶绿素浸提参考陈红妙等[35]方法测定。取高粱同一部位展开叶片,剪碎,片段长约3 cm,浸泡在30 mL 80%的乙醇中,黑暗条件下轻轻摇晃,分别于20、60、120、180 和240 min 取3 mL浸提液用于测定其在λ664和λ647波长下的吸收值(A664和A647),测定后浸提液均倒回至相应的样品瓶中,每种处理均做3 个重复。
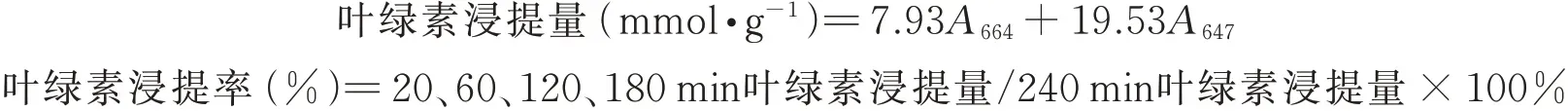
1.4 数据分析
所有数据均以指标平均值±标准误表示。单因素方差分析用于比较处理间的蜡质含量、相对含水量、叶片失水率以及叶绿素浸提率指标(SPSS 17.0)。根据最小显著性差异法(LSD)检验显著性(P<0.05)。
2 结果与分析
2.1 种子引发对高粱叶角质层蜡质总量的影响
高粱从苗期到成熟期,引发处理植株叶片蜡质含量均呈增加趋势(图2)。2020 年,苗期H2O、PEG、SA、ABA与GA 引发处理的蜡质总量较对照分别增加了24.7%,57.6%,50.8%、80.3%和36.7%(图2A)。除水引发外,其他处理均达到显著水平。拔节期,PEG 引发处理的蜡质总量较对照增加了12.0%,而SA 与ABA 引发处理的蜡质总量较对照分别显著下降了32.2%和25.8%(图2B)。抽穗期,ABA 引发处理的蜡质总量较对照显著增加了38.6%(图2C)。成熟期,PEG、SA 与ABA 引发处理的蜡质总量较对照分别显著增加了33.5%,26.3%和37.0%(图2D)。2021 年,苗期PEG、SA、ABA 引发的蜡质总量仍显著高于对照,与2020 年的各引发处理蜡质总量变化情况一致(图2E);拔节期H2O、PEG、SA 引发的蜡质总量显著高于对照(图2F);抽穗期与成熟期各引发处理蜡质总量无显著变化(图2G,H)。因此,不同年份间,仅PEG 与ABA 引发对角质层蜡质含量的影响效果一致,影响效果最长且存在跨代效应。
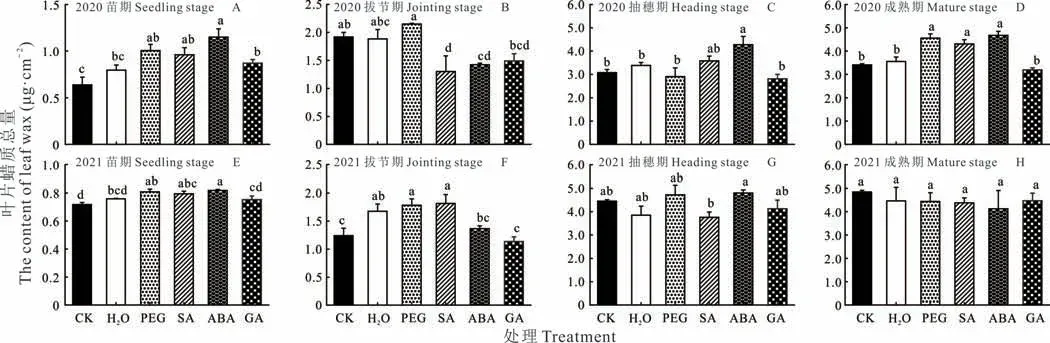
图2 种子引发对高粱叶片角质层蜡质总量的影响Fig.2 Effects of different seed priming on total contents of leaf wax
2.2 种子引发对高粱叶角质层蜡质组分的影响
2.2.1烷烃 除ABA 引发成熟期烷烃含量低于抽穗期外,其他引发处理烷烃含量均随着生育期的推进一直增加(图3)。种子引发对高粱叶片烷烃含量有显著影响,但其效果在引发处理间存在差异(图3)。具体为ABA引发可显著增加苗期、抽穗期的烷烃总量,PEG 引发则显著增加拔节期烷烃总量,SA 引发仅增加2020 年成熟期烷烃总量。此外,与对照相比,引发显著影响C27~C35烷的相对丰度。苗期,除H2O 引发外,各引发处理均可增加C29与C33烷烃的相对丰度(图4A)。抽穗期,ABA 引发显著增加C27烷相对丰度(图4C);成熟期,PEG 引发显著增加了C35烷相对丰度,ABA 引发显著增加了C27烷相对丰度(图4D)。进一步分析发现,PEG 引发较激素引发显著增加了C31、C33与C35烷相对丰度(图4D)。2021 年,PEG 引发显著增加拔节期烷烃总量及C27烷相对丰度(图3F 和图4F),ABA 引发显著增加抽穗期烷烃总量(图3G)。因此,仅PEG 与ABA 引发对烷烃含量及碳链组分的影响存在跨代效应(图3 和图4)。
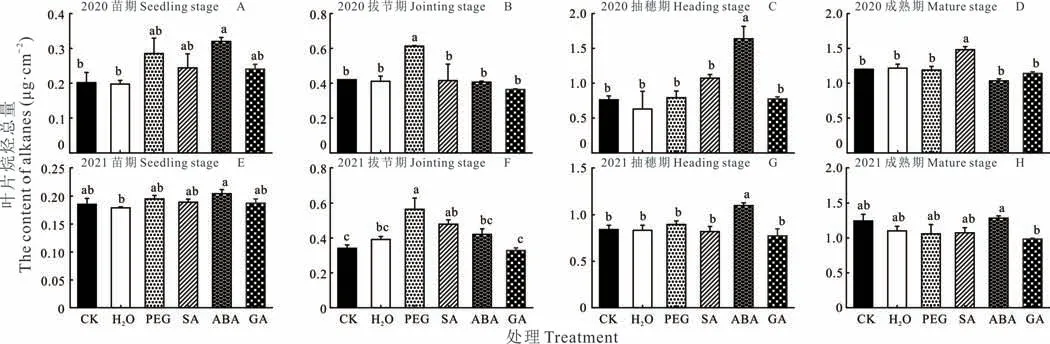
图3 种子引发对高粱烷烃含量的影响Fig.3 Effects of different seed priming on total contents of alkanes
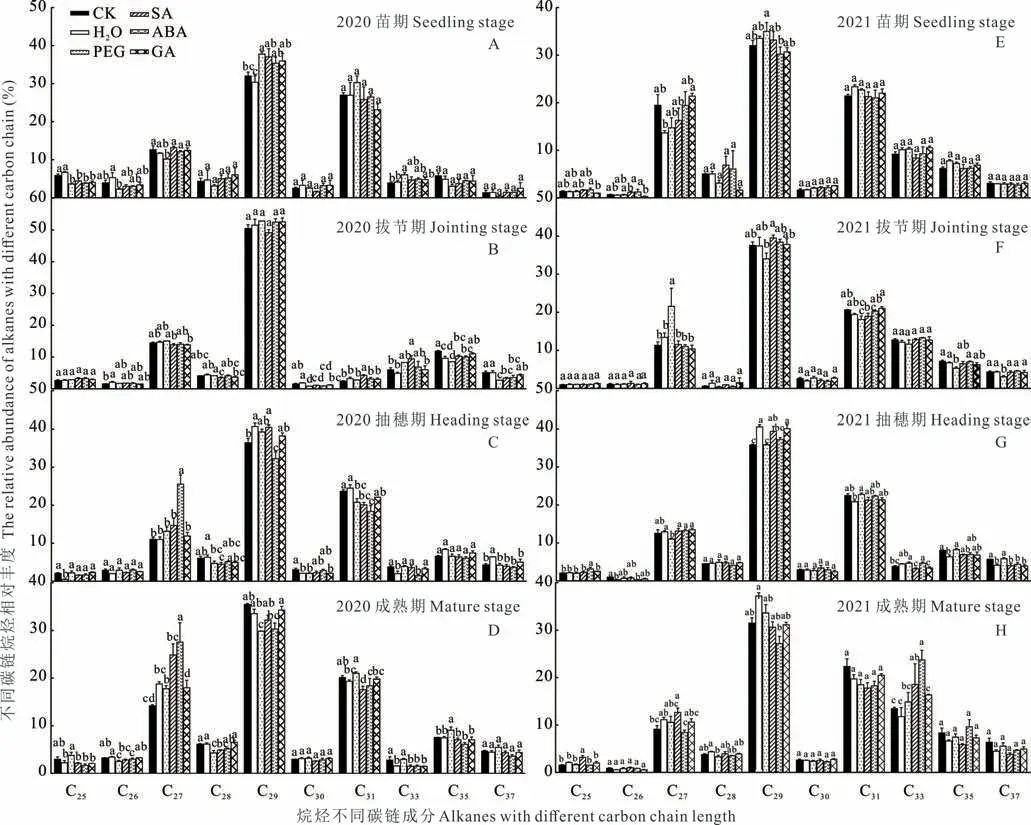
图4 种子引发对高粱不同碳链烷烃相对丰度的影响Fig.4 Effects of different seed priming on the relative abundance of alkanes with different carbon chain of alkanes
2.2.2醇 2020 年从高粱苗期到成熟期,各引发处理醇含量呈增加趋势,而2021 年成熟期醇含量则低于抽穗期含量(图5)。同一生长期,种子引发对高粱叶片醇含量及C28醇相对丰度有显著影响(图5)。2020 年,PEG、SA与ABA 引发均可显著增加成熟期醇含量,而对其他生长期醇含量的影响因引发处理不同而不同(图5A~D)。此外从苗期到拔节期,除H2O 引发外,其他引发均可增加C28醇的相对丰度且拔节期达显著水平(图5I,J)。成熟期,PEG 引发显著增加C32醇相对丰度,SA、ABA 与GA 较PEG 引发增加了C28醇相对丰度,其中SA 与GA 引发达显著水平(图5L)。2021 年,PEG 与ABA 引发仍显著增加了苗期醇含量(图5E),但对不同碳链醇相对丰度无显著影响(图5M~P)。
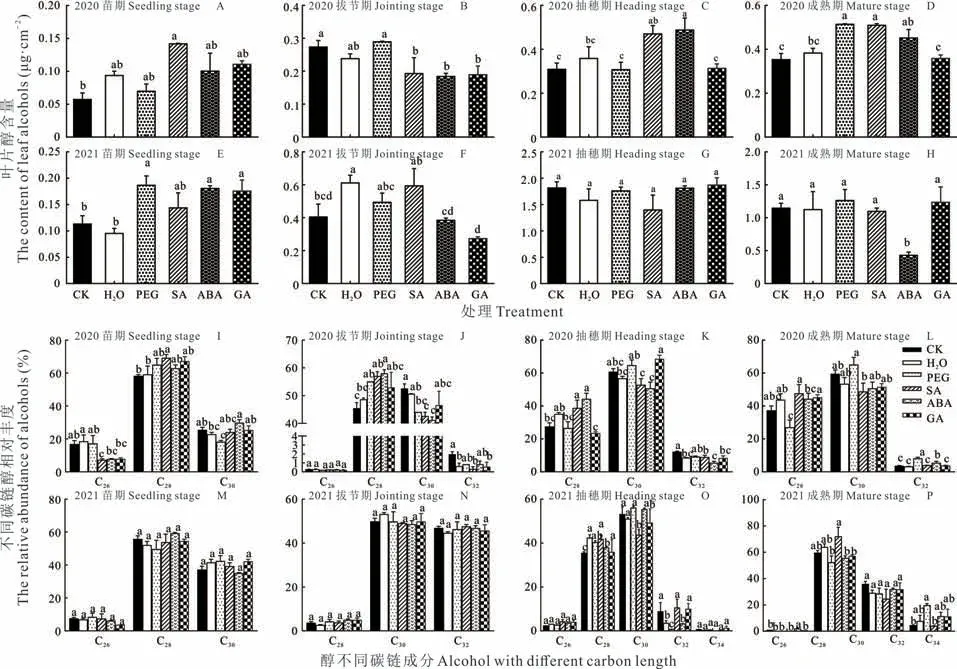
图5 种子引发对高粱蜡质醇组分含量及其碳链分布的影响Fig.5 Effects of different seed priming on total contents of alcohols and carbon chain distribution
2.2.3醛 高粱从苗期到成熟期,叶片醛含量呈增加趋势,PEG 引发与激素引发均显著影响C28醛与C30醛的相对丰度(图6)。同一生长期,种子引发对高粱叶片醛含量同样存在显著影响(图6)。2020 年苗期,除水引发外,其余引发处理均显著增加了醛含量(图6A)。与对照相比,PEG 引发显著增加了C30醛相对丰度(图6I)。拔节期,激素引发显著降低醛含量却显著增加了C28与C30醛相对丰度(图6J)。抽穗期,引发对不同醛含量及其链长分布无显著影响,除ABA 引发醛优势链长从C28转变为C30(图6K)。成熟期,与对照相比,PEG 与ABA 引发显著增加了醛总量(图6D),PEG 引发还显著增加了C28醛相对丰度(图6L)。2021 年,引发对高粱叶片醛含量及醛链长分布无显著影响。因此,引发对醛含量影响不存在跨代效应。
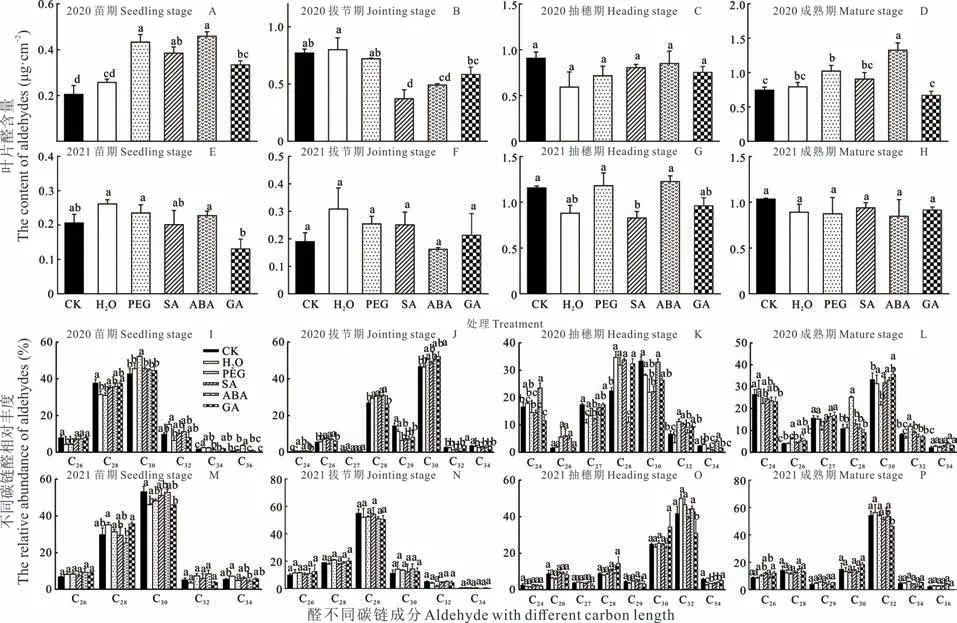
图6 种子引发对高粱蜡质醛组分及其碳链分布的影响Fig.6 Effects of different seed priming on total contents of aldehydes and carbon chain distribution
2.2.4三萜类组分 高粱叶片三萜类组分主要包括香树脂醇与羊毛甾醇(图7)。2020 年,苗期仅ABA 引发显著降低香树脂醇含量(图7A);拔节期,仅PEG 引发显著增加香树脂醇含量(图7B);抽穗期,ABA 引发显著增加香树脂醇含量(图7C);成熟期,激素引发显著降低香树脂醇含量(图7D)。2021 年,引发处理对香树脂醇含量无显著影响。2020 年,H2O 引发显著增加了拔节期与抽穗期的羊毛甾醇含量(图7J,K),SA 与ABA 引发显著增加了成熟期羊毛甾醇含量(图7L)。2021 年,引发处理对羊毛甾醇含量无显著影响。综上所述,与烷、醇、醛含量一致,从苗期到成熟期三萜类组分含量呈增加趋势。
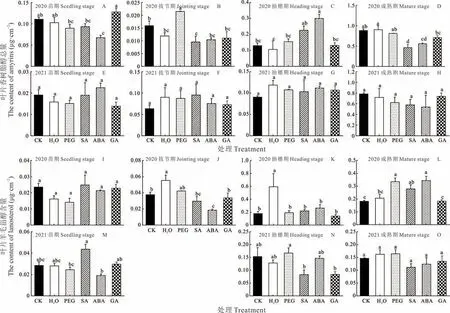
图7 种子引发对高粱蜡质三萜类组分的影响Fig.7 Effects of different seed priming on total contents of triterpenoids
2.3 种子引发对叶片水分与叶绿素的影响
种子引发可增加高粱不同生长期的叶片含水量(图8A)。不同生长期各引发处理失水率从高到低分别为:苗期,H2O>CK>PEG、SA、ABA、GA(图8B);拔节期,H2O>GA>CK>SA>PEG>ABA(图8C);抽穗期,SA>GA>CK、H2O、ABA>PEG(图8D);成熟期,GA>CK>H2O>SA、ABA>PEG(图8E)。总之,高梁苗期、拔节期与成熟期除H2O 与GA 引发外,PEG、SA 与ABA 引发处理的失水率一直低于对照。
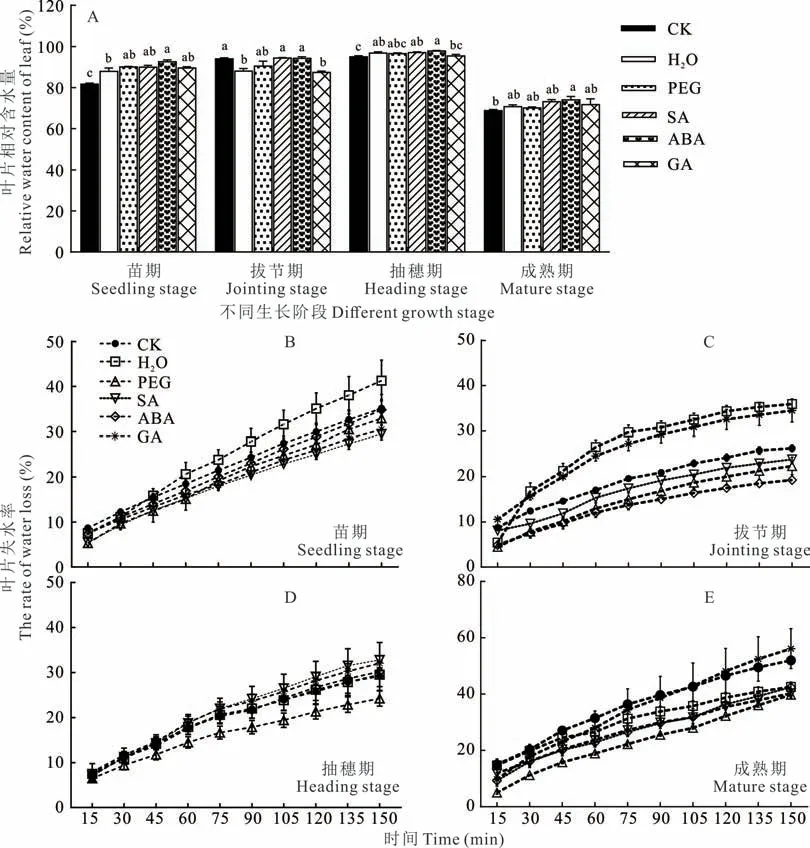
图8 引发处理对叶片相对含水量及失水率的影响Fig.8 Effects on relative water content and water loss rate of seed priming
种子引发可显著影响高粱不同生长期叶片的叶绿素含量(图9A)。苗期到拔节期,PEG 与SA 可显著增加叶绿素含量,ABA 仅显著增加苗期叶绿素含量,而抽穗期与成熟期则显著降低叶绿素含量(图9A)。对叶绿素浸提率的分析发现,不同生长阶段各引发处理浸提率从高到低分别为,苗期,CK>H2O>SA、GA>PEG、ABA(图9B);拔节期,CK>H2O>SA、GA、PEG、ABA(图9C);抽穗期,CK、PEG>GA、SA>H2O>ABA(图9D);成熟期,CK>H2O、GA>PEG>SA、ABA(图9E)。总之,各引发处理均可降低叶绿素浸提率,特别是ABA 引发,说明引发处理可增加叶片细胞膜稳定性。
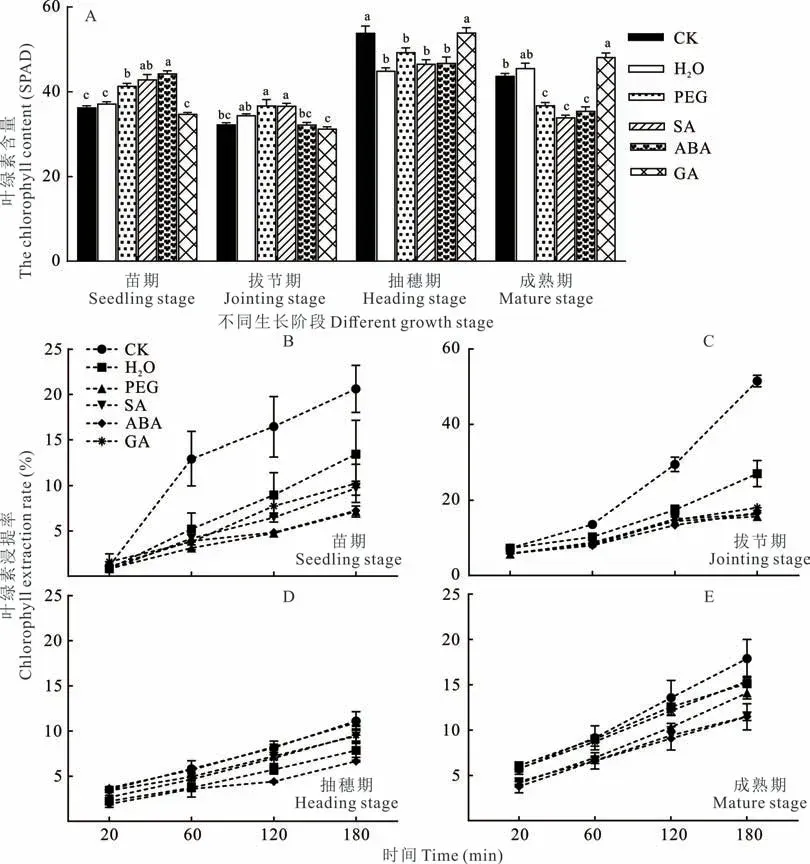
图9 引发处理对高粱叶片叶绿素含量及叶绿素浸提率的影响Fig.9 Effects on chlorophyll content and extraction rate of seed priming
3 讨论
3.1 种子引发改变高粱叶片蜡质及其组分含量
角质层蜡质是植物脂质代谢产物,覆盖于植物表面抵御外界胁迫[14]。本研究中,种子引发显著增加不同生长期高粱叶片蜡质总量,表明引发可在高粱角质层响应其生长期环境变化时发挥作用[17]。据报道,种子引发也可产生长期或跨代记忆以响应生长期间遭遇的环境胁迫,如盐胁迫等[36-37]。因此,引发同样可增加角质层蜡质含量以响应长时间干旱[36,38]。值得注意的是,种子引发对蜡质总量及组分含量存在年际效应,证明引发效应也可产生跨代“记忆”。但具体存在跨代效应的分子机理有待进一步研究。
研究表明,植物会改变蜡质组分以响应外界环境[39-40]。本研究中,种子引发可改变烷烃、醇及醛成分的总量及各组分不同碳链组分的相对丰度。这说明种子引发影响了蜡质基因的表达,从而影响蜡质沉积。如CER1是合成烷烃的关键基因[41],脂肪酰辅酶A 还原酶(fatty acyl CoA reductase,FAR)是脂肪醇还原所需的重要酶[42],种子引发后幼苗蜡质组分及相对丰度变化可能与这些基因的表达存在差异有关。同时发现,PEG、SA、ABA 对蜡质组分影响程度不一致,说明不同引发处理作用于不同蜡质合成过程,参与的调控途径各不相同。如显著提高烷烃或醛含量,表明引发主要作用于脱羰基途径,醇含量的增加表明引发主要影响酰基还原途径[43]。本研究中,PEG 引发显著增加C27烷烃与C28醛相对丰度,显著降低C29烷与C28醇相对丰度,说明PEG 引发将更多长链脂肪酸前体从酰基还原途径转化为脱羰基途径,相对促进了烷烃的生物合成[44]。另外,PEG 引发与激素引发作用机理也不同,PEG 引发主要影响细胞膜渗透水平,激素引发则对细胞的离子运输发挥作用,这同样可导致PEG 引发与ABA 引发对蜡质组分影响的不一致。总之,引发可能通过影响参与不同蜡质合成途径的基因表达进而改变高粱蜡质及其组分含量。
3.2 种子引发改变蜡质含量及组分,提高角质层抗性
角质层蜡质组分的改变与其功能变化相关。蜡质及其组分含量增加的同时高粱叶片失水率下降,叶片含水量增加,说明蜡质可有效防止水分散失。研究表明,蜡质组分随环境变化而变化[39,45],其中烷烃是蜡质组分中保水最有效的部分[46]。这表明水分散失不仅受蜡质含量影响,也与其组分显著相关。本研究中,种子引发特别是PEG、SA 与ABA 引发显著增加了低极性组分如烷烃、醛的含量。同时,C27~C33烷与C28醛相对丰度的增加表明引发主要促进长链脂肪酸的伸长,以减少叶片水分损失。此外,角质层蜡质组分烷烃及醛含量的下降可显著增加叶片叶绿素浸提率,使植物抗旱性降低[47]。本研究中,PEG、SA 与ABA 引发同样增加了烷烃及醛含量,从而降低了高粱叶绿素浸提率。这表明引发显著降低高粱叶片质膜透性,使角质层抗性增加及细胞膜受环境胁迫伤害程度降低[48]。进一步分析发现,引发处理后叶片相对含水量也显著增加。而叶片水分含量与植物光合作用密切相关[46-47],说明引发有利于高粱生物量的积累。与光合作用密切相关的叶绿素也受引发影响。引发处理可增加苗期与拔节期叶绿素含量,却降低抽穗期与成熟期的叶绿素含量。综上所述,PEG、SA 与ABA 引发可通过影响蜡质合成从而提高角质层的抗性。
激素引发显著增加高粱叶片蜡质积累,这与施加外源激素对植物蜡质的影响作用一致[49]。PEG 引发与激素引发对蜡质总量与高粱抗性具有同样的效果,可增加约50%的蜡质总量。这可能是由于PEG 引发对高粱产生渗透胁迫,打破植物体内激素平衡,进而诱导蜡质基因表达[45]。但其具体影响机制异同仍需进一步研究。
总之,种子引发可增加高粱不同生育期角质层蜡质及其优势组分含量,增加叶片含水量,降低角质层失水率及叶绿素浸提率,从而增加各生长期抗性。更重要的是,种子引发具有跨代“记忆”,但其机制需进一步研究。

