抗补体5a受体抗体对变应性鼻炎大鼠Treg/Th17免疫失衡的调控作用
刘玉娟,吴云霄,魏燕高△
杨凌示范区医院:1.耳鼻喉科;2.神经内科,陕西咸阳 712100
变应性鼻炎(AR)是一种I型过敏性免疫球蛋白E(IgE)依赖型鼻黏膜疾病,由吸入的过敏原包括尘螨、花粉和动物皮屑等引起[1]。AR对患者生活质量产生了较大影响,也给社会医疗服务造成了一定负担,现已成为全世界重大公共卫生问题[2-3]。目前,AR的发病机理尚未完全阐明。有研究表明,在多数情况下运用抗组胺药和皮质类固醇激素可以减轻AR症状[4],但是,耐药性的产生使AR患者难以治愈。因此,迫切需要开发新颖且有效的药物来治疗AR。
补体C5a是活化的补体系统C5裂解后的小分裂片段产物,其能够促进炎症因子的释放,通过与特定的补体5a受体(C5aR)结合发挥作用,已有研究表明,C5a激活后参与多种疾病反应,例如系统性红斑狼疮、败血症、缺血再灌注损伤和类风湿关节炎等[5-7]。目前,靶向C5a和C5aR开发抗体以及小分子化合物已成为多种疾病的治疗靶点,其中,抗C5aR抗体是C5a拮抗剂,可抑制C5a的活性从而减轻炎性反应。为了探索抗C5aR抗体对AR的作用,本研究以构建的大鼠AR模型为研究对象,观察抗C5aR抗体施用后的效果,为临床AR的治疗提供实验依据。现报道如下。
1 材料与方法
1.1材料来源 60只无特定病原体(SPF级)Wistar大鼠,雌雄各30只,4~6周龄,体质量160~220 g,由本院SPF级动物实验中心提供,饲养于标准动物环境条件下,实验期间自由饮水、摄食。
1.2仪器与试剂 抗C5aR抗体购自上海吉尔生物化学有限公司,Jagged1肽、卵清蛋白(OVA)和氢氧化铝[Al(OH)3]干粉购自美国Sigma公司,酶联免疫吸附试验(ELISA)试剂盒购自南京建成生物工程研究所,HE染色试剂盒、PAS染色试剂盒和免疫组织化学染色试剂购自武汉博士德生物公司,抗体Notch1、Jagged1、RORγt、Foxp3购自美国Cell Signaling公司,辣根过氧化物酶标记的山羊抗兔/山羊抗鼠和β-actin购自北京康为世纪生物科技有限公司,BCA蛋白检测试剂盒和增强化学发光法(ECL)发光液购自上海碧云天生物研究所。
1.3方法
1.3.1大鼠AR模型制备 建立Wistar大鼠AR模型,具体按照参考文献[8]方法操作。首先进行基础致敏,将0.3 mg OVA和30 mg Al(OH)3加入1 mL的生理盐水混合均匀,制成混悬液,通过腹腔注射,隔日注射1次,共注射7次,用时14 d,同时对照组大鼠腹腔注射等量生理盐水;接着进行鼻腔激发,致敏后的大鼠取2%OVA进行滴鼻,采用微量进样器从鼻腔滴入,每侧滴入50 μL,每天1次,连续7 d,对照组以等量生理盐水滴入鼻腔。末次鼻腔激发后,进行表观行为学指标评估大鼠AR模型是否造模成功,观察30 min内大鼠喷嚏、鼻溢和搔鼻动作行为,采用叠加量化计分,具体为(1)喷嚏:1~4个为1分,>4~10个为2分,>10个为3分;(2)流鼻涕:流至鼻孔前为1分,流出鼻孔为2分,流至面部计为3分;(3)挠痒:单前肢偶有挠鼻为1分,双前肢挠鼻为2分,双前肢不停挠鼻为3分。叠加评分总分>5分,判断为造模成功。
1.3.2分组与给药 将60只Wistar大鼠按照随机数字表法分为4组,包括对照组、模型组、抗C5aR抗体组、抗C5aR抗体+Jagged1组,每组15只。除对照组外其余3组大鼠均建立AR模型,对照组予以生理盐水处理。造模完成后,抗C5aR抗体组大鼠腹腔注射20 μL抗C5aR抗体(10 μg/mL),抗C5aR抗体+Jagged1组大鼠腹腔注射20 μL抗C5aR抗体(10 mg/kg),同时注射5 μL Jagged1钛(10 μg/mL),对照组和模型组注射等体积的生理盐水,每周注射1次,共持续4周。
1.3.3ELISA 断颈法处死各组大鼠,通过眼眶采血,将收集的血液静置于室温下2 h,接着以4 000 r/min离心15 min,分离血清,保存在-80 ℃冰箱中。使用大鼠特异性ELISA试剂盒检测血清中IgE、干扰素-γ(IFN-γ)、白细胞介素(IL)-6、IL-10和IL-17的水平,步骤严格按照试剂盒说明书进行操作。
1.3.4HE染色 处死大鼠后分离鼻骨前皮肤,咬除鼻骨,取双侧鼻腔黏膜组织,迅速清洗干净,置于4%多聚甲醛中固定;将固定好的组织常规石蜡包埋,在切片机上切成5 μm的组织薄片,通过HE染色观察组织学改变。步骤包括:组织切片采用二甲苯脱蜡,梯度乙醇脱水,加入苏木精染色5 min,流水冲洗干净,再加入伊红染色3 min,流水再次冲洗干净,利用梯度乙醇脱水,二甲苯透明,中性树胶封片,通过光学显微镜观察鼻腔黏膜组织形态变化,并随机选择6个不同视野观察计数嗜酸性粒细胞数目,取平均值作为结果。
1.3.5PAS染色 取制备的鼻腔黏膜组织石蜡切片,二甲苯脱蜡、梯度乙醇脱水后,将切片置于阿利新蓝溶液中浸泡10 min,流水冲洗干净,置于过碘酸溶液中氧化5 min,接着浸入Leagene Schiff Reagent中染色10 min,流水冲洗后,通过Mayer Lillie苏木素染色液染核,酸性乙醇分化,加入氨水溶液返蓝,洗净后,再次进行脱水与透明处理,中性树胶封片,通过光学显微镜观察鼻腔黏膜组织染色情况,并随机选择6个不同视野观察计数杯状细胞数目,取平均值作为结果。
1.3.6免疫组织化学染色 鼻腔黏膜组织石蜡切片经过二甲苯脱蜡、梯度乙醇脱水后,置于0.3%过氧化氢中30 min,并通过高温(98 ℃)加热5 min进行抗原修复,接着加入山羊血清,室温孵育1 h,将切片与兔抗Notch1(1∶200)一抗工作液,在4 ℃共同孵育过夜。PBS缓冲液清洗,加入辣根过氧化物酶标记的山羊抗兔IgG(1∶5 000)二抗工作液,在室温下孵育1 h,在切片上滴加 DAB 显色,自来水清洗干净,加苏木素复染,二甲苯透明,中性树胶封片,在光学显微镜下观察组织中阳性表达并捕获图像,胞质染成黄色至棕色即为阳性,随机选择6个视野,采用Image-Pro Plus软件统计阳性表达面积。
1.3.7Western blot 将鼻腔黏膜组织充分剪碎,PBS缓冲液清洗干净,加入RIPA裂解缓冲液提取组织总蛋白,通过BCA法测定蛋白质含量。以30 μg各组蛋白样品加样,通过10% SDS-PAGE凝胶分离蛋白质,转移至PVDF膜上,5%脱脂奶粉中室温封闭2 h,TBST洗膜,加入RORγt(1∶1 000)、Foxp3(1∶1 000)、Notch1(1∶1 000)与Jagged1(1∶1 000)一抗工作液,以β-actin作为内参蛋白(1∶1 000),4 ℃下孵育过夜。次日,TBST洗膜,加入对应的辣根过氧化物酶标记二抗工作液(1∶5 000),室温下孵育1 h,TBST洗膜后,滴加ECL发光液显色曝光,凝胶成像系统拍照,Image Pro-Plus分析系统分析蛋白条带灰度值,计算各蛋白表达水平。
1.3.8流式细胞术分析外周血CD4+Foxp3+调节性T细胞(Treg细胞)和CD4+IL-17A+辅助性T细胞17(Th17细胞)百分比 采集各组小鼠外周血,流式细胞仪检测Treg、Th17细胞比例,取肝素抗凝血,在避光条件下加入抗体,Treg细胞以CD4/Foxp3标记,Th17细胞以CD4/IL-17A标记,室温孵育15 min,接着加入500 μL裂解液,轻轻混匀,室温避光孵育10 min,加入1.5 mL PBS缓冲液,置于离心机中以2 500 r/min离心10 min,弃上清液后加入PBS缓冲液轻轻混匀,立即通过流式细胞仪进行分析。

2 结 果
2.1建模后4组大鼠表观行为学评分比较 末次鼻腔激发后,4组大鼠30 min内喷嚏、鼻溢和搔鼻动作行为的评分结果见表1。对照组大鼠未见明显的喷嚏与流涕表现,偶有抓鼻;而模型组、抗C5aR抗体组和抗C5aR抗体+Jagged1组的大鼠均表现出烦躁不安,打喷嚏、流涕以及频繁抓鼻等现象,表观行为学评分均高于5分,且明显高于对照组(P<0.05),说明AR模型构建成功。

表1 4组大鼠表观行为学评分比较分)
2.24组大鼠血清IgE水平比较 模型组大鼠血清中IgE水平明显低于对照组(P<0.05);抗C5aR抗体组IgE水平较模型组明显升高(P<0.05);抗C5aR抗体+Jagged1组IgE水平高于抗C5aR抗体组(P<0.05)。见表2。

表2 4组大鼠血清IgE水平比较
2.34组大鼠血清IFN-γ、IL-6、IL-10和IL-17水平比较 与对照组比较,模型组血清IFN-γ、IL-10水平明显下降,IL-6、IL-17水平明显升高(P<0.05);与模型组比较,抗C5aR抗体组IFN-γ、IL-10水平明显升高,而IL-6、IL-17水平明显下降(P<0.05);与抗C5aR抗体组比较,抗C5aR抗体+Jagged1组IFN-γ、IL-10水平明显下降,同时IL-6、IL-17水平明显升高(P<0.05),见图1。

注:A~D分别为4组IFN-γ、IL-6、IL-10和IL-17水平比较;与对照组比较,*P<0.05;与模型组比较,#P<0.05;与抗C5aR抗体组比较,&P<0.05。
2.44组大鼠鼻腔黏膜组织病理学变化比较 HE染色和PAS染色结果显示,对照组大鼠鼻腔黏膜组织结构整齐、排列有序,未发现组织损伤;模型组大鼠鼻腔黏膜组织可见明显的血管扩张、水肿和严重炎性细胞浸润,嗜酸性细胞粒数目和杯状细胞数目均明显增加;抗C5aR抗体组鼻腔黏膜组织仍有水肿,相较于模型组炎症细胞浸润程度减轻,嗜酸性细胞粒数目和杯状细胞数目均减少;而与抗C5aR抗体组相比较,抗C5aR抗体+Jagged1组鼻腔黏膜组织水肿和炎性细胞浸润较为严重,嗜酸性细胞粒数目和杯状细胞数目也表现为增加,见图2。
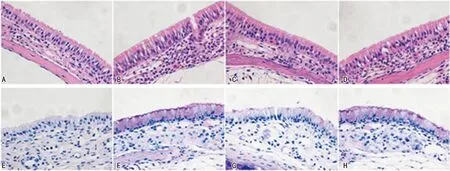
注:A为对照组大鼠鼻腔黏膜组织HE染色,B为模型组大鼠鼻腔黏膜组织HE染色,C为抗C5aR抗体组大鼠鼻腔黏膜组织HE染色,D为抗C5aR抗体+Jagged1组大鼠鼻腔黏膜组织HE染色,E为对照组大鼠鼻腔黏膜组织PAS染色,F为模型组大鼠鼻腔黏膜组织PAS染色,G为抗C5aR抗体组大鼠鼻腔黏膜组织PAS染色,H为抗C5aR抗体+Jagged1组大鼠鼻腔黏膜组织PAS染色。
2.54组大鼠鼻腔黏膜组织RORγt与Foxp3表达比较 Western blot检测结果显示,模型组鼻腔黏膜组织中RORγt蛋白表达较对照组明显上调,Foxp3蛋白表达则明显下调(P<0.05);与模型组比较,抗C5aR抗体组RORγt蛋白表达明显下调、Foxp3蛋白表达明显上调(P<0.05);而相较于抗C5aR抗体组,抗C5aR抗体+Jagged1组RORγt蛋白表达明显上调,Foxp3蛋白表达明显下调(P<0.05),见图3。
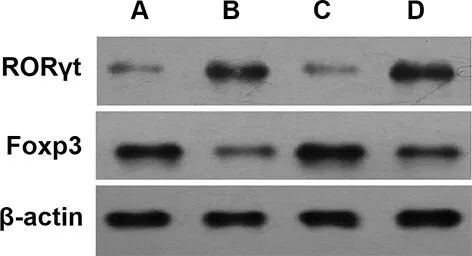
注:A为对照组,B为模型组,C为抗C5aR抗体组,D为抗C5aR抗体+Jagged1组。
2.64组大鼠外周血Treg细胞和Th17细胞亚群比例分析 流式细胞术检测结果显示,与对照组比较,模型组外周血中Th17细胞比例升高,Treg 细胞比例降低,Th17/Treg比值明显增加(P<0.05);与模型组比较,抗C5aR抗体组Th17细胞比例降低而Treg 细胞比例升高,Th17/Treg比值明显下降(P<0.05);而相较于抗C5aR抗体组,抗C5aR抗体+Jagged1组Th17细胞比例升高,Treg细胞比例降低,同时,Th17/Treg比值明显增加(P<0.05),见图4。

注: A为对照组大鼠外周血中Th17细胞比例,B为模型组大鼠外周血中Th17细胞比例,C为抗C5aR抗体组大鼠外周血中Th17细胞比例,D为抗C5aR抗体+Jagged1组大鼠外周血中Th17细胞比例,E为对照组大鼠外周血Treg 细胞比例,F为模型组大鼠外周血Treg 细胞比例,G为抗C5aR抗体组大鼠外周血Treg 细胞比例,H为抗C5aR抗体+Jagged1组大鼠外周血Treg 细胞比例。
2.74组大鼠鼻腔黏膜组织Notch1-Jagged1信号途径相关蛋白表达比较 通过免疫组织化学染色结果可观察到,对照组鼻腔黏膜组织中染色较浅,Notch1蛋白阳性表达率为(8.50%±0.66%);模型组中染色较深,Notch1蛋白阳性表达率为(38.03%±3.15%),较对照组明显增加(P<0.05);抗C5aR抗体组中染色明显变浅,Notch1蛋白阳性表达率为(8.47%±0.70%),较模型组明显降低(P<0.05);而抗C5aR抗体+Jagged1组染色又明显加深,Notch1蛋白阳性表达率为(43.55%±3.89%),相较于抗C5aR抗体组明显增加(P<0.05),见图5。

注:A为对照组大鼠鼻腔黏膜组织Notch1蛋白染色,B为模型组大鼠鼻腔黏膜组织Notch1蛋白染色,C为抗C5aR抗体组大鼠鼻腔黏膜组织Notch1蛋白染色,D为抗C5aR抗体+Jagged1组大鼠鼻腔黏膜组织Notch1蛋白染色。
Western blot检测结果显示,与对照组比较,模型组鼻腔黏膜组织中Notch1与Jagged1蛋白表达明显升高(P<0.05);与模型组比较,抗C5aR抗体组鼻腔黏膜组织中Notch1与Jagged1蛋白表达则明显下降(P<0.05);而抗C5aR抗体+Jagged1组Notch1与Jagged1蛋白表达较抗C5aR抗体组则明显升高(P<0.05),见图6。

注:A为对照组,B为模型组,C为抗C5aR抗体组,D为抗C5aR抗体+Jagged1组。
3 讨 论
AR是由IgE介导的与过敏原免疫反应相关的鼻黏膜炎症疾病,AR患者通常以鼻塞、打喷嚏和鼻痒等症状为主要特征。在AR反应中,当过敏原与鼻腔黏膜接触后,肥大细胞通过分泌释放炎性介质如组胺、IL等,诱导急性过敏反应的发生;当在过敏原中持续暴露6~10 h后,鼻腔中会引发炎性细胞如嗜酸性粒细胞浸润,嗜酸性粒细胞来源的介质诱导上皮损伤并致使鼻腔黏膜肿胀[9]。如今,AR已影响全球10%~20%成年人的健康[3],因此,了解AR的性质是改善该疾病的有效途径。本研究使用OVA和Al(OH)3诱导构建大鼠AR模型,在经过抗C5aR抗体治疗后发现,AR大鼠炎性反应及鼻腔黏膜组织病变现象均得到了明显改善。
补体系统是人体重要的免疫防御系统,活化后参与多种疾病的发生、发展,包括癌症、炎症及自身免疫性疾病等。该系统主要由血浆蛋白与膜蛋白组成,级联反应的激活通过3个主要途径的链式反应发生:经典途径、替代途径和凝集素途径,这些途径启动后最终形成C3、C5转换酶并产生过敏毒素C3a、C5a,它们主要通过与其相应的受体C3aR和C5aR结合来发挥作用[10]。其中,补体成分C5a是主要的促炎介质,该活性片段可激活中性粒细胞与巨噬细胞,合成并释放炎性介质而致使炎性反应的发生,其特异性受体C5aR也在单核细胞和巨噬细胞上表达。研究表明,C5a/C5aR相互作用导致中性粒细胞募集和巨噬细胞积累,并加剧多种炎症反应性疾病[11-12]。而以C5aR作为靶点开发补体C5aR单克隆抗体可有效治疗其介导的疾病。如抗C5aR抗体联合大蒜素对大鼠炎性肠病具有较好的治疗效果,可抑制炎性反应,提高动物生存率[13]。本研究结果显示,抗C5aR抗体对AR大鼠也有良好的治疗效果。
Th17细胞和Treg细胞是人类免疫系统的重要组成部分。Th17细胞代表促炎性T细胞的子集,可促进组织损伤和自身免疫病理损伤。IL-17是Th17细胞发挥生物学作用的主要细胞因子。相比之下,Treg细胞发挥免疫抑制作用,其功能障碍可能诱发自身免疫性疾病[14]。在生理条件下,Th17细胞和Treg细胞在动态平衡中互相拮抗,并参与维持机体正常的免疫状态。当Treg细胞数量减少或Th17细胞数量增加时,Th17/Treg失衡并诱导炎性反应[15-16]。本研究结果显示,AR发生后大鼠机体内Th17/Treg失衡,在经过抗C5aR抗体治疗后Th17/Treg趋于平衡状态。
Notch信号传导是一个保守且特征明确的途径,在动物发育、维持体内稳态和疾病中发挥关键作用,并介导细胞增殖、发育及分化。在哺乳动物中已发现了Notch信号的4个受体(Notch1~4)和5个配体(Jagged1~2和Delta-like 1、3、4)。Notch受体与其配体结合后,Notch信号通路被激活并催化Notch受体,导致Notch细胞内结构域(N-ICD)的释放。接着,N-ICD易位到细胞核中,并与共激活因子结合以介导下游基因的表达[17-18]。以往研究表明,Notch1-Jagged1信号途径在AR中被激活,Notch1可通过抑制Treg 细胞分化而调节Foxp3表达[19]。本研究结果同样显示,AR大鼠鼻腔黏膜组织中Notch1与Jagged1蛋白表达明显升高,使用抗C5aR抗体治疗后,组织内Notch1与Jagged1蛋白表达均下降。为了进一步验证抗C5aR抗体是否通过Notch1-Jagged1信号途径发挥作用,笔者通过联合使用抗C5aR抗体与Jagged1肽作用后发现其对AR大鼠未起到改善作用。由此推测,抗C5aR抗体可能通过调控Notch1-Jagged1信号途径在AR中发挥作用。
综上所述,抗C5aR抗体可能通过减轻炎性反应,调控RORγt与Foxp3蛋白表达,介导Th17/Treg平衡及抑制Notch1-Jagged1信号途径激活,从而对AR大鼠的症状起到一定的改善作用。然而,Notch信号通路与Hedgehog、Wnt、NF-κB、AKT/mTOR等多个信号通路交互作用参与细胞、组织、器官的分化与发育过程,在本研究中,给予Notch信号传导途径配体的Jagged1肽作用,是直接还是间接与抗C5aR抗体治疗产生拮抗作用还有待后续进行深入探究。

