肝脏单中心型Castleman病1例并文献复习
李 锐,曹冠柏,吴 俊△,罗卫庆,王德树
1.重庆市九龙坡区人民医院肝胆外科,重庆 400050; 2.树兰医疗(杭州)医院肝胆外科,浙江杭州 310000
Castleman病(CD)又称血管滤泡性淋巴结增生症或巨大淋巴结病,2018年被列入国家卫生健康委员会等5个部门联合发布的《第一批罕见病》目录中,该病病因不明[1]。CD是淋巴细胞增殖导致淋巴结过度增大,常见于胸部和颈部,腹部少见,肝脏罕见。在影像学上,肝脏CD通常表现为单一的、边界清晰的软组织病变,病变中钙化常见,囊性变性和局灶性坏死少见。然而,这些异常发现是非特异性的。因此,仅凭CT扫描和MRI成像诊断肝脏CD仍然非常困难。本研究报告重庆市九龙坡区人民医院手术切除1例肝脏单中心型CD,结合文献复习,阐述CD的临床特征及诊断治疗情况。
1 资料与方法
1.1一般资料 女性患者,45岁,因“右上腹疼痛2月”于2021年9月13入院。7年前因宫外妊娠破裂出血行右侧卵巢及输卵管切除术。入院前2月开始出现右上腹疼痛,起初疼痛轻微,随着时间推移,疼痛转为持续性,有时需要服用止痛药后才能缓解。不伴有发热、盗汗、体质量下降及贫血。体格检查:右上腹部轻度压痛,无肌紧张及反跳痛。未发现浅表淋巴结肿大及肝脾肿大。
1.2实验室检查 实验室检查结果如下,血常规检查:白细胞5×109/L、红细胞 3.84×1012/L、血红蛋白 122 g/L、血小板计数 299×109/L、中性粒细胞百分比55.8%、淋巴细胞百分比26.0%。超敏C反应蛋白(全血) <0.50 mg/L。肝功能及肾功能检查未见异常。空腹血糖 4.31 mmol/L。乙型肝炎(乙肝)表面抗原(-)、乙肝表面抗体(+)、乙肝e抗原(-)、乙肝e抗体(-)、乙肝核心抗体(+)、丙肝抗体(-)、梅毒抗体(-)、梅毒血清试验(TRUST)(-)、人类免疫缺陷病毒(HIV)检测(-)。
1.3病理及影像学检查 腹部超声检查:肝脏形态大小正常,包膜光滑,边缘锐利,血管纹理走行清晰,肝右前叶上段见大小37 mm×31 mm低回声,形态尚规则,边界尚清,其内可见强回声,彩色多普勒超声:未见明显血流信号。脾脏无肿大。
胸部CT平扫:双侧胸廓对称,胸廓骨质及胸壁软组织未见异常。双肺支气管血管束清晰,双肺未见明确实质性病变,气管支气管通畅,双侧肺门及纵膈未见肿大淋巴结。腹部CT平扫:肝脏大小、形态未见异常,包膜光整,肝S8段见类圆形低密度影,边界清晰,其内见多个结节状钙化灶。腹部CT增强扫描:肝脏形态大小正常,肝S8段见类圆形低密度影,大小30 mm×40 mm×41 mm,内见结节状钙化影,边缘尚清,增强后强化。延伸扫描包膜强化,实质明显减低。腹腔未发现淋巴结肿大或其他肿块,见图1~3。

注:肝S8段见类圆形低密度影,其内见多个结节状钙化灶。
腹部MRI弥散加权成像:肝S8段可见一类圆形稍长T1长T2信号影,内见多个结节状长T1短T2信号影,大小38 mm×38 mm×44 mm,边缘清晰,外侧缘见条状等T1长T2信号影。DWI均呈高信号,ADC值减低,反相位信号减低。腹膜后淋巴结未见确切肿大,见图4。腹部MRI增强成像:肝脏轮廓规则,形态无增大,肝S8段见团状稍长T2信号,DWI呈稍高信号,直径38 mm,同反相对信号未见减低,增强后动脉期明显强化,静脉期、延时期强化减低,可见包膜强化,见图5。

图2 腹部CT增强扫描(动脉期)

图3 腹部CT增强扫描(静脉期)

图4 腹部MRI弥散加权成像

图5 腹部MRI增强成像
肝脏肿块穿刺标本病理检查:送检散碎肝脏组织间见大量淋巴细胞及血管组织增生,局部生发中心形成伴小血管玻璃样变性,灶性纤维组织增生伴玻璃样变性及黏液变性。免疫组织化学:CK(Pan)(上皮+),CK18(肝细胞+),CK19(胆管细胞+),CK7(胆管细胞+),CK8(肝细胞+),EMA(灶+),CD34(血管+),ERG(血管+),CD20(B细胞+),CD21(滤泡网+),CD5(T细胞+),CD3(T细胞+),CD23(灶+),Hepatocyte(肝细胞+),CD138(个别+),CD38(个别+),LEF-1(散在+),Ki-67(3%+)。穿刺标本无明确肿瘤性诊断考虑,是否有淋巴组织增生性疾病或免疫相关性疾病,需结合临床表现、影像资料综合考虑。
肝脏肿块切除术:术中见肝脏表面光滑,切断肝圆韧带,分离镰状韧带至第二肝门区,游离肝脏右侧冠状韧带、三角韧带,显露肝脏肿物,见图6,沿肿物与正常肝组织10 mm设定切除线,超声刀配合电凝切除肝脏肿块。
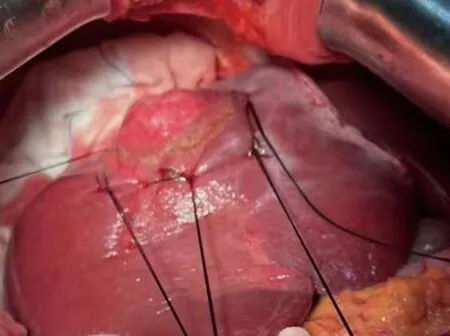
图6 手术中所见
手术标本病理检查结果如下,大体所见:肝组织一块,大小65 mm×55 mm×50 mm,肝被膜下见直径40 mm的灰白色质软肿块,与周围组织界限较清,有白色纤维包膜,周围有血管组织。肿块切面灰白质中,局部质硬,部分区域有钙化。镜下观察:多量淋巴细胞及血管组织增生,局部生发中心形成伴小血管玻璃样变性,灶性纤维组织增生伴玻璃样变性及黏液变性。免疫组织化学:CK(Pan)(上皮+),CK18(肝细胞+),CK19(胆管细胞+),CK7(胆管细胞+),CK8(肝细胞+),EMA(灶+),CD34(血管+),ERG(血管+),CD20(B细胞+),CD21(滤泡网+),CD5(T细胞+),CD3(T细胞+),CD23(灶+),Hepatocyte(肝细胞+),CD138(个别+),CD38(个别+),LEF-1(散在+),Ki-67(3%+)。病理诊断:透明血管型的单中心型CD。见图7。

注:淋巴结肿大伴淋巴滤泡增多,多发小血管玻璃样变性。
1.4诊断与治疗 患者因“右上腹疼痛2月”入院,入院后经腹部彩超、胸部及腹部CT扫描、腹部MRI成像等检查,不能明确肝脏肿块性质,肝脏肿块穿刺标本病理检查,诊断考虑淋巴组织增生性疾病可能。之后在全身麻醉后行肝脏肿块切除术,手术顺利完成,平稳恢复,痊愈出院,无并发症。
2 讨 论
CASTLEMAN等[2]于1956年首次报道CD,CD是一种罕见的淋巴细胞增生性疾病。虽然此病被发现50多年,但其病理生理基础仍不清楚。CD发病率为0.001%~0.050%,常见于30~40岁的女性,发生部位通常在胸部(70%)、颈部(15%)、腹部盆腔(12%)和腋窝淋巴组织(3%),肝脏罕见[3-4]。有研究者认为,CD的发生是由于白细胞介素(IL)-6,病毒,特别是人类疱疹病毒8型(HHV-8),肿瘤或炎性反应相互作用所致。受影响的细胞分泌IL-6,诱导血管内皮生长因子的产生,进一步增强淋巴结内的血管增殖和内皮细胞IL-6的产生,导致淋巴细胞增生、淋巴结过度增大和全身症状[3]。本例患者血清HIV阴性,没有肿瘤病史。
病理形态上,CD可分为3种主要亚型;透明血管型CD(70%~80%)、浆细胞型CD和混合细胞型CD[1]。透明血管型CD的特征是淋巴结体积通常较大,直径可达数厘米至十余厘米,包膜完整,血供丰富。镜下形态包括淋巴滤泡增多、生发中心缩小、套细胞区增宽及滤泡间区血管增生。萎缩的生发中心淋巴细胞削减,仅剩余滤泡树突细胞成分,增生的套细胞可呈同心圆状排列或出现“洋葱皮”样外观,部分滤泡内可有多个萎缩的生发中心。滤泡间区淋巴窦消失,多有显著性厚壁小血管增生,且血管壁可出现程度不等的玻璃样变性。淋巴结包膜和小梁也多有增厚、增宽伴玻璃样变性。浆细胞型CD的肿大淋巴结的体积通常较小。镜下可见透明血管型CD样淋巴滤泡,伴有数量显著增加的浆细胞浸润。混合细胞型CD形态特点兼具透明血管型CD及浆细胞型CD的特征[1]。3种亚型在临床上均可表现为淋巴结病或全身症状[5]。本例患者病理检查显示淋巴结肿大伴淋巴滤泡增多,多发小血管玻璃样变性,诊断为透明血管型CD。
根据淋巴结累及的范围可将CD分为单中心型CD和多中心型CD,仅有同一淋巴结区域内一个或多个淋巴结受累的CD被定义为单中心型CD[1]。病理类型上单中心型CD是以透明血管型为主的局灶性病变,占确诊病例的90%。本例患者为肝脏透明血管型单中心型CD。
由于多种疾病可能会伴发淋巴结的“CD样”病理改变。因此,诊断CD第1步是排除可能的相关疾病[6],包括肿瘤性疾病(如POEMS综合征、淋巴瘤、滤泡树突细胞肉瘤、浆细胞瘤等),感染性疾病(如HIV、梅毒、EB病毒感染、结核等),以及自身免疫性疾病(如系统性红斑狼疮、类风湿关节炎、自身免疫性淋巴细胞增生综合征等)。诊断CD第2步是根据全身查体及影像学检查明确淋巴结受累范围,将患者分型为单中心型CD和多中心型CD。单中心型CD通常是由于其他原因行影像学检查时偶然发现,无明显的临床症状。随着淋巴结增大,患者可能出现与邻近器官受压有关的症状。多中心型CD是以浆细胞型为主的全身性疾病,伴有全身症状,包括疲劳、发热、盗汗、体质量减轻、关节痛和肝脾肿大[1]。
由于单中心型CD临床表现为非特异性症状,如果没有影像学检查,术前诊断则非常困难[7]。CT扫描、MRI和超声成像等可以发现淋巴肿块的位置和特征,然而,许多肿瘤,包括肝脏肿瘤、神经源性肿瘤或异位嗜铬细胞瘤,可以显示类似的放射学特征,使得鉴别诊断更具挑战性[7]。
单中心型CD的超声图像显示边界清晰、内部回声不均的低回声病灶,内部血流信号丰富,周边有环形或半环形绕行血流信号,有粗大血管穿入时应考虑到CD可能,内部有强回声钙化者,高度提示透明血管型CD[8]。浆细胞型CD和以浆细胞为主混合型CD,病灶呈椭圆形、欠均匀低回声,血流信号丰富,超声造影可见高增强或等增强、呈周边向中心增强,边界清晰。CD的超声和超声造影图像表现有一定的特征性,对CD的诊断和治疗具有重要的价值,可提高临床诊断的准确率[9]。
单中心型CD的CT扫描或MRI成像通常显示圆形或椭圆形孤立性病灶,多数密度均匀,平扫CT值40~45 HU,低密度囊变影少见。边缘光滑清楚,钙化是CD的重要征象之一,钙化可能是由于肿块内增生的小血管壁发生玻璃样变及纤维化,继而钙质沉着所致,钙化多为斑点、条形或分支状[10]。CT增强扫描病灶可呈显著强化、明显强化或中度强化。MRI成像病灶主体表现为 T1WI 等信号或稍低信号,T2WI及DWI呈高信号,增强扫描表现为明显强化。病灶边缘可见供血动脉进入,同时可见与之伴行的粗大引流静脉,病灶周围迂曲增粗的血管等对诊断有重要价值[11]。MRI成像对于病灶内出血、囊变及纤维成分等的显示优于CT扫描,而CT扫描对钙化的显示更有优势。单中心型CD无卫星结节。
实验室检查,部分CD可显示HIV或HHV-8呈阳性,以及血浆IL-6和IL-10水平升高。淋巴结病理检查是CD诊断的金标准。细针穿刺活检可能对CD诊断会有所帮助,但应考虑是否能获得足够数量的组织标本、肿瘤细胞扩散的可能性,以及血供丰富肿块严重出血的风险[12]。免疫组织化学检测抗体组合应包括CD20、CD79a、CD3、CD38、CD138、Mum-1、kappa、lambda、IgG、IgG4、HHV-8(LANA-1)、CD21或CD23、Ki-67等。
单中心型CD患者无论是否伴有高炎症状态或全身症状,对于有可能行完整切除病灶的患者,首选外科手术完整切除病灶[1]。对于无法行完整手术切除病灶的单中心型CD患者,首先评估有无CD压迫相关症状、高炎症状态或副肿瘤性天疱疮等。存在肿块压迫相关症状者,可首选利妥昔单抗加糖皮质激素或利妥昔单抗加化疗,用药后肿块体积缩小,若可行完整手术切除,则建议手术切除病灶。用药后仍难以完整手术切除肿块者,可考虑放疗或动脉栓塞治疗。对于伴高炎症状态且病灶难以行完整手术切除的单中心型CD患者,可使用司妥昔单抗加糖皮质激素或沙利度胺-环磷酰胺-泼尼松等[13-14]。治疗后应再次评估病灶的可切除性,若药物治疗后病灶缩小且具有可切除性,仍应考虑手术切除[15]。
手术完全切除肿块是唯一的治愈方法,绝大多数单中心型CD患者在病灶完整切除后可达到治愈。极少数病例可能复发,对于复发病例,可以再次评估病灶的可切除性,若能完整切除,仍然可考虑再次手术切除[1]。手术不仅能够切除CD病灶,还能够改善相应高炎症状态[14]。手术治疗的单中心型CD患者总生存率为95.3%[1]。多中心型CD者预后较差,5年生存率仅51%~77%[1]。由于腹部单中心型CD是一种罕见的疾病,大多数病例仍然采用传统的开腹手术。随着经验积累和技术进步,腹腔镜或机器人技术在大多数患者手术治疗中的应用会逐渐增多。
肝脏单中心型CD是一种罕见疾病,至今研究者仍对其了解较少,由于单中心型CD缺乏临床表现及影像学特异性,临床上容易出现漏诊、误诊,术前诊断通常很困难,当对肝脏肿物进行鉴别诊断时,应考虑单中心型CD的可能,手术完全切除是治疗单中心型CD最有效的方法。

