lncRNA RP11-680F8.1在肺癌组织中的表达及对肺癌细胞增殖和侵袭的影响
张雁飞 吴中杰 胡奕 丁聪毅
肺癌是全球发病率最高的恶性肿瘤,具有高复发率的特点[1]。尽管近年来手术切除、免疫治疗、化疗、放疗等肺癌治疗方式得到不断改进,但是肺癌患者的预后仍较差[2]。因此,迫切需要寻求新的具有治疗价值和预后监测价值的分子靶点。长链非编码RNA(long non-coding RNA,lncRNA)属于非编码RNA分子,长度>200个核苷酸,其通过在转录水平、转录后水平调节特定基因谱的表达,影响细胞表观遗传信号传导,从而参与各种细胞活动[3]。越来越多的研究显示,lncRNA在肺癌的发生和进展过程中起到关键作用,在肺癌组织和细胞系中表现为多种lncRNA表达水平的异常降低或升高[4-6]。根据Ensembl Release v105数据库显示,RP11-680F8.1是一种新发现的lncRNA,长度为2 588个核苷酸。RP11-680F8.1在肿瘤特别是肺癌中的表达和作用尚未阐明。本研究通过分析RP11-680F8.1表达水平与肺癌患者总生存期和无病生存期的关系,检测肺癌组织和细胞系中RP11-680F8.1的表达,构建敲减RP11-680F8.1的肺癌细胞模型,探讨RP11-680F8.1调节肺癌细胞增殖和侵袭的分子机制。
1 材料和方法
1.1 细胞系、试剂和仪器 人肺癌细胞系H1650、A549、HCC1588、H1299、HCC827和正常肺泡上皮细胞系HPAEpiC均购自美国ATCC细胞培养中心。FBS、RPMI 1640培养基、DMEM培养基和基质胶均购自美国Gibco公司;CCK-8试剂盒、双荧光素酶报告基因检测试剂盒均购自北京索莱宝生物科技公司;抗RP11-680F8.1慢病毒、非靶向对照慢病毒、RP11-680F8.1-WT载体、RP11-680F8.1-Mut载体、miR-NC、miR-195-5p均购自江苏碧云天生物技术公司;Lipofectamine 3000脂质体转染试剂和Transwell小室均购自美国Invitrogen公司;Ⅰ抗和Ⅱ抗叉头框K1(forkhead box K1,FOXK1)、磷脂酰肌醇3-磷酸(phosphatidylinositol 3-phosphate,PI3P)、磷酸化蛋白激酶 B(phosphorylated protein kinase B,p-Akt)、哺乳动物雷帕霉素靶蛋白复合体1(mammalian target of rapamycin complex 1,mTORC1)、磷酸化血清/糖皮质激素调节激酶1(phosphorylated serum and glucocorticoid-induced protein kinase 1,p-SGK1)、beta肌动蛋白(beta actin,β-actin)均购自美国Santa Cruz公司。酶标仪(型号:Multiskan™FC)购自美国Thermo Fisher Scientific公司。凝胶成像仪(型号:ChemiDoc MP)购自美国Bio-Rad公司。
1.2 临床标本 收集2021年2月至2022年1月嘉兴市第一医院心胸外科手术切除的肺癌组织及相应癌旁组织32对,均经至少2位病理科专家确诊。所有标本均冷冻保存在液氮中,所有患者术前均未接受放化疗及生物治疗。本研究经医院医学伦理委员会批准,所有患者均签署知情同意书。
1.3 生物信息学方法 利用GEPIA数据库分析RP11-680F8.1表达水平与肺癌患者总生存期和无病生存期的关系。采用LncBase Predicted v.2软件分析RP11-680F8.1与miR-195-5p的靶向关系。
1.4 细胞培养和慢病毒转染 H1650、HCC1588、H1299、HCC827细胞培养在含10%FBS的RPMI 1640培养基中,A549和HPAEpiC细胞培养在含10%FBS的DMEM培养基中,培养条件为37℃、5%CO2。选择RP11-680F8.1表达水平最高的HCC1588细胞为研究对象,将对数生长期的HCC1588细胞接种到6孔板,培养至融合度65%。将HCC1588细胞分别转染抗RP11-680F8.1慢病毒以敲减RP11-680F8.1的表达(sh-RP11-680F8.1组)和非靶向对照慢病毒(sh-NC组)。转染时将 200 μl RPMI 1640 培养基与 10 μl慢病毒混匀,静置15 min,添加至HCC1588细胞培养基中;72 h后,采用RT-qPCR验证慢病毒转染后的敲减效率。
1.5 RP11-680F8.1、miR-195-5p和FOXK1 mRNA表达水平检测 采用RT-qPCR法。采用Trizol试剂分离组织或细胞中的总RNA,进一步反向转录为cDNA。RT-qPCR反应条件:97℃预变性7 min、54℃ 20 s、71℃20 s,共32个循环。GAPDH用于标准化RP11-680F8.1和FOXK1 mRNA的相对表达,U6用于标准化miR-195-5p的相对表达。RP11-680F8.1上游引物:5'-CCCCAGGTAAGAGGGAAGAG-3',下 游 引 物 :5'-CCAACACACCTGTTGGTCAG-3';FOXK1上游引物:5'-TCCAGGAGCCGCACTTCTA-3',下游引物:5'-CTCCGGGATGTGGATCTTCA-3';GAPDH上游引物:5'-TGCACCACCAACTGCTTAGC-3',下游引物:5'-GGCATGGACTGTGGTCATGAG-3';U6 上 游 引 物 :5'-CTCGCTTCGGCAGCACA-3',下游引物:5'-AACGCTTCACGAATTTGCGT-3';miR-195-5p 上游引物 :5'-GCGTAGCAGCACAGAAATATTGGC-3',下游引物:5'-CTGTCGTCGTAGAGCCAGGGAA-3'。 采 用 2-ΔΔCt法 计 算RP11-680F8.1、miR-195-5p和FOXK1 mRNA相对表达水平。
1.6 细胞增殖能力检测 采用CCK-8法。将两组HCC1588细胞以每孔2.5×103个接种至96孔板,分别培养1、2、3、4、5 d。每天相同时间点,每孔加入40 μl CCK-8溶液,避光孵育3 h,通过酶标仪分析每孔在450 nm波长处的吸光度(A)值。A值越大,HCC1588细胞增殖能力越强。
1.7 细胞侵袭能力检测 采用Transwell侵袭实验。将两组HCC1588细胞以每孔2.5×104个接种至涂有基质胶的Transwell上室,在下室中加入500 μl完全培养基。培养箱内培养24 h后,用2%多聚甲醛溶液固定,用0.3%结晶紫溶液染色。在倒置显微镜下拍照,随机选取5个视野计数侵袭细胞数。
1.8 RP11-680F8.1和miR-195-5p的靶向关系检测采用双荧光素酶报告基因实验。采用Lipofectamine 3000脂质体转染试剂分别将RP11-680F8.1-WT+miR-195-5p、RP11-680F8.1-WT+miR-NC、RP11-680F8.1-Mut+miR-195-5p、RP11-680F8.1-Mut+miR-NC共转染HCC1588细胞。转染48 h后,采用裂解液裂解细胞,按照双荧光素酶报告基因检测试剂盒说明书检测每组细胞的相对荧光素酶活性。
1.9 FOXK1蛋白水平和PI3K/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路蛋白水平检测 采用Western blot法。弃去细胞培养基,加入细胞裂解液,采用细胞刮收集细胞裂解物。以恒压120 V经聚丙烯酰胺凝胶电泳分离蛋白,以恒流200 mA转膜至硝酸纤维素膜。在10%脱脂牛奶中常温封闭3.5 h,经TBST溶液洗膜,加入Ⅰ抗FOXK1抗体(1∶2 000)、PI3P(1∶2 500)、p-Akt(1∶3 500)、mTORC1(1∶3 500)、p-SGK1(1∶3 500)、β-actin(1∶3 000),冰箱内孵育 15 h。经TBST溶液洗膜,加入辣根过氧化物酶标记的Ⅱ抗(1∶20 000),室温孵育3.5 h。经TBST溶液洗膜,加入增强化学发光液,在凝胶成像仪中曝光、显影。使用Image J软件计算各个条带的灰度值,即蛋白表达水平。
1.10 统计学处理 采用SPSS 20.0统计软件。计量资料以表示,两组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同RP11-680F8.1表达水平肺癌患者总生存期和无病生存期比较 GEPIA数据库资料分析显示,与RP11-680F8.1高表达患者相比,RP11-680F8.1低表达患者总生存期和无病生存期均较长(均P<0.01),见图1。

图1 不同RP11-680F8.1表达水平肺癌患者总生存期和无病生存期比较(a:总生存期;b:无病生存期)
2.2 RP11-680F8.1在肺癌组织和肺癌细胞系中的表达 与癌旁组织相比,肺癌组织中RP11-680F8.1表达水平明显上调(1.48±0.12比5.53±0.24,P<0.01),见图2。与正常肺泡上皮细胞系HPAEpiC相比,肺癌细胞系H1650、A549、HCC1588、H1299、HCC827中RP11-680F8.1表达水平均上调(均P<0.05),其中HCC1588细胞中RP11-680F8.1表达水平最高,见图3。

图2 肺癌组织和癌旁组织中RP11-680F8.1表达水平比较
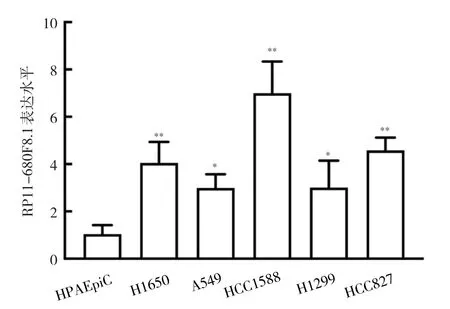
图3 不同肺癌细胞中RP11-680F8.1表达水平比较
2.3 转染抗RP11-680F8.1慢病毒的敲减效率 在HCC1588细胞中转染抗RP11-680F8.1慢病毒和非靶向对照慢病毒后,sh-NC组和sh-RP11-680F8.1组细胞中RP11-680F8.1表达水平分别为7.50±0.75和1.02±0.10,与sh-NC组相比,sh-RP11-680F8.1组细胞中RP11-680F8.1表达水平明显下降(P<0.01)。
2.4 敲减RP11-680F8.1表达对HCC1588细胞增殖能力的影响 sh-RP11-680F8.1组细胞在2、3、4、5 d时的增殖能力均明显低于sh-NC组(均P<0.05),见图4,提示敲减RP11-680F8.1表达降低了HCC1588细胞增殖能力。

图4 敲减RP11-680F8.1表达对HCC1588细胞增殖能力的影响
2.5 敲减RP11-680F8.1表达对HCC1588细胞侵袭能力的影响 sh-NC组和sh-RP11-680F8.1组侵袭细胞数分别为(70.56±4.71)和(37.33±8.32)个/视野,sh-NC组侵袭细胞数明显多于sh-RP11-680F8.1组(P<0.05),见图5,提示敲减RP11-680F8.1表达抑制了HCC1588细胞侵袭能力。

图5 敲减RP11-680F8.1表达对HCC1588细胞侵袭的影响(a:侵袭细胞染色图;b:侵袭细胞数柱状统计图,与sh-NC组相比,**P<0.01)
2.6 RP11-680F8.1和miR-195-5p之间的靶向关系LncBase Predicted v.2软件预测显示,miR-195-5p可能是RP11-680F8.1的靶点,见图6。双荧光素酶报告基因实验显示,与共转染miR-NC和RP11-680F8.1-WT相比,共转染miR-195-5p和RP11-680F8.1-WT的HCC1588细胞相对荧光素酶活性明显降低(P<0.01),见图7,证实miR-195-5p是RP11-680F8.1的直接靶点。

图6 RP11-680F8.1与miR-195-5p的结合位点

图7 RP11-680F8.1与miR-195-5p的靶向关系
2.7 敲减RP11-680F8.1表达对miR-195-5p和FOXK1 mRNA表达的影响 与sh-NC组相比,sh-RP11-680F8.1组细胞中miR-195-5p表达水平上调、FOXK1 mRNA表达水平下调(均P<0.01),见表1,提示敲减RP11-680F8.1表达促进了miR-195-5p表达,抑制了FOXK1 mRNA表达。

表1 敲减RP11-680F8.1表达对miR-195-5p和FOXK1 mRNA表达的影响
2.8 敲减RP11-680F8.1表达对FOXK1蛋白和PI3K/Akt/mTOR信号通路蛋白表达的影响 与sh-NC组相比,sh-RP11-680F8.1组HCC1588细胞中FOXK1蛋白表达水平降低,PI3K/Akt/mTOR信号通路蛋白表达水平降低,见图8。

图8 敲减RP11-680F8.1后HCC1588细胞FOXK1蛋白和PI3K/Akt/mTOR信号通路蛋白表达的电泳图
3 讨论
随着深度测序的广泛应用,lncRNA已成为表观遗传学研究领域的热点[7]。lncRNA通过调节各种分子信号通路,在细胞的生理和病理过程中发挥关键调节作用,有望成为各种疾病的早期诊断标志物和治疗靶标[8]。越来越多的研究发现,肺癌中存在异常过表达或低表达的lncRNA,与肺癌患者的病理分期、化疗敏感性、放疗敏感性等密切相关[9-11]。Feng等[11]研究发现,lncRNA PGM5P4-AS1在肺癌组织中的表达低于癌旁组织,其过表达在体外抑制了肺癌细胞的增殖、迁移和侵袭,在体内抑制了裸鼠肺癌肿瘤的生长。Wang等[12]研究发现,lncRNA AC079630.4在肺癌组织中显著下调,其低表达的样本比高表达的样本具有更晚期的病理分期和更差的预后。Cheng等[13]研究发现,lncRNA PSMA3-AS1在肺癌细胞系中的表达明显高于人支气管正常上皮细胞,敲低lncRNA PSMA3-AS1通过竞争性结合miR-17-5p,显著抑制肺癌细胞的增殖、迁移和侵袭。RP11-680F8.1是一种罕见报道的lncRNA,其在肺癌中的表达和功能尚未被探讨。
本研究首先通过GEPIA数据库分析RP11-680F8.1表达水平与肺癌患者总生存期和无病生存期的关系,证明RP11-680F8.1低表达患者的总生存期和无病生存期均较长,提示RP11-680F8.1可能是促癌lncRNA。本研究进一步显示,RP11-680F8.1在人肺癌组织和细胞系中高表达,敲减RP11-680F8.1表达能够抑制体外肺癌细胞的增殖和侵袭,证实RP11-680F8.1是一种癌基因,其可能作为肺癌治疗的靶点。先前研究显示,lncRNA通过竞争性结合微小RNA,促进肿瘤相关基因表达[14-16]。本研究使用生物信息学数据库LncBase Predicted v.2分析显示,miR-195-5p可能与RP11-680F8.1相互作用。双荧光素酶报告基因实验证实RP11-680F8.1能够靶向结合miR-195-5p。
研究表明,miR-195-5p在前列腺癌、膀胱癌、结直肠癌、甲状腺癌等肿瘤中发挥抑癌作用,其表达与患者肿瘤分期、肿瘤大小、淋巴结转移等均呈负相关[17-20]。值得注意的是,Long等[21]发现miR-195-5p在肺癌组织和肺癌细胞系中下调,过表达miR-195-5p通过下调FOXK1基因表达抑制肺癌细胞增殖、迁移和侵袭。本研究中,敲减RP11-680F8.1表达后,miR-195-5p表达明显增加,FOXK1 mRNA表达明显降低,证实RP11-680F8.1通过调节miR-195-5p和FOXK1表达发挥作用。FOXK1基因通过活化PI3K/Akt/mTOR信号通路,促进肿瘤细胞的生长和转移[22-23]。本研究中,敲减RP11-680F8.1表达后,PI3K/Akt/mTOR信号通路活化被抑制,间接提示RP11-680F8.1发挥作用依赖于miR-195-5p/FOXK1信号通路。
综上所述,本研究证实RP11-680F8.1是肺癌中的癌基因,与肺癌患者的总生存期和无病生存期密切相关。敲减RP11-680F8.1通过上调miR-195-5p表达,下调FOXK1 mRNA表达,进而抑制肺癌HCC1588细胞的增殖和侵袭。RP11-680F8.1可能为肺癌的治疗和预后监测提供了有效的分子靶点。

