过路黄MYB转录因子家族成员的挖掘及鉴定
杨敬天,黎 华,赵 欢,龙 芸,张咏祀,刘小红*
过路黄MYB转录因子家族成员的挖掘及鉴定
杨敬天1,黎 华3,赵 欢2,龙 芸2,张咏祀2,刘小红2*
1. 绵阳师范学院生态安全与保护四川省重点实验室,四川 绵阳 621000 2. 西华师范大学生命科学院,四川 南充 637009 3. 北川羌族自治县国有林场,四川 绵阳 622761
分析过路黄MYB转录因子家族相关成员的结构和功能,挖掘与黄酮类物质生物合成相关的基因信息。基于过路黄全长转录组数据库,利用ProtParam、GenStript、MEME、WebLogo、SOPMA、Swiss-Model等在线网站分析过路黄MYB转录因子家族蛋白的理化性质、亚细胞定位、保守基序和结构域、蛋白高级结构等。利用MEGA软件构建系统发育树,分析过路黄MYB转录因子家族(LcMYB)与拟南芥MYB蛋白的系统发育关系。挖掘到51个LcMYB基因,预测51条具有MYB转录因子保守结构域的蛋白序列;根据结构域可分为R1-LcMYB、R2R3-LcMYB和R3-LcMYB 3个亚类,且所有LcMYB基序中都含有3个保守的色氨酸;过路黄MYB家族蛋白均为亲水性蛋白,热稳定性较高且富含碱性氨基酸,大部分蛋白以无规则卷曲为主,其中R2R3-LcMYB39、R2R3-LcMYB47、R2R3-LcMYB48与R2R3-LcMYB50蛋白是以α-螺旋为主;与拟南芥MYB转录因子家族共同构建的进化树发现,过路黄MYB家族在进化上包括3个大类。在过路黄物种中获得了51个MYB转录因子家族成员的基因的结构和功能信息,其中有2个成员与黄酮类物质的生物合成有关,该研究结果为后续克隆利用黄酮类物质生物合成相关基因提供了分子基础。
过路黄;MYB;生物信息学;黄酮类;转录因子
过路黄Hance为报春花科(Primulaceae)珍珠菜属L.植物,其新鲜或干燥全草又名金钱草,在我国分布较为广泛,主要产于四川、云南、贵州、陕西、河南、湖北、湖南、浙江等省区[1-2]。中医认为过路黄味酸、苦、微寒,其归肝、胆、肾、膀胱经,具有利湿退黄、利尿通淋及解毒消肿等功效,主要用于治疗湿热黄疸、石淋、热淋、痈肿疔疮、小便涩痛、肝胆结石和尿路结石等症状[3-4]。过路黄的化学成分有黄酮类、酚类、多糖类、三萜皂苷类、挥发油、醌类等,其中以黄酮类化合物槲皮素和山柰素为主要有效成分[5-6]。药理学研究表明,这些化学成分具有抗肿瘤、抗氧化、保肝、保护内皮、治疗痛风等多种药理活性[7-9]。因此,研究过路黄黄酮生物合成途径具有重要价值。
植物中黄酮类化合物主要通过苯丙烷代谢途径合成。苯丙氨酸依次由苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)、肉桂酸4-羟化酶(cinnamate 4-hydroxylase,C4H)和4-香豆酸CoA连接酶(4-coumarate:CoA ligase,4CL)催化形成4-香豆酰CoA(4-counmarinyl-CoA)[10]。再以1分子的4-香豆酰CoA和3分子丙二酰CoA为底物,经黄酮类化合物合成途径的查耳酮合成酶(chalconesynthetase,CHS)、查耳酮异构酶(chalcone isomerase,CHI)和黄烷酮3-羟化酶(flavanone 3-hydroxylase,F3H)等多种酶共同催化完成[11-12]。植物中发现很多转录因子家族(如MYB、bHLH、bZIP、MADS-box、WRKY和WDR等)参与调控黄酮类化合物的合成[12-13]。已有研究表明拟南芥L. MYB可以增加黄酮等次级代谢产物的含量,从而提高对虫害、干旱和高盐胁迫的抵御能力[14-15]。其中MYB转录因子是植物最大的转录因子家族之一,其DNA结合域中含有4个不完全重复的R1、R2、R3和R4序列[16]。每个MYB结构域(R)由51~53个氨基酸组成,编码3个α-螺旋,其第2和第3个螺旋通过3个色氨酸残基组成螺旋-转角-螺旋(HTH)的结构,参与结合DNA大沟,从而提高或抑制下游基因的转录[17]。根据R的重复数目,可将MYB家族分为4类:R1-MYB型(含MYB-related)、R2R3-MYB型、3R-MYB型和4R-MYB型,其中,R2R3-MYB型MYB因子在植物MYB家族中所占比例最大[18-19]。
目前,对过路黄的研究主要集中于化学成分、药理活性等方面,有关过路黄分子生物学方面的研究鲜有报道。课题组前期对过路黄全长转录组进行了测序,在此基础上,本实验进一步利用生物信息学对过路黄MYB转录因子蛋白(LcMYB)的分类、理化性质、亚细胞定位、保守基序、结构域、系统发育树、氨基酸高级结构及生物学功能注释等进行分析,以期为过路黄MYB家族参与调控黄酮类化合物的作用机制研究、高产优质过路黄育种和种植提供参考依据。
1 材料与方法
1.1 序列来源
采集田间自然生长于西华师范大学校园内的过路黄幼嫩植株(30°49′25″N, 106°03′43″E),液氮速冻后,分别提取根、茎和叶的总RNA,等质量混匀后,由派森诺生物科技有限公司进行mRNA纯化、反转录构建全长cDNA文库,再作三代高通量转录组测序,对测序结果去除接头和低质量的reads后获得clean reads。基于转录组测序数据,在PFAM、GO、NR、Swiss-Prot、eggNOG和KEGG 6个等数据库初步注释7个MYB转录因子相关基因,将这些基因编码蛋白逐个进行NCBI Blast和SMART预测,去除冗余序列后,最后得到51条具有完整MYB保守结构域的序列。从TAIR数据库中下载已知并鉴定功能的拟南芥AtMYB家族的编码序列(CDS)和氨基酸序列,使用在线软件Expasy中的Translate对LcMYB家族各成员的全长cDNA序列进行分析,从而得到其对应的编码蛋白的氨基酸序列。利用SMART检测候选蛋白质序列,选择具有MYB结构域的氨基酸序列,剔除不含MYB基序的蛋白序列和冗余序列,最后得到过路黄MYB蛋白的氨基酸序列。
1.2 LcMYB理化性质分析
采用网络在线分析软件Expasy中的Protparam对过路黄MYB蛋白的氨基酸数目、相对分子质量、等电点(pI)、脂肪族氨基酸数和蛋白质疏水性等理化性质进行分析。采用在线GenStript软件预测LcMYB蛋白的亚细胞定位。
1.3 LcMYB保守结构域分析
采用MEME软件预测LcMYB蛋白的保守基序(Motif),基序的查找数量设为10,其他参数为默认值。采用ClustalW软件分别对过路黄MYB序列中3个SANT序列进行比对,再用WebLogo在线软件绘制LcMYB蛋白保守结构域可视化图。
1.4 LcMYB空间结构和生物学功能分析
采用SOPMA在线软件预测LcMYB蛋白二级结构,并采用Swiss-Model在线软件预测LcMYB蛋白的三级结构。采用Blast2GO软件注释LcMYB蛋白的生物学功能。
1.5 聚类分析
利用在线软件Clustalw对51条过路黄MYB转录因子蛋白和与其结构相似的65条拟南芥MYB转录因子的氨基酸序列进行比对。然后利用MEGA7.0软件以邻接法(neighbor-joining method)绘制进化树,参数选择P-distance、pairwise deletion和Bootstrap method为1000,其他参数选择默认值。
2 结果与分析
2.1 过路黄MYB基因挖掘以及蛋白序列分析
从过路黄全长转录组数据库中筛选出54条LcMYB核苷酸序列,经与网络数据库进行同源比对,最后获得51条具有完整MYB保守结构域的序列,分别命名为LcMYB1~LcMYB51,其中属于R1-MYB类转录因子的序列有19条,长度分布在420~2125 bp;属于R2R3-MYB类序列有31条,长度分布在650~5340 bp;属于R3-MYB类序列仅1条,长度为2114 bp。
2.2 过路黄MYB转录因子家族蛋白理化性质及亚细胞定位
采用ProtParam在线软件分析过路黄LcMYB转录因子家族蛋白的理化性质(表1),结果表明,预测的51个LcMYB蛋白在氨基酸数目、蛋白相对分子质量、pI、脂肪系数、不稳定系数和总平均亲水性等方面均存在显著差异。LcMYB蛋白的氨基酸残基(aa)长度变化范围为57~989 aa,平均长度为299.1 aa。其中,R1型LcMYB蛋白的aa长度为57~632 aa,平均长度为259.79 aa;R2R3型LcMYB蛋白的长度为120~989 aa,平均长度为321.03 aa;而R3型LcMYB蛋白的长度为367 aa。LcMYB蛋白理论相对分子质量(W)范围为6 588.31~111 684.07,平均值为33 185.75。其中,R1型LcMYB蛋白的W为6 588.31~70 486.65,平均为29 100.87;R2R3型LcMYB蛋白的W为14 320.34~111 684.07,平均值为35 430.66;而3R型LcMYB蛋白的MW为41 206.18。在上述2种理化性质中,氨基酸残基序列长度最短和MW最小的是LcMYB4,氨基酸序列最长和MW最大的是LcMYB47(表1)。
另外,LcMYB蛋白家族的理论pI范围在5.05(LcMYB1)~10.44(LcMYB33),平均值为7.98,其中35个LcMYB蛋白的pI值大于7,其余16个LcMYB蛋白的pI值小于7,表明大多数过路黄LcMYBs蛋白为偏碱性。所有LcMYB家族蛋白的总平均亲水性为负值,说明其均为亲水性蛋白。R1型LcMYB蛋白中仅LcMYB 4(不稳定性指数为33.93)、LcMYB 14(37.11)和LcMYB 19(28.77)3种蛋白的不稳定性指数小于40,为稳定蛋白,其余R1型蛋白均为不稳定蛋白;所有R2R3型和R3型LcMYB蛋白的不稳定性指数均大于40,为不稳定蛋白(表1)。
利用ProtComp在线网站分析LcMYB蛋白的亚细胞定位,结果显示,39种LcMYB蛋白定位于细胞核,8种LcMYB蛋白定位于叶绿体,剩余的4种LcMYB蛋白定位于过氧化物酶体,说明LcMYB家族成员功能可能有所差异或具有多种功能(表1)。
2.3 过路黄MYB转录因子家族蛋白保守序列分析
采用HEME在线软件分析过路黄MYB转录因子蛋白家族的氨基酸序列,结果表明,共鉴定出10个保守序列,长度为8~50 aa,且不同LcMYB蛋白含有的序列数不尽相同。其中,LcMYB21、LcMYB26、LcMYB29、LcMYB32、LcMYB35、LcMYB36、LcMYB38和LcMYB42 8个MYB蛋白的氨基酸序列中所含的保守序列数目最多,为6个;而LcMYB1、LcMYB2、LcMYB5、LcMYB6、LcMYB18和LcMYB49 6个MYB蛋白的保守序列数最少,仅为1个;其余37个MYB转录因子所含的序列数为2~5个。
表1 过路黄MYB转录因子的理化性质及亚细胞定位
Table 1 Physicochemical property and subcellular localization of MYB in L.christinae
编号类型长度/aa相对分子质量pI脂肪系数总平均亲水性不稳定系数亚细胞定位 LcMYB1R1360 40 682.60 5.0572.33−0.67657.56叶绿体 LcMYB2R1210 23 882.87 5.1972.43−0.64354.59叶绿体 LcMYB3R1 59 6 982.95 6.5779.32−0.82770.85细胞核 LcMYB4R1 57 6 588.31 9.2253.16−1.40033.93细胞核 LcMYB5R1437 48 857.19 9.30 75.01−0.68750.09过氧化物酶体 LcMYB6R1464 53 380.90 9.7674.03−0.74950.97过氧化物酶体 LcMYB7R1282 30 947.95 9.0871.56−0.54152.32细胞核 LcMYB8R1301 33 072.95 9.5876.38−0.52641.76细胞核 LcMYB9R1289 31 860.98 9.1168.48−0.58453.10细胞核 LcMYB10R1330 36 103.28 6.8760.33−0.67356.45过氧化物酶体 LcMYB11R1258 28 665.7710.0871.20 −0.720 60.62细胞核 LcMYB12R1333 36 032.08 6.4658.02−0.66458.02过氧化物酶体 LcMYB13R1280 30 982.54 7.9965.39 −0.66759.10叶绿体 LcMYB14R1249 27 949.35 6.0867.71−0.63037.11细胞核 LcMYB15R1 71 8 408.39 8.0861.83−1.04969.91细胞核 LcMYB16R1 81 9 135.14 8.0760.25−0.86964.61细胞核 LcMYB17R1 84 10 287.76 9.4652.26−1.07995.27细胞核 LcMYB18R1632 70 486.65 9.3573.42−0.65253.59细胞核 LcMYB19R1159 18 608.88 6.3466.73−1.13428.77叶绿体 LcMYB20R2R3466 52 434.97 5.6775.13−0.67465.80叶绿体 LcMYB21R2R3227 26 091.71 8.3275.20−0.63057.65细胞核 LcMYB22R2R3308 3 474.81 7.7670.91−0.69548.93叶绿体 LcMYB23R2R3286 31 397.48 8.8054.62−0.65152.83细胞核 LcMYB24R2R3220 25 714.90 8.6360.73−0.81946.15细胞核 LcMYB25R2R3286 32 539.37 7.7862.03−0.770 54.51细胞核 LcMYB26R2R3336 37 598.27 5.7879.55−0.49047.19细胞核 LcMYB27R2R3184 20 540.25 9.9365.27−0.78943.20细胞核 LcMYB28R2R3320 35 755.94 6.6667.34−0.72250.73细胞核 LcMYB29R2R3258 29 388.75 9.7185.78−0.52041.10细胞核 LcMYB30R2R3307 34 691.71 6.6065.80 −0.75555.91细胞核 LcMYB31R2R3303 33 390.08 7.6274.59−0.43857.26细胞核 LcMYB32R2R3271 30 417.42 8.8972.36−0.60449.84细胞核 LcMYB33R2R3126 14 843.2310.4469.68−0.96455.97细胞核 LcMYB34R2R3306 35 342.34 5.7370.39−0.74460.65细胞核 LcMYB35R2R3260 29 553.18 5.5073.54−0.73750.45细胞核 LcMYB36R2R3304 34 338.21 7.1763.52−0.92249.43细胞核 LcMYB37R2R3315 35 737.58 5.4464.06−0.72145.26细胞核 LcMYB38R2R3221 25 245.80 8.9776.38−0.71848.58细胞核 LcMYB39R2R3120 14 320.34 9.00 67.42−0.96266.73细胞核 LcMYB40R2R3237 27 632.28 9.1568.35−0.83456.06细胞核 LcMYB41R2R3150 16 983.46 9.5170.93−0.71562.72细胞核 LcMYB42R2R3249 28 573.26 8.6070.88−0.79251.04细胞核 LcMYB43R2R3165 19 181.92 9.80 73.33−1.00943.26细胞核 LcMYB44R2R3247 28 229.65 8.4265.95−0.85751.51细胞核 LcMYB45R2R3174 20 331.91 9.3457.76−1.04561.31细胞核 LcMYB46R2R3176 20 148.16 9.7290.34−0.72644.06细胞核 LcMYB47R2R3989111 684.07 5.2178.00−0.82548.32细胞核 LcMYB48R2R3924104 152.62 5.4473.48−0.880 47.76细胞核 LcMYB49R2R3579 65 384.06 9.1468.55−0.69444.57叶绿体 LcMYB50R2R3638 73 232.63 8.6565.82−1.00355.67叶绿体 LcMYB51R3367 41 206.18 8.0963.81−0.78957.86细胞核
进一步分析发现,在预测的10个保守序列中,51种LcMYB蛋白至少含有motif1、motif2、motif3中的一个,推测这3个氨基酸序列是MYB保守结构域的主要部分。其中,R1型LcMYB蛋白含有motif2、motif3、motif4、motif6、motif7、motif8和motif9;R2R3型LcMYB蛋白含10种保守序列且均含有motif3;R3型LcMYB蛋白含有motif1、motif2、motif3和motif6(图1)。
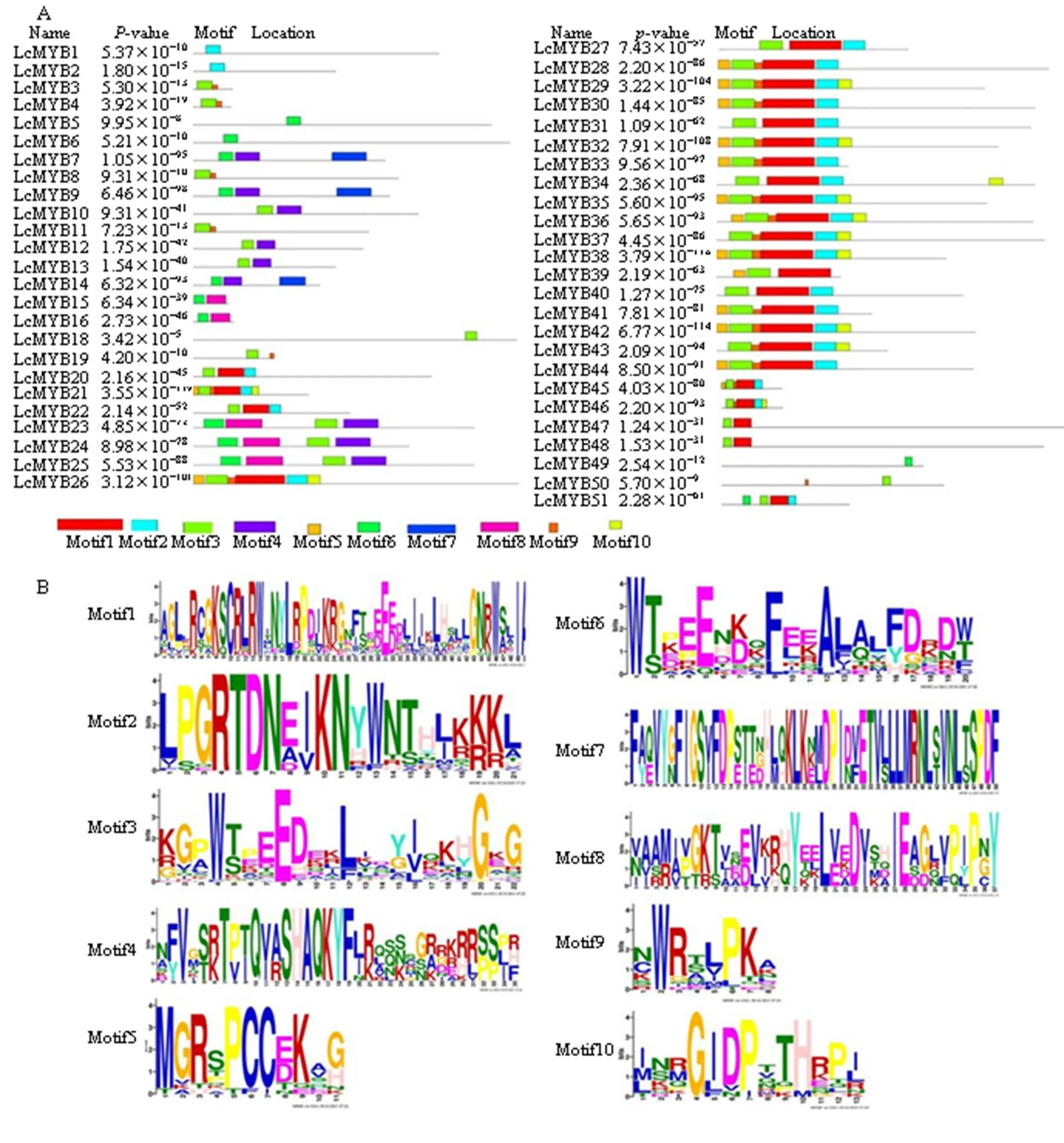
A-LcMYB转录因子的基序分布 B-LcMYB转录因子的各基序的氨基酸排列
2.4 过路黄MYB转录因子家族蛋白保守结构域分析
利用WebLogo网站对51个LcMYB蛋白的保守结构域进行分析。结果表明,LcMYB蛋白每个重复的结构域(R)均为51 aa,序列含有3个色氨酸(W),分别位于序列的第5、25、45位,且两相邻色氨酸的间距相同,为19 aa。进一步分析发现,在R1、R2和R3结构域的色氨酸均以第25位最为保守,R1结构域中的第5个氨基酸W存在甲硫氨酸(M)取代情况,而第45个氨基酸的W位由酪氨酸(Y)、丙氨酸(A)和W共同组成;R2结构域中的第5个氨基酸W部位高度保守,但第3个W也存在Y取代的情况;而R3结构域中的第1个W部位由苯丙氨酸(F)、异亮氨酸(I)和W共同组成,第45位的W也存在Y取代的现象。此外,MYB结构域中还包括其它较为保守的氨基酸残基,如第9位的谷氨酸(E)、第21位的甘氨酸(G)和第36位精氨酸(R)(图2)。
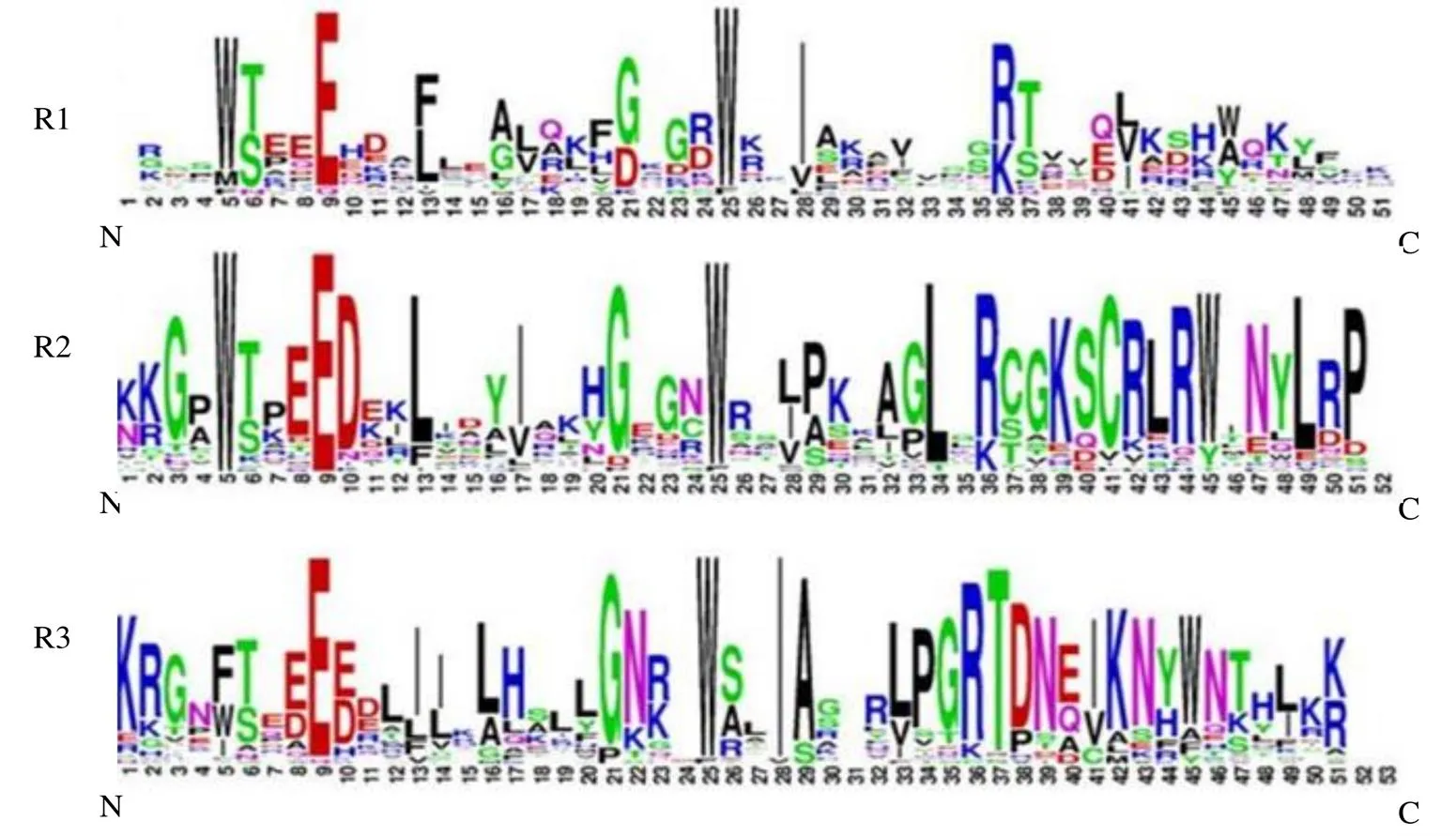
R1、R2和R3分别表示R1-MYB、R2R3-MYB和3R-MYB
2.5 过路黄MYB转录因子家族进化树分析
采用MEGA7.0软件绘制过路黄和拟南芥MYB蛋白家族系统进化树(图3),结果显示,来源过路黄的MYB转录因子分为3类,分别聚在系统进化树的3个不同分支下(Group I、Group II、GroupIII),其中R1-MYB类转录因子主要是分布在I、II类,占过路黄总R1-MYB类转录因子的37.25%,R2R3-MYB类转录因子主要被聚在第III类中,占过路黄总R2R3-MYB类转录因子的60.78%。R2R3-MYB类转录因子,结构多样导致其在进化树上分布范围最广。第III大类被分为2个亚类,R1-LcMYB5最先被分化,其中R1-LcMYB5与AT1G77450、AT1G32450聚在一起。
从过路黄和拟南芥MYB转录因子家族系统进化树(图3)中可以看出大部分过路黄MYB转录因子可与拟南芥聚在一起,说明过路黄MYB转录因子和拟南芥MYB转录因子可以相互匹配,如LcMYB19与AT1G15720、LcMYB13与AT1G70000、LcMYB23与AT5G04760、LcMYB16与AT2G21650、LcMYB24与AT3G11280、LcMYB50与AT5G45420、LcMYB17与AT2G46410、LcMYB51与AT3G09370、LcMYB22与AT1G17950、LcMYB2与AT3G23250、LcMYB3与AT3G46130、LcMYB41与AT5G57620、LcMYB39与AT1G63910、LcMYB43与AT1G22640、LcMYB26与AT1G34670、LcMYB29与AT4G28110、LcMYB45与AT1G16490和LcMYB33与AT5G49330分别聚在一起,根据系统进化的序列相似性,表明其进化关系较近,说明其与拟南芥的亲缘关系比较接近,在蛋白结构和序列上更为相似,可以根据此来预测LcMYB的生物学功能。在该进化树中存在着不同结构域但同源性较高的情况,如R2R3-LcMYB20与R1-LcMYB1相邻;同时存在着相同结构域同源性高的情况,如R2R3-LcMYB21与R2R3-LcMYB38、R2R3- LcMYB28与R2R3-LcMYB30分别相邻。总体表明,MYB家族蛋白与拟南芥MYB家族蛋白同源性高,在相邻或较近进化关系上的蛋白有可能具有相似的功能。
2.6 过路黄MYB转录因子家族蛋白高级结构分析
利用SOPMA预测过路黄MYB蛋白质的二级结构,结果显示,除LcMYB15蛋白不含延伸链外,其余50个LcMYB蛋白均具有α-螺旋、β-转角、无规卷曲和延伸链4种构型。其中部分R1-LcMYB蛋白(LcMYB6、LcMYB17)及部分R2R3-LcMYB蛋白(LcMYB39、LcMYB47、LcMYB48、LcMYB50)是以α-螺旋为主,β-转角、延伸链以及无规则卷曲分布在蛋白序列中;而其余44种LcMYB蛋白则都以无规则卷曲为主,α-螺旋、β-转角、延伸链散布于整个蛋白序列(表2)。
蛋白质的三级结构与其功能密切相关,使用Swiss-Model对过路黄的氨基酸序列进行三级结构同源建模(图4),结果表明,过路黄MYB家族蛋白均具有α-螺旋、无规则卷曲、β-折叠和β-转角,这与二级结构预测相符合。R2R3-LcMYB亚族蛋白三级结构相似性较高,R2、R3结构分别有3个α-螺旋,能明显看到HTH结构,主要是无规则卷曲长度有所不同。对于R1-LcMYB亚族蛋白,主要在α-螺旋数量上存在差异。
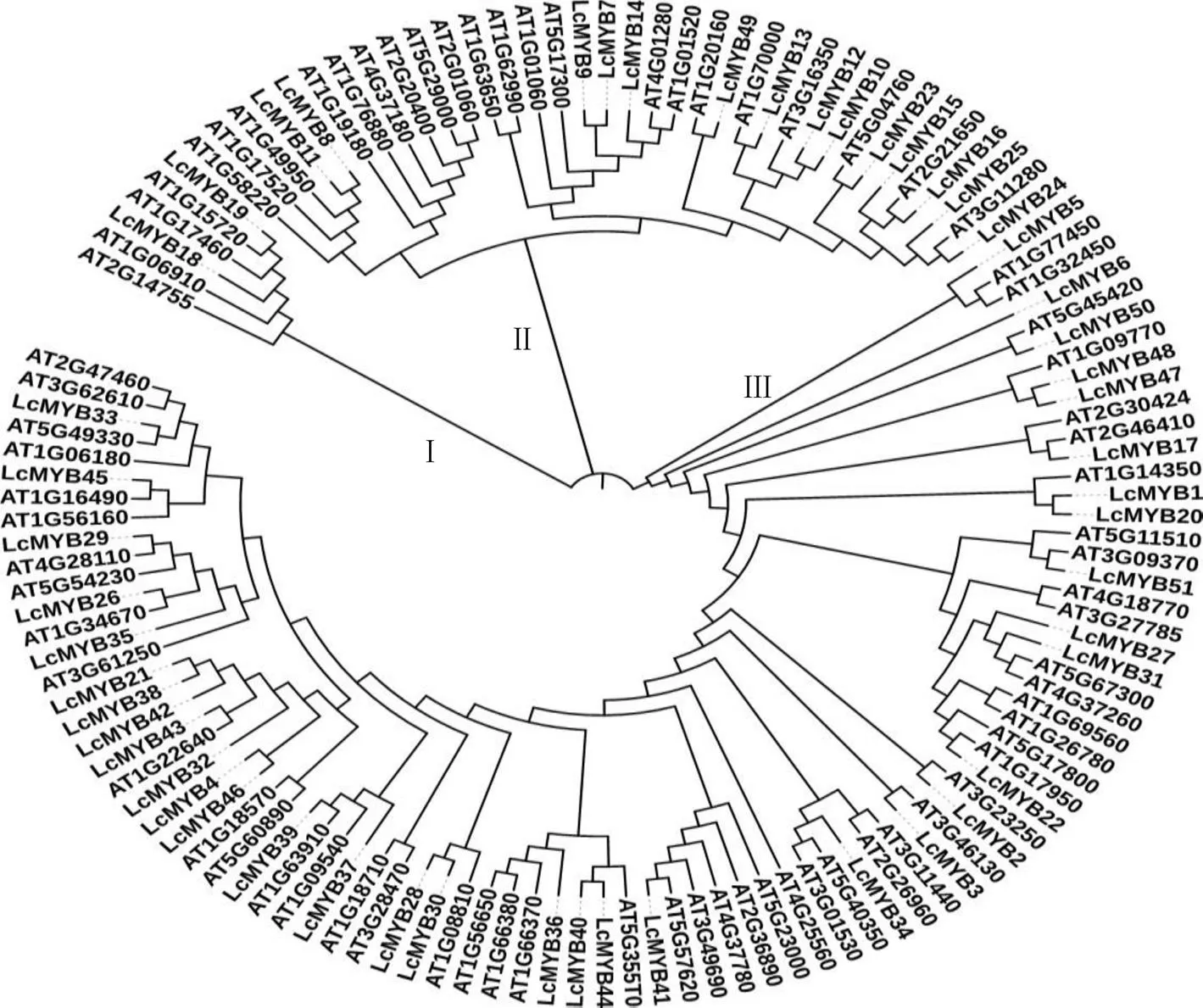
图3 过路黄MYB转录因子家族进化树
表2 过路黄MYB转录因子家族蛋白的二级结构
Table 2 Secondary structure of MYB proteins in L.christinae
编号α-螺旋/%β-转角/%无规则卷曲/%延伸链/%编号α-螺旋/%β-转角/%无规则卷曲/%延伸链/% LcMYB138.892.2251.39 7.50LcMYB2741.30 4.3545.65 8.70 LcMYB229.056.6754.2910.00LcMYB2831.56 1.8860.00 6.56 LcMYB335.598.4740.6815.25LcMYB2934.50 8.5343.4113.57 LcMYB421.057.0261.4010.53LcMYB3028.99 2.6161.89 6.51 LcMYB540.051.3753.09 5.49LcMYB3127.72 3.6360.73 7.92 LcMYB653.454.0933.62 8.84LcMYB3225.09 5.9057.2011.81 LcMYB727.304.2661.70 6.74LcMYB3334.1311.9043.6510.32 LcMYB844.523.3242.52 9.63LcMYB3434.64 2.6158.17 4.58 LcMYB927.686.2357.89 9.00LcMYB3536.54 3.8553.85 5.77 LcMYB1016.062.7369.3911.82LcMYB3624.67 5.9261.51 7.89 LcMYB1134.113.4952.3310.08LcMYB3738.10 4.7651.43 5.71 LcMYB1216.223.6066.6713.51LcMYB3831.67 5.8852.49 9.95 LcMYB1317.144.2961.0717.50LcMYB3948.33 5.8339.17 6.67 LcMYB1429.726.0254.2210.04LcMYB4026.58 5.0664.56 3.80 LcMYB1556.345.6338.030LcMYB4136.67 8.6747.33 7.33 LcMYB1649.382.4746.91 1.23LcMYB4227.31 5.6256.2210.84 LcMYB1754.763.5733.33 8.33LcMYB4343.03 9.0944.24 3.64 LcMYB1819.303.0164.8712.82 LcMYB4428.74 6.8858.70 5.67 LcMYB1928.932.5259.75 8.81LcMYB4544.25 9.2043.10 3.45 LcMYB2034.984.0853.22 7.73LcMYB4632.39 6.8247.1613.64 LcMYB2128.635.2956.83 5.29LcMYB4753.69 2.2240.24 3.84 LcMYB2232.146.2847.7313.31LcMYB4854.55 2.9237.12 5.41 LcMYB2321.332.8065.3810.49LcMYB4945.42 3.9740.93 9.67 LcMYB2426.825.4550.9116.82LcMYB5063.17 4.2328.06 4.55 LcMYB2521.333.1559.4416.08LcMYB5128.07 5.4561.04 5.45 LcMYB2641.963.5752.68 1.79

图4 过路黄MYB蛋白的三级结构
2.7 过路黄MYB转录因子蛋白的功能注释
Blast2GO软件处理结果表明,51条LcMYB序列被注释到分子功能、生物过程和细胞组成3个GO类别的24小组。分子功能注释均为binding,LcMYB序列数量为36条,表明所筛选的MYB转录因子通过与目的基因的启动子区结合,调控生物体的生长发育。生物过程中注释的生物过程和细胞过程丰度最高,均为16条;其次是代谢过程、大分子代谢过程、细胞内代谢过程、初级代谢过程、细胞内大分子代谢过程和有机物代谢过程,丰度均为13条;生物调节、细胞过程调节和生物过程调节丰度也较高,为8条,其他基因均较小。值得注意的是,参与芳香族化合物生物合成的有8条,分别为LcMYB10、LcMYB12、LcMYB21、LcMYB23、LcMYB24、LcMYB25、LcMYB7和LcMYB9。细胞组成中注释最多的为细胞组分、细胞器及内腔(图5)。
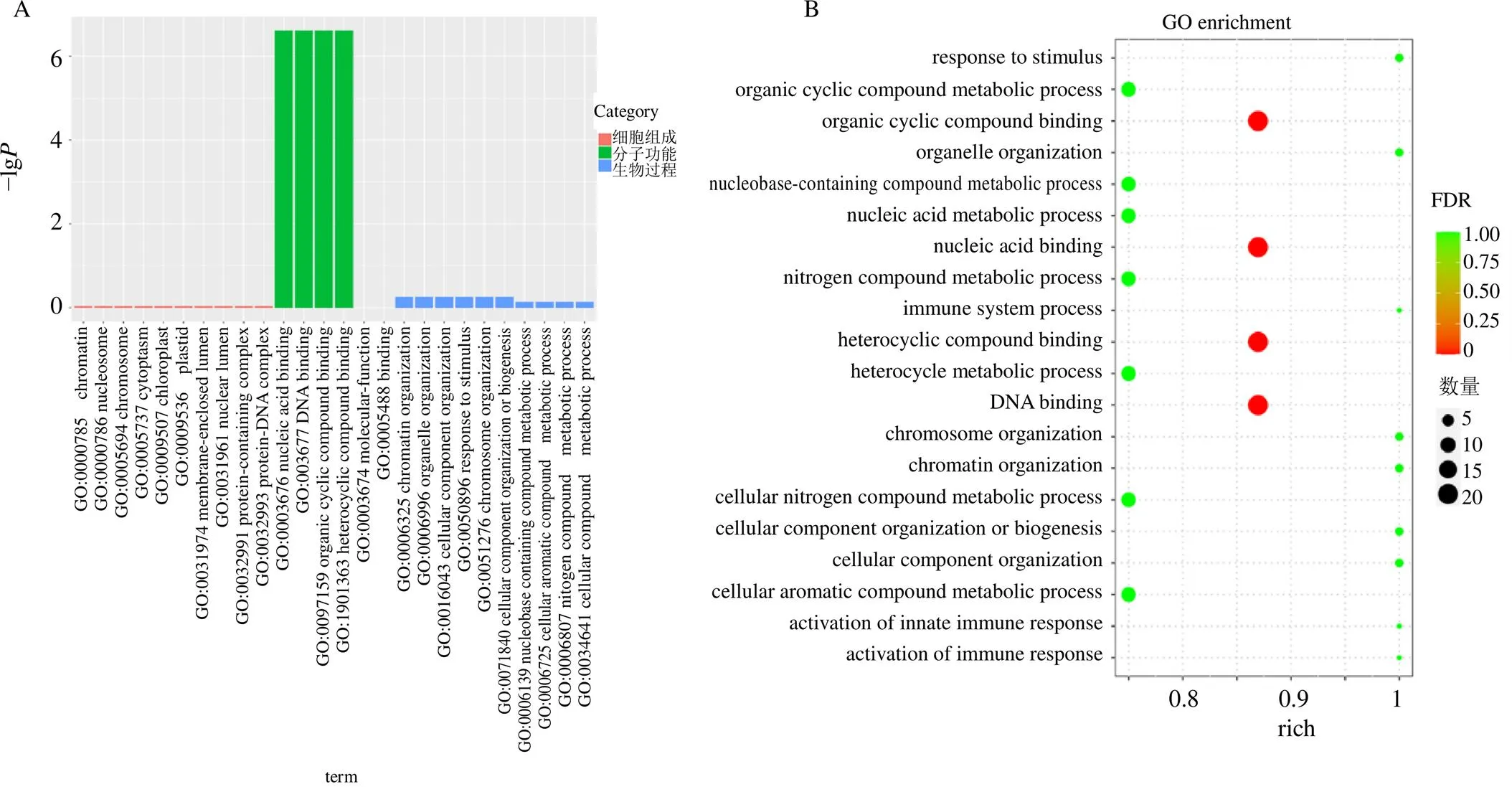
图5 过路黄MYB转录因子家族蛋白的GO注释 (A)和富集分析(B)
3 讨论
3.1 LcMYB的理化性质及细胞定位
本实验首次从过路黄全长转录组中分别鉴定出19个R1型LcMYB、31个R2R3型LcMYB和1个R3型LcMYB基因,相较于拟南芥、大豆(Linn.) Merr.、水稻L.、柑橘Blanco、葡萄树L.、毛果杨Torr. & Gray等基因组中相应的3种类型基因均偏少,但比细叶百合的23个MYB家族成员多,这可能与各植物基因组倍数以及基因的复制相关[20]。此外,过路黄中R2R3型LcMYB基因所占比例最大,与上述物种中R2R3-MYB基因在MYB家族中的分布比例相同[17]。在少数物种中还发现了R4型MYB蛋白,但在过路黄全长转录组中尚未发现。
3.2 LcMYB的保守结构域
通过对其翻译的氨基酸序列中保守结构域基序分析,表明R2R3-LcMYB结构域比R1-LcMYB结构域保守。其中,R2-LcMYB与R3-LcMYB基序中都含有3个保守的色氨酸,色氨酸之间的间隔氨基酸数目分别为20、20与20、19。R3-LcMYB基序第1个和第3个色氨酸处还包括疏水氨基酸苯丙氨酸,这与黑果枸杞L. R3-MYB基序一致[21],表明MYB基因家族N端在不同植物间高度保守,对于维持HTH构型有着重要的作用[22];其中R2-LcMYB基序中2个色氨酸之间的间隔与杜海描述大豆植物R2R3-MYB一致[23],说明过路黄R2-LcMYB基序的色氨酸非常保守;而R3-LcMYB基序中色氨酸比大豆中少1个氨基酸残基,表明过路黄R2R3-LcMYB类转录因子中的R3-LcMYB基序发生氨基酸缺失,该区域可能是其植物进化和功能分化的热点区;而R1-LcMYB基序只有2个保守的色氨酸且间隔19个氨基酸,第3个色氨酸被组氨酸(H)、赖氨酸(K)以及精氨酸(R)取代。
3.3 LcMYB高级结构分析
分别对R1-LcMYB和R2R3-LcMYB蛋白进行二级结构预测,分析表明所有蛋白都具有α-螺旋、β-转角、β-折叠及无规则卷曲结构,且大部分以无规则卷曲为主,只有R2R3-LcMYB3、R2R3-LcMYB4与R1-LcMYB15蛋白是以α-螺旋为主;从2个亚族中选取具有代表性的序列R2R3-LcMYB9、R2R3-LcMYB4、R1-LcMYB2、R1- LcMYB15进行三级结构同源建模,发现R2R3-LcMYB亚族中的蛋白质三级结构相似性较高,在无规则卷曲长度上略有不同;而R1-LcMYB亚族蛋白,主要是在α-螺旋数量上差异较大。通过对过路黄MYB转录因子的保守结构域基序分析以及氨基酸高级结构的预测,为研究过路黄属及报春花科其他植物的MYB转录因子的结构和功能进化奠定基础。
3.4 聚类分析
过路黄与拟南芥MYB蛋白的聚类分析结果表明,大部分LcMYB都与拟南芥处于同一分支,表明过路黄和拟南芥MYB成员具有相近的进化起源,但一些分支中缺少拟南芥或过路黄MYB成员,证明这2个物种的R2R3-MYB基因可能存在多样性。R3-MYB转录因子被认为具有相同或相似功能[21];本研究用所得47条过路黄MYB类转录因子蛋白与22条拟南芥MYB蛋白作系统进化树,结果显示过路黄和拟南芥MYB基因被聚为3个大类,其中R2R3-MYB分布广泛,在II类中占过路黄总R2R3-MYB类转录因子的60.9%,R1-MYB主要被聚在第I类中,占过路黄总R1-MYB类转录因子的37.3%;在该进化树中存在着不同结构域与相同结构域相邻的情况。总体表明,过路黄MYB家族蛋白与拟南芥MYB家族蛋白同源性高。其中,R2R3-LcMYB28与R2R3-LcMYB30相邻;R2R3-LcMYB40与R2R3-LcMYB44相邻且在R2R3-LcMYB34基础上进化而来。研究表明拟南芥中黄酮类物质主要受AtMYB11、AtMYB12和AtMYB111以及AtMYB75/PAP1、AtMYB90、AtMYB114调控[24-25]。因此可以推测R2R3-LcMYB33及R2R3-LcMYB36可能具有相似的功能,参与过路黄中黄酮类次生代谢物的生物合成,这将为过路黄MYB转录因子的功能研究提供参考,进而为过路黄MYB基因调控黄酮类化合物合成的功能鉴定与作用机制研究、高产优质过路黄育种和种植提供科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 229.
[2] 万德光,彭成,赵军宁. 四川道地中药材志 [M]. 成都: 四川科学技术出版社, 2005: 367-375.
[3] 莫刘基, 邓家泰, 张金梅, 等. 几种中药对输尿管结石排石机理的研究(摘要) [J]. 新中医, 1985, 17(6): 53-54.
[4] 金丽鑫. 金钱草对照药材标定技术标准的研究 [D]. 成都: 成都中医药大学, 2012.
[5] 王佰灵, 罗伦, 戈振凯, 等. 基于网络药理学和分子对接探讨金钱草治疗痛风的作用机制 [J]. 天然产物研究与开发, 2021, 33(5): 859-867.
[6] 王宇杰, 孙启时. 金钱草的化学成分研究 [J]. 中国药物化学杂志, 2005, 15(6): 357-359.
[7] Kim H A, Lee D S, Lee H,.Hance as an anticancer agent against breast cancer cells [J]., 2020, 8(10): 5717-5728.
[8] Wu N H, Ke Z Q, Wu S,. Evaluation of the antioxidant and endothelial protective effects ofHance (Jin Qian Cao) extract fractions [J]., 2018, 18(1): 128.
[9] Wang J M, Zhang Y Y, Zhang Y S,. Protective effect ofagainst acute alcohol-induced liver injury in mice [J]., 2012, 6(2): 89-97.
[10] 伍小方, 高国应, 左倩, 等. FtMYB1转录因子调控苦荞毛状根黄酮醇合成的机理研究 [J]. 植物遗传资源学报, 2020, 21(5): 1270-1278.
[11] 赵莹, 杨欣宇, 赵晓丹, 等. 植物类黄酮化合物生物合成调控研究进展 [J]. 食品工业科技, 2021, 42(21): 454-463.
[12] Falcone Ferreyra M L, Rius S P, Casati P. Flavonoids: biosynthesis, biological functions, and biotechnological applications [J]., 2012, 3: 222.
[13] Kocábek T, Mishra A K, Matoušek J,. The R2R3 transcription factor HlMYB8 and its role in flavonoid biosynthesis in hop (L.) [J]., 2018, 269: 32-46.
[14] Onkokesung N, Reichelt M, van Doorn A,. Modulation of flavonoid metabolites inthrough overexpression of the MYB75 transcription factor: Role of kaempferol-3, 7-dirhamnoside in resistance to the specialist insect herbivore[J]., 2014, 65(8): 2203-2217.
[15] Nakabayashi R, Yonekura-Sakakibara K, Urano K,. Enhancement of oxidative and drought tolerance inby overaccumulation of antioxidant flavonoids [J]., 2014, 77(3): 367-379.
[16] Ogata K, Kanei-Ishii C, Sasaki M,. The cavity in the hydrophobic core of Myb DNA-binding domain is reserved for DNA recognition and trans-activation [J]., 1996, 3(2): 178-187.
[17] Liu J Y, Osbourn A, Ma P D. MYB transcription factors as regulators of phenylpropanoid metabolism in plants [J]., 2015, 8(5): 689-708.
[18] Du H, Zhang L, Liu L,. Biochemical and molecular characterization of plant MYB transcription factor family [J].(), 2009, 74(1): 1-11.
[19] Dubos C, Stracke R, Grotewold E,. MYB transcription factors in[J]., 2010, 15(10): 573-581.
[20] 王静文, 谭萌萌, 孙绍营, 等. 基于转录组信息的细叶百合MYB转录因子家族分析 [J]. 分子植物育种, 2021, https://kns.cnki.net/kcms/detail/46.1068.S.2021 1213. 1536.009.html
[21] 严莉, 王翠平, 陈建伟, 等. 基于转录组信息的黑果枸杞MYB转录因子家族分析 [J]. 中国农业科学, 2017, 50(20): 3991-4002.
[22] Jin H, Martin C. Multifunctionality and diversity within the plant-gene family [J]., 1999, 41(5): 577-585.
[23] 杜海. 植物MYB转录因子家族的分子进化机制及调控类黄酮生物合成MYB基因的鉴定 [D]. 雅安: 四川农业大学, 2013.
[24] Qi X W, Fang H L, Chen Z Q,. Ectopic expression of a R2R3-transcription factor gene LjaMYB12 fromincreases flavonoid accumulation in[J]., 2019, 20(18): 4494.
[25] Wang X C, Wu J, Guan M L,.MYB4 plays dual roles in flavonoid biosynthesis [J]., 2020, 101(3): 637-652.
Excavation and identification of members of MYB transcription factor family in
YANG Jing-tian1, LI Hua3, ZHAO Huan2, LONG Yun2, ZHANG Yong-si2, LIU Xiao-hong2
1. Sichuan Key Laboratory of Ecological Security and Protection, Mianyang Normal University, Mianyang 621000, China 2. College of Life Science, China West Normal University, Nanchong 637009, China 3. State-owned Forest Farm of Beichuan Qiang Minority Autonomous County, Mianyang 622761, China
To analyze the structure and function of the members of MYB transcription factor family in, and excavate some information of the genes related to flavonoid biosynthesis.Based on transcriptome database of, the physicochemical properties, subcellular localization, conserved motifs and domains and protein structures of the LcMYB were analyzed by online websites, including ProtParam, GenStript, MEME, WebLogo, SOPMA, Swiss-Model, etc. The MYB phylogenetic tree was constructed by MEGA to analyze the phylogenetic relationship betweenand.A total of 51 LcMYB genes were identified, 51 MYB protein sequences with conserved domain were predicted. LcMYB can be divided into three classes (R1-LcMYB, R2R3-LcMYB and R3-LcMYB) according to the conserved domain, and all the LcMYB motifs contained three conserved tryptophan. All the MYB proteins ofwere hydrophilic and rich in basic amino acids, with high thermal stability. Most of the proteins were mainly in random curl, among them, R2R3-LCMYB39, R2R3-LCMYB47, R2R3-LCMYB48 and R2R3-LCMYB50 were mainly in α-helix. MYB family ofcould be divided into three groups on the basis of evolutionary tree with the MYB family of.The structure and function information of 51 genes associated with MYB transcription factor family members was obtained in, thereinto, two genes were involved in the biosynthesis of flavonoids, which provided molecular basis for the subsequent cloning of genes related to the biosynthesis of flavonoids.
Hance; MYB; bioinformatics; flavonoids; transcription factor
R282.12
A
0253 - 2670(2022)16 - 5149 - 10
10.7501/j.issn.0253-2670.2022.16.024
2022-02-03
西华师范大学校基本科研业务费(19B033);青海民族大学校级理工科项目(2019XJY02);绵阳师范学院科研启动项目(QD2019A13)
杨敬天(1983—),男,四川绵阳人,博士,讲师,主要从事植物系统进化与药用植物学研究。Tel: 13699629310 E-mail: yjtdc83@163 com
刘小红(1975—),男,重庆彭水人,博士,教授,主要从事植物分子遗传学研究。Tel: 13330761109 E-mail: 350783409@qq.com
[责任编辑 时圣明]

