铜绿假单胞菌噬菌体K4 的性质及其在食品防腐方面的应用
庞文静,韩庆竹,尤甲甲,李东航,李佩泽,李玥莹,杨洪江
(工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
铜绿假单胞菌(Pseudomonas aeruginosa)是一种机会致病菌,可引起人类一系列感染疾病[1]。在某些环境中,铜绿假单胞菌可污染食物,引起食源性疾病[2]。目前在食品、医疗领域中常用使用抗生素以达到对其的治疗和预防作用,然而在临床分离菌株中,约90%的铜绿假单胞菌对单一抗生素产生了耐药性,这极大威胁到了人类的公共健康、食品安全及畜禽饲料安全,因此具有宿主特异性的噬菌体疗法应被重视。
噬菌体(phage)是细菌病毒,能够特异性地杀死宿主菌,是一种具有抑菌活性的天然抗菌剂并具有一定的防腐能力[3-5]。噬菌体可特异性裂解多重耐药性菌株,菌株的耐药性与噬菌体感染过程无关,且噬菌体在感染宿主菌的过程中数量不仅不会减少,反而会在宿主菌内增多,有较好的抑菌效果[6-8]。目前已分离鉴定多株铜绿假单胞菌噬菌体,其中部分铜绿假单胞菌噬菌体的受体已被发现,如噬菌体MPK7[9]和D3112[10]的受体为Type IV 菌毛,噬菌体K8[11]、C11[12]、O4[13]、K5[14]、FIZ15[15]、PaP1[16]、PaP3[17]、JG024[18]的受体为LPS。噬菌体具有宿主特异性,很多铜绿假单胞菌噬菌体的受体是脂多糖(LPS),铜绿假单胞菌的LPS 结构比较复杂,血清型较多,噬菌体识别LPS 特异性较强,因此宿主范围较窄。为了满足噬菌体应用需求,尽可能多的分离鉴定噬菌体,分析噬菌体受体、基因组功能注释,此举将为制备不同噬菌体制剂提供实验材料[19]。
本实验室在之前的工作中以P.aeruginosaPAK为指示菌,从公园污泥中分离得到了一株铜绿假单胞菌噬菌体K4[20]。透射电镜显示噬菌体K4 具有正二十面体的头部和可伸缩的尾部。本研究以噬菌体K4 为研究对象,分别对其生物学特性、基因组学、比较基因组学以及在牛奶和午餐肉中的抑菌效率进行分析,探讨噬菌体K4 在食品安全[10]等领域中控制铜绿假单胞菌污染的可能性。
1 材料与方法
1.1 材料与仪器
铜绿假单胞菌菌株、噬菌体、质粒等 如表1所示;牛奶、午餐肉 购自超市;蛋白胨、酵母浸粉北京奥博星生物技术有限责任公司;氯化钠、氢氧化钠(分析纯)天津市津东天正精细化学试剂厂;硫酸庆大霉素(纯度≥590 mcg/mg)北京博奥拓达科技有限公司;氨苄青霉素钠(纯度≥85%)北京索莱宝科技有限公司。
HZQ-X100 恒温振荡培养箱 苏州市培英实验设备有限公司;TG16-W 微量高速离心机 长沙湘仪离心机仪器有限公司;LRH-250S 恒温培养箱 上海福玛实验设备有限公司;Infinite F50 ELISA 酶标仪瑞士TECAN 公司。
1.2 实验方法
1.2.1 噬菌体K4 悬液的制备 培养100 mL 铜绿假单胞菌PAK 至对数生长期(OD600=0.4),加入109PFU/mL噬菌体K4,于37 ℃条件下振荡培养4 h,裂解液12000 r/min 离心10 min,上清液再用0.22 μm 滤膜过滤除菌制得噬菌体K4 悬液。
1.2.2 噬菌体K4 的氯仿稳定性实验 取500 μL 噬菌体悬液与500 μL 氯仿充分振荡后静置1 h,12000 r/min离心10 min,10-4~10-8系列稀释的样品分别与指示菌混合倒双层平板,37 ℃过夜培养后噬菌斑计数,计算培养液中噬菌体的浓度,测定上清液中噬菌体滴度。
1.2.3 噬菌体K4 的热稳定性实验 分别取1 mL 滴度为3.84×1010PFU/mL 噬菌体K4 悬液分装于1.5 mL EP 管中,分别置于30、40、50、60、70、80 ℃的水浴锅中处理1 h,10-1~10-7梯度稀释处理后的样品,测定噬菌体滴度,计算噬菌体在各个温度下的存活率。将30 ℃处理的样品设置为对照组。
1.2.4 噬菌体K4 宿主范围的确定 选择铜绿假单胞菌野生型PAK 和多株插入突变株(表1),确定宿主范围。挑取单菌落于LB 培养基中过夜培养,制备双层平板,稀释噬菌体悬液至108PFU/mL 取1 μL噬菌体稀释液点板,进行spotting 实验,所用噬菌体K4[20]、K5[14]、K8[11]、O4[13]、C11[12]。

表1 本研究中所用菌株、噬菌体和质粒Table 1 Strains,phages and plasmids used in this study
1.2.5 噬菌体K4 基因组的提取及测序 按照文献[22]提供的方法提取噬菌体基因组,具体为:培养宿主菌PAK 至OD600=0.6,加入噬菌体K4 裂解液,振荡培养4~5 h,扩增噬菌体。
向裂解液中加入氯化钠,终浓度为0.1 mol/L 冰浴1 h 后,12000 r/min 离心去除沉淀。上清液中加入DNase I 和RNase A 至终浓度均为10 μg/mL,37 ℃静置1 h,去除宿主菌的DNA 和RNA。上清液中加入聚乙二醇6000(PEG 6000)至终浓度为10%(w/v)充分溶解,4 ℃静置过夜。
12000 r/min 离心保留沉淀,用2 mL TM 溶液(0.05 mol/L Tris-HCl 与0.2% MgSO4·7H2O 混合,pH 调至7.0)重悬噬菌体,分别加入DNase I 和RNase A 至终浓度为10 μg/mL,37 ℃静置1 h。分别加入SDS 和蛋白酶K,终浓度分别为0.5%和50 μg/mL,56 ℃水浴4 h。加入与重悬液等体积的氯仿/异戊醇(24:1),振荡30 s,12000 r/min 离心10 min,收集上层水相,去除PEG 6000,再用等体积的苯酚-氯仿抽提至无蛋白膜后用氯仿抽提一次,加入2.5 倍体积的95%乙醇,-20 ℃静置2 h,12000 r/min 离心10 min,用70%乙醇洗涤,干燥后用ddH2O 重悬噬菌体基因组DNA。
将K4 基因组DNA 送至金唯智公司(www.genewiz.com)进行测序,测序平台为Illumina Hiseq2500。将测序结果使用Trimmomatic(v0.30)软件去除低质量及接头序列获得Clean Data,有4229838 条reads,共计419367181 bp。使用软件Velvet_v1.12.10 进行组装拼接,获得1 条组装基因组序列,共计50284 bp。并将该序列保存在NCBI 的GenBank 中,登录号为MW929175。
1.2.6 噬菌体K4 基因组的功能注释 使用在线网站RAST Server(https://rast.nmpdr.org/)[23]和NCBI(https://www.ncbi.nlm.nih.gov/)对噬菌体K4 的基因组进行蛋白功能注释。推定铜绿假单胞菌噬菌体K4 基因组上的编码基因,将基因编码的蛋白在NCBI数据库中进行分析比对,推测其蛋白的功能[24]。使用在线软件CGview Server(http://cgview.ca/)绘制基因组功能注释图[25]。
1.2.7 噬菌体K4 的比较基因组分析与分类 利用NCBI 数据库对K4 基因组序列进行同源性搜索,获得与噬菌体K4 同源的噬菌体基因组序列,利用在线软件Circoletto 分析基因组间的同源性(http://tools.bat.infspire.org/circoletto/)。另一方面,利用在线软件CoreGenes5.0(https://coregenes.ngrok.io/),分别分析噬菌体K4 与其它噬菌体蛋白质组相似的程度。对病毒蛋白编码基因碱基序列的相似性,其Evalue 小于1e-5 的且覆盖率大于或等于75%,则判断为相似。两个噬菌体蛋白质组中,超过40%的噬菌体蛋白相似,则将两个噬菌体分类为同一属[26-27]。
1.2.8 噬菌体K4 的一步生长曲线 宿主菌培养至OD600=0.6,5000 r/min 离心5 min,收集的宿主菌细胞重悬于500 μL 液体LB 培养基中,加入等体积噬菌体悬液,使得MOI 约为0.0001,混匀后静置吸附1 min,12000 r/min 离心30 s,去除上清液,将沉淀重悬于100 mL 新鲜LB 液体培养基中。每隔5 min取样100 μL,测定噬菌体滴度。
1.2.9 噬菌体K4 的抑菌活性分析 将300 μL 宿主菌PAK 以3%转接量转接至含有100 mL 液体LB 培养基中,将噬菌体K4(滴度约为3.384×1010PFU/mL)分别控制MOI 在10、1、0.1、0.01、0.001 和0.0001;按照不同MOI,使指示菌与噬菌体混合,取上述混合培养液200 μL 至无菌96 孔板中,每个MOI 设置6 个平行。并加入200 μL 液体LB 培养基作为对照组。将96 孔板置于37 ℃摇床中,160 r/min 振荡培养12 h,每隔30 min 测量96 孔板中培养物的OD600数值,测定细菌浓度,绘制噬菌体抑菌曲线。
1.2.10 噬菌体对牛奶中细菌的影响 取20 mL 规格为1×250 mL 的无菌牛奶与20 μL 109CFU/mL 的宿主菌PAK 混匀后,取1.8 mL 混合液分装于4 mL无菌EP 管中。将用0.22 μm 滤膜过滤处理两次的噬菌体裂解液系列稀释,取200 μL 稀释液与1.8 mL牛奶样品混匀,使得最终MOI 为1 和10,样品分别于4 和25 ℃静置培养24 h。取样系列稀释后涂布LB 平板,37 ℃过夜培养后菌落计数,计算培养液中的细菌浓度。系列稀释的样品分别与指示菌混合倒双层平板,37 ℃培养过夜培养后噬菌斑计数,计算培养液中噬菌体的浓度。只加噬菌体K4 和只加宿主菌的样品作为空白对照,每组设立三个平行。
1.2.11 噬菌体对午餐肉中细菌的影响 将340 g/罐的无菌午餐肉罐头切成1.5 cm×1.5 cm 的小方块,然后放于30×40 mm,体积为20 mL 的无菌取样瓶中。取10 μL 宿主菌PAK 滴加到午餐肉切块表面(菌浓为106CFU/mL)。分别取10 μL 噬菌体裂解液(滴度约为3.38×108和3.38×109PFU/mL),以MOI为1 和10 滴加到午餐肉表面,样品分别于4 和25 ℃静置培养24 h。取样系列稀释后涂布LB 平板,37 ℃培养过夜培养后菌落计数,计算培养液中的细菌浓度。系列稀释的样品分别与指示菌混合倒双层平板,37 ℃过夜培养后噬菌斑计数,计算培养液中噬菌体的浓度。只加噬菌体K4 和只加宿主菌的样品作为空白对照,每组设立三个平行。
1.3 数据处理
实验中每组数据均为3 次重复,利用Student ttest 进行组间数据分析,采用Excel 2016 软件作图。
2 结果与分析
2.1 噬菌体K4 的稳定性分析
噬菌体在氯仿中的稳定性实验表明:在滴度为3.84×1010PFU/mL 的噬菌体K4 裂解液中加入氯仿,结果如图1A 所示,噬菌体滴度降至1.6×1010PFU/mL,存活率为42%,其氯仿的耐受程度高于噬菌体PA-27-1[28]、PaP6[29]、PHW2[30]等铜绿假单胞菌噬菌体。
噬菌体在不同温度下的稳定性实验表明:滴度为3.84×1010PFU/mL 的噬菌体K4 分别在30、40、50、60、70、80 ℃培养1 h 后,测定噬菌体滴度变化如图1B 所示。在32~50 ℃噬菌体滴度轻微下降,50 ℃时存活率为74.12%,60 ℃时存活率为28.10%,70 ℃时存活率仅为1.10%,80 ℃几乎检测不到噬菌体,噬菌体K4 与噬菌体D204[31]、PaP3[32]、PA-YS35[33]的温度敏感性相似,即在30~60 ℃温度范围内较稳定,60 ℃以上噬菌体数量急剧下降。综上所述,该噬菌体易于制备、储存及运输,为在食品中应用提供了实验材料[34]。
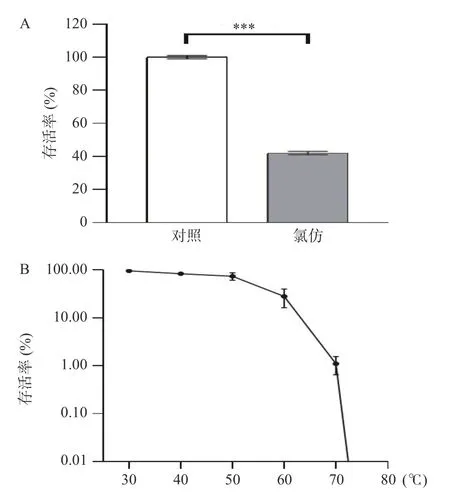
图1 噬菌体K4 的稳定性分析Fig.1 Stability analysis of phage K4
2.2 噬菌体K4 的宿主范围
为了进一步确定噬菌体K4 的受体是否与LPS相关。本研究分别测定了噬菌体K4[20]作用于噬菌体K8[11]、C11[12]、K5[14]、O4[13]完全耐受突变株M4、SK45(阻断基因为wbpR),M19(阻断基因为wbpT),M25、M30、SK75(阻断基因为wzy),M39、SK16(阻断基因为wbpV),RC11-2(阻断基因为BN889_05221),SK98(阻断基因为ssg)及回复株的敏感性实验。结果如表2 所示,噬菌体K4、K5、O4 在除RC11-2 突变株外,均无透明区域形成,K8、C11 在10 株突变株上均能形成透明区域;上述噬菌体在10 株突变株的互补株上均出现透明区域。上述基因均为生物合成O-specific antigen(OSA)的相关基因,因此本研究推测OSA 为噬菌体K4 的受体。

表2 噬菌体K4 的宿主范围分析Table 2 Host range of phage K4
2.3 基因组末端的确定
通过Illumina Hiseq2500 对噬菌体K4 进行测序,测序结果显示组装基因组大小为50284 bp。将测序结果在NCBI 中进行BlastN 比对,噬菌体K4与噬菌体O4 有96%同源性,且均为铜绿假单胞菌噬菌体。噬菌体O4 为线性双链DNA,推测噬菌体K4 也为线状。噬菌体O4 基因组末端存在74 bp 的正向末端重复序列,比对分析发现,噬菌体K4 基因组序列的6436~6509 bp 与噬菌体O4 的末端74 bp的重复序列具有100%同源性,推测其可能为噬菌体K4 的正向末端重复序列。为了验证噬菌体K4重组基因组结果的正确性,本研究提取噬菌体K4 基因组,进行补平连接和扩增,测序后发现发现扩增产物中有两个74 bp 的相同序列,为该基因组的真实末端序列。本文将噬菌体K4 基因组结构进行重新调整,在基因组3'端加上一个74 bp 的拷贝,修订后的噬菌体K4 实际基因组大小为50358 bp。
2.4 基因组功能注释
噬菌体K4 基因组分别通过RAST Server、CGview Server 在线软件和NCBI 蛋白数据库进行比对分析,选取最优匹配结果作为注释信息。外环表正义链和负义链上的基因,次外环表示为GC Skew,计算公式为(G-C)/(G+C),绿色代表(G-C)/(G+C)>0,紫色代表(G-C)/(G+C)<0,内环表示基因组G+C 含量的分布。噬菌体K4 基因组的GC 含量为44.61%,与其他假单胞菌噬菌体相近,其中K8 基因组[11]和K5 基因组[14]的GC 含量为49.35%,O4 基因组[13]的GC 含量为44.55%,而PAK 菌株的GC 含量为66.25%(图2)。K4 基因组长度为50358 bp,编码46 个假定蛋白、31 个具有假定功能的蛋白以及1 个tRNA-Arg 基因。噬菌体K4 基因组中蛋白编码基因包含参与复制、转录、DNA 修复蛋白、磷代谢的蛋白以及假定蛋白;有22 个基因位于负义链上,56 个基因位于正义链上。除gp01、gp10、gp45基因仅存在于K4 噬菌体基因组外,其余基因均与其他噬菌体有不同程度的相似性(表3)。

图2 噬菌体K4 基因组序列的注释Fig.2 Annotation of the phage K4 genome
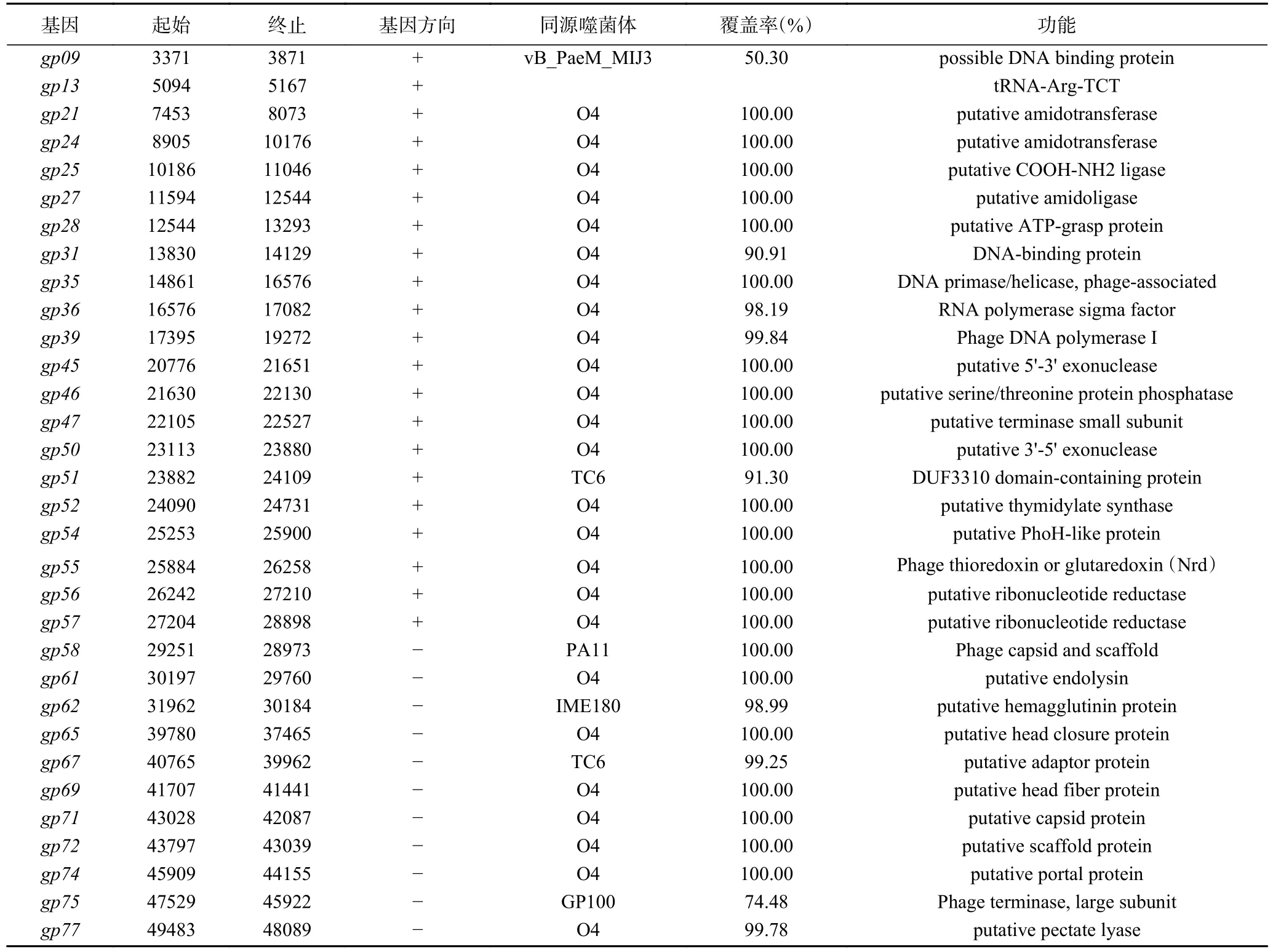
表3 噬菌体K4 基因组注释Table 3 Annotation of the phage K4 genome
噬菌体K4 基因组中gp51和gp46分别编码DNA的核酸外切酶,此外噬菌体还携带编码DNA 和RNA聚合酶、DNA 结合蛋白等基因,在噬菌体复制及裂解宿主菌发挥作用。在K4 基因组中,gp01、gp10和gp45等基因编码的蛋白为假定蛋白,在数据库中没有发现同源蛋白,其功能有待于进一步研究。噬菌体K4 编码末端酶大亚基具有核酸内切酶活性和拓扑酶活性,在没有小亚基的存在的情况下完成噬菌体基因组的包装[35]。
2.5 比较基因组学分析与分类
利用BLASTN 软件,在NCBI 的GENBANK数据库进行比对分析,获得8 个噬菌体基因组序列,与噬菌体K4 基因组序列具有较高的同源性。噬菌体K4 与噬菌体O4(NC_031274.1)、IME180(MF788 075.1)、TC6(MG676466.1)、PA11(NC_007808.1)、BUCT566(MW748993.1)、MD8(KX198612.1)、LKA5(KC900378.1)和F116(NC-006552.1)的同源性分别为99.53%、98.18%、95.2%、95.08%、71.84%、95.56%、86.27%、86.27%,与之相应的覆盖率分别为96%、94%、85%、82%、1%、0%、0%和0%。分析显示,噬菌体K4 与噬菌体O4、IME180、TC6、PA11的同源性较高,而与噬菌体LKA5、F116、BUCT566、MD8 覆盖率极低,几乎没有同源性。
如图3,将这些基因组序列导入线上分析软件Circoletto,进一步分析噬菌体K4 和8 株噬菌体基因组的同源性。圆环内为使用circletto 软件将比对的序列不同的色带表示blast 生成的数据局部对齐。颜色根据bitscore 的宽度和对齐长度划分,相似度不同即丝带的颜色不同,丝带颜色表示为最大的命中值,即蓝色≤25%,绿色≤50%,黄色≤75%,红色>75%。

图3 噬菌体比较基因组学分析Fig.3 Comparative genomic analysis of phage
进一步通过CoreGenes5.0 在线软件分析发现,噬菌体K4 与噬菌体O4(NC_031274.1)、IME180(MF788075.1)、TC6(MG676466.1)、PA11(NC_007808.1)、共享核心基因的比例分别为85.9%、87.1%、70.5%、70.5%,超过了40%的标准,属于同一属的病毒。根据国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)(https://talk.ictvonline.org/)发布的病毒分类清单(ICTV 2020 Master Species List,MSL36)显示,PA11 属于Zobellviridae 科Paundecimvirus属,因此噬菌体K4 可能是该属的新成员[26-27,36-37]。
2.6 噬菌体K4 的抑菌活性
在MOI 约为10-5时,噬菌体K4 一步生长曲线的结果显示,噬菌体K4 的潜伏期约为15 min,13~28 min 噬菌体滴度急剧增加,此时为噬菌体的爆发期,爆发期后的10 min 内噬菌体数量几乎无变化,即此时间段为噬菌体进入稳定期。根据释放量公式:释放量=平台期噬菌体平均滴度/潜伏期噬菌体平均滴度,即此噬菌体释放量约为95.2 PFU/Infection Center,一个感染周期约为35 min(图4A)。
不同MOI 的噬菌体K4 与宿主菌铜绿假单胞菌PAK 混合培养,测定噬菌体K4 作用于PAK 的抑菌曲线。结果表明,随着加入的噬菌体效价的增加,宿主菌铜绿假单胞菌生长趋势明显下降,当MOI=10 和MOI=1 时,宿主菌几乎不生长;当MOI=0.00001和0.0001 时,宿主菌0~2 h 生长趋势与对照组几乎一致,2~3 h 之间菌液生长趋势迅速下降且在3 h 后宿主菌PAK 不继续生长(图4B)。实验结果表明,噬菌体K4 能显著抑制铜绿假单胞菌PAK 的生长,噬菌体应用在食品中控制致病菌将成为一个热点和趋势[38]。
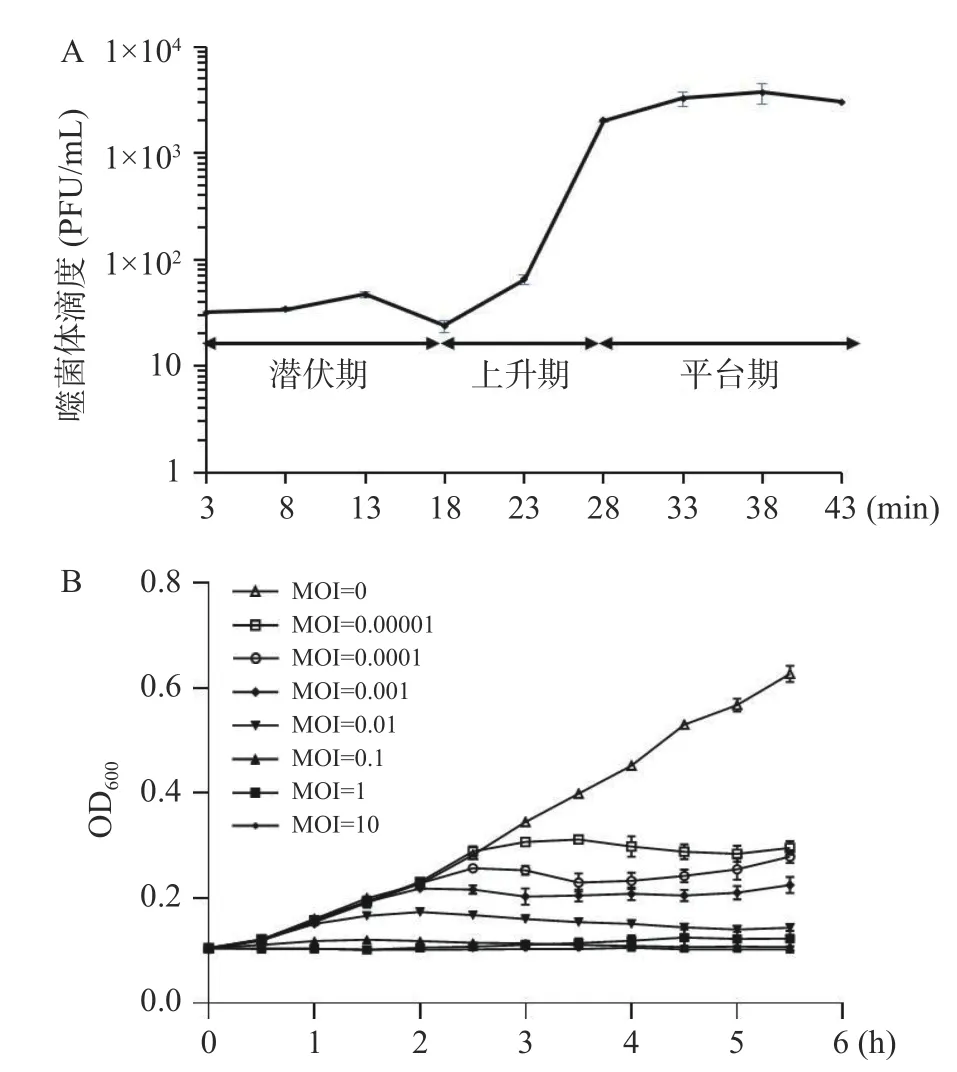
图4 噬菌体K4 生物学特性Fig.4 Biological characteristics of phage K4
2.7 噬菌体K4 控制牛奶中细菌的生长
Donovan 等将噬菌体phi11 应用到牛奶中的实验表明该噬菌可有效控制牛奶中的致病菌[39]。本研究在牛奶中加入铜绿假单胞菌,分析噬菌体K4 的杀菌效果。在4 ℃条件下,对照组中的细菌浓度为1.31×108CFU/mL,实验组细菌浓度分别为8.08×106CFU/mL(MOI=1)和1.26×108CFU/mL(MOI=10),杀菌效率分别为93.73%和99.02%,杀菌效果显著。在抑制细菌增长的同时,噬菌体由2.20×107PFU/mL分别增长到1.59×109PFU/mL(MOI=1)和4.95×108PFU/mL(MOI=10),分别增长了约71 和22 倍。25 ℃条件下,对照组的细菌浓度为6.79×108CFU/mL,实验组细菌浓度分别为1.41×108CFU/mL(MOI=1)和7.90×106CFU/mL,杀菌效率分别为79.29%和98.84%。与此同时,噬菌体浓度由1.47×107PFU/mL 分别增长到2.20×109PFU/mL(MOI=1)和2.09×109PFU/mL(MOI=10),噬菌体分别增长了约149 和142 倍(图5)。结果显示,在牛奶中,噬菌体K4 可以有效抑制铜绿假单胞菌的生长。
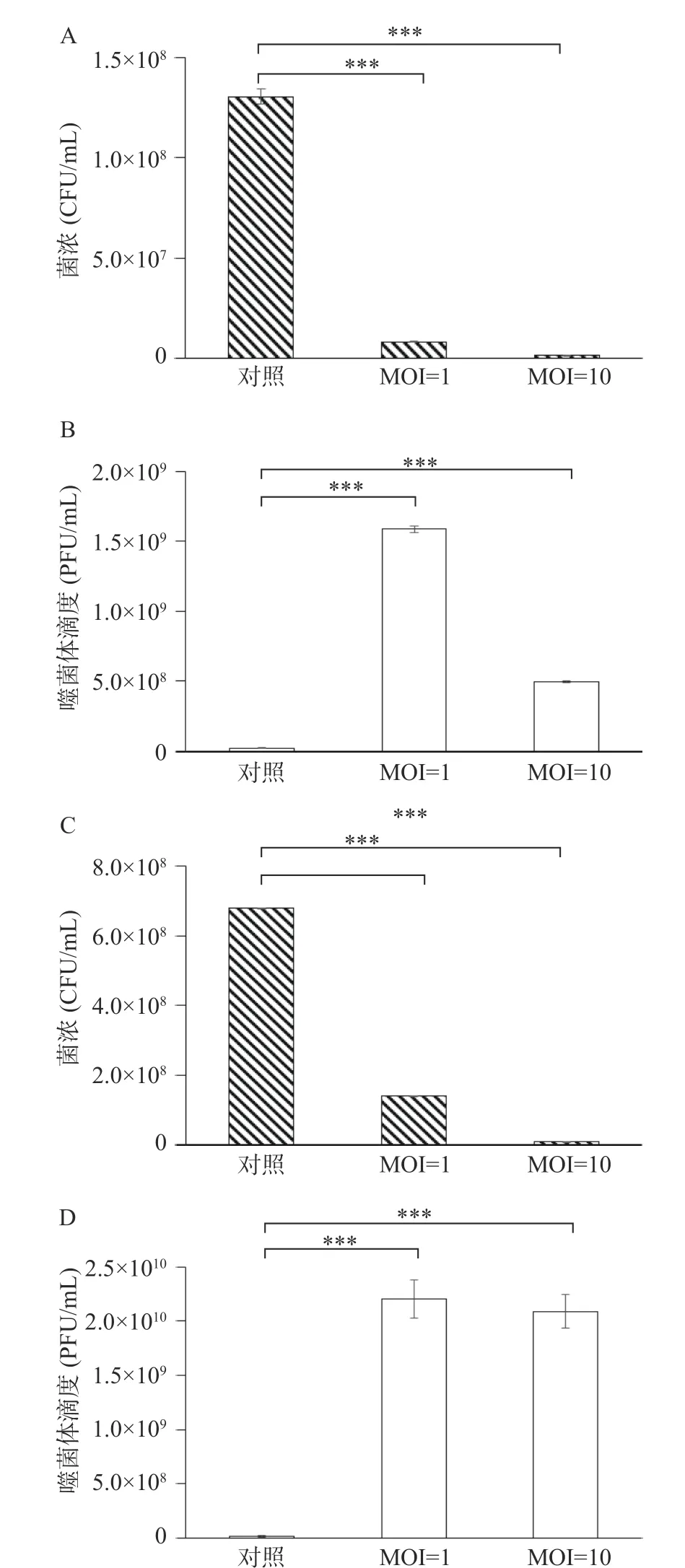
图5 在4 和25 °C 条件下不同MOI 的噬菌体在牛奶中的细菌浓度和噬菌体滴度Fig.5 Colony forming unit and titer of phage with different MOI in milk at 4 and 25 °C
2.8 噬菌体K4 控制午餐肉中细菌的生长
在午餐切片上涂布铜绿假单胞菌细胞,分析噬菌体K4 的杀菌效果,在4 ℃条件下,对照组的细菌浓度为9.30×104CFU/mL。MOI=10 时,细菌的浓度为3.40×103CFU/mL 杀菌效率为96.34%,噬菌体由3.30×104PFU/mL 增长到1.44×105PFU/mL,噬菌体增长了约3 倍;当MOI=1 时,细菌的浓度为1.09×104CFU/mL,杀菌效率为88.28%,噬菌体由3.30×104PFU/mL 增长到2.26×105PFU/mL,增长了约6 倍。在25 ℃条件下,在MOI 分别为1 和10时,噬菌体的杀菌效率分别为94.89%和99.15%,均能超过90%,杀菌效果显著,噬菌体分别增长了约33 和78 倍(图6)。数据显示,在不同条件下,噬菌体K4 可以有效抑制铜绿假单胞菌在午餐肉表面的生长[38,40]。
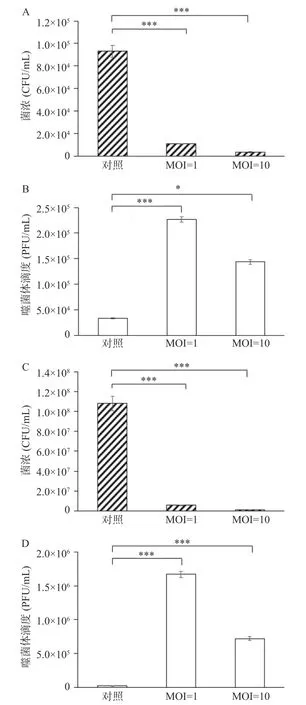
图6 在4 和25 °C 条件下不同MOI 的噬菌体在午餐肉中的细菌浓度和噬菌体滴度Fig.6 Colony forming unit and titer of phage with different MOI in Luncheon meat at 4 and 25 °C
3 结论
一步生长曲线结果显示,该噬菌体具有潜伏期较短、释放量大的特点,具有较高的感染性。另一方面,噬菌体K4 在抑菌曲线等实验中,显示了较强的杀菌活性。其基因组不携带重组酶、抗性及毒力因子等编码基因,具有安全性,能够有效地控制牛奶和午餐肉等食品中铜绿假单胞菌的生长。因此,噬菌体K4 可以用于食品等行业控制铜绿假单胞菌的污染。

