真菌Simplicillium lanosoniveum DT06 对雨生红球藻生长与脂类合成的影响
燕 然, 邢向英, 董庆霖, 于仙永, 史康丽
(河北工业大学 化工学院 代谢工程实验室, 天津 300130)
0 引言
微藻是脂类和其他生物活性分子 (如蛋白质、多糖、多不饱和脂肪酸、色素等)的重要来源,可作为生产生物柴油和高附加值产品的原料[1]。但是,微藻生物柴油的生产成本较高,无法实现可持续的商业化生产[2]。 解决此问题的策略有两个:将藻类与真菌或细菌混合培养,利用微生物与藻类之间的协同作用,促进藻类生长与脂类合成,以此直接降低生物柴油的生产成本[3];用微藻生产生物柴油的同时生产高附加值的产品,从而间接降低生产成本[4]。
雨生红球藻(Haematococcus pluvialis)是一种能够合成脂类和高附加值的虾青素的单细胞绿藻,是生产生物柴油的优良藻种[5]。 虽然雨生红球藻能够合成高附加值的虾青素并且脂类含量较高,但其生长速率慢,生物量低,进而导致脂类产量低。 这是因为雨生红球藻是弱势藻类,容易受到有害细菌和真菌的感染,从而使其生长受到抑制[6]。 实际上,在开放式大规模培养藻类过程中,无菌培养是不可能实现的,有害微生物的污染是任何藻类大规模生产生物柴油的主要障碍。 因此,如何减缓或消除有害细菌或真菌的感染是促进雨生红球藻等藻类细胞生长和脂类合成的关键。
在此前的研究中,我们从蓝藻Chroococus sp.的培养液中分离得到一株共生真菌Simplicillium lanosoniveum DT06(记为DT06)[7]。DT06 能够合成一种抑制革兰氏阴性细菌和部分真菌的新抗生素,并且在无菌条件下能够促进模式绿藻-衣藻的生长和脂类合成[8],[9]。 在工业生产中,雨生红球藻无法做到无菌培养, 为模拟雨生红球藻的实际生产过程, 本研究将雨生红球藻进行不灭菌的开放式培养,以此研究DT06 与雨生红球藻混合培养对雨生红球藻生长以及脂类和虾青素合成的影响。
1 实验方法
1.1 藻种和菌种
实验所用雨生红球藻购于中科院武汉水生生物研究所,保存于4 ℃液体BBM 培养基中[5]。BBM液体培养基的配方:NaNO3250 mg/L,MgSO4·7H2O 75 mg/L,NaCl 25 mg/L,Na2MoO41.79 mg/L,KOH 31 mg/L,FeSO4·7H2O 4.98 mg/L,MnCl2·4H2O 1.44 mg/L,CuSO4·5H2O 1.57 mg/L,EDTA·Na2(乙二胺四乙酸二钠)50 mg/L,H3BO311.4 mg/L,K2HPO4·3H2O 75 mg/L,KH2PO4175 mg/L,CaCl2·2H2O 25 m g/L,ZnSO4·7H2O 8.82 mg/L。
DT06 从蓝藻Chroococus sp. 的培养液中分离,并保存于中国科学院微生物研究所菌物标本馆(编号HMAS 242045)[7]。
1.2 仪器与设备
GXZ-300D 型光照培养箱、LRH-150S 型恒温恒湿培养箱、HZQ-QG 型全温振荡器、723N 型可见分光光度计、XSZ-H 型光学显微镜、YX280型加压灭菌锅、LG16-B 型台式高速离心机、DH-101-0S 型电热恒温鼓风干燥箱、GC-AGILENT 7890B 型气相色谱仪。
1.3 雨生红球藻接种液及DT06 孢子悬浮液的制备
雨生红球藻接种液的制备: 将5 mL 活化的雨生红球藻细胞接种到含有100 mL BBM 培养基的250 mL 锥形瓶中, 置于光照摇床[温度为25℃,转速为110 r/min,光照强度为60 μmol/(m2·s)]中培养,培养到稳定期后,离心(9 000 r/min,10 min)收集细胞,用BBM 培养基洗涤两次,制备雨生红球藻接种液(细胞浓度为2.5×105个/mL)。
DT06 孢子悬浮液的制备:将DT06 划线接种于PDA 琼脂培养基(马铃薯200 g/L,无水葡萄糖20 g/L,琼脂20 g/L)上,在28 ℃下培养7 d 后,用20 mL 无菌水从琼脂平板上采收真菌孢子, 制备孢子悬浮液(孢子浓度为1.25×107个/mL)。
1.4 雨生红球藻单独培养及混合培养
雨生红球藻灭菌单独培养(AH):在装有100 mL 灭菌的BBM 培养基的250 mL 锥形瓶中接种体积分数为10%的雨生红球藻接种液。
雨生红球藻不灭菌单独培养(NH):除培养基不灭菌外,培养方法与AH 相同。
雨生红球藻-DT06 不灭菌混合培养(NM):在含有100 mL 不灭菌的BBM 培养基的250 mL 锥形瓶中加入体积分数为10%的雨生红球藻接种液和DT06 孢子悬浮液的混合液 (雨生红球藻与DT06 的细胞比为50∶1)。
上述接种后的锥形瓶均置于光照摇床[温度为25 ℃,转速为110 r/min,光照强度为60 μmol/(m2·s)]中培养。
1.5 参数测定
1.5.1 生物量及生长动力学
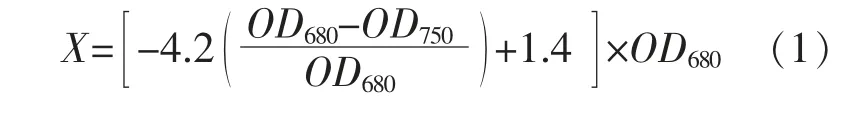
雨生红球藻生物量X 的计算式为式中:OD680和OD750分别为雨生红球藻藻液在680 nm 和750 nm 处的吸光度。
雨生红球藻的生长速率rg和比生长速率μ的计算式分别为

式中:tn和t0分别为实验结束与实验开始的时间,d;Xn与X0分别为tn与t0时刻雨生红球藻的生物量,g/L。
1.5.2 硝态氮浓度
配制浓度分别为0.2,0.5,1,3,5,7 mmol/L 的硝态氮标准溶液。分别取上述标准溶液0.1 mL,以无氮BBM 培养基作空白, 再分别加入0.4 mL 质量分数为5%的水杨酸-浓硫酸溶液,摇匀,室温放置25 min 显色,然后分别加入9.5 mL 质量分数为8%的NaOH 溶液,混匀,冷却至室温,用分光光度计在410 nm 处测其吸光值。 以硝态氮浓度为横坐标(x),吸光度(OD410)为纵坐标(y),绘制硝态氮浓度标准曲线 (拟合方程为y=0.084 89 x+0.008 73,R2=0.999)。
取0.1 mL 雨生红球藻培养液于试管中,重复上述操作,测定其在410 nm 处的吸光值,根据标准曲线计算雨生红球藻培养液中的硝态氮浓度。
1.5.3 pH
用pH 计测定培养液的pH 值。
1.5.4 脂类产量及脂类合成动力学
称取0.05 g 干燥的雨生红球藻细胞与5 mL氯仿/甲醇(体积比为2∶1)溶液混合,然后在磁力搅拌器上以2 000 r/min 的转速搅拌20 min。 上述步骤重复2 次,收集氯仿层,在60 ℃下蒸发至干燥,在分析天平上称重,得到总脂质的质量GL。 雨生红球藻脂类含量G 的计算式为

1.5.5 脂肪酸组成
采用萃取-酯交换法制备脂肪酸甲酯(FAME),取烘干后的总脂与6 mL 甲醇、浓硫酸与氯仿的混合溶液(体积比为2.55∶0.45∶3)混合,90 ℃下水浴90 min 进行脂交换反应。 反应完成后, 收集含有FAME 的氯仿层。 采用GC-Agilent 7890B 型气相色谱仪和Agilent INNOWAX 毛细管柱(30 m×0.32 mm×0.5 μm) 分析雨生红球藻的脂肪酸组成。 将初始柱温设为80 ℃并保持2 min,然后以12℃/min 的升温速率升温至140 ℃, 再以20 ℃/min的升温速率升温至240 ℃,保持20 min。进样器和检测器的温度分别为250 ℃和280 ℃。 以C17∶0为内标,将峰面积与FAME 混合标准品(C8~C22)的峰面积进行比较,对样品中的FAME 进行定性和定量。
1.5.6 虾青素产量
虾青素产量的测定参照文献[5]。
2 结果与分析
2.1 细胞生长
2.1.1 生物量
不同培养条件下, 雨生红球藻的生物量随培养时间的变化情况如图1 所示。

图1 雨生红球藻生长曲线Fig.1 The growth curves of H. pluvialis
由图1 可知:在最初2 d(延滞期),AH 的雨生红球藻生物量缓慢增长,2 d 后开始显著上升,并于第8 天后稳定在1.57 g/L(稳定期);NH 的雨生红球藻生物量的变化与AH 相似,但低于AH,在实验结束时达到1.12 g/L,较AH 低29%;在第2~10 天,NM 的雨生红球藻生物量增长显著,并在第12 天达到最高,为2.45 g/L,较AH 和NH 的雨生红球藻生物量分别提高了56%和119%。 这表明, 与AH 相比,NM 可以促进雨生红球藻生长,而NH 则抑制其生长。
2.1.2 生长动力学参数
雨生红球藻的生长动力学分析结果见表1。

表1 雨生红球藻的生长动力学参数Table 1 The growth kinetic parameters of H. pluvialis
由表1 可知,NM 的雨生红球藻平均生长速率[194.2 mg/(L·d)]和平均比生长速率(0.25 d-1)均最高,比AH 的雨生红球藻平均生长速率[120.8 mg/(L·d)]和平均比生长速率(0.21 d-1)分别提高了60.8%和19%, 比NH 的雨生红球藻平均生长速率[83.3 mg/(L·d)]和平均比生长速率(0.19 d-1)分别提高了133.1%和31.6%。
在NM 中, 雨生红球藻生物量的提高是由于藻细胞的生长得到了促进, 细胞平均生长速率和平均比生长速率的提高可以证明这一点。DT06 促进雨生红球藻细胞生长的原因有以下两个方面:
①DT06 可以通过合成抗生素抑制甚至消除有害微生物(细菌和真菌)。 由于NM 和NH 均为不灭菌培养, 而NH 的雨生红球藻生物量比AH的雨生红球藻生物量低, 说明有害微生物会对雨生红球藻的生长产生抑制; 而NM 的雨生红球藻生物量高于AH 的雨生红球藻生物量, 表明NM对有害微生物有抑制甚至消除作用;
②DT06 与雨生红球藻在代谢方面存在协同效应。 雨生红球藻在光合自养条件下的生长仅靠光合作用吸收CO2并释放O2, 而自养条件下CO2的不足和O2的积累都限制了雨生红球藻的生长;而NM 条件下的DT06 代谢会吸收O2并释放CO2, 从而促进雨生红球藻在NM 条件下生长,这与其他微藻-微生物混合培养的机理类似[10]。
2.2 培养液的硝态氮浓度
在不同培养条件下, 培养液中硝态氮浓度的变化如图2 所示。从图2 可以看出:在不同培养条件下,培养液的硝态氮浓度的变化趋势相似;在培养的前2 d,AH 和NH 的培养液硝态氮浓度急剧下降, 从250 mg/L 分别下降到了73.43 mg/L 和106.43 mg/L, 从第2 天到培养结束时,AH 和NH的培养液硝态氮浓度分别缓慢下降到了11.34 mg/L 和18.53 mg/L;在培养至第2 天时,NM 的培养液硝态氮浓度急剧下降至40.56 mg/L, 第8 天时硝态氮已检测不到。 NM 的培养液硝态氮浓度下降速率较AH 和NH 快, 说明NM 加快了雨生红球藻对硝态氮的吸收和利用。
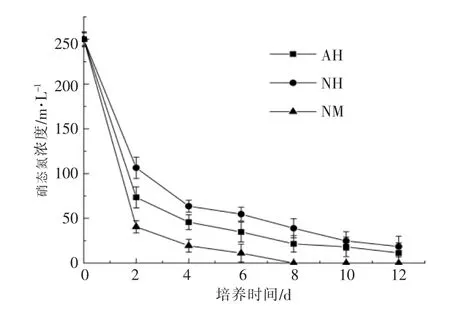
图2 不同培养条件下硝态氮浓度的变化Fig.2 Variation of nitrate nitrogen concentration in different cultures
2.3 培养液pH 值
在不同培养条件下, 雨生红球藻培养液pH值的变化如图3 所示。
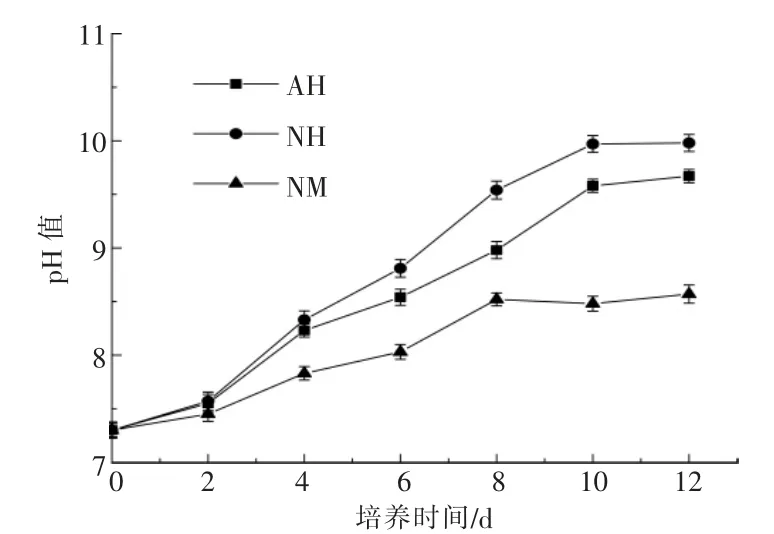
图3 不同培养条件下pH 值的变化Fig.3 Fluctuation of pH in different cultures
从图3 可以看出: 随着实验的进行,AH 和NH 的培养液pH 值持续升高,实验结束时分别达到9.67 和9.98;相比之下,NM 的培养液pH 值变化相对缓慢,在第8 天后缓慢上升至8.52,然后保持在8.48~8.57。 上述结果表明,DT06 的代谢稳定了NM 的培养液pH 值。 AH 和NH 的培养液pH值快速升高,抑制了雨生红球藻细胞的生长,这主要是由于雨生红球藻会吸收生理碱性盐,如NaNO3,并分泌NH4+[11]。 在NM 中,DT06 会释放CO2和吸收NH4+,降低并稳定培养液的pH 值,从而有利于雨生红球藻的生长。 值得注意的是,DT06 在吸收NH4+后, 可能会分泌有机氮以促进雨生红球藻的生长。
2.4 脂类合成
2.4.1 脂类产量与脂类含量
在不同培养条件下培养12 d 后,雨生红球藻的脂类产量与脂类含量如图4 所示。 从图4 可以看出,NM 的雨生红球藻脂类产量(0.837 g/L)和脂类含量(341.8 mg/g)均最高,比AH 的雨生红球藻脂类产量(0.394 g/L)和脂类含量(251.4 mg/g)分别提高了112.4%和36%,比NH 的雨生红球藻脂类产量(0.221 g/L)和脂类含量(197.5 mg/g)分别提高了279%和73%。
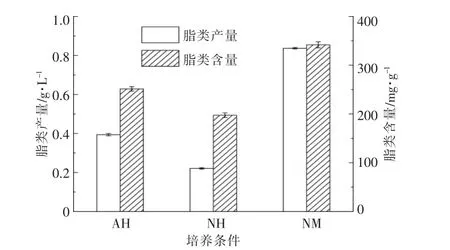
图4 不同培养条件下的脂类产量和脂类含量Fig.4 The lipid production and lipid content in different cultures
2.4.2 脂类合成动力学
雨生红球藻的脂类合成动力学分析结果如表2 所示。 由表2 可知,NM 的雨生红球藻平均脂类合成速率和平均脂类比合成速率均最高, 分别为69.75 mg/(L·d)和28.47 mg/(g·d),比AH 的雨生红球藻平均脂类合成速率[32.83 mg/(L·d)]和平均脂类比合成速率[20.91 mg/(g·d)] 分别提高了112.5%和36.15%,比NH 的雨生红球藻平均脂类合成速率[18.42 mg/(L·d)]和平均脂类比合成速率[14.45 mg/(g·d)]分别提高了278.66%和97%。
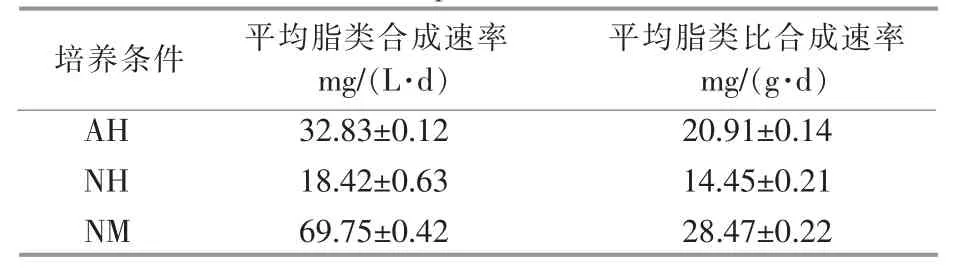
表2 雨生红球藻的脂类合成动力学参数Table 2 The lipid synthesis kinetic parameters of H. pluvialis
NM 的雨生红球藻脂类产量提高的原因主要有: 雨生红球藻生物量的提高为脂类合成奠定了细胞基础;雨生红球藻脂类含量、平均脂类合成速率和平均脂类比合成速率的提高。 后者提高的原因可能是:硝态氮的快速消耗导致氮饥饿,氮饥饿能够使碳通量流向脂类合成的方向[9];DT06 产生的CO2提高了CO2浓度,CO2浓度的提高有利于脂质的合成[12]。
2.5 虾青素产量与虾青素含量
为了研究雨生红球藻中虾青素含量的变化,本研究测定了不同培养条件下的虾青素产量和虾青素含量,结果如图5 所示。

图5 不同培养条件下的虾青素产量和虾青素含量Fig.5 The astaxanthin production and astaxanthin content in different cultures
结合图4,5 可以看出,在不同培养条件下,雨生红球藻的虾青素产量和虾青素含量与脂类产量和脂类含量的变化相一致。 NM 的雨生红球藻的虾青素产量和虾青素含量均最高, 分别为88.84 mg/L 和36.26 mg/g,AH 的雨生红球藻的虾青素产量和虾青素含量分别为51.04 mg/L 和32.51 mg/g,NH 的雨生红球藻的虾青素产量和虾青素含量分别为32.31 mg/L 和28.85 mg/g;NM 的雨生红球藻的虾青素产量和虾青素含量分别比AH 的雨生红球藻提高了74%和11.53%,比NH 的雨生红球藻提高了175%和25.68%。 NM 的雨生红球藻的虾青素产量提高的原因与脂类产量提高的原因相似甚至相同,这是由于虾青素是脂溶性色素,分散在雨生红球藻细胞的脂滴中[13]。因此,虾青素和脂类的合成密切相关,有利于脂类合成的条件,同样有利于虾青素合成[14]。
2.6 脂肪酸组成
不同培养条件下, 雨生红球藻油脂的主要脂肪酸组成见表3。 由表3 可以看出,雨生红球藻在不同培养条件下产生的脂肪酸分布在C14~C22范围内,主要为C16~C18,适合生产生物柴油。AH和NH 的雨生红球藻中,C16~C18 脂肪酸的含量分别为82.6%和80.71%, 而NM 的雨生红球藻中,C16~C18 脂肪酸的含量可达到83.19%, 高于AH 和NH 的雨生红球藻。 油酸(C18∶1)是衡量生物柴油质量的关键指标,其占NM 的雨生红球藻总脂肪酸的21.69%, 分别比AH 的雨生红球藻(19.95%)和NH 的雨生红球藻(17.59%)提高了8.72%和23.3%。 NM 的雨生红球藻细胞中饱和脂肪酸(SFA)含量为36.12%,比AH 的雨生红球藻(34.62%)和NH 的雨生红球藻(33.59%)分别提高了4.3%和7.5%。 C16~C18 脂肪酸 (特别是油酸) 在NM 的雨生红球藻中富集的原因可能是,DT06 释放的CO2提高了培养液的CO2浓度,从而影响了雨生红球藻细胞中脂肪酸的组成[15]。 DT06的加入促进了雨生红球藻油酸的积累, 对于生物柴油质量和产量的提高均有重要意义。
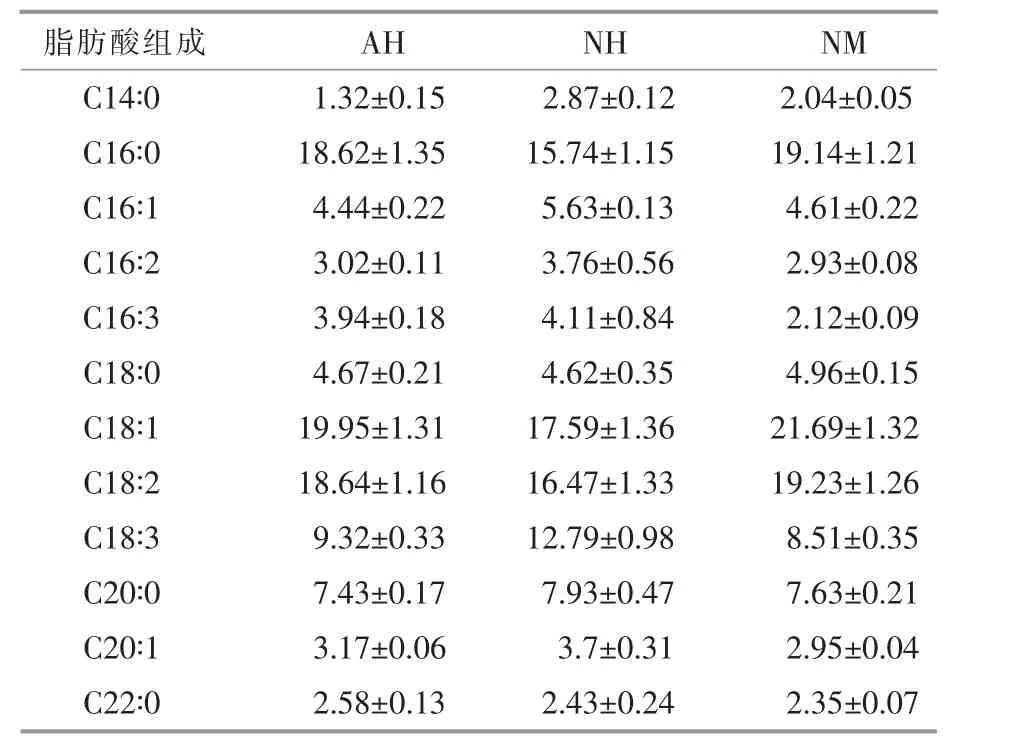
表3 不同培养条件下雨生红球藻的脂肪酸组成Table 3 The fatty acid composition of H. pluvialis in different cultures %
3 结论
本研究将雨生红球藻与DT06 在不灭菌条件下混合培养(NM),发现DT06 能够促进雨生红球藻脂类和虾青素合成。 与雨生红球藻灭菌单独培养(AH)和不灭菌单独培养(NH)相比,NM 的雨生红球藻生物量分别提高了56%和119%, 油脂含量分别提高了112.4%和279%, 虾青素含量分别提高了74%和175%。 在NM 过程中,DT06 能够稳定培养液的pH 值,促进氮代谢,提高雨生红球藻的生长速率和油脂合成速率。 NM 的雨生红球藻的C16~C18 脂肪酸含量可达到83.19%, 适合生物柴油生产。 因此,DT06 与雨生红球藻混合培养为生物燃料和高附加值产品的联合生产提供了一条有效途径。

