干细胞治疗在角膜重建中的研究进展
王力 综述 欧阳宏 审校
(中山大学中山眼科中心,眼科学国家重点实验室,广东省眼科视觉科学重点实验室,广州 510060)
2019年世界卫生组织发布的《世界视觉报告》指出,全球至少22亿的视力损伤患者中与角膜有关的未矫正屈光不正约有1.27亿,角膜浑浊约有420万[1]。角膜是位于眼球最前端的透明圆顶形结构,作为前屏障,角膜保护其他所有眼球结构,使其免受外部损伤。角膜也是透光和分光的结构基础,光线的透射和折射在很大程度上依赖于角膜的透明度和曲率[2],因此角膜也是视觉形成的关键组织。
干细胞治疗属于再生医学范畴,其应用于临床实践的首要目标是利用干细胞重建功能性组织。随着精准医疗概念的提出和发展,干细胞治疗也进入了新的精细阶段,针对角膜各组分的干细胞重建取得了进展。
1 角膜上皮层的干细胞重建
角膜上皮重建是干细胞治疗的主战场,角膜上皮维持着角膜的无血管和相对脱水状态,使角膜透明和完整而保持清晰的视力。角膜上皮的生理来源是角膜缘干细胞(limbal stem cells,LSCs),LSC属成体干细胞,通过连续不对称地分裂、分化,并向角膜中心迁移,以补充脱落的角膜上皮细胞[3]。
2 角膜缘干细胞标志物
体内LSCs始终处于持续分化阶段,因此很难有明确的干细胞标志物。Pellegrini等[4]在2001年确定了核蛋白p63可以作为角膜缘干细胞标志物。近年的研究陆续发现了一些潜在的候选标志物,包括ABCB5[5]、ABCG2[6]等。受益于单细胞测序技术的发展,对角膜缘组织的单细胞测序研究也挖掘了一系列的角膜缘干细胞的可能标志物,如TSPAN7和SOX17等,并借助免疫组织荧光方法在空间分布上得到了验证[7]。虽然这些标志物有助于区分不同的干细胞,但对区分不同分化状态角膜缘前体细胞和过渡扩充细胞(transit-amplifying cell,TACs)的帮助仍属有限。
3 干细胞移植治疗角膜缘干细胞缺乏症的不同方式
角膜缘干细胞缺乏症(limbal stem cell deficiency,LSCD)指角膜缘干细胞的缺失或功能障碍,表现为角膜新生血管和结膜化,可通过对眼表细胞进行转移、印迹和免疫染色,即印迹细胞学(impression cytology)验证[8]。LSCD的临床症状包括慢性眼表不适、视力下降、畏光等,病因可分为2类:外在原因,如化学烧伤、放射线和感染等;内在原因,如Stevens-Johnson综合征(Stevens-Johnson syndrome,SJS)、无虹膜、单纯疱疹性角膜炎和慢性角膜缘炎等。对于角膜中心部分相对透明的部分LSCD,应选择保守措施进行治疗[9],而对于较严重或完全的LSCD病例,通过移植手术补充角膜缘干细胞则被考虑为主要的治疗方法。传统的LSCD移植治疗方法主要包括结膜角膜缘自体移植(conjunctival limbal autograft,CLAU)、角膜缘异体移植(limbal allograft,LAL)以及人工角膜移植。
3.1 结膜角膜缘自体移植
CLAU技术直接应用另一只健眼的结膜角膜缘组织进行自体移植,以治疗单侧全眼LSCD患者。作为LSCD的治疗技术之一,CLAU早在1989年就由Kenyon等[10]首次应用。CLAU可提供适量的LSCs用于角膜表面修复,且无免疫排斥风险,长期成功率可达到82%[11]。尽管成功率相对较高,但在进行CLAU手术前应考虑到对健康眼球的风险。对于没有或少有自体移植的双侧LSCD患者,可采用LAL作为角膜表面重建的替代方法[12]。LAL的角膜组织来源可以来自亲属或尸体角膜缘组织,供体来源非常有限,还需使用全身性免疫抑制剂防止免疫排斥,会引起贫血、肌酐升高、高血糖等不良反应[13],移植成功率也较自体移植低[14-15]。双侧LSCD患者在免疫抑制剂不适用的情况下,可以选择I型波士顿角膜移植治疗,但易引发严重并发症[16]。尽管如此,随着材料科学的发展以及3D打印技术的成熟,人工角膜的应用将成为未来的发展方向[17]。
3.2 角膜上皮移植术
再生医学(利用干细胞产生生物代用品并改善组织功能)已成为近30年来最有希望的LSCD治疗策略[18]。1997年,Pellegrini等[19]首次将培养的角膜上皮移植(cultivated limbal epithelial transplantation,CLET)应用于眼科疾病,在研究中将自体人角膜上皮与小鼠成纤维细胞饲养层共培养后移植到2例单侧LSCD患者,这两例角膜缘上皮完全丧失患者的角膜表面得到修复,视力均获得明显提升,术后2年的随访结果显示两位患者的临床指征均正常。2010年,Kolli等[20]建立了一种以人羊膜(human amniotic membrane,hAM)为基质促进细胞扩增的方法。该方法采用无饲养层培养条件,不含动物产品,成功治疗了8例患者。同时Mariappan等[21]也发表了人角膜缘上皮细胞体外扩增的标准方案,也是以hAM为培养基质的无饲养层技术。CLET是所有报道的干细胞疗法中最成熟的技术,欧洲医药署(European Medicine Agency,EMA)已于2015年批准CLET作为角膜烧伤的合法治疗方法(Holoclar;Holostem Terapie Avanzate,意大利摩德纳)。根据最近的统计结果,自体CLET的眼表重建率中位数可达到74.1%,视力恢复率为54.5%,免疫排斥反应发生率为0%,感染性角膜炎发生率为4.6%,眼压/青光眼发生率为6.3%[22]。
CLET技术的一般过程是,首先从供体眼中收获健康的LSCs,然后将收获的LSCs进行体外培养和扩增。当体外细胞达到移植量时,将同时以羊膜或其他基质为载体支持CLET移植,该技术已被广泛应用于各类LSCD的治疗。与其他移植技术相比,CLET最重要的优点是它达到良好治疗效果所需的LSCs数量明显减少,还可以提高上皮化率,降低炎症风险。为了突破CLET来源的限制,自体和异体LSCs都在临床试验中得到了验证。因为自体组织不需要系统性免疫抑制,所以自体角膜缘干细胞被认为是CLET的最佳来源。尽管CLET的效果良好、优点明确,但步骤中确实存在安全问题和技术挑战,现行方案中涉及部分的动物和/或人源产品或组织,这对患者有一定风险。不安全的血清产品、毒性或传染性物质以及细胞培养过程中的污染都可能导致CLET的失败。此外,良好的生产实践(good manufacturing practice,GMP)也是CLET的要求,提高了该技术的门槛。
3.3 口腔黏膜上皮移植术
虽然CLET在LSCD治疗中表现良好,但为了克服依旧存在的LSCs来源短缺,近来有多项研究致力于寻找干细胞治疗的替代来源。利用口腔黏膜上皮细胞(口腔黏膜)培养的口腔黏膜上皮移植(cultivated oral mucosal epithelial transplantation,COMET)技术首先被开发为CLET的一个有希望的替代方案[23-24]。2004年,Nishida等[24]首次将培养的自体口腔黏膜细胞移植应用于4例双侧LSCD患者,4例患者的视力均有明显改善。但COMET的远期效果显示出弊端,所有患者移植后均出现角膜新生血管化,严重影响视力,研究中使用的失活小鼠成纤维细胞作为培养基质,也限制了COMET的使用[24]。
3.4 角膜上皮重建的其他细胞来源
除COMET外,越来越多的干细胞研究已经被用作探索CLET的新来源。在人类表皮细胞中,PAX6的过表达可将表皮细胞转分化为角膜上皮样细胞,并可用于修复兔角膜损伤模型中的角膜缘和角膜上皮[25]。此外,来自脂肪[26]或骨髓组织[27]的间充质干细胞,毛囊干细胞[28]、脐带干细胞[29]和牙髓干细胞[30]也被证明具备移植治疗LSCD的潜能。这些研究表明利用其他来源干细胞获得角膜组织细胞的可能性,拓展了角膜缘干细胞的替代来源,但疗效仍待验证,具体临床应用方式也亟待开发。
诱导型多能干细胞(induced pluri potent stem cells,iPSCs)技术具有无免疫排斥风险、伦理安全等优点,2016年Hayashi等[31]成功利用iPSCs作为LSCs移植的来源。在动物模型中,iPSCs可以成功分化为角膜上皮细胞,随后的移植可以有效地恢复视觉功能。2019年,日本大阪大学Kohji Nishida团队已经利用iPSCs分化的角膜上皮片层进行了1例LSCD的临床移植治疗试验,治疗前期视力有所改善,后续的治疗效果仍在观察中。iPSCs治疗的弊端也是不可忽视的,体内移植后存在一定的致癌风险,如开发为治疗的临床级产品需要经过严格的安全性验证。在下表总结了干细胞重建角膜上皮的主要方法及主要优缺点(表1)。
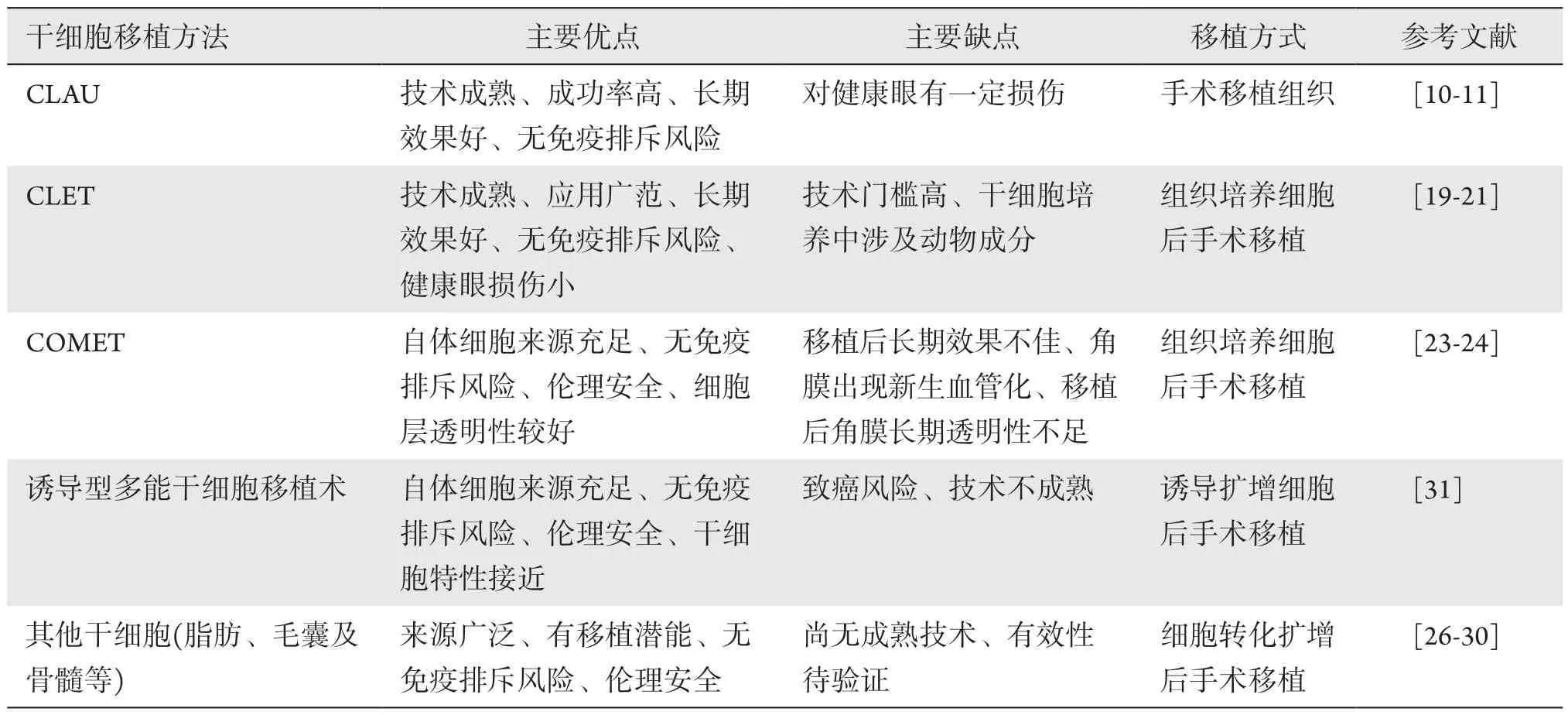
表1 干细胞移植重建角膜上皮方法优缺点Table 1 Advantages and disadvantages of stem cell transplantation for corneal epithelial reconstruction
4 角膜基质层的干细胞重建
角膜基质约占角膜厚度的90%,主要由I型和V型胶原纤维片层状排列组成[32-33],为角膜提供了结构支撑和抗拉强度、稳定性和透明等重要特性。角膜基质细胞位于角膜缘片层之间产生胶原蛋白和蛋白多糖,从而有助于角膜基质的稳定、细胞外基质的调节以及愈合过程[34-35]。在角膜损伤修复过程中,角膜基质细胞容易变性转化为成纤维细胞和肌成纤维细胞,且此过程不可逆转,通常会造成角膜的混浊。
角膜基质干细胞存在于角膜缘基质中,能通过基底膜与角膜缘干细胞有直接的细胞连接,为角膜缘干细胞提供支持维持其干细胞特性[36]。角膜缘基质干细胞表达间充质和干细胞相关的表面标志物(CD73、CD90、CD105、CD140b),能够在体外分化为脂肪、骨和软骨[37]。Basu等[38]成功从角膜缘上层组织中分离出角膜基质干细胞,可形成表达干细胞基因(ABCG2、Nestin、NGFR、Oct4、PAX6和Sox2)的克隆球,并且能进一步分化为表达ALDH3A1、AQP1、KERA和PTGDS等标志基因的角膜基质细胞。当移植到小鼠角膜伤口中时,角膜基质干细胞可防止光散射瘢痕组织的形成。此外,角膜中注射分离的角膜基质干细胞,可以恢复角膜基质的透明度和结构[39],其外泌体也对受伤角膜起促进愈合的作用[40]。
除了角膜基质的原生干细胞外,来源于骨髓、脐带、脂肪组织、人羊膜的其他间质干细胞以及iPSCs治疗也能防止受伤角膜基质的不透明和新生血管[41]。干细胞能通过类似的机制调节角膜基质愈合:向角膜基质细胞分化、抑制中性粒细胞的浸润和功能、免疫调节、防止异常细胞外基质(extracellular matrix,ECM)沉积、优选产生正常ECM成分、释放旁分泌因子影响周围损伤细胞和正常细胞来防止角膜瘢痕[36,40-43]。尽管角膜基质干细胞的研究在近期获得了一些进展,但距离真正的角膜基质层重建还有一定距离,需要克服细胞纯度、细胞特征鉴定、细胞移植术式建立等一系列困难。
5 角膜内皮层的干细胞重建
角膜内皮细胞是神经嵴衍生的细胞,位于特殊的细胞外基质上,维持着角膜基质水合所必需的狭窄生理范围,同时通过离子转运功能抵消了从基质到房水的扩散梯度并进行物质转运,对角膜功能的实现至关重要[44]。人角膜内皮细胞无法再生,受损后细胞通常会发生变形、变大,但整体数量相应减少,导致角膜内皮功能失代偿。当细胞密度低于维持其生理功能的临界密度,将发生严重的病理改变[45]。
体外获得角膜内皮干细胞的技术还不成熟,只有少数研究开发了获得具备角膜内皮前体细胞特征细胞的体外方法[46-47],应用细胞移植技术治疗角膜内皮疾病的报导较少。2018年,Kinoshita等[48]将体外扩增培养的异体内皮细胞注射到11例大疱性角膜病患者前房。24周的随访后接受治疗的眼睛的角膜内皮细胞密度均超过500个细胞/mm2,其中10个超过1 000个细胞/mm2,且没有发生任何不良事件。该临床试验表明了细胞移植技术治疗角膜内皮疾病是可行的。牙髓干细胞也被证明可转化为表达ZO1、ATP1A1以及COL4A2等角膜内皮特异性标志物的细胞[49],有望作为角膜内皮细胞的替代细胞。
6 结语
近30年角膜领域新技术使数百万患者免于失明,但利用角膜缘干细胞重建功能性角膜仍需深入研究,如鉴定更多的特异性干细胞标志物,包括细胞表面标志物以检测和富集干细胞群体;研发维持角膜缘干细胞扩增的稳定体系,避免细胞在体外培养过程中增殖能力减弱;此外,应着力解决诸如大规模无异种蛋白(Xeno-free)培养、干细胞治疗GMP通用化以及低不良反应高效免疫抑制等瓶颈问题。
角膜基质和角膜内皮的干细胞治疗相比角膜上皮仍处于不成熟阶段。角膜基质干细胞缺乏国际范围内认可的特异性标志物,临床试验尚未开展。角膜内皮细胞则需要寻找种子细胞以实现“开源”,同时也需要发展成熟的干细胞治疗方案来实现科研和临床的同步。
开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。详情请访问:https://creativecommons.org/licenses/by-ncnd/4.0/。

