磷烯纳米材料的生物毒性研究进展*
苟元园 张 伟,*** 李保玉 申雅璇 崔丹妮 史佳琪
(1)中国矿业大学材料与物理学院,徐州 221116;2)苏州大学放射医学与防护学院,苏州 215123)
近年来,纳米材料在细胞成像、靶向给药、生物传感,以及癌症免疫治疗等方面展示出优异的特性,同时也促进了纳米技术的飞速发展[1-7]。目前,已对各种形式的纳米粒子,包括不同元素类型的碳、金、磷和氮化硼纳米颗粒,不同尺寸不同维度的纳米管、纳米片、量子点,还有纳米粒子胶束、脂质体、聚合物粒子等进行了生物学效应的研究[2]。纳米材料可以通过与生物大分子如蛋白质、脂类或核酸等相互作用导致生物大分子的失活、诱发或产生生物毒性。例如,氧化石墨烯在低浓度下能够诱导氧化应激和炎症反应。在高浓度下,毒性表现为红细胞有丝分裂紊乱,导致细胞在G0/G1期聚 集[8]。Huang等[9]发 现,石 墨 烯 量 子 点(GQDs)可以通过范德华力、氢键与人血清白蛋白(HSA)发生结合相互作用,作用过程中GQDs会改变HSA的整体或局部结构,表现出潜在毒性作用。模拟结果表明,由于石墨烯的疏水特性,在能量上有利于石墨烯纳米片进入两个接触蛋白(如二聚体)的疏水界面。结果会扰乱细胞的新陈代谢,甚至导致细胞死亡[10]。在对DNA大分子的作用研究方面,也有模拟结果表明,纳米粒子对双链DNA(dsDNA)有潜在破坏效果。例如,dsDNA吸附在(C3N)纳米片上后,其末端碱基对会变性、解缠绕并直接堆积在(C3N)表面[11]。纳米材料对生物体尤其是对人体的影响,受到了人们极大的关注[12]。研究显示,石墨烯纳米片会抽取大肠杆菌细胞膜上的磷脂分子,这种抽取会造成细胞膜结构的破坏,进而产生细胞毒性[13]。石墨烯和氧化石墨烯纳米片也都会破坏蛋白质的二级结构[14]。磷烯是二维纳米材料的新成员,具有直接带隙、电荷载流子迁移率高、结构和性能各向异性等特性。自从磷烯在实验上被成功剥离以来,其生物学效应就一直是人们研究的重点。磷烯也会破坏蛋白质结构,但与石墨烯相比,磷烯的生物毒性更小[15]。磷烯在生物体系中表现出的低毒性以及更好的生物相容性使得学者们对磷烯生物学效应的研究更加关注[16-18]。
磷烯是单层黑磷(black phosphorus,BP),BP是众多磷元素中最稳定的一种,1914年首次经高温高压由白磷制得[19]。2014年,科学家首次利用机械剥离的方法成功制备了二维磷烯纳米片,它是一种表面呈褶皱状的新型二维纳米材料[20]。与石墨烯相比,磷烯具有载药量高[21]和对近红外激光照射敏感的特点,磷烯的这些特性有助于其负载分子的触发和释放行为,比如向所需部位释放治疗药物等[22]。基于第一性原理,通过计算磷烯和典型氨基酸的相互作用,证实了其生物友好性[23]。磷烯量子点于2015年首次被发现并被制备出来[24]。由于它具有优良的物理、电化学性能,因此被广泛应用于各种领域。磷烯量子点不同于二维层状磷烯纳米片,它具有不同的大小和厚度[25]。磷烯量子点细胞毒性低,对主要器官的毒副作用可忽略不计,生物相容性好[26-28]。并且体外和体内实验研究表明,磷烯量子点能产生活性氧,杀死癌细胞[24,29]。目前的研究表明,磷烯纳米材料与其他纳米材料相比,在生物医药领域会有更广阔的应用前景,但人们对磷烯与生物分子相互作用所产生的生物学效应和毒性机制缺乏系统的认知。近年来人们越来越关注磷烯与生物大分子之间的相互作用。分子动力学(molecular dynamic,MD)模拟结果表明,磷烯和氧化磷烯会破坏脂质膜的结构[30],Liu等[31]的模拟结果证实了磷烯对单体蛋白质具有较低的毒性,也有研究表明碳化磷不会引起蛋白质结构的扭曲。就目前的研究情况而言,有必要更全面地了解磷烯纳米材料与生物分子相互作用的细节及机制。
大量研究表明,磷烯纳米材料在生物医药领域具有巨大的应用潜力。在实际应用之前应该了解磷烯与环境以及与包括人类在内的生物体的相互作用。目前,常规用于细胞毒性评估的5种测定方法有:MTT、WST、XTT、LDH试验、Multi-Tox Glo试验[32]。由于不同细胞对磷烯纳米材料具有不同反应,以及性质的测定是基于不同的原则等,实验中得到的毒性结果会受到所选择测定方法的影响而出现偏差。最近一些学者对于磷烯纳米片毒性实验的结果会同时利用分子模拟给出验证,从而提供更加合理的解释[33-34]。所以,选择合适的方法,从分子机理上给出正确的评估,是至关重要的。
MD模拟是分子模拟基于统计力学发展出的一个分支。1957年第一次MD模拟就已经实现,如今随着计算机计算能力和计算方法的不断提高,模拟技术在医学、生物学、化学等相关领域以及交叉学科中不断渗透和发展解决了很多在现实中无法解决的实际问题[35-37]。MD模拟可以研究多粒子系统,模拟得到粒子的运动轨迹,最终获得研究对象在某时刻的位置和速度,同时在蛋白质结构预测和核酸结构模拟方面也有重要应用。目前,二维纳米材料如石墨烯、氮化硼、磷烯、硅烯等已经广泛应用于各行各业。就纳米材料的生物医学应用而言,由于体内的各种成分会与进入人体的纳米材料相结合,并通过多种形式产生相互作用,最终对生物组分乃至生命体产生破坏(即纳米毒性)[38-40]。近年来,人们借助MD模拟这一强有力的研究手段对磷烯纳米材料的生物安全问题进行了深入的探索。
本文将综述近年来人们通过实验和模拟的方法在磷烯纳米材料生物毒性方面所取得的进展,对磷烯纳米材料与细胞膜、蛋白质、DNA分子等的相互作用及生物毒性机制作出评述,并对未来磷烯生物学效应的研究给出预测和建议。
1 磷烯纳米材料与细胞膜的相互作用
细胞膜是保护细胞的第一道防线,防止细胞外的物质自由进入细胞,保证细胞内环境相对稳定。因此,研究磷烯纳米材料与细胞膜的相互作用具有重要意义。近年来,磷烯纳米材料在生物医药领域的应用优势越来越明显,被期待在生物医疗与生物分析方面获得更广泛的应用[41]。实验结果表明,与对正常细胞的毒性相比,磷烯纳米材料对癌细胞的毒性更大[42-43],同时实验也证明磷烯纳米材料可诱导巨噬细胞的免疫毒性和免疫紊乱[44]。因此,加深对磷烯纳米材料和细胞膜相互作用机理的理解,可以帮助人们在生物医学应用中更有效地使用磷烯纳米材料。
1.1 磷烯和细胞相互作用的实验研究
在推进磷烯潜在的生物医学应用之前,迫切需要对其进行系统的细胞毒性研究。Xiong等[45]证明磷烯纳米片对大肠杆菌(E.coli)和枯草芽孢杆菌(B.subtilis)两种类型菌均具有毒性,这一毒性机制是由于活性氧的生成和尖锐边缘对细菌膜造成损伤。这一结果表明,磷烯可能通过破坏细胞膜结构而对细胞产生潜在的毒性作用。纳米材料的性质、结构、尺寸、浓度均会影响其医学性能。最近的实验探测了磷烯的尺寸对其生物毒性的影响。Zhang等[46]利用不同尺寸磷烯纳米片与细胞作用,结果表明较大尺寸的磷烯对细胞膜的严重物理损伤可能是它们具有更高细胞毒性的原因。Fu等[47]通过液相剥离制备了3种不同的横向尺寸磷烯纳米片,与人乳腺癌细胞(MCF-7)相互作用的结果证明较大尺寸的磷烯纳米片杀死癌细胞的能力更强,光热治疗效果更明显。
大量的实验结果表明,磷烯的细胞毒性也与其浓度和细胞类型有关。早在2015年,Latiff等[48]首次利用磷烯在人肺癌上皮细胞(A549)中的细胞毒性实验发现其毒理学效应是浓度依赖性的,在50 mg/L浓度下细胞活性降低。并且他们观察到这种毒性通常介于氧化石墨烯和剥离的过渡金属二硫属化物之间。而Fu等[47]实验结果表明,同样50 mg/L浓度下磷烯与人肝细胞(LO2)相互作用时,细胞活性仍超过80%表现出良好的细胞相容性。He等[49]实验研究也证明磷烯量子点在小鼠和人肾管状上皮细胞中只显示中度肾毒性,他们发现磷烯量子点导致肾脏胰岛素不敏感和内质网应激。但也有大量学者的实验研究表明磷烯量子点对部分细胞具有明显的毒性作用。Mu等[50]在细胞、组织和全身水平上研究了磷烯量子点的毒性,他们的结果证实磷烯量子点对活细胞和小鼠造成短期明显的毒性;体外实验研究表明,当磷烯量子点的浓度高达200 mg/L时对HeLa细胞具有显著的凋亡作用。最近,Song等[43]的实验结果表明,层状磷烯的细胞毒性与它们的浓度和暴露时间成正比,浓度高于4 mg/L的层状磷烯在与L-929成纤维细胞相互作用时就表现出明显的细胞毒性效果。因此,磷烯纳米材料以不同浓度作用在不同生物体中的生物毒性极为复杂,一些推测仍在等待更深入的研究和验证。
除了体外细胞实验验证磷烯对细胞的生物毒性,最近一些科研人员利用体内细胞实验探索磷烯释放到水中对水生生物以及生态的潜在毒性影响。Li等[51]利用一系列毒性试验研究了磷烯纳米片对普通小球藻(C.vulgaris)的潜在毒性机制。小球藻在磷烯纳米片中暴露120 h后,1 mg/L的磷烯纳米片促进C.vulgaris的生长,而较高浓度(5 mg/L和10 mg/L)的磷烯纳米片抑制其生长。而纳米片的浓度高达20 mg/L时小球藻细胞壁明显受损,毒性作用明显。Wu等[52]研究的磷烯对单细胞生物嗜热四膜虫的潜在毒性实验表明,磷烯会导致细胞膜和纤毛损伤以及抑制该单细胞生物的繁殖。Yang等[53]研究发现,磷烯对斑马鱼具有发育毒性,浓度为10 mg/L的磷烯可以渗透到胚胎内导致发育畸形。总之,磷烯纳米材料对生物体的生物学影响极其复杂,此类研究仍处于早期阶段。
实验中探讨磷烯对细胞膜毒性作用的影响因素主要集中在材料的尺寸、浓度以及细胞类型等方面。大尺寸的磷烯纳米片更具有杀伤力,如增大膜的面积以及抑制脂类扩散等,从而对膜造成损伤。纳米材料的浓度导致的毒性效应需要具体而言,例如针对不同的细胞给予同样浓度磷烯纳米材料结果截然不同。磷烯量子点要达到和磷烯纳米片相似的毒性效应时,所需浓度更高,这可能与磷烯量子点体积更小、低浓度时对细胞膜的机械损伤更小有关。磷烯在不同细胞中的毒性效应比较复杂,但最近有关课题组揭示了磷烯选择性杀伤的一些原因。肿瘤细胞代谢活性高,磷烯更容易在肿瘤细胞内富集并快速降解,在肿瘤细胞中诱导G2/M期阻滞和自噬介导的细胞凋亡,进一步发生导致肿瘤细胞死亡。而对于正常细胞,由于其较弱的摄取活性和代谢速率,磷烯的摄取少且降解缓慢,从而保持了很高的生物相容性[54]。磷烯在体内细胞实验方面的探索还需要更加深入。
1.2 磷烯和细胞膜相互作用的模拟研究
Zhang等[30]采用MD模拟方法研究了磷烯与细胞膜的相互作用,发现磷烯纳米片能插入细胞膜,从细胞膜中抽取大量的磷脂分子,从而破坏细胞膜的结构,减弱细胞的活性。模拟结果显示,由于磷烯纳米片独特的褶皱蜂窝状结构,被抽取的磷脂分子沿其表面褶皱方向定向排列(图1)。磷脂分子在磷烯表面定向分布,是由磷脂分子与磷烯纳米材料相互作用的能量最小化决定的。
插入脂膜的小尺寸磷烯纳米片会与脂膜形成固定的夹角(定向插入),夹角的大小取决于磷烯的表面构型。如图2所示,长边为扶手椅形的矩形磷烯长边与脂膜表面的夹角约为0°;长边为锯齿形的矩形磷烯长边与脂膜表面的夹角约为56°。矩形磷烯长边与脂膜表面的夹角θ可写成如下表达式[30]:
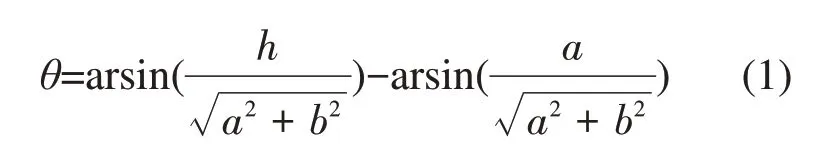
这里的a<h<b,h为脂膜的厚度,a和b分别为矩形磷烯纳米片的短边和长边。形成该夹角是疏水效应和磷脂分子在磷烯表面定向分布之间竞争的结果。长边为锯齿形的矩形磷烯纳米片斜插在脂膜中表明疏水效应占主导作用。

Fig.1 Extraction of lipid molecules from cell membranes by phosphorene nanosheets图1 磷烯纳米片对细胞膜中脂质分子的抽取
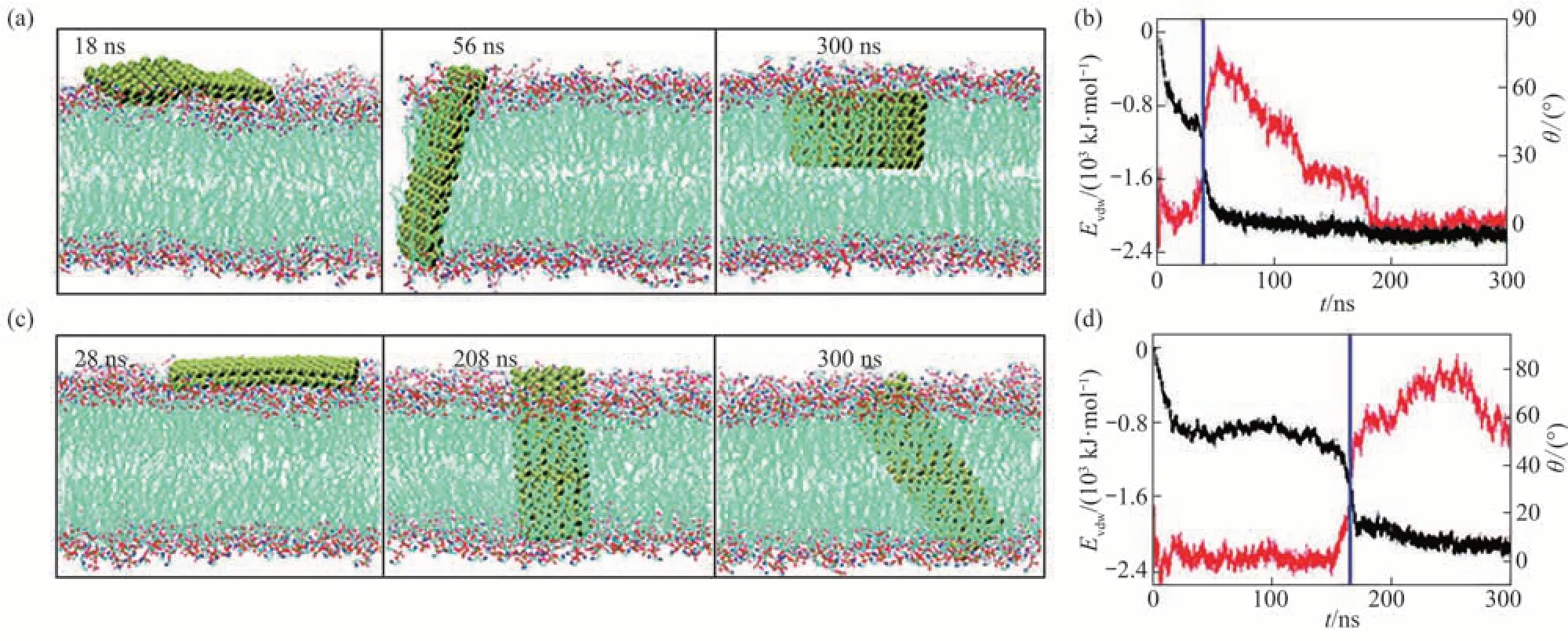
Fig.2 Directional insertion of phosphorene nanosheets into membranes图2 磷烯纳米片定向插入膜内
磷烯表面有孤立的电子对,很容易与大气环境中的氧气和水发生反应形成氧化磷烯(PO)[55]。磷烯在空气中的氧化降解对其电子学和光电子学性能有极大地影响,会导致其光学和电学特性的迅速退化,对电子器件造成影响[56]。例如,氧化会降低磷烯场效应晶体管的性能。随着氧化浓度的增大,磷烯甚至会失去其重要的半导体特性[57]。
尽管氧化会导致磷烯的结构出现显著的变化[58],但氧化磷烯能够在相当长的一段时间内保持稳定,从而使其可用于传感应用,受控氧化还可用于设计其电子性质[59]。目前,对氧化磷烯细胞毒性的研究还很缺乏。Chen等[60]通过MD模拟研究发现,氧化磷烯也会破坏脂膜双层,具有细胞毒性。磷烯有三种典型的氧化模式[55]:悬挂式氧化(模式I)、间隙氧化(模式II)、表面桥式氧化(模式III)。模拟结果表明,氧化磷烯纳米片能够插入脂膜并破坏性地从膜上抽取大量磷脂分子(图3)。磷脂分子被大量抽取会导致脂膜的完整性丧失,膜上磷脂分子密度变小致使膜的黏度降低,这加速了膜上磷脂的扩散。不同的氧化模式对氧化磷烯抽取磷脂分子的程度几乎没有影响;但氧化浓度越高氧化磷烯纳米片对磷脂的抽取量越少,对膜的破坏性也越小[60]。
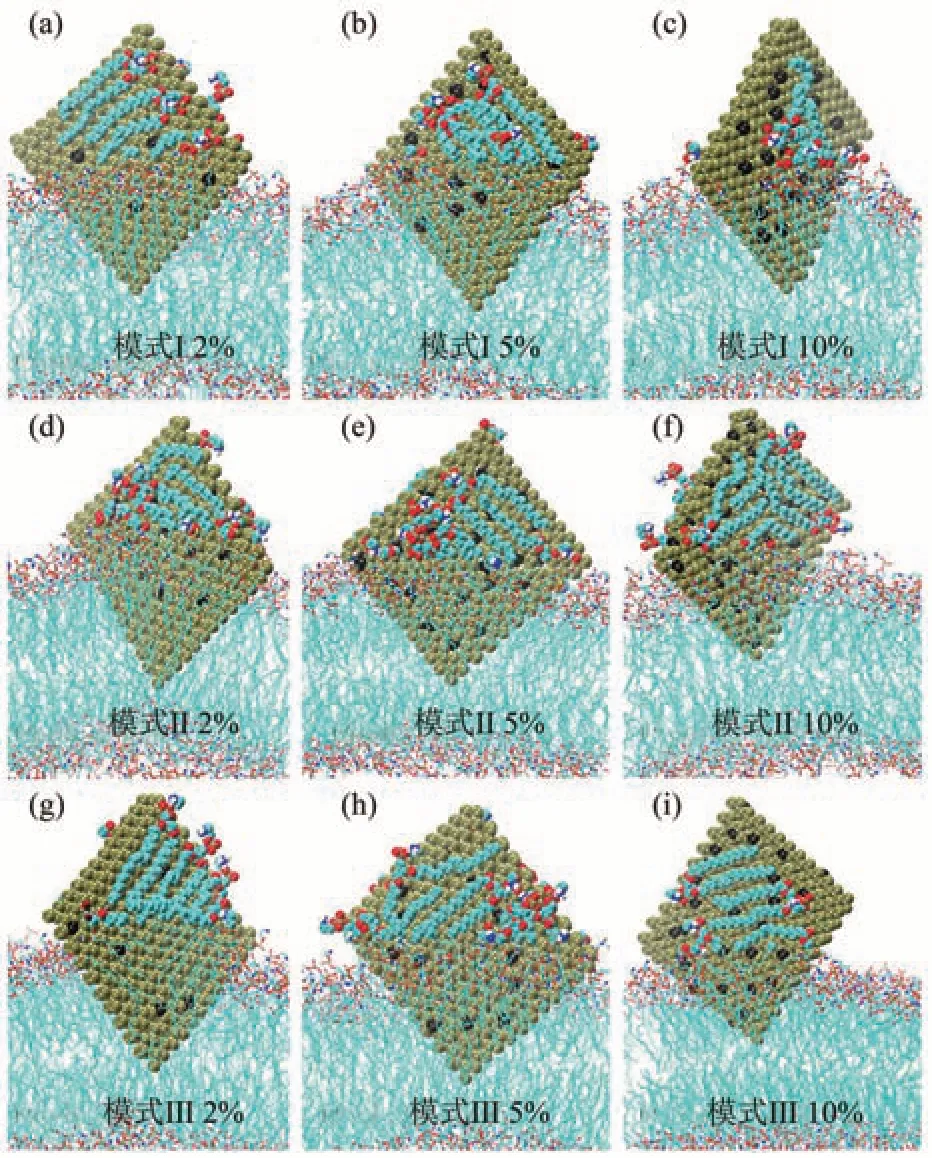
Fig.3 The conformation of lipid membranes and PO nanosheets with 3 oxidation concentrations and oxidation modes at 200 ns[60]图3 3种氧化模式和氧化浓度下的氧化磷烯与脂膜在200 ns时的构型[60]
2 磷烯与蛋白质的相互作用
蛋白质是生物大分子中的一种,其在有机体中具有特殊的地位。如今纳米材料的生物应用发展迅速,研究表明,某些纳米材料与蛋白质的相互作用会干扰生物功能,产生毒性效应。比如,石墨烯、氧化石墨烯以及碳纳米管等纳米材料与蛋白质的相互作用均会产生生物毒性[14,61-62]。Matesanz等[62]发现,石墨烯纳米片对蛋白质二级结构有一定的破坏力。实验表明,磷稀纳米材料可以吸附血浆蛋白形成磷烯-电晕复合物,用来诱导巨噬细胞分化从而有效地吞噬癌细胞[63]。近几年更多的学者借助不同的实验方法和利用分子动力学模拟手段研究磷烯纳米材料与生物大分子蛋白质的相互作用,从不同维度更有效地解读蛋白质结构受到的影响。
2.1 磷烯与蛋白质相互作用的实验研究
最近,大量实验研究了磷烯与不同蛋白质相互作用的生物学效应,以说明它们的生物学毒性。Xia等[64]使用表面等离子体共振传感(SPR)和具有耗散监测的石英晶体微天平(QCM-D)研究了磷烯量子点在黏蛋白表面的吸附-解吸行为。结果表明,聚乙二醇-胺(PEG-NH2)对磷烯量子点的表面改性和环境条件(pH、离子强度和离子价)对磷烯量子点在黏蛋白表面的吸附有显著的影响。PEG修饰提高了磷烯量子点的稳定性,也导致了其在黏蛋白表面上有更高的吸附量。在低pH值情况下,磷烯量子点在黏蛋白表面的吸附量增加。这种行为归因于表面配体的空间位阻、静电相互作用和电荷筛选。由于一些纳米粒子可以诱导黏蛋白分泌[65],从而导致疾病。此项研究对磷烯纳米材料相关毒理学的评估很重要。
Wang等[34]利用远紫外圆二色光谱和原子力显微镜,发现无毒且生物相容好的磷烯量子点在超低浓度下也具有抑制胰岛素聚集和分解形成成熟原纤维的特殊能力。并且这种纳米材料和蛋白质之间的特定相互作用使得磷烯量子点能够稳定胰岛素的α螺旋结构。远紫外圆二色光谱测量结果显示磷烯量子点能够抑制胰岛素的α螺旋向β折叠的转变(图4a~c)。图4d中的胰岛素在两种磷烯量子点浓度(50和500µg/L)溶液中孵育后,胰岛素淀粉样纤维化随时间的变化很明显,磷烯量子点在抑制胰岛素聚集方面具有优异性。这种特性使得磷烯量子点可以应用于预防淀粉样变性、疾病治疗以及胰岛素储存和加工。基于以上结果,研究人员对磷烯纳米颗粒进行修饰,通过增强静电和疏水相互作用,改进后的聚乙二醇化LK7-BP纳米片对淀粉样蛋白原纤维形成的抑制效力增强。随着纳米粒子的浓度增加,β淀粉样蛋白(Aβ)毒性作用降低,细胞活性增强[66]。这些工作表明,磷烯纳米颗粒和这种经过修饰的纳米颗粒是很有前途的淀粉样蛋白抑制剂,有望对抗阿尔茨海默病。
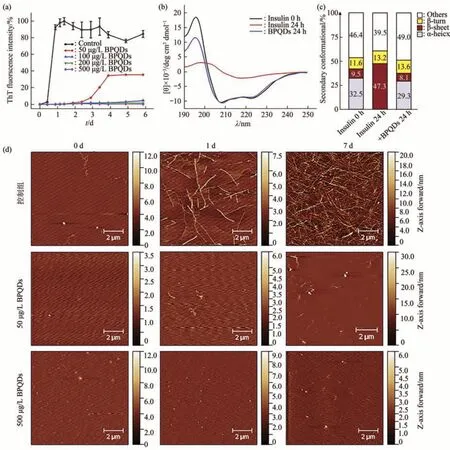
Fig.4 Influence of BPQDs on the inhibition of insulin fibrillation aggregation[34]图4 磷烯量子点对抑制胰岛素纤维聚集的影响[34]
然而,当学者们研究磷烯量子点对HSA内在荧光和自然构象的生物学影响时发现,磷烯量子点与HSA结合并导致HSA的二级结构α螺旋结构降低,导致HSA的热稳定性降低[67]。磷烯量子点对HSA的这种作用是由范德华相互作用和氢键驱动的。同样,实验研究发现,磷烯量子点对胰蛋白酶的构象影响是由范德瓦尔斯相互作用和疏水相互作用驱动的,磷烯量子点通过构建稳定的基态复合物来静态猝灭胰蛋白酶的固有荧光,导致胰蛋白酶的亲水环境和结构不紧密[68]。这种相互作用对胰蛋白酶的活性造成干扰。因此,蛋白质的种类对磷烯纳米材料生物毒性的影响机制是复杂的,仍需大量的研究和验证。
通过实验可以发现,磷烯量子点纳米颗粒对蛋白质结构的作用影响了蛋白质功能的表达。这种影响对不同种类的蛋白质表现出不同的结果。例如,对胰岛素蛋白有抑制作用而对人血清蛋白有干扰和破坏作用。总的来说,磷烯量子点与蛋白质的作用机制是相似的。磷烯量子点通过范德华作用和疏水作用会和某些氨基酸残基位点结合,从而阻止α螺旋结构的形成和转变或者降低α螺旋结构的含量,最终影响蛋白质的表达。
2.2 磷烯与蛋白质相互作用的模拟研究
磷烯可以通过与蛋白质表面的残基相互作用而吸附蛋白质。2015年,Zhang等[15]通过比较磷烯和石墨烯对蛋白质结构和功能的破坏作用,发现磷烯的褶皱表面可以降低其对蛋白质的破坏。模型蛋白HP35吸附在磷烯表面有4种典型的接触构型。结果表明,接触构型不同磷烯对HP35的破坏性也不同。
通过计算吸附在磷烯及石墨烯表面的HP35蛋白的RMSD、二级结构及α螺旋结构中的残基数量等,发现石墨烯对HP35的二级结构的破坏比磷烯严重,而磷稀只是导致蛋白质轻微损伤。与磷烯和蛋白质之间的相互作用不同,Liu等[31]发现,α相碳化磷(α-PC)与HP35之间较弱的结合强度不会引起蛋白质结构的扭曲。
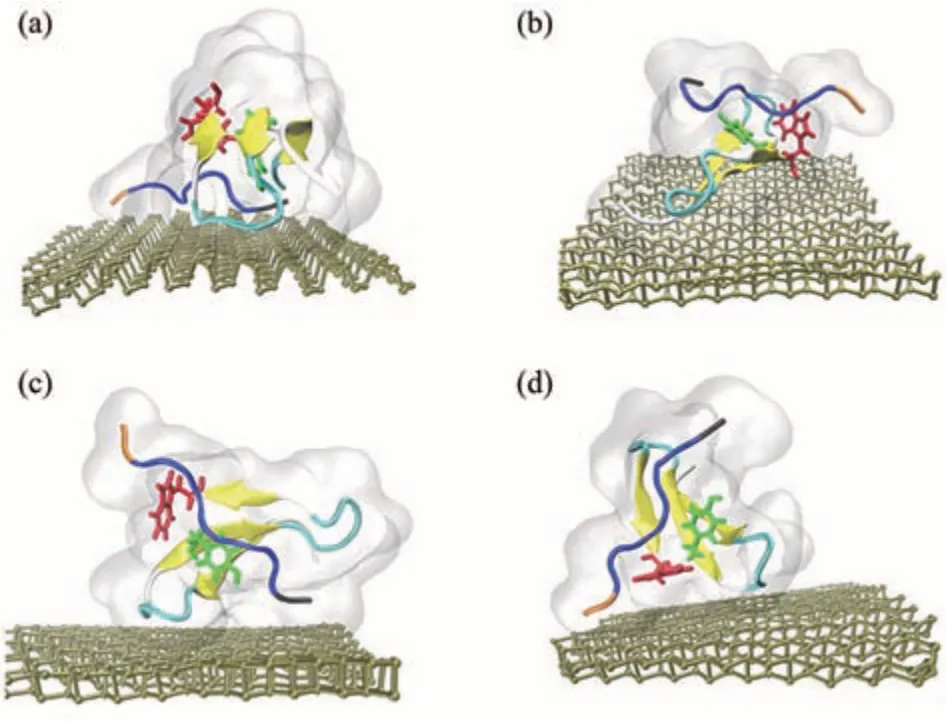
Fig.5 Four representative contact orientations图5 四种具有代表性的接触构型
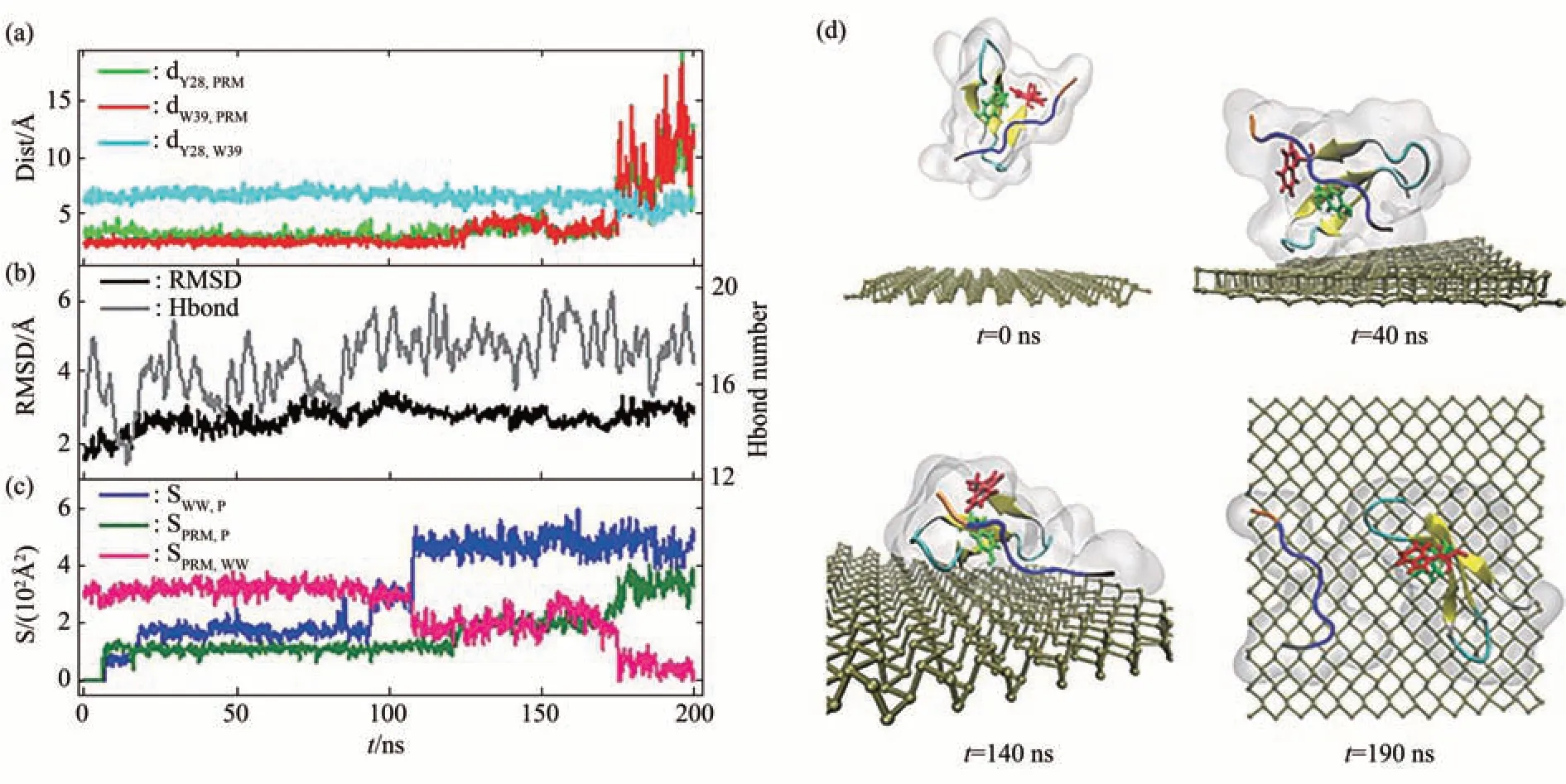
Fig.6 Adsorption of proteins on the surface of phosphorene and their correlation analysis:snatching models[69]图6 蛋白质吸附在磷烯表面的过程及相关分析:抢夺模式[69]
2017年Zhang等[69]从原子水平解释了磷烯纳米毒性及其对信号蛋白功能破坏的机制。模拟结果显示,磷烯对信号蛋白WW结构域的破坏有两种模式:破坏结构和抢夺配体。WW结构域在磷烯纳米材料表面有4种具有代表性的接触构型(图5),初始接触构型决定磷烯对信号蛋白的破坏类型。图6d中显示了抢夺配体模式在200 ns时间内相互作用的过程。很明显在190 ns时,由于磷烯与PRM配体强烈的相互作用,从而将PRM配体从WW结构域中拉出。图6的数值结果也表明,在170 ns开始,PRM被从WW结构域中分离,并且两者与磷烯的接触面积均增大,在这个过程中WW结构域保持结构稳定。这种抢夺配体模式是蛋白质与纳米材相互作用中的一种新的破坏途径。图7显示的是破坏结构模式,磷烯对WW结构域的二级结构造成严重破坏。这种破坏蛋白质功能的方式不同于第一种抢夺配体模式。不管是抢夺配体还是破坏蛋白质的结构,纳米材料都将使蛋白质失去原有的功能,产生毒性。
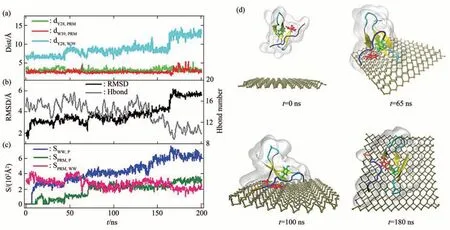
Fig.7 Adsorption of proteins on the surface of phosphorene and their correlation analysis:failure modes[69]图7 蛋白质吸附在磷烯表面的过程及相关分析:破坏模式[69]
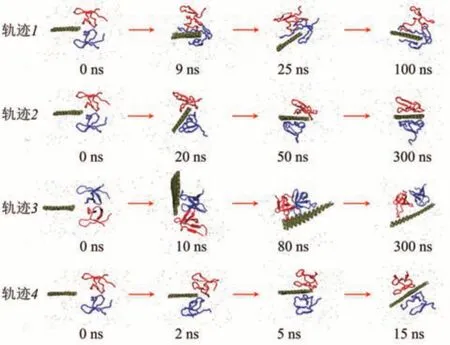
Fig.8 Selected snapshots from different trajectories of the interaction of HIV-1 integrase protein and a small BP nanosheet at different time instants,representing distinct mechanisms[70]图8 HIV-1聚合酶蛋白与一个小的BPN纳米片在不同时刻相互作用的不同轨迹,代表不同的机制[70]
磷烯除了可以通过与蛋白质表面残基的相互作用而吸附蛋白质,还可以插入蛋白质。最近,模拟研究发现磷烯会插入HIV-1二聚体蛋白的疏水区,阻断蛋白质信号通路,产生毒性[70]。全原子MD模拟显示磷烯纳米片与HIV-1蛋白之间有4种不同的相互作用模式(图8)。
轨迹1展示了第一种相互作用模式,纳米片先滑向任意一个蛋白质单体并与其相互作用,最终插入这个单体。轨迹2展示了第二种作用模式,纳米片优先将一个单体从二聚体中抢走,从而导致二聚体解离。一旦二聚体分开,它们就可以彼此独立地自由移动,并可以吸附在纳米片的两侧。轨迹3展示的是第三种相互作用模式,磷烯纳米片对二聚体结构的解离无效。在这种情况下,磷烯纳米片经历旋转,变得几乎平行于二聚体主轴,两个单体同时吸附在磷烯表面同侧,而不会失去单体间的相互作用。轨迹4展示的是第四种作用模式,磷烯纳米片通过与两个单体的同等相互作用直接插入到二聚体中间,阻断了单体-单体间的相互作用。该相互作用模式是所有观察到的作用模式中衍化速度最快的。当HIV-1蛋白顶部因非共价作用吸附在磷烯表面时,其二级结构基本保持不变,没有明显的纳米毒性。当相互作用发生在磷烯纳米片边缘与二聚体疏水界面处时,蛋白质的二聚体轴线垂直于磷烯平面,蛋白质二聚体容易被“干净切割”,此时,蛋白质两个单体的二级结构也基本保持不变,但有毒性。
蛋白质是由氨基酸组成的,磷烯纳米片对蛋白质的影响主要是通过与组成蛋白质的氨基酸相互作用实现的。密度泛函理论和MD模拟显示,磷烯纳米片会选择性地与丙氨酸、天冬氨酸等氨基酸形成复合物。不同的磷烯-氨基酸复合物静电和范德瓦尔斯相互作用强度不同,利用这一特性磷烯纳米材料可以用来选择性地检测不同的氨基酸[71]。
最近几年,磷烯量子点在蛋白质上的潜在生物毒性也引起了人们的注意,研究发现磷烯量子点可以与蛋白质相互作用[68,72]。Huang等[67]利用实验和模拟相结合的方法,发现磷烯量子点能与HSA结合,导致HSA二级结构α螺旋降低,导致HSA结构稳定性降低。由于HSA的α螺旋结构与其生物学功能密切相关,因此磷烯量子点对HSA的生物学功能具有干扰作用。不过磷烯量子点的这种损伤程度与石墨烯量子点相比,生物毒性相对较低[9]。
有趣的是,与Huang等的结果相反,Wang等[34]的MD模拟结果显示,超低浓度的磷烯量子点作为一种有效的、无毒的淀粉样纤维抑制剂能够稳定胰岛素的α螺旋结构,消除β折叠结构,抑制原纤维的形成。磷烯量子点主要通过疏水和范德瓦尔斯相互作用与胰岛素相互作用,结合位点保留了胰岛素的初始构型,阻止了从α螺旋结构到β折叠结构的转变,打开了形成的β折叠片段(图9),有助于淀粉样蛋白纤维的解聚过程。
分子模拟手段的利用,更加明确了实验中观察到的磷烯对蛋白质的毒性作用,通过范德华作用和疏水作用与蛋白质表面残基或蛋白质配体结合而吸附蛋白质,进而影响蛋白质的生物功能。这一方法也显示了实验中未曾观察到的毒性作用机制,通过疏水作用可以插入蛋白质二聚体中间切断蛋白质单体,从而对蛋白质的组成和功能产生明显的影响。
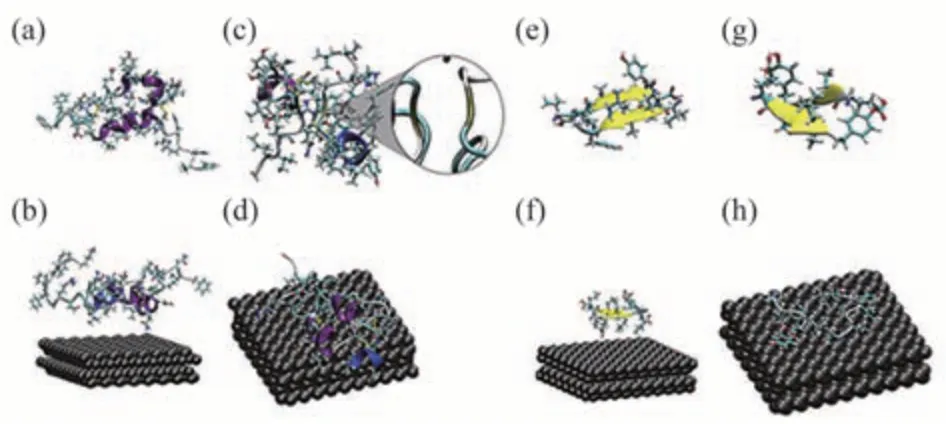
Fig.9 BPQDs interact with insulin and destroy the β-folded structure[34]图9 磷烯量子点与胰岛素相互作用并破坏β折叠结构[34]
3 磷烯与DNA的相互作用
DNA是主要的遗传物质,也是最重要的生物大分子之一。随着二维纳米材料的迅速发展以及在生物医学上的应用,探究它们与生物大分子DNA之间的相互作用产生的毒性机理有助于纳米材料生物相容性的研究和设计。Zhao[73]采用MD方法模拟了石墨烯表面对双链DNA(dsDNA)的吸附,结果表明dsDNA结构被破坏。但是,dsDNA片段却在两种石墨烯衍生物——硼化石墨烯(BC3)和氮化石墨烯(C3N)上表现出高度的生物相容性,不会出现dsDNA双链结构扭曲的情况[74]。但同时Zhao等[11]认为dsDNA吸附在(C3N)纳米片上后,也会引起局部的解折叠。dsDNA是否会出现解折叠取决于dsDNA与(C3N)在初始结合时的界面碱基对是否解开,如果dsDNA与(C3N)在初始结合时的界面碱基对是解开的,那么结合到(C3N)上就会发生持续的解折叠,如果不解开,那么dsDNA就能够稳定在(C3N)上。目前纳米材料对DNA大分子的作用机制仍需要深入全面的研究。对于新兴的磷烯纳米材料,dsDNA在该纳米材料表面的吸附效应也是近期的研究热点。
3.1 磷烯与DNA相互作用的实验研究
磷烯作为一种新兴二维纳米材料在生物传感器的应用中展现出独特的优势。Yew等[75]在2017年首次将磷烯作为纳米荧光团应用于DNA检测荧光传感平台的研发中。最近利用磷烯和核酸基相互作用进行DNA测序的研究发展迅速[76-77]。随着这些应用的发展,磷烯对DNA结构的影响也需要明确。一些学者们通过实验观察到磷烯对DNA片段的影响。Li等[33]为了定量比较DNA在磷烯和石墨烯上的吸附行为,进行了琼脂糖凝胶电泳分析,实验结果表明磷烯对DNA的吸附能力较温和。如图10所示,磷烯处理后的上清液中的DNA浓度为17.98×103g/L,高于石墨烯作用组(7.63×103g/L)。结合他们利用分子模拟方法得到的结果分析,导致这一差异的原因是磷烯褶皱的表面形貌降低了核苷酸在磷烯表面上的吸附自由能。在功能化磷烯应用于生物传感器的实验中,研究人员发现利用硝基苯基功能化的磷烯对单链DNA(ssDNA)和dsDNA具有不同的亲和力,这种功能化增强了生物传感器与核苷酸碱基之间的疏水性和π-π堆积相互作用,从而达到对目标对象的特异性检测功能[78]。而在体外活性实验中,Phakatkar等[79]利用磷烯纳米片处理大肠杆菌的透射电子显微镜分析实验中发现DNA分子出现团聚现象并且失去了复制能力,从而导致细胞代谢紊乱,体现了其良好的抗菌性质。这种大分子DNA的损伤是由磷烯纳米片产生氧化应激反应造成。对于DNA的这种损伤也发生在银离子对大肠杆菌的作用实验中。总的来说,磷烯与生物大分子DNA一方面展现出温和的吸附,另一方面也会造成无法复制的损伤情况,两者之间的相互作用规律仍缺乏全面的研究。
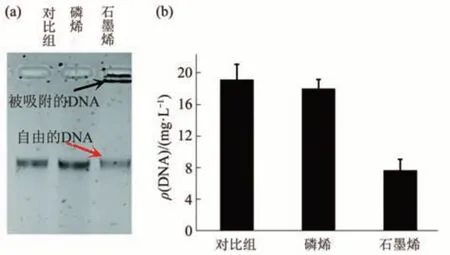
Fig.10 Comparison of DNA adsorption behavior on phosphorene and graphene图10 DNA在磷烯和石墨烯上的吸附行为的比较
3.2 磷烯与DNA相互作用的模拟研究
Li等[33]在2020年利用MD模拟结合实验研究了磷烯与DNA片段的相互作用,DNA可以通过末端碱基对稳定地吸附在磷烯表面,不会对DNA的内部结构造成扭曲。如图11示,DNA初始结构平行于磷烯纳米片放置,在运动过程中可以通过末端的碱基与磷烯形成稳定的结合,在经历200 ns的运动后,最终在纳米片上呈垂直取向,其自然结构不会被破坏。DNA初始结构垂直于磷烯纳米片放置的情况,模拟结果与此一致。已知在DNA被石墨烯吸附会导致其结构被破坏[73]。因此,磷烯的生物相容性比石墨烯更好。磷烯具有这种优异的生物相容性,是因为磷烯褶皱的表面形貌降低了核苷酸在磷烯表面上的吸附自由能。量子化学研究[80]同样表明,磷烯比石墨烯更适合于碱基和碱基对的物理吸附,稳定性提高了27%。这种优势源自磷烯与碱基之间较强的色散相互作用和静电相互作用。他们还证明DNA碱基通过配位共价键以堆积吸附的方式与掺杂磷稀纳米片形成稳定的复合物[80]。从现有的模拟结果可以得知,磷烯对DNA大分子似乎没有明显的毒性作用。
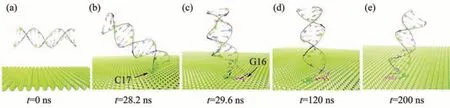
Fig.11 A snapshot of trajectories simulating the interaction of phosphorene with DNA fragments[33]图11 模拟磷烯与DNA片段的相互作用的轨迹快照[33]
4 总结与展望
本文总结了借助实验和分子模拟方法发现和验证的磷烯及其衍生物的生物毒性。相关研究通过分析磷烯纳米材料与生物分子的相互作用,揭示磷烯纳米材料潜在的毒性及其物理机制。研究发现浓度较高,尺寸较大的磷烯纳米材料细胞毒性更明显,不同种类的细胞对磷烯纳米材料有着不同的毒性反应。磷烯纳米片对蛋白质的影响既有破坏作用又有抑制作用,这取决于纳米材料是和哪些氨基酸残基位点相结合。磷烯纳米片与DNA大分子相互作用方面的研究仍然比较缺乏,已有的研究结果显示,磷烯纳米片对DNA大分子没有明显的破坏。总的来说磷烯的生物相容性较好,但也具有一定的生物毒性。磷烯产生生物毒性的途径主要有以下几种:a.抽取细胞膜上的磷脂分子,破坏脂膜的完整性,减弱细胞活性;b.产生活性氧,使细胞失去活性;c.破坏生物分子的结构,使其失去生物功能;d.夺走配体、占据活性位点,从而阻断信号蛋白的信号通路,致其功能丧失。
目前,对磷烯生物毒性的研究还不够全面和透彻,磷烯纳米材料在生物系统中的安全应用还有很多问题亟待解决,主要包括以下3点。
a.材料性质方面。磷烯纳米材料的各种性质对其生物学效应会有极大的影响。比如,磷烯纳米材料的尺寸、形状、浓度、氧化程度、表面电荷、材料掺杂、受体介导等,这些因素对磷烯纳米材料的生物毒性的影响的研究非常缺乏。
b.真实生物细胞环境方面。目前模拟结果中所使用的大分子模型简单,种类单一。真实生物微环境中存在着许多不同的细胞器,不同部位的细胞膜组成也不相同,膜的状况也有所不同,如高流动性的膜、凝胶相的膜,这些对磷烯纳米材料的细胞毒性的影响还都是未知的。
c.全面性方面。磷烯纳米材料的生物毒性研究最终是走向临床和实践应用,那么全面系统的研究显得极其重要。而磷烯纳米材料的生物毒性研究仍然缺乏全面性。目前的研究主要集中在二维的磷烯纳米片和零维的磷烯量子点方面。相关的纳米材料,比如,用磷烯卷成的一维纳米管和三维纳米球的研究目前基本还没有涉及。
任何事物都有两面性,毒性有害但可以杀菌也有利于杀死癌细胞;磷烯纳米材料不稳定,但有利于其在生物体内降解。具有弱生物毒性易降解的磷烯纳米材料将成为纳米药物的理想候选者。如何有效降低磷烯纳米材料的负面效应,最大限度地发挥其生物医药功能将是未来需要面对的重要问题。
虽然学者们已对磷烯的一些生物医学应用进行了探索,但磷烯-生物分子相互作用的原理及细节研究仍处于起步阶段,这意味着在未来磷烯及其衍生物的生物毒性问题还有很大的探讨空间。学者们需要更加关注相关的理论研究以及相应的实验验证,理论与实验相结合推动更多难点突破,为磷烯纳米材料在生物医药临床应用方面提供支持。

