电子束辐照对核桃青皮醌类物质提取及活性的影响
何涵茜,邹光铭,姬敏慧,张莹莹,马海敏,蔡莹莹,罗安伟*,白俊青,蔚江涛
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.杨凌核盛辐照技术有限公司,陕西 杨凌 712100)
核桃青皮,又称青龙衣,是胡桃科胡桃属胡桃楸(Juglans regia L.)或胡桃的外果皮。核桃青皮广泛地用于中医药领域,其味辛、苦、涩、平,有清热解毒、止痢镇痛等功效[1]。现代医学研究表明,核桃青皮具有抑菌、抗氧化、抗病毒和抗肿瘤等功效[2]。核桃青皮作为一种农业废弃物,易破坏田间的生态平衡,造成环境污染。因此,如何有效地将这一农业废弃物利用在医药、食品、染料[3-5]等领域,变废为宝显得至关重要。
醌类物质是核桃青皮中主要的活性物质之一,具有抗菌[6]、抗氧化[7]及染色[3-5]作用。目前核桃青皮醌类物质的提取方法主要有超高压提取[8]、亚临界水提取[9]、碱提酸沉淀法提取[10]、有机溶剂萃取法[11]、微波辅助法[12]等。以上方法存在提取率不够高,提取不充分等问题。超声辅助提取具有提取效率高、时间短、无污染等优点,因此被广泛应用于食品工业中[13-14]。电子束辐照具有对环境影响小、穿透率高、能耗低等优点,且电子束辐照为低温处理,对热敏性活性物质也有保护作用。利用电子束辐照对样品进行预处理可以破坏植物细胞壁的结构,从而促进细胞中活性物质的溶出,提高活性物质的提取率[15-16]。通过电子束辐照预处理耦合超声辅助的方法,能促进核桃青皮中醌类物质的提取。
本文以干燥后的核桃青皮为原料,用电子束辐照技术预处理,再用超声辅助乙醇溶剂提取核桃青皮粉末中的醌类物质,并对提取物的抑菌活性和抗氧化活性进行研究,为电子束辐照技术在天然产物提取及核桃青皮的开发利用提供理论参考与技术支撑。
1 材料与方法
1.1 材料与试剂
核桃青皮(新新2号核桃的成熟外果皮):2020年8月25日采收自新疆阿克苏核桃基地;胡桃醌标准品(纯度≥98% )、庆大霉素:上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼 (1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS]:北京博奥拓达科技有限公司;无水乙醇、水杨酸-乙醇、硫酸亚铁、过氧化氢、抗坏血酸(VC)(分析纯):广东光华科技股份有限公司;石油醚、二氯甲烷、乙酸乙酯(分析纯):成都市科隆化学品有限公司;LB琼脂培养基、LB肉汤培养基:北京路桥技术股份有限公司;蜡样芽孢杆菌(Bacillus cereus)、大肠杆菌(Escherichia coli)、沙门氏菌(salmonella)、金黄色葡萄球菌(Staphylococcus aureus):西北农林科技大学食品科学与工程学院微生物实验室。
1.2 仪器设备
Spark多功能酶标仪:奥地利Tecan Austria GmbH公司;UV-2550双光束紫外分光光度计:日本岛津公司;KQ-700DE型数控超声波清洗器:昆山市超声仪器有限公司;HC-3018R高速冷冻离心机:安徽中科中佳科学仪器有限公司;万能高速粉碎机:衢州普润日用品有限公司;RE-52AA旋转蒸发仪:上海亚荣生化仪器厂;无菌工作台:苏州净化设备有限公司;BXM-30R蒸汽灭菌锅:上海博迅实业有限公司;DHP9025电热恒温生化培养箱:上海一恒科技有限公司;D2-10 MeV/20 kV高能电子直线型加速器(功率为20kW,扫描宽度80cm,额定能量为10 MeV):陕西杨凌核盛辐照技术有限公司;场发射扫描电子显微镜:美国FEI公司。
1.3 方法
1.3.1 原料处理
将成熟的核桃鲜果外果皮进行手工剥皮,自然晒干(水分含量9.03% ),粉碎过筛(60目),得到的核桃青皮粗粉即为试验所需原料。
1.3.2 胡桃醌标准曲线的绘制
以胡桃醌为标准品,研究核桃青皮中醌类物质的得率。用60% 乙醇溶液配制浓度分别为0.01、0.02、0.03、0.04、0.05、0.06、0.07 mg/mL 的胡桃醌标准品溶液。对胡桃醌标准品溶液进行全波长扫描,确定吸光值最大峰处的波长。以60% 乙醇溶液作为空白对照,读取不同浓度标准品在检测波长处的吸光值,每个浓度重复3次,最后绘制吸光值与胡桃醌质量浓度的标准曲线,并得到回归方程。
1.3.3 醌类物质的提取
称取1.0 g核桃青皮粗粉,加入30 mL浓度为60% 乙醇溶液,在提取温度60℃[17-18],超声功率350 W条件下提取120 min,将得到的样品提取液离心,取上层清液。将上清液定容到50 mL,移取5 mL样品液至25 mL容量瓶中,用60% 乙醇溶液定容至25 mL,在检测波长处测其吸光值,每个浓度重复3次。
1.3.4 醌类物质得率的测定
醌类物质得率的计算公式如下。

1.3.5 单因素试验
在初始试验条件的基础上,改变乙醇浓度、料液比和提取时间3个因素条件进行单因素试验。乙醇浓度分别为30% 、40% 、50% 、60% 、70% 、80% ; 料液比分别为 1∶20、1∶25、1∶30、1∶35、1∶40、1∶45(g/mL);提取时间分别为 30、60、90、120、150、180 min。按照 1.3.3 所述方法,测定醌类物质浓度,重复3次试验,按照1.3.4所述公式计算醌类物质得率,计算平均值和标准差。
1.3.6 响应面试验设计
根据单因素试验结果,根据Box-Behnken中心组合设计原理,选择对核桃青皮色素提取效果影响显著的3个主要因素进行三因素三水平响应面试验,每组试验重复3次。响应面试验设计见表1。

表1 响应面试验设计Table 1 Experimental design of response surface
1.3.7 电子束辐照剂量筛选试验
称取核桃青皮粉末,用PE封口袋封装,每袋100g,单层摆放在辐照托盘上,放置于传送带上送入辐照室进行处理,辐照剂量分别为 10、20、30、40、50、60 kGy,每个剂量平行3次。
根据1.3.6响应面试验结果,设计辐照剂量的单因素试验,将被辐照的核桃青皮粉末作为样品,控制乙醇浓度、料液比和提取时间,按照1.3.3所述方法,测定醌类物质浓度,重复3次试验,按照1.3.4所述公式计算醌类物质得率,计算平均值和标准差。
用扫描电镜对核桃青皮粉末样品进行结构观察,分析电子束辐照前后核桃青皮表面组织结构,设置电镜的工作电压为5 kV,放大1 600倍。
1.3.8 活性评价试验
1.3.8.1 试液的制备
根据响应面试验结果,在最优条件下提取,提取液旋蒸浓缩得浸膏,用蒸馏水溶解浸膏。分别用石油醚、二氯甲烷、乙酸乙酯溶液萃取浸膏水溶液,将萃取后得到的萃取相旋蒸至干。分别用无水乙醇将不同萃取相萃取得到的浸膏配制成5 mg/mL的乙醇溶液,备用。
1.3.8.2 DPPH·清除率
参照Ma[19]的方法,用无水乙醇稀释试液,配制成浓度分别为 0.1、0.2、0.3、0.4、0.5 mg/mL 的样品溶液,配制浓度为2×10-4mol/L的DPPH无水乙醇溶液。向反应管中加入1 mL不同浓度的样品溶液和1 mL DPPH溶液,充分摇匀,静置30 min,在波长517 nm处测定吸光度,以VC作为阳性对照。DPPH·清除率计算公式如下。
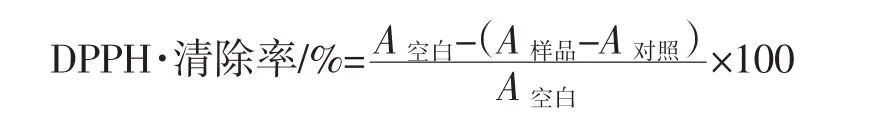
式中:A样品为样品和DPPH溶液反应测得的吸光度;A空白为用无水乙醇代替样品测得的吸光度;A对照为用蒸馏水代替DPPH溶液测得的吸光度。
1.3.8.3 ABTS+·清除率
参照赵国超等[20]的方法,用无水乙醇稀释试液,配制成浓度分别 0.012、0.018、0.024、0.030、0.036 mg/mL的样品溶液。取0.0384 g ABTS定容到10 mL配制为ABTS 溶液,0.013 4 g过硫酸钾定容到 10 mL,1∶1 混合,避光反应12 h,使用时稀释20倍。向反应管中加入1 mL不同浓度的样液和1 mL ABTS溶液,充分摇匀,在室温下避光反应30 min,在波长734 nm处测定,以VC作为阳性对照。ABTS+·清除率计算公式如下。

式中:A样品为样品和ABTS溶液反应测得的吸光度;A空白为用无水乙醇代替样品测得的吸光度;A对照为用蒸馏水代替ABTS溶液测得的吸光度。
1.3.8.4 ·OH清除率
参照韩春平等[21]的方法,用无水乙醇稀释试液,配制成浓度分别 0.1、0.4、0.7、1.0、1.3 mg/mL 的样品溶液,配制10 mmol/mL的水杨酸-乙醇溶液、10 mmol/mL的FeSO4溶液、100 mmol/mL的H2O2溶液。向反应管中加入0.5 mL水杨酸-乙醇溶液、1 mL不同浓度的样液、0.5 mL FeSO4溶液和3 mL蒸馏水,最后加入5 mL的H2O2溶液,启动芬顿反应,充分摇匀,在波长510 nm处测定,以VC作为阳性对照。·OH清除率计算公式如下。

式中:A样品为样品与溶液反应测得的吸光度;A空白为用无水乙醇代替样品测得的吸光度;A对照为用蒸馏水代替FeSO4溶液测得的吸光度。
1.3.8.5 菌悬液的制备
用移液枪吸取100μL供试菌种接种到灭菌的LB肉汤液体培养基中,在37℃条件下连续培养18h进行增菌,离心菌悬液并用磷酸缓冲盐溶液(phosphate buffered saline,PBS)清洗,收集菌体,在菌体中加入一定量的LB肉汤液体培养基进行稀释,使菌悬液在650 nm处的麦氏比浊度为0.5,此时菌悬液浓度为1×108CFU/mL。
1.3.8.6 抑菌圈的测定
抑菌试验采用牛津杯法,将已灭菌的LB琼脂培养基在无菌条件下倒入培养皿中,待LB琼脂培养基冷却凝固后,在每个培养皿中加入100 μL菌悬液并涂布均匀。取灭菌的牛津杯放于涂布了试验菌的LB琼脂培养基上,用移液枪吸取200 μL试液于牛津杯中,每个样品重复3次。将培养皿37℃恒温培养36 h,用十字交叉法测定抑菌圈的大小,取平均直径作为试验结果。以庆大霉素溶液作为阳性对照。
1.4 数据分析
响应面试验数据采用Design-Expert 12.0软件处理和分析;数据显著性分析用t检验法检验,P<0.05表示差异显著,P<0.01表示差异极显著;图表采用Origin 2021进行制作。
2 结果与分析
2.1 胡桃醌标准品测定
根据1.3.2的方法,利用双光束紫外分光光度计对胡桃醌标准品溶液进行全波长扫描。结果如图1a所示,得到吸光值最大峰处的波长为426 nm。在426 nm处测定不同浓度的胡桃醌标准品溶液的吸光度,得到胡桃醌标准曲线如图1b所示,标准曲线方程为y=15.179x+0.040 3,其中回归系数R2=0.999。
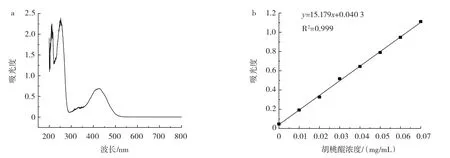
图1 胡桃醌标准品测定Fig.1 Determination of quinone standards from walnut
2.2 胡桃醌提取参数优化
2.2.1 单因素试验结果
2.2.1.1 乙醇浓度对醌类物质得率的影响
乙醇浓度对醌类物质得率的影响如图2所示。
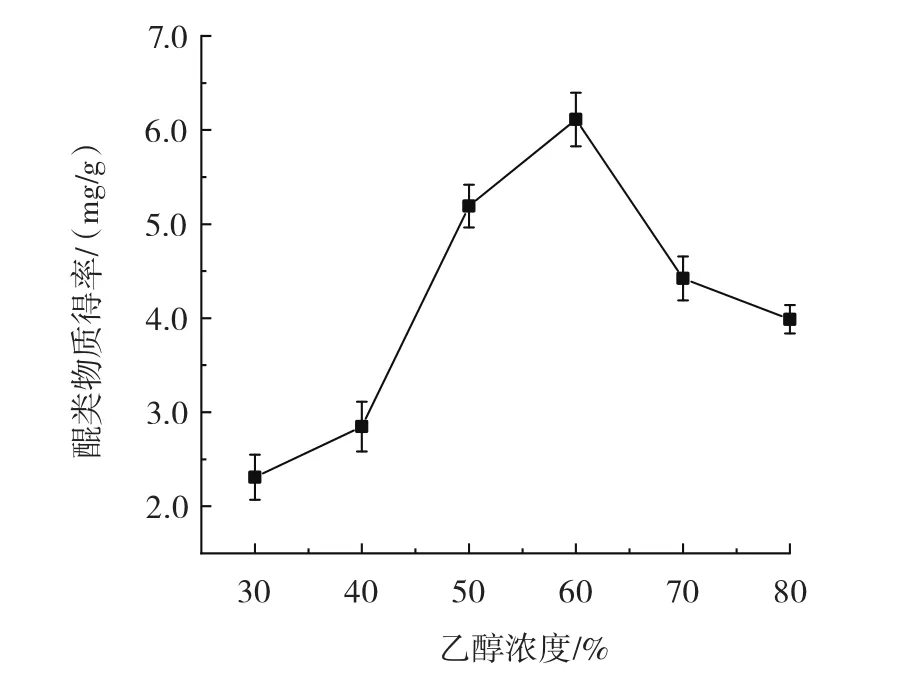
图2 乙醇浓度对醌类物质得率的影响Fig.2 Effect of ethanol concentration on the yield of quinones
由图2可知,随着乙醇浓度的增加,醌类物质得率呈先增加后降低趋势,在乙醇浓度为60% 时,达到最大得率6.11 mg/g;之后随着乙醇浓度的增大得率逐渐下降,可能是溶剂中水分越来越少,导致细胞通透性越来越差,细胞内的醌类物质向外扩散的难度变大,同时可能因为其他活性物质溶出会抑制醌类物质的溶解[12]。
2.2.1.2 超声时间对醌类物质得率的影响
超声时间对醌类物质得率的影响如图3所示。

图3 超声时间对醌类物质得率的影响Fig.3 Effect of ultrasound time on the yield of quinones
由图3可知,随着超声时间的延长,醌类物质得率呈先增加后降低趋势,在150 min时达到最大得率6.54 mg/g;之后随着超声时间的延长,得率逐渐下降,可能是超声波使得醌类物质受到破坏分解,或是与其它物质结合,使醌类物质得率降低。
2.2.1.3 料液比对醌类物质得率的影响
料液比对醌类物质得率的影响如图4所示。

图4 料液比对醌类物质得率的影响Fig.4 Effect of material-to-liquid ratio on the yield of quinones
由图4可知,随着溶液体积的增加,醌类物质得率逐渐增大,在料液比为 1∶25(g/mL)~1∶40(g/mL)时,得率增加幅度最大,料液比在1∶40(g/mL)后得率增加不明显,最大得率为6.57 mg/g。当料液比达到一定值后,醌类物质得率基本没有明显变化,是由于溶剂体积增大后醌类物质基本被提取完全。
2.3 响应面设计试验优选最佳工艺组合
响应面试验结果如表2所示,响应面结果方差分析如表3所示。

表2 响应面试验结果Table 2 Response surface test results
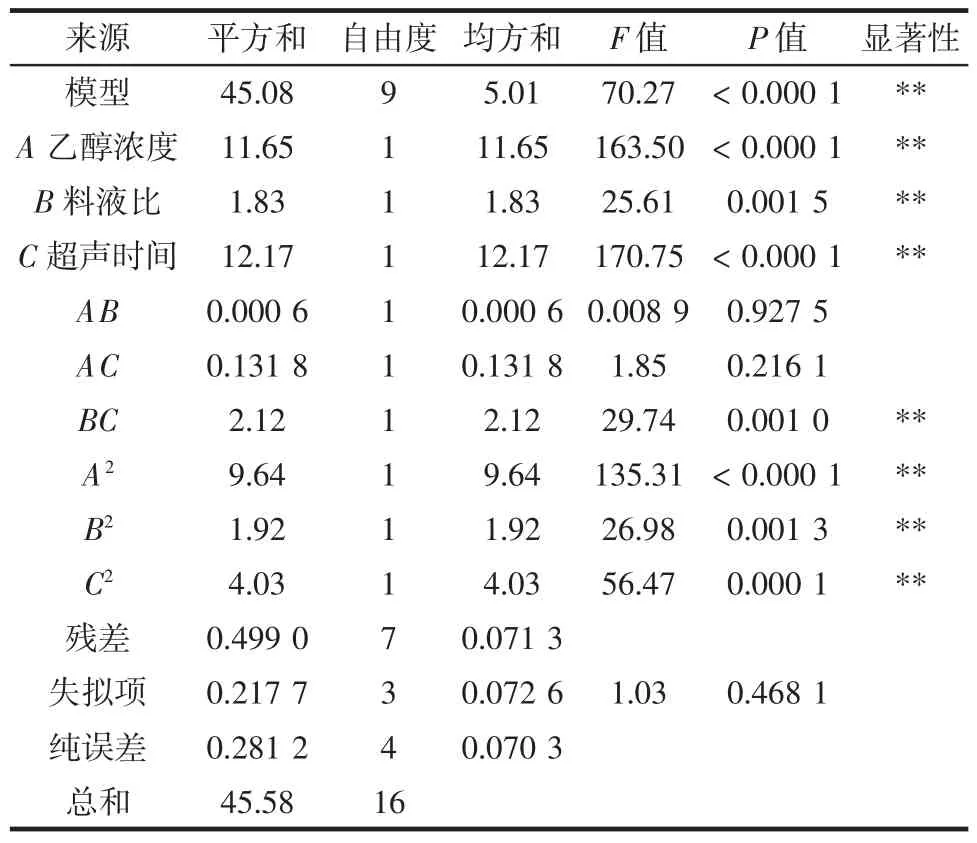
表3 响应面结果方差分析Table 3 Variance analysis of results of response surface test
通过回归分析,可以得到该模型的二次回归方程,即醌类物质得率:Y=7.66+1.21A+0.477B+1.23C-0.012 6AB+0.181 5AC-0.728 0BC-1.51A2-0.675 8B2-0.977 8C2。最佳提取条件为乙醇浓度64.4% ,料液比1∶39.93(g/mL),超声时间 170.31 min,预测最大醌类物质得率为8.34 mg/g。为了便于工业化操作的控制,对最佳提取条件进行修正,得到乙醇浓度65% ,料液比1∶40(g/mL),超声时间170 min为最优提取条件。通过对最优提取条件的实际操作,重复3次平行,得到醌类物质得率为8.31 mg/g。
模型P<0.01,说明该模型为极显著模型;失拟项P>0.05,说明失拟项不显著,因此该模型符合要求。其中该模型的R2=0.989 1,R2Adj=0.975 0,说明该模型的拟合性较好。
各因素交互作用对醌类物质得率的影响如图5所示。
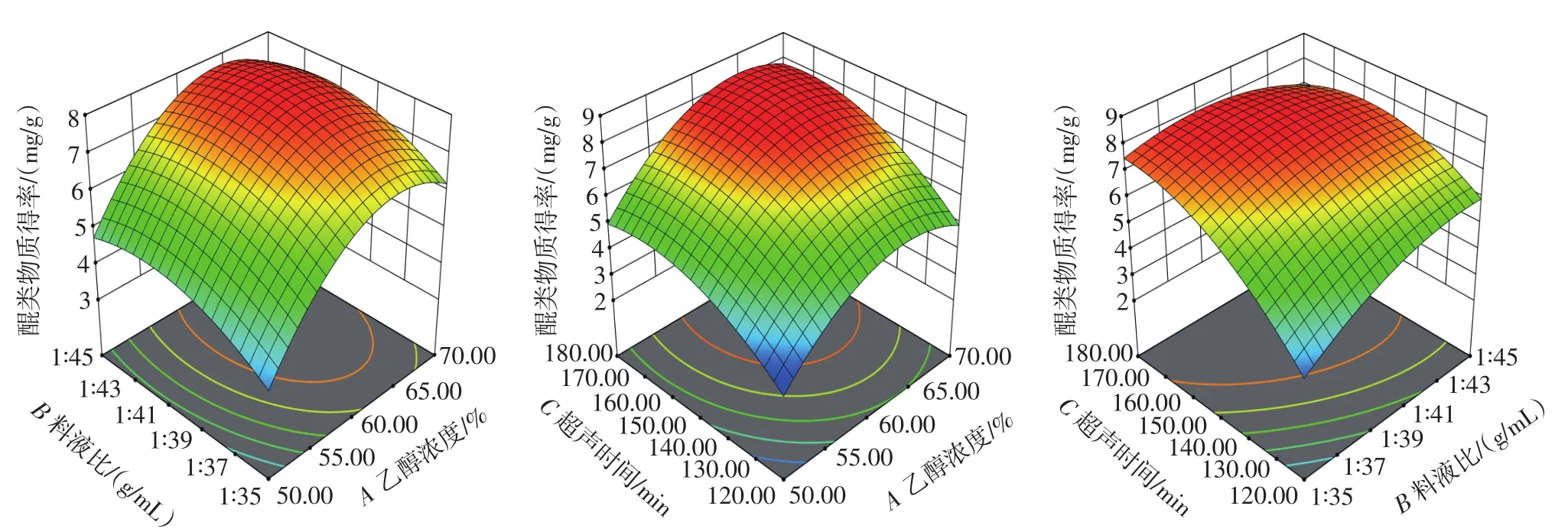
图5 各因素交互作用对醌类物质得率的影响Fig.5 Effect of interaction of various factors on the yield of quinones
通过对各因素进行方差分析可以发现,乙醇浓度、料液比、超声时间的影响极显著(P<0.01),乙醇浓度的二次方、料液比的二次方、时间的二次方影响极显著(P<0.01),料液比和超声时间的交互作用影响极显著(P<0.01)。其中各因素的影响顺序为:超声时间>乙醇浓度>料液比。
2.4 辐照强度对醌类物质提取效果的影响
辐照强度对醌类物质得率的影响如图6所示。

图6 辐照强度对醌类物质得率的影响Fig.6 Effect of radiation intensity on the yield of quinones
由图6可知,醌类物质的得率随辐照剂量的增加先上升后下降,在10 kGy~30 kGy时,得率随剂量的升高而增加。当辐照强度较小时,核桃青皮细胞破裂不充分,活性物质溶出较少,醌类物质得率较小;辐照强度达到30 kGy时,醌类物质的提取效果较好,得率为8.35 mg/g;而当辐照剂量超过30 kGy时,随着剂量的增大,醌类物质得率反而呈逐渐下降趋势。
核桃青皮辐照处理前后扫描电镜(scanning electron microscope,SEM)如图7所示。
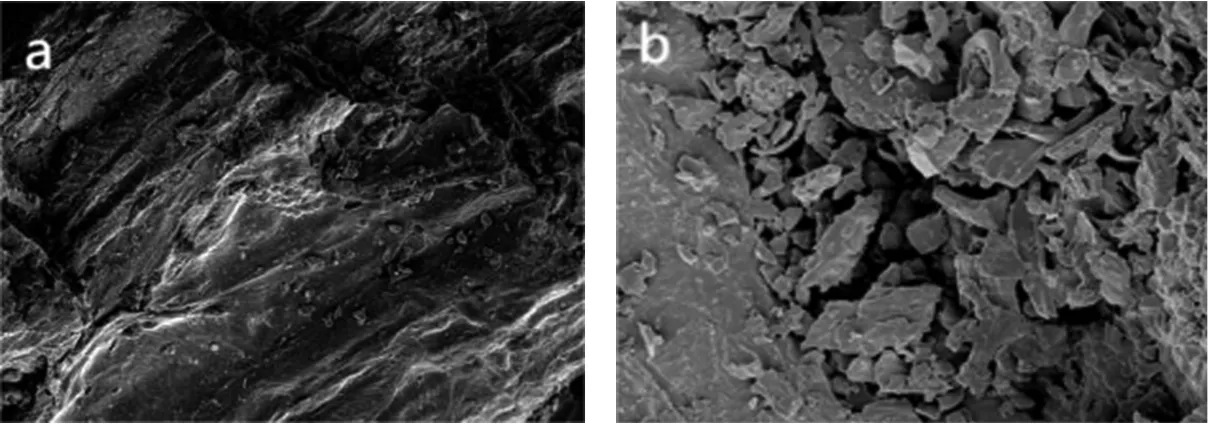
图7 核桃青皮粉末扫描电镜图Fig.7 SEM images of green walnut husk powder
在扫描电镜下观察,经电子束辐照处理后的核桃青皮组织细胞壁出现微断裂和断裂;未辐照样品的核桃青皮组织表面结构相对规则、致密和交联。在辐照剂量(30 kGy)下,核桃青皮粉末的表面微观结构比未辐照的样品更加不均匀和分散。同时,随着辐照剂量的增加,出现了大量的孔洞、碎片和裂纹。表明电子束辐照预处理改变了核桃青皮的内部和表面结构,包括孔隙度和渗透性,这能有效增强活性物质的溶解,提高活性物质得率。而当剂量超过30 kGy时,醌类物质得率逐渐下降,可能是过高剂量的电子束辐照对醌类物质结构有破坏作用,导致醌类物质分解而使其含量下降,得率降低。
2.5 不同萃取相的核桃青皮提取物抗氧化活性
2.5.1 DPPH·清除率
不同萃取相活性物对DPPH·的清除作用如图8所示。

图8 不同萃取相活性物对DPPH·的清除作用Fig.8 Scavenging effect of active compounds in different extract phases on DPPH·
由图8可知,核桃青皮乙醇提取液经过不同萃取相萃取后得到的提取物有一定的DPPH·清除能力。其清除作用随溶液浓度增大而增大,即DPPH·清除能力与提取液浓度有明显的正相关性。其中乙酸乙酯萃取相对DPPH·的清除效果最好,最大清除率可达95.8% ,二氯甲烷和石油醚相萃取得到的溶液对DPPH·的清除效果相差不大。
2.5.2 ABTS+·清除率
不同萃取相活性物对ABTS+·的清除作用如图9所示。

图9 不同萃取相活性物对ABTS+·的清除作用Fig.9 Scavenging effect of active compounds in different extract phases on ABTS+·
由图9可知,核桃青皮乙醇提取液经过不同萃取相萃取后得到的提取物有一定的ABTS+·清除能力。其清除作用随溶液浓度增大而增大,即ABTS+·清除能力与提取液浓度有明显的正相关性。其中乙酸乙酯萃取相对ABTS+·的清除效果最好,清除率最大可达70.7% ,二氯甲烷萃取相对ABTS+·的清除效果次之,清除率最大达57.7% ,石油醚萃取相对ABTS+·的清除效果最差,清除率最大仅43.2% 。
2.5.3 ·OH清除率
不同萃取相活性物对·OH的清除作用如图10所示。

图10 不同萃取相活性物对·OH的清除作用Fig.10 Scavenging effect of active compounds in different extract phases on·OH
由图10可知,核桃青皮乙醇提取液经过不同萃取相萃取后得到的提取物有一定的·OH清除能力,但总体效果不理想。其清除作用随溶液浓度增大而增大,即·OH清除能力与提取液浓度有明显的正相关性。其中石油醚萃取相对·OH的清除效果较差,最大为13.2% ,二氯甲烷和乙酸乙酯萃取相对·OH的清除效果相对较好,但相差不大,清除率最大分别为30.3% ,27.7% 。
2.5.4 不同萃取相的核桃青皮提取物抗氧化活性分析
由于石油醚、二氯甲烷、乙酸乙酯极性逐渐增大,萃取得到的物质极性也逐渐增大。据“相似相溶”原理,核桃青皮中抗氧化有效成分应多为极性较大的物质,易溶解在极性大的溶剂中,所以乙酸乙酯层抗氧化能力突出[22]。极性大的有机萃取物的结构中可能含有较多的羟基,由于羟基具有天然的抗氧化活性,核桃青皮中不同极性部位的抗氧化活性与其中天然物质的成分含量相关,而梯度萃取实现了核桃青皮乙醇提取物中抗氧化成分的富集,使核桃青皮乙醇提取物中具有抗氧化作用的成分主要集中在乙酸乙酯部位,从而导致乙酸乙酯相的抗氧化活性较强[23]。
2.6 不同萃取相的核桃青皮提取物抑菌活性
核桃青皮提取物的抑菌活性结果如表4所示。

表4 不同萃取相抑菌效果比较Table 4 Comparison of antibacterial effects of different extraction phases
由表4可知,核桃青皮乙醇提取液经不同有机相萃取后得到的活性物质均有一定的抑菌活性。不同萃取相对大肠杆菌的抑菌活性强弱依次为乙酸乙酯相>石油醚相>二氯甲烷相,对金黄色葡萄球菌的抑菌活性强弱依次为乙酸乙酯相>石油醚相>二氯甲烷相,对沙门氏菌的抑菌活性强弱依次为乙酸乙酯相>二氯甲烷相>石油醚相,对蜡样芽孢杆菌的抑菌活性强弱依次为乙酸乙酯相>石油醚相>二氯甲烷相。其中乙酸乙酯相的抑菌效果最好,尤其是对大肠杆菌的抑菌活性最强,抑菌圈直径达(13.81±0.42)mm。核桃青皮乙醇提取液经不同有机相萃取后得到的活性物质抑菌活性不同是由于不同的萃取相,萃取出来的活性物质不一样,石油醚、二氯甲烷、乙酸乙酯的极性逐渐增大,萃取出来的物质极性也逐渐增大,从而对不同的细菌有不同的抑菌效果。
3 结论
通过对核桃青皮提取条件的研究表明,电子束辐照耦合超声辅助提取核桃青皮醌类物质的适宜参数为核桃青皮粉碎60目,电子束辐照剂量30 kGy,乙醇浓度 65% ,料液比 1∶40(g/mL),超声时间 170 min,此条件下醌类物质得率达到8.35 mg/g。通过对核桃青皮乙醇提取液经过不同萃取相萃取后得到的提取物进行抗氧化活性评价得到,65% 乙醇提取物的不同有机溶剂萃取相活性物均有一定抗氧化能力,能清除DPPH·、ABTS+·、·OH,且乙酸乙酯相萃取物的抗氧化活性最强,对 DPPH·、ABTS+·、·OH 的清除率分别达 95.8% ,70.7% 和27.7% ;不同萃取相活性物对大肠杆菌、金黄色葡萄球菌、沙门氏菌、蜡样芽孢杆菌均有一定的抑制效果,其中乙酸乙酯相的抑菌效果最好,尤其是对大肠杆菌的抑菌活性最强,抑菌圈直径达(13.81±0.42)mm。适宜剂量的电子束辐照预处理能有效破坏植物细胞壁,促进活性物质溶出,提高活性物质提取效率,在天然产物提取中具有较好的应用前景。核桃青皮醌类等活性物质具有较好的抑菌和抗氧化活性,在开发为抑菌剂及抗氧化剂等综合利用上具有良好的潜力。

