固定化酶/细胞用于功能糖生物制造的研究进展
张佳旭,储子仪,吴振华,石家福
(天津大学环境科学与工程学院,天津 300072)
功能糖是一类糖类碳水化合物,具有一系列独特的功效,包括低热量、降血糖、抗龋齿、改善肠道菌群等,在医药与食品安全领域具有重要的应用前景[1-2]。作为蔗糖的重要取代物,功能糖具有巨大的市场发展潜力。功能糖工业化生产已成为新型生物制造产业链之一。大力发展绿色生物制造,应坚持绿色、交叉、创新、协调发展。基于酶催化和细胞催化的生物法合成功能糖路径契合绿色生物制造的基本内涵。为解决生物法中酶或细胞不能重复利用、稳定性差的问题,越来越多的固定化酶和固定化细胞技术被开发应用于功能糖生物制造。本文对用于功能糖生物制造的固定化酶或固定化细胞技术进行综述,以期为功能糖的绿色生物制造提供一定的参考。
1 功能糖
功能糖主要包括功能性单糖、功能性低聚糖、功能性糖醇等。功能性单糖是一类具有独特功效的单糖,包括甘露糖、阿洛酮糖、塔格糖、氨基葡萄糖等。一些单糖例如果糖,可通过肠壁吸收进身体,进入血流并储存起来。如果储存的时间足够长,某些碳水化合物将会转变成脂肪。而功能性单糖如D-阿洛酮糖,对脂肪肝酶有抑制作用,可阻止体内脂肪的堆积,对肠道α-糖苷酶有抑制作用,可抑制血糖浓度的升高。功能性低聚糖是指通过糖苷键将2个~10个单糖连接形成的直链或支链的低度聚合糖,包括异麦芽低聚糖、低聚果糖等。功能性低聚糖在进入大肠后会直接被双歧杆菌所利用,不会在人体肠胃道内被消化吸收[3]。功能性糖醇是含有2个以上羟基的多元醇类甜味剂,由相应糖分子上的醛基或酮基还原成羟基可得到糖醇,包括甘露醇、异麦芽酮糖醇、赤藓糖醇等。
目前功能糖的合成方法主要有化学法和生物法。较为常见的化学法为关环转换合成法和两步合成法,其存在反应条件苛刻、副产物多、产率较低、环境污染等问题。生物法通过酶催化转化合成功能糖。由于具有反应条件温和、特异性高、可持续性、环境友好等优点[4],近年来,越来越多基于生物法合成功能糖的路径被开发并投入工业应用。
2 功能糖的合成路径
基于生物法合成功能糖的路径主要分为单酶/多酶催化合成路径和全细胞催化合成路径两类。单酶催化合成路径的底物与产物单一,而多酶催化合成路径通过级联方式控制多个酶发生一系列反应,实现由低价值化学品到高价值功能糖的定向、高效、连续转换[5]。全细胞催化合成路径将全细胞、组织甚至个体作为催化剂,利用胞内酶进行催化。与酶催化相比,全细胞催化省去酶的纯化操作,从而降低经济成本。功能糖的合成路径决定了后续固定化技术中涂层的设计和制备。固定化酶材料的设计与制备需要考虑催化酶自身性质,如酶的尺寸、酶的最适温度、最适pH值等。固定化细胞材料的设计与制备需要考虑细胞自身性质,如细胞膜/壁的组成成分、细胞的最适温度、最适pH值等。
常用功能糖的单酶/多酶催化合成路径见表1。

表1 常用功能糖的单酶/多酶催化合成路径Table 1 Single-enzyme/multi-enzyme catalyzed synthetic pathways for commonly used functional sugars
目前功能糖的合成路径倾向于选择廉价易得、安全无毒的淀粉、葡萄糖、果糖等作为底物,选择转化率高的催化反应路径用于功能糖生物制造。常用功能糖的全细胞催化合成路径见表2。
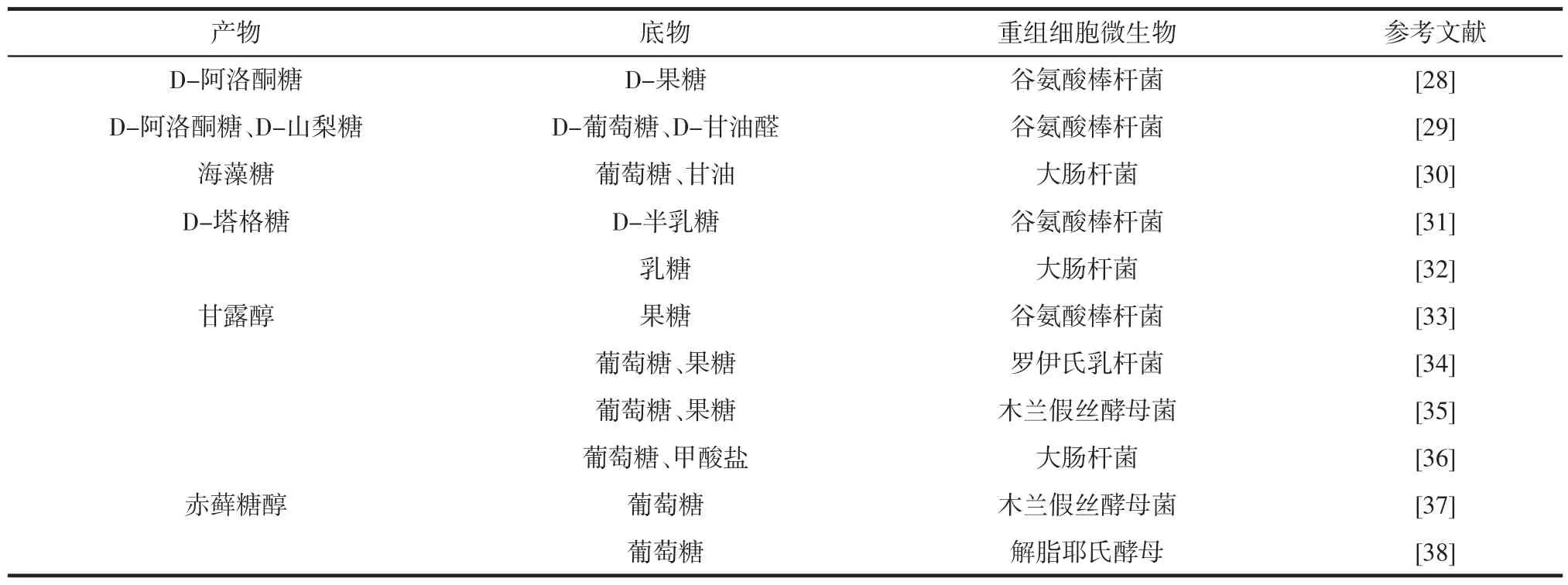
表2 常用功能糖的全细胞催化合成路径Table 2 Whole-cell catalyzed synthetic pathway for commonly used functional sugars
作为常见的构建酶表达重组细胞,大肠杆菌具备易培养、生长快、重组体稳定等优点,但含有内毒素,不能用于食品生产。与大肠杆菌不同,枯草芽孢杆菌由于无外膜,其分泌的蛋白质可以直接扩散到培养基中,且枯草芽孢杆菌为食品级,不含内毒素。酿酒酵母也具有易培养、生长快等特点,但其存在基因表达低、发酵时间长等不足。与其他微生物相比,谷氨酸棒杆菌可以同时利用多种碳源,且对芳香族化合物的耐受性更高[39]。
2.1 D-阿洛酮糖的合成路径
D-阿洛酮糖是D-果糖的C-3位差向异构体,甜度约为蔗糖的70%[40],热量值为0.007 kcal/g,能量为蔗糖的0.3%[41-42]。2014年,D-阿洛酮糖被正式批准为一般公认安全,可添加在食品、膳食补充剂以及医药制剂中[43]。D-塔格糖3-差向异构酶家族是一种催化酮单糖C-3位置使其发生异构化的酶,能够催化D-果糖转化为D-阿洛酮糖,包括D-塔格糖3-差向异构酶[44],D-阿洛酮糖3-差向异构酶[45],酮糖3-差向异构酶[46]。其中,D-阿洛酮糖3-差向异构酶在催化D-果糖转化为D-阿洛酮糖的反应中具有最高的效率,在2006年由Kim等[47]首次发现。通过使用D-葡萄糖异构酶和D-阿洛酮糖3-差向异构酶(来源于瘤胃菌),可从520 g/L的D-葡萄糖和380 g/L的D-果糖中获得135 g/L的D-阿洛酮糖,转化率为15%[7]。通过使用D-阿洛酮糖3-差向异构酶(来源于根癌农杆菌),可从700 g/L的D-果糖中获得230 g/L的D-阿洛酮糖,转化率为32.9%[8]。D-阿洛酮糖3-差向异构酶(来源于珀氏解黄酮菌)在谷氨酸棒杆菌中表达。通过使用经过透化处理的重组谷氨酸棒杆菌,可从750 g/L的D-果糖中获得235 g/L的D-阿洛酮糖,转化率和产率分别为31% 、353 g/(L·h)[28]。此外,最新的研究发现,通过热力学驱动的磷酸化/去磷酸化级联反应,使用几种嗜热酶可从10、50 g/L的麦芽糊精(淀粉衍生物)中分别获得48.5、217.8 mmol/L的D-阿洛酮糖,产率分别为88.2% 和79.2%[10]。
2.2 D-甘露糖的合成路径
D-甘露糖是D-葡萄糖的C-2差向异构体,甜度约为蔗糖的60%[48]。D-甘露糖异构酶[11]、D-来苏糖异构酶[12,49]、D-甘露糖 2-差向异构酶[13]和纤维二糖 2-差向异构酶[14]可将D-葡萄糖或D-果糖转化为D-甘露糖,具有实现D-甘露糖大规模工业化生产的潜力。通过使用纤维二糖2-差向异构酶(来源于极端嗜热纤维素降解菌),可从500 g/L的D-葡萄糖中获得75 g/L的D-甘露糖,转化率和产率分别为15% 、25 g/(L·h)[14]。通过使用来苏糖异构酶(来源于斯氏普鲁菲登菌),可从600 g/L的D-果糖中获得150 g/L的D-甘露糖,转化率和产率分别为25% 、75 g/(L·h)[49]。与来苏糖异构酶(来源于斯氏普鲁菲登菌)相比,甘露糖异构酶(来源于大肠杆菌)可得到相同的转化率和产率[11]。通过使用来苏糖异构酶(来源于海洋嗜热杆菌),可从400 g/L的D-果糖中获得101.6 g/L的D-甘露糖,转化率和产率分别为25.4% 、11.28 g/(L·h)[12]。通过两种D-甘露糖2-差向异构酶(分别来源于飘软古字状菌和双歧杆菌),可从500 g/L的D-葡萄糖中分别获得122、114 g/L的D-甘露糖,转化率分别为24.4% 、22.8% ,产率分别为2.54、2.38 g/(L·h)[13]。
2.3 D-塔格糖的合成路径
D-塔格糖甜度约为蔗糖的92% ,热量为蔗糖的38%[50]。D-塔格糖3-差向异构酶能够催化D-山梨糖转化为D-塔格糖,在20世纪90年代由Saburi等[20]首次发表。L-阿拉伯糖异构酶也可用于催化D-半乳糖合成D-塔格糖[51]。D-塔格糖的工业化生产中通常使用乳糖作为廉价原料,在偏酸性条件下水解为D-半乳糖,进而酶法合成D-塔格糖。通过使用L-阿拉伯糖异构酶(来源于植物乳杆菌)可两步法催化牛奶乳清粉中的乳糖转化为D-塔格糖,从140 g/L乳糖的牛奶乳清粉中获得51.5 g/L的D-塔格糖,产率为0.54 g/(L·h)[17]。通过使用L-阿拉伯糖异构酶(来源于植物乳杆菌WU14)生产D-塔格糖,转化率为69.6%[18]。
3 固定化技术
酶自身存在最适pH值、最适温度等约束条件,这对于实际工业操作是不利的。固定化酶/细胞后可提高酶的耐用性,扩大酶/细胞的适用范围。高温可抑制细菌的外来污染,提高反应速率,但对于游离酶,高温会直接降低酶活,影响酶的催化效率,对于细胞,高温会引起细胞凋亡,细胞的通透性发生变化,进而发生酶损坏或酶泄露,最终导致全细胞催化效率降低。固定化技术解决了这一问题,通常在固定化酶或固定化细胞后,酶的热稳定性提高,即可以在更高温度下保持活性,有利于功能糖的连续高效生产[52]。
3.1 固定化酶
酶固定化技术指将酶限制在不同于底物和产物存在的固体载体或基质上[53]。固定化酶的方法可分为吸附法(将酶吸附在载体上)、包埋法(将酶在载体内部封装)、交联法(酶不额外使用载体自固定)和共价法(载体上活泼的反应基团和酶形成共价键)[54]。相比游离酶,固定化酶可以循环使用,易于从反应体系中分离,因此生产成本降低。另外,固定化酶的稳定性通常高于游离酶,比如能够耐受一定高温,pH值耐受范围变广。但在固定化过程中可能存在一定的问题,如酶活损失,还有某些酶经固定化后底物特异性发生改变,这可能与底物结合口袋的变化有关[55]。为了解决这些问题,应针对不同种类酶的反应条件选择合适的载体和固定化方法,调控优化固定化条件。用于合成功能糖的固定化酶载体主要为天然高分子材料(海藻酸钠[16,56]、壳聚糖[26,57-59]等)、合成高分子材料(离子交换树脂[49,60-61]、环氧树脂[62-63]、聚丙烯腈[64]、聚乙烯醇[27,65]等)、纳米材料(有机-无机杂化纳米花[66]、氧化石墨烯[67-68]、纳米纤维素[69-70]、磁性纳米粒子[23,61]等)。
3.1.1 天然高分子材料
海藻酸钠是一种天然高分子多糖,成本低廉且具有良好的生物相容性,常被用于固定化酶领域。通过滴加法或乳化法,海藻酸钠分子链段中的羧基可以与多价阳离子(通常为钙离子)发生交联反应,使溶胶态转变为凝胶态。海藻酸钠通常与戊二醛共固定化酶,防止包埋在海藻酸钙微球中的酶泄漏。戊二醛作为交联剂,可用于连接酶和载体,但其戊二醛对酶蛋白具有一定的毒性,需控制戊二醛用量,减少对酶活的抑制作用。通过海藻酸钠与戊二醛的包埋-交联法,孙玉英等[56]对壳聚糖酶和β-D-氨基葡萄糖苷酶混合液进行固定,用于从壳聚糖中获得D-氨基葡萄糖,固定化酶的酶活为38.5% 。Rai等[16]通过同样方法对L-阿拉伯糖异构酶进行固定,用于生产D-塔格糖。在40℃~60℃下,固定化酶的酶活能保留在80% 以上。在填充床反应器中循环使用6次后,转化率可达90% 以上,第7次转化率降低至63% ,第8次转化率降低至44% 。
壳聚糖由甲壳素形成,甲壳素作为地球上存量最多的氨基多糖,主要分布于甲壳动物的壳中、真菌细胞壁等地方。壳聚糖带有大量活性氨基,属于阳离子聚电解质,可通过静电吸附作用与阴离子聚电解质发生聚集现象[71]。李晓波等[57]通过壳聚糖固定D-阿洛酮糖3-差向异构酶,并在填充床中利用固定化酶持续转化D-果糖为D-阿洛酮糖。固定化酶的酶活回收率可达45% ,且在填充床中反应的转化率和产率分别为24% 、6.7 g/(L·h),在反应168 h后,转化率仍然能保留13% 以上。将吸附与交联法相结合,耿梦华等[58]通过壳聚糖与戊二醛的吸附-交联法固定蔗糖异构酶(来源于重组短小芽孢杆菌)。固定化酶的酶活回收率最高可达70.3% ,异麦芽酮糖的产率达到87.8% 。固定化酶循环使用16次后,产率仍能保留87.52% 。Chen等[26]通过同样方法固定α-葡萄糖苷酶(来源于嗜热脂肪土芽孢杆菌),该固定化酶可与其他成本相对较低的游离酶和淀粉共同作为底物用于生产异麦芽低聚糖。纳米二氧化硅比表面积大,富含羟基基团,可由正硅酸乙酯的溶胶-凝胶过程形成,用于固定化酶领域[72]。纳米二氧化硅形成过程中,正硅酸乙酯水解生成硅羟基,硅氧基团之间会发生缩聚反应最终形成高度网络化结构。王艳君等[59]通过壳聚糖与正硅酸乙酯形成的溶胶-凝胶杂化载体与戊二醛固定壳聚糖酶,用于生产氨基葡萄糖。固定化酶在4℃条件下,酶半衰期约为28 d,循环使用10次后,酶活损失小于30% 。
3.1.2 合成高分子材料
常用于固定化酶的树脂主要为离子交换树脂和环氧树脂。离子交换树脂具备较高的机械强度,且树脂的粒径基本在 300 μm~800 μm,适合装柱,利于固定化酶与反应液的后续分离,但是固定化基本依赖于离子交换作用,酶负载少且在不利环境中易解吸。Li等[60]通过阴离子交换树脂D301固定D-阿洛酮糖3-差向异构酶(来源于重组短小芽孢杆菌),用于从D-果糖中获得D-阿洛酮糖。固定化酶的酶活为(24.06±0.80)U/g载体,产率为(90.0±2.8)% ,将其循环使用10次后,酶活仍能保留约70% 。Park等[49]通过使用Duolite树脂A568固定D-来苏糖异构酶(来源于斯氏普鲁菲登菌),可从300 g/L的D-果糖中获得75 g/L的D-甘露糖,23个周期后转化率和产率分别为25% 、75g/(L·h)。金辉[61]通过强碱性苯乙烯系阴离子交换树脂Amberlite FPA90 Cl固定D-甘露糖异构酶,固定化酶的酶活为19.21 U/g载体,将其循环使用8次后,酶活保留80.8% 。
环氧树脂不仅具有机械强度高、固定化酶易于从反应体系中分离的优点,也解决了离子交换树脂易解吸的问题。环氧树脂中的环氧基可与酶蛋白表面的基团(如氨基、巯基)反应会形成牢固的共价键,酶稳定不易解吸。Torres等[62]将β-半乳糖苷酶、L-阿拉伯糖异构酶和D-葡萄糖异构酶单独固定并共同固定在环氧树脂Eupergit C和Eupergit C 250 L上,用于生产塔格糖。具有共固定化稳定三酶系统的单反应器工艺可实现完全乳解,产生45% 的D-塔格糖和39% 的D-果糖,D-塔格糖产率为9.5 g/(L·h)~10 g/(L·h),可循环使用至少12次。Bu等[63]采用离子交换、共价结合、戊二醛交联法,将D-阿洛酮糖3-差向异构酶固定在环氧树脂Reli Zyme HFA403/M上,固定化酶的酶活为103.48 U/g载体。引入甘氨酸使甘氨酸的氨基与固定化酶残余的环氧基、醛基发生反应,可阻断残余基团与酶蛋白的进一步结合,控制过度共价结合。在循环使用8次后,未经甘氨酸阻断和经甘氨酸阻断的固定化酶的酶活分别保留89.98% 和105.43% 。
聚丙烯腈是一种由85% 以上丙烯腈与第二、第三单体聚合而成的高分子聚合物[73],稳定性好、膜易形成、成本低廉,常用于工业化生产的分离过程。娄倩芳等[64]通过聚丙烯腈吸附将海藻糖合酶固定,可用于生产海藻糖。在40℃、pH7.4和底物浓度为200 g/L条件下生产海藻糖,固定化酶在循环使用6次后,酶活仍保留64.4% 。聚乙烯醇作为另一种水溶性高分子聚合物,由于其可生物降解性、高机械稳定性等优势被应用于固定化酶领域[74]。聚乙烯醇与海藻酸钠共固定化酶可弥补海藻酸钠强度较低、热稳定性差、酶泄漏率大的缺点。通过聚乙烯醇-海藻酸钠固定重组蔗糖异构酶,固定化酶的酶活回收率为82.4% ,可催化蔗糖产生620.7 g/L的异麦芽酮糖,反应13个批次后转化率仍能保持90% 以上[65]。蔗糖异构酶固定在聚乙烯醇-海藻酸钠上,也可用于催化甜菜糖蜜生产异麦芽酮糖。固定化酶的酶活回收率为82.4% ,反应8个批次后转化率仍能保留97.5% ,异麦芽酮糖浓度为(446.4±5.5)g/L(纯度 85.8% )[27]。
3.1.3 纳米材料
纳米材料作为一种新型的固定化酶载体,因其比表面积大、表面易于修饰、与酶分子尺寸相近等优点,具有潜在的应用价值[75]。纳米材料可通过是否具有磁性来分类。用于合成功能糖的非磁性纳米材料种类较多,Zheng等[66]使用D-阿洛酮糖3-差向异构酶作为有机成分,磷酸钴作为无机成分,制备有机-无机杂化纳米花,用于从D-果糖中获得D-阿洛酮糖。在60℃和pH8.5条件下,纳米花的酶活为36.2 U/mg,比游离酶高约7.2倍,在循环使用6次后酶活仍能保留90% 。氧化石墨烯作为基于石墨烯的纳米材料,具有高比表面积、出色的热稳定性和机械性能[76]。Zhang等[67]通过氧化石墨烯固定蔗糖异构酶(来源于欧文氏菌属),用于从蔗糖中获得异麦芽酮糖。在40℃和pH6.0条件下反应180 min后,转化率为95.3% ,在循环反应10个批次后,酶活仍能保留80% 左右。通过氧化石墨烯固定D-阿洛酮3-差向异构酶(来源于根癌农杆菌),在60℃条件下固定化酶的半衰期为720 min,约是游离酶的180倍,且可循环使用10次[68]。Gennari等[69]分别使用微晶纤维素、碱性纳米纤维素和酸性纳米纤维素对β-半乳糖苷酶进行固定,用于合成低聚半乳糖。3种固定化酶的酶活分别达到 106.88、115.03、108.47 IU/g载体。通过物理吸附将β-半乳糖苷酶固定在埃洛石(一种铝硅酸盐纳米材料)上[70],将埃洛石吸附酶包裹在硫酸化细菌纤维素纳米晶体的多孔基质中,进一步提高稳定性。在25℃条件下,固定化酶在反应60 d后,酶活仍能保留75.8% ,而游离酶的酶活仅保留29.2% 。Ran等[77]通过功能化聚羟基脂肪酸纳米粒子固定D-塔格糖3-差向异构酶(来源于重组无内毒素大肠杆菌),用于从D-果糖中获得D-阿洛酮糖。固定化酶的酶活高达649.3 U/g载体,但粒径仅为50 nm~200 nm,需要依赖离心的方式将固定化酶从反应体系中分离。
磁性纳米材料通过共价结合法固定化酶,在外部磁场的作用下解决了后续操作中酶难以分离回收的问题。Panek等[23]通过戊二醛活化的硅烷化磁性氧化亚铁将重组海藻糖合酶固定,用于从麦芽糖中获得海藻糖。固定化酶在循环反应12次后,酶活仍能保留82% 。金辉[61]通过壳聚糖改性的磁性四氧化三铁纳米粒子将D-甘露糖异构酶固定,用于从D-果糖中获得D-甘露糖。固定化酶在循环反应6个批次后,酶活保留26.19% 。反应连续进行11 h后,D-甘露糖的浓度达到最大值76.64 g/L。
3.2 固定化细胞
不同于化学法和传统酶催化法,全细胞催化法合成功能糖无需补充昂贵的辅因子,也无需酶的纯化和分离,可大大降低成本,具有底物来源广、反应无污染、产物纯度高的优点。固定化细胞是指利用物理或化学的方法(吸附法、包埋法、共价法和交联法)将细胞固定在一定材料中,从而促进细胞回收和再循环[78]。20世纪90年代,固定化细胞被首次用于工业生产,固定化大肠杆菌实现了L-天冬氨酸的工业化生产[79]。固定化细胞载体有无机载体(硅藻土[80]、多孔玻璃[81]等)、有机载体(海藻酸钠[82]、壳聚糖[52]、晶胶介质[83]等)、复合载体(聚乙烯醇-海藻酸钠[84]、硅藻土-海藻酸钠[85]、海藻酸钠-二氧化钛[86]等),其中复合载体为两种固定方法共同作用,例如吸附-交联法、吸附-包埋法[87]。
作为常用的细胞固定方法,基于海藻酸钠的包埋法操作较为简便。将菌悬液与海藻酸钠溶液混合后,向溶液中滴入氯化钙溶液,即得到含有菌体的海藻酸钙微球,这种方法得到的固定化细胞再利用率提高了37.3%[88]。张煊钧[82]通过海藻酸钠包埋重组菌,用于生产D-塔格糖。反应时间为36h,底物浓度150g/L时,固定化细胞的酶活可达29U/mL,在反应3个批次后,酶活约为27U/mL,反应4个批次后,酶活仍能维持21 U/mL左右。李秋喜等[89]通过海藻酸钠与戊二醛的包埋-交联法固定化大肠杆菌,用于生产D-阿洛酮糖。固定化细胞的酶活回收率为76% ,在循环使用8次后,酶活仍能保留60% 以上。在形成海藻酸钙微球前加入硅藻土可以扩大微球内孔道,得到催化活性更高的细胞。孙帆等[85]通过硅藻土-海藻酸钠的吸附-包埋法固定重组枯草芽孢杆菌,用于生产D-阿洛酮糖。固定化细胞酶活回收率为64% ,连续反应7个批次后转化率为28% ,酶活仍能保留81% 。在海藻酸钠溶液中加入二氧化钛可减少固定化细胞中的细胞泄露,增大了机械强度。但其使用注射器将混合液缓慢滴入氯化钙中的方式比较繁琐,且颗粒之间由于滴入时间的不同,导致颗粒的硬化时间存在较大误差。魏玉霞等[86]通过海藻酸钠-二氧化钛固定重组枯草芽孢杆菌,用于生产D-阿洛酮糖。固定化细胞的酶活回收率为82% ,在循环使用10次后,酶活回收率仍保留58% 。
壳聚糖与戊二醛的吸附-交联法是另一种简单有效的细胞固定方法。Hirose等[52]在白蛋白存在下通过壳聚糖与戊二醛固定放射土壤杆菌细胞,用于生产D-甘露糖。固定化酶的转化率在20% ~23% ,半衰期约为60 d。反应14 d后,180 mL流出液中积累多达9 g的D-甘露糖。
4 结论与展望
固定化酶和固定化细胞技术的运用将成为功能糖生物制造未来的发展趋势,天然高分子、合成高分子和纳米材料已被开发用于固定化酶/固定化细胞合成功能糖。目前,大部分研究的重点在于功能糖合成路径的构建,如高表达菌株的构建以及多基因的共表达菌株的构建。用于功能糖生物制造的固定化酶和固定化细胞研究较少,还需要在以下几个方面做出努力:(1)引入高性能、低成本的固定化新材料,在一定程度上维持固定化酶/固定化细胞的酶活,延长固定化酶/固定化细胞的使用寿命,进而大大降低功能糖的生产成本;(2)消除功能糖合成过程中可能产生的副反应,如美拉德反应,提高目标产物的产量;(3)构建适于固定化技术的反应器,如填充床反应器,通过批次反应、放大试验,实现功能糖连续、稳定、规模化合成,促进绿色生物制造产业发展。

