红海藻多糖提取、分离纯化及生物活性研究进展
郭建行,贾颂华,李博润,李珊珊,冀晓龙,2,3*,刘延奇,2,3*
(1.郑州轻工业大学食品与生物工程学院,河南 郑州 450001;2.食品生产与安全河南省协同创新中心,河南 郑州 450001;3.河南省冷链食品质量安全控制重点实验室,河南 郑州 450001)
地球表面大约70% 的面积被海洋覆盖,海洋中拥有丰富的海洋生物资源。大型藻类是其中之一,被人们广泛利用的主要有红藻门、褐藻门以及绿藻门三大类[1],在生产上具有很高的经济价值和发展潜力[2-3]。红海藻(Bangia fusco-purpurea)主要生长在太平洋和大西洋的亚热带和温带海域,广泛分布于我国福建等沿海地区。红藻种类繁多,包括紫菜、麒麟菜、石花菜、角叉菜、龙须菜、江蓠、马尾藻等属植物,红海藻含有丰富的营养成分,是海藻中营养价值最高的天然水产之一[4]。据农业百科全书记载,红海藻是一种兼具药食两用价值的物质,具有滋阴祛火及预防疾病等作用[5],是一种畅销的海洋绿色植物。红海藻中含有许多生物活性成分,如多酚、黄酮、多糖、多种维生素(VA、VC、VE等)、多不饱和脂肪酸等[6-8]。
近年来,对于红海藻的研究主要集中在多酚、黄酮等活性物质,但随着糖化学和糖生物学技术的快速发展,红海藻多糖也逐渐成为国内外学者研究的热点。由于红海藻多糖具有特殊的结构特征和生物学特性,使其成为功能性食品和保健食品的来源;其生物活性主要包含抗氧化、免疫调节、抗病毒、抗癌和调节肠道菌群等[2,9-10]。红海藻多糖的生物活性与其理化结构密切相关;因此,研究红海藻多糖的结构特性是探索生物活性的基础[11]。本文以红海藻多糖的国内外近期的研究成果为基础,综述红海藻多糖的提取、分离纯化、理化性质及结构特征、生物活性的研究现状,以期为红海藻多糖构效关系研究提供理论依据,为进一步开发红海藻多糖生物制品提供参考。
1 红海藻多糖的提取、分离纯化
1.1 红海藻多糖提取
提取红海藻多糖前需要对原料进行预处理,即清洗红海藻,对新鲜红海藻进行脱水干燥处理(常用的干燥方法有热风干燥、真空冷冻干燥、旋转干燥以及辐射干燥[12]等),然后对干制品进行粉碎过筛得红海藻粉[13-14],红海藻多糖的提取、纯化、结构特征及生物活性如图1所示。
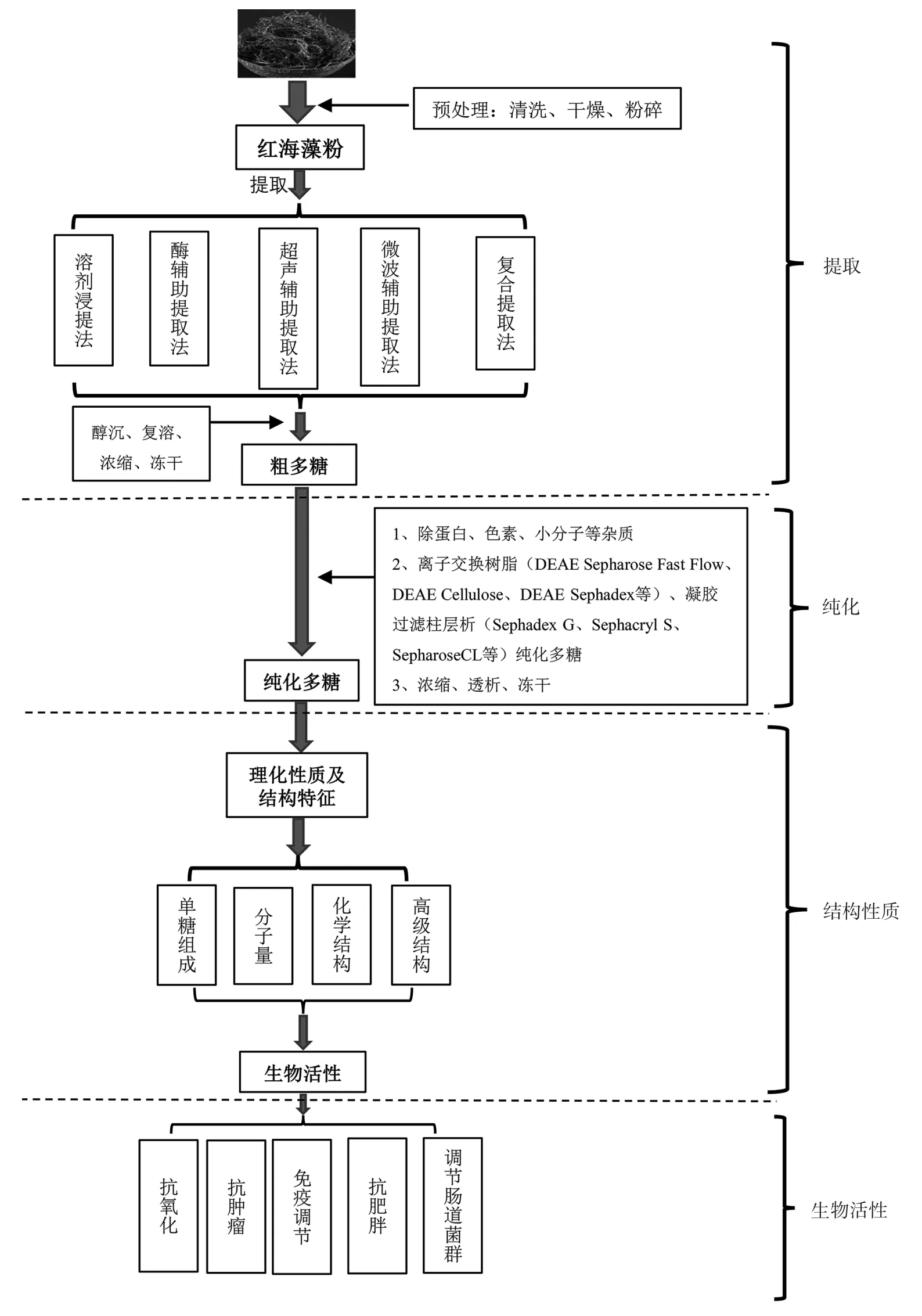
图1 红海藻多糖的提取、纯化、结构特征及生物活性示意图Fig.1 Schematic diagram of extraction,purification,structural characteristics,and biological activity of polysaccharides from red seaweed
红海藻的品种、生长条件、提取条件以及提取方法等因素都会影响红海藻多糖的提取率,甚至对多糖结构生物活性产生一定的影响[2,15]。红海藻多糖的提取方法有很多,主要包括溶剂浸提法(热水浸提法、碱浸提法、酸浸提法)、酶辅助提取法、超声辅助提取法、微波辅助提取法等,主要相关方法的原理及评价见表1。

表1 红海藻多糖提取方法及评价Table 1 Extraction method and evaluation of red seaweed polysaccharides
1.2 分离纯化
提取的红海藻粗多糖通常含有蛋白质、色素以及小分子化合物等杂质,对多糖结构分析和生物活性有较大的影响,所以杂质的去除十分重要。去除红海藻多糖中的蛋白质通常采用Sevag法、三氯乙酸法、酶法。Sevag法除蛋白成本低、效果好,但经过多次操作多糖损失大;三氯乙酸法操作简单,但是会破坏多糖结构;酶法除蛋白效果更好,虽不引入有机试剂,但耗时长、成本高,不适用于工业生产[25]。当红海藻粗多糖有颜色时,需要进行脱色处理,常用的脱色方法有活性炭吸附法、过氧化氢氧化法、大孔树脂吸附法。其中过氧化氢氧化法脱色效果最好,但须严格控制过氧化氢的用量,否则会导致多糖降解,目前应用范围较广的脱色技术是树脂吸附法[2,26]。对于多糖中的小分子化合物一般会采用膜分离技术[27],根据多糖分子量大小选取不同分子量截留膜,由于其操作简单,易获得膜材料,能够用于未来工业化生产。
为了得到纯度更高的多糖,还需对红海藻粗多糖做进一步的分离纯化,常用的分离纯化方法主要有阴离子交换树脂(DEAE Sepharose Fast Flow、DEAE Cellulose、DEAE Sephadex等)和凝胶过滤柱层析(Sephadex G、Sephacryl S、Sepharose CL等),它们是纯化红海藻多糖最有效的方法之一[28],最后用不同浓度梯度的NaCl进行洗脱、收集、浓缩、透析、冻干得到纯化的红海藻多糖。Jiang等[29]采用Sephacryl S-400对提取的红海藻多糖进行纯化得到均一的红海藻多糖。Geng等[30]采用Sephadex G-200对提取的粗多糖进行纯化,得到两种红海藻多糖。通过柱层析纯化可以获得高纯度的红海藻多糖,能够更进一步地对红海藻多糖结构进行解析,研究其生物学功能,以便深入挖掘红海藻多糖构效关系及其生物活性作用机理。
2 红海藻多糖的理化性质及结构特征
红海藻多糖生物活性与结构密切相关,探究红海藻多糖结构对研究生物活性及潜在构效关系具有十分重要意义。红海藻多糖的理化和结构特征主要包括单糖组成、分子量、糖苷键的类型、糖苷键的构型以及糖苷键的位置。目前主要采用化学分析、光谱分析以及色谱分析技术来确定多糖化学结构,包括甲基化分析、Smith降解、气相色谱、液相色谱、凝胶色谱、核磁共振等。红海藻多糖种类、提取方法、分离纯化方法都会对多糖结构产生影响。
2.1 理化特性
红海藻多糖易溶于水,不溶于乙醇等有机试剂,纯化后的多糖在260、280 nm处无紫外吸收峰,说明不含蛋白质和核酸,在红外光谱下检测出多糖特征吸收峰。
2.2 平均分子量
红海藻多糖理化性质及生物活性与其分子量密切相关,通常采用高效液相凝胶色谱(high performance gel permeation chromatography,HPGPC) 结合多角度激光光散射折射率检测器(multiangle laser light scattering-refractive index detector,MALLS-RID) 测定多糖分子量[31]。红海藻多糖分子量一般分布在30kDa~610kDa,红海藻多糖理化特性、化学结构及药理活性如表2所示[11,29,32-37]。
研究表明,一般植物多糖分子量在90 kDa以上时,基本上都能形成三股螺旋结构并具有生物活性[38]。测定红海藻水溶性组分及碱溶性组分分子量分布在6 kDa~2 400 kDa,且不同浓度的多糖分子量分布在10 kDa~1400 kDa,分子量分布广泛与多糖组分复杂程度以及多糖溶解度有关[39]。从紫菜中提取的多糖分子量分布在7.86 kDa~600 kDa[40],龙须菜多糖平均分子量为157 kDa[31],这些多糖分子量的差异可能是由于不同生长环境因素、不同提取条件以及不同纯化方式造成的。如超声辅助提取马尾藻多糖,经过超声处理后多糖分子量降低,这是因为长时间超声波辅助提取会破坏多糖的分子链,使多糖主链断裂进而导致分子量降低[41]。

表2 红海藻多糖理化特性、化学结构及药理活性Table 2 Physicochemical properties,chemical structure,and pharmacological activity of red seaweed polysaccharides
2.3 单糖组成
多糖主要由单糖和糖醛酸组成,分析红海藻多糖、单糖组成是研究结构与生物活性的前提。红海藻多糖经过三氟乙酸水解糖苷键和衍生化后,通常用气相色谱、高效液相色谱和质谱技术联用研究红海藻多糖单糖组成。Malafronta等[42]采用不同的方式处理方式红海藻多糖,研究发现经过处理后果糖、半乳糖、木糖、甘露糖、葡萄糖醛酸含量下降,而甘露糖醛酸、半乳糖醛酸含量升高,表明经过高压均质和超滤处理后单糖含量增多。Yu等[11]从不同海域收集提取红海藻多糖,它们主要由半乳糖、葡萄糖、木糖、果糖、阿拉伯糖和甘露糖组成,但不同海域单糖含量比例不同。Cui等[34]对红海藻多糖进行纯化,并对纯化组分进行单糖分析,研究发现中性糖主要由半乳糖和木糖组成。红海藻多糖的单糖组成主要受多种因素影响,如不同来源、提取纯化方法以及生长条件等因素。
2.4 一级结构
关于红海藻多糖的一级结构通常采用高碘酸氧化、甲基化、Smith降解、核磁共振技术来确定多糖骨架和分支结构(表2)。另外采用DEAE-Cellulose离子交换色谱以及Sephacryl凝胶渗透色谱对红海藻多糖进行分离纯化,利用甲基化反应、红外光谱、核磁共振技术对纯化组分进行结构解析,推断多糖主链以及重复单元。 LJP-11 主链主要包含 1,3,6-Manp、1,4-Glcp;LJP-12 主链主要包含 1,4-Manp、1-α-D-Galp、1,3,6-Manp、1,6-Glup;LJP-31 主链主要包含 1,3,6-Manp、1,4-Glcp、1-β-L-Araf、1-α-D-Glap、1,4-Manp[43-44]。Jiang等[29]采用Sephacryl-400分离纯化红海藻多糖,利用Smith降解、甲基化分析、高碘酸盐氧化、核磁共振技术对纯化组分进行结构解析,BFP主链主要由(1→3)-β-D-Galp、(1→3)-β-D-Galp6S-(1→ 4)-α-DGalp、(1→4)-α-D-Galp-(1→ 4)-α-L-Galp-(1 → 3)-β-D-Galp、(1→4)-α-D-Galp 组成。 采用强阴离子交换色谱和凝胶渗透色谱对海藻多糖进行分离纯化,对纯化组分HP2S进行主链结构解析,HP2S主链主要由(1→2)-Rhap、(1→3)-Rhap 和(1→2,3)-Rhap 构成,且硫酸根也位于碳链上组成硫酸化多糖[45]。通过研究红海藻多糖的结构,以探索它们的构效关系及生物差异是至关重要的。
2.5 高级结构特征
植物多糖空间结构复杂,现有关海藻多糖高级结构研究主要有扫描电镜、原子力显微镜、X-射线衍射等方法对多糖高级结构进行表征[46]。海藻多糖作为生物抑菌膜,在扫描电镜下呈连续、无孔、光滑、无裂纹的形貌,且有扩散宽的衍射峰,表明多糖形成的膜是高结晶度的非晶态性质[47]。Lakshmi等[48]从海藻中提取的海藻多糖在扫描电镜下呈现较小微孔的海绵状结构,在X-射线衍射中有3个弥散峰。而且高浓度的多糖在原子力显微镜中呈现多个分子相互缠绕、折叠,形成紧密稳定的网状结构。多糖生物活性与空间结构密不可分,对多糖高级结构的研究有助于阐明多糖的构效关系。
3 红海藻多糖生物活性
近年来,随着对红海藻多糖研究的不断深入,对其生物活性有了更全面的发现,免疫调节、抗肿瘤、抗氧化、调节肠道菌群等生物活性对人类健康有不同程度的促进作用。
3.1 抗氧化
在生物体内会产生各种活性氧自由基,导致细胞氧化损伤,从而导致机体各种疾病的发展,如心血管疾病、神经性疾病、癌症、肾脏疾病、动脉硬化以及糖尿病等,这是由于过多的氧自由基破坏了活性氧水平和自由基清除之间的平衡[49]。植物中含有许多天然活性成分被筛选出来作为抗氧化剂,尤其是多糖,具有很高的抗氧化能力。
体外自由基清除试验是测定红海藻多糖清除自由基能力的方法,包括ABTS+自由基清除率、DPPH自由基清除率、还原力、超氧阴离子自由基清除能力、铁离子还原能力等都被用于测定红海藻多糖抗氧化能力。Jaballi等[33]采用DPPH法测定从红海藻多糖分离CCP组分的抗氧化能力,在浓度为2 mg/mL时,红海藻多糖分离组分具有几乎和没食子酸相同的抗氧化活性。从江蓠中提取纯化的多糖组分对超氧阴离子自由基和ABTS+自由基具有很强的清除能力,IC50为2.5 mg/mL,同时还能抑制脂质氧化[50]。从龙须菜中分离出不同组分的多糖,它们抗氧化能力和浓度呈正相关,其中龙须菜多糖分离组分抗氧化活性最强。在体内抗氧化实验中,以江蓠中分离出的硫酸多糖,对大鼠进行腹腔注射,氧化应激反应有明显效果,且各剂量均能提高过氧化氢酶和超氧化物歧化酶活性[51]。红海藻多糖在体内外都显示出了良好的清除自由基能力,因此可以作为食品添加剂或功能性保健产品原料。
3.2 抗肿瘤
目前植物多糖发挥抗癌作用的机制是通过激活宿主免疫反应发挥抗癌活性,诱导癌细胞凋零,直接作用于癌细胞将其杀死或抑制其生长[52]。He等[53]从条斑紫菜中分离出的两种多糖PYP-20、PYP-50对正常人肝细胞HL-7702没有毒性,但可以抑制Hep3B、HeLa和MDA-MB-231等癌细胞的增殖。朱正日等[54]探讨海藻多糖对H22肝癌小鼠抗肿瘤作用机理时发现海藻多糖能够抑制癌细胞生长,增强机体免疫能力,同时下调Bcl-2基因表达,达到抑癌效果。通过对比分离后多糖的分子量及结构,发现低分子量多糖片段对肿瘤细胞的抑制效果最好。
3.3 免疫调节
红海藻多糖具有独特的生物活性,尤其是免疫调节活性,不仅可以保护相关免疫器官,还可以增强巨噬细胞、淋巴细胞、自然杀伤细胞等免疫细胞功能[55]。巨噬细胞是主要的免疫细胞之一,主要通过吞噬功能发挥免疫活性。红海藻多糖通过激活NF-κB和p38MAPK信号通路增强RAW264.7细胞的吞噬功能[56]。
研究发现,红海藻多糖的免疫调节活性与多糖分子量大小以及多糖取代度有关。从红藻中提取纯化了4 种多糖组分 PHPD-Ⅰ、PHPD-Ⅱ、PHPD-Ⅲ、PHPD-Ⅳ并对其进行免疫活性比较,发现最低分子量组分(PHPD-Ⅳ)具有最高的免疫调节活性。对活性最高的组分PHPD-Ⅳ进行纯化,纯化组分PHPD-Ⅳ-4能明显上调ERK1/2、JNK和p38的磷酸化水平,并呈剂量依赖性[57]。利用硫酸盐修饰龙须菜多糖可以显著提高吞噬细胞RAW264.7的吞噬增殖能力,并通过激活诱导型一氧化氮合酶、白细胞介素-6和肿瘤坏死因子-α基因表达,促进活性氧、一氧化氮、白细胞介素-6和肿瘤坏死因子-α的产生[56]。综上所述,红海藻多糖的免疫调节能力主要是抑制MAPK、ERK1/2、NF-κB的活性,促进细胞因子的分泌和巨噬细胞的吞噬作用来实现的,但是对红海藻多糖的免疫活性与结构的关系缺乏系统的研究。
3.4 抗肥胖
长期使用抗肥胖药物会引起严重的副作用,如胃肠道不良反应、肝肾功能损伤等,对身体产生严重危害[58]。因此,探索更加安全有效的药物或功能性食品预防和治疗肥胖已成为新的研究热点。抑制脂质的合成是有效的抗肥胖方法,高脂饮食会导致体重、体脂、胆固醇水平异常。在高脂食品中添加红海藻多糖可以降低小鼠体重、肝脏脂肪以及血浆中胆固醇含量,多糖通过抑制SREBP-2和HMGR基因表达,使胆固醇转化为胆汁,从而抑制胆固醇合成;(1→4)-β-D-Glu 单元通过抑制甘油三酯转移蛋白基因、肝脏脂肪酸结合蛋白基因以及肠道脂肪酸结合蛋白基因的表达来降低脂肪含量[59]。硫酸化海藻多糖和龙须菜多糖通过抑制α-淀粉酶和α-葡萄糖苷酶活性来达到抗肥胖作用[60]。将红海藻多糖作为食品添加剂,研发抗肥胖和抗糖尿病的食品,以达到减脂的效果。
3.5 调节肠道菌群
植物多糖通过调节肠道菌群结构功能、维护肠道屏障完整性来改善肠道微生物菌群稳定,并为机体提供能量以及代谢产物。红海藻多糖在唾液、胃以及小肠中的消化系统中缺乏相应的酶无法被消化吸收,但被盲肠和结肠中的微生物群代谢吸收[61]。短链脂肪酸是结肠细菌发酵代谢的主要产物,对宿主胃肠上皮细胞完整性、免疫功能、食欲调节和葡萄糖稳态有重要影响。喂食高脂饲料小鼠体内的短链脂肪酸水平显著下降,而在添加红海藻多糖时短链脂肪酸水平上升[62-63]。红海藻多糖还能够改善肠道微生物区系的组成和丰度,例如龙须菜中提取的硫酸化多糖能增加类杆菌、双歧杆菌、乳酸菌等有益菌的丰度,降低厚壁菌、萨特氏菌等有害菌的丰度,调节肠道微生物菌群比例,增加有益菌群比例[64]。在未来还需对肠道微生物进行代谢组学研究,使其对红海藻多糖的降解朝着对人体有益的方向进行。
4 结论与展望
对红海藻多糖提取、分离纯化、结构特性及生物活性进行综述,探讨了红海藻多糖构效关系。目前红海藻多糖的研究受到国内外学者广泛的关注,也取得了一定的成果,但对红海藻多糖的研究还缺乏广度和深度。红海藻多糖的提取纯化仅限于实验室研究,未达到工业应用的要求;红海藻多糖结构多样且复杂,而目前对其研究主要集中在一级结构,未能深入挖掘多糖生物活性的构效关系、量效关系;关于红海藻多糖抗氧化、抗肿瘤、免疫调节等生物活性的研究多为体外研究,少有体内研究和临床试验。未来,应围绕创新高效的提取纯化工艺,深入开展红海藻多糖生物活性和临床应用研究,明确作用机理、构效关系和量效关系,为红海藻多糖的开发应用提供理论依据。

